Что такое фенолфталеин. Основные опасности при перегонке с водяным паром.
(Документ)
n2.doc
Федеральное агентство по образованию
Общий эксперимент 1: титрования
Почему вы должны следить за тем, чтобы ваши глаза были ровными с отметкой при добавлении последних нескольких капель воды?
- Какова концентрация этого стандартного решения?
- Какова цель промывки стакана и воронки водой?
- Какова цель промывки внутренней части мерной колбы водой?
Методика перекристаллизации из горячего спирта
Из таблицы определите средний объем титрования для этого эксперимента и используйте это значение в остальных ваших расчетах. Используя предыдущие приведенные примеры, определите концентрацию уксусной кислоты в образце уксуса. Помните, что у вас есть следующая информация: объем объема виноградной лозы раствора гидроксида натрия, концентрация раствора гидроксида натрия. Определить концентрацию раствора гидроксида натрия с неизвестной концентрацией.
Государственное образовательное учреждение высшего профессионального образования
Поморский государственный университет им М. В. Ломоносова
Кафедра химии
Курсовая работа
Синтез фенолфталеина.
Исследование растворимости в растворителях с различной диэлектрической проницаемостью
Выполнил:
Концентрированные кислоты и основания могут вызывать серьезные ожоги. Мы предлагаем использовать перчатки и защитные очки, когда вы работаете с кислотой или основанием. Убедившись, что бюретка закрыта, аккуратно добавьте стандартное решение щавелевой кислоты в бюретку, пока бюретка не заполнится. Поместите чистый стакан под бюреткой и осторожно поставьте часть раствора щавелевой кислоты в нее. Это обеспечит отсутствие пузырьков воздуха в бюретке. Верхняя часть раствора должна теперь находиться между отметками 0 и 1 см 3. Запишите значение ко второму знаку после запятой. Используйте пипетку для измерения 20 см 3 \\ раствора в конической колбе. Добавьте в коническую колбу 3-4 капли индикатора фенолфталеина. Проведите грубый эксперимент по титрованию, быстро добавив щавелевую кислоту в коническую колбу и постоянно закручивая коническую колбу. Остановите, как только цвет раствора изменится, и после завихрения он будет изменен. Если изменение цвета не останется, когда колба закручена, добавьте больше щавелевой кислоты до тех пор, пока цвет не останется. Повторите шаги 4-7 со второй конической колбой. Быстро добавьте щавелевую кислоту в коническую колбу, пока вы не добавите на 2 см 3 меньше, чем ваш грубый объем титрования. На данный момент не должно быть длительного изменения цвета. Постепенно добавляйте щавелевую кислоту. Вихрь между каждой каплей и, если необходимо, промыть стороны колбы водой. Когда решение меняет цвет и остается новым цветом, обратите внимание на громкость на бюретке. Помните, что титрованный объем: -. Для точности повторите шаги 9-11, пока у вас не будет трех показаний с разницей не более 0, 1 см 3.
- Пометьте один из стаканов \\.
- Используйте пипетку для измерения 100 см 3 воды в стакан.
- Добавьте примерно 4 г \\ в стакан и перемешайте.
- Закрепите бюретку на стенде реторты и поместите маленькую воронку сверху.
- Каким цветом был раствор гидроксида натрия, когда был добавлен фенолфталейн?
- Какой был цвет, когда было добавлено достаточно кислоты?
студент 3 курса
отделения химии
Алфёров Владимир Иванович
Проверили:
Доцент, канд. хим. наук
Левандовская Т. В.
Доцент, канд. техн. наук
Чагина Н. Б.
АРХАНГЕЛЬСК
1. Литературный обзор………………………………………………..5
Внешний вид и физические свойства фенолфталеина………….5
Применение фенолфталеина……………………………………...6
Химические свойства……………………………………………...8
Получение фенолфталеина………………………………………11
1.4.2 Физические свойства веществ используемых при синтезе….15
Используя предыдущие приведенные примеры, определите концентрацию раствора гидроксида натрия. Помните, что у вас есть следующая информация: объем раствора гидроксида натрия в объеме раствора щавелевой кислоты концентрация раствора щавелевой кислоты. Сбалансированное химическое уравнение для этой реакции.
Рассчитайте массу щавелевой кислоты, которую ученик должен растворить, чтобы составить требуемое стандартное решение. Он считает, что 40 см 3 раствора щавелевой кислоты полностью нейтрализует 35 см 3 раствора гидроксида натрия.
- Нам нужна масса щавелевой кислоты.
- Тем не менее, мы пока не знаем количество родинок.
1.4.3 Методика перегонки с водяным паром……………………….16
1.4.4 Методика перекристаллизации из горячего спирта………….18
1.5 Техника безопасности……………………………………………20
1.5.1 Основные опасности при работе с концентрированными кислотами……………………………………………………………..20
1.5.2 Основные опасности при перегонке с водяным паром……..21
- Напишите сбалансированное химическое уравнение для реакции.
- Вычислите концентрацию кислоты.
Этот дождь часто кислый был впервые отмечен в девятнадцатом веке, но только до двадцатого века эта кислотность стала широко распространенной на опасных уровнях, которые мы связываем с термином «кислотный дождь». Главным виновником оказался уголь, содержащий серу в качестве примеси. При сжигании на электростанции эта сера сочетается с кислородом с образованием двуокиси серы, которая поднимается через дымовую трубу и рассеивается через атмосферу.
1.5.3 Основные опасности при перекристаллизации из горячего спирта………………………………………………………………….21
1.5.4 Особенности работы с веществами, используемыми при синтезе…………………………………………………………………22
1.6 Характеристика растворителей………………………………….24
1.6.1 Классификация растворителей по физическим свойствам…25
Серная кислота является очень сильной кислотой, и когда вода конденсируется из воздуха с образованием капель дождя, кислота растворяется в воде. Затем дождь падает и собирается в телах пресной воды, повышая их кислотность. Северо-восточные Соединенные Штаты пострадали больше всего от этого, потому что Долина Огайо, включая районы Огайо и Пенсильвании, - это места с большей частью угольной промышленности последних полутора веков. Из-за преобладающих погодных условий эти дымовые газы попадают в атмосферу в долине Огайо, но дождь опускается на север штата Нью-Йорк и Нью-Англия.
1.6.2 Системы классификаций растворителей, основанные на их химических свойствах………………………………………………..30
1.7 Обзор методик определения растворимости твердых веществ………………………………………………………………..35
1.7.1 Гравиметрический метод…………………………………….35
1.7.2 Электрохимический метод……………………………………37
1.7.3 Фотоэлектрокалориметрический метод……………………..41
Увеличение кислотности дождя может иметь разрушительные последствия. Металлические примеси в почве, которые обычно плотно связаны с другими соединениями, могут быть промыты кислотным дождем в озера и ручьи; в свое время многие пруды в Новой Англии оказались неспособными поддерживать ручейную форель из-за этого. Растения также очень чувствительны к рН почвы. полезные питательные вещества также могут быть вымыты из почвы, оставляя растения неспособными выжить в нем. В особенно сильно пострадавших районах можно найти десятки мертвых деревьев, как показано выше.
2. Экспериментальная часть…………………………………………43
2.1 Синтез фенолфталеина…………………………………………...43
2.2 Перекристаллизация из горячего спирта………………………..45
2.3 Определение растворимости…………………………………….47
Заключение……………………………………………………………50
Библиографический список………………………………………….51
Здания и статуи также были повреждены кислотными дождями, которые съедают камень, особенно известняк. Увеличенная эрозия скульптур, надгробий и даже некоторых зданий привела к огромным потерям - некоторые произведения искусства были полностью разрушены.
С тех пор выбросы значительно сократились, и поэтому кислотный дождь также снизился. Однако проблема еще не устранена, и многое еще предстоит сделать по этой серьезной экологической проблеме. Давайте рассмотрим соляную кислоту, которая является основным компонентом кислоты в желудке, и гидроксид натрия, который часто упоминается как «щелочь», и используется в мыле. Однако почти все гидронион и гидроксид объединяются, чтобы сделать молекулы воды, Оставляя за собой только хлорид-зритель и ионы натрия.
Введение
Фенолфталеин – один из наиболее широко используемых в химии кислотно-основных индикаторов. Он относится к триарилметановым красителям, называемых фталеиновыми .
Целью данной работы является синтез фенолфталеина и исследование его растворимости в растворителях с различной диэлектрической проницаемостью. Для достижения данной цели, необходимо решить следующие задачи:
Если количество соляной кислоты точно такое же, как количество гидроксида натрия, в молях, то каждый гидроний должен иметь гидроксид, чтобы реагировать с оставлением раствора, который в настоящее время нейтрален. теперь он должен быть стаканом чистой воды с рН 7 и обычной столовой солью, растворенной в нем. Мы начинаем с двух чрезвычайно едких веществ и заканчиваем доброкачественными продуктами.
В общем случае, когда кислоты и основания взаимодействуют друг с другом, они нейтрализуют друг друга и рН раствора приближается к этому. Это называется «.». Только тогда, когда равное количество сильной кислоты и сильного основания складывается вместе, рН будет точно. Но во многих случаях слабые кислоты и слабые основания объединяются. Тем не менее, рН приблизится к 7, но решение не будет нейтральным. В случае кислотных дождей камни и почва часто являются основными, особенно карбонатными породами, обнаруженными в некоторых частях страны.
1. Проанализировать литературу по данному вопросу;
2. Подобрать методики синтеза и выбрать наиболее приемлемую из них;
3. Провести синтез, выделение и очистку продукта;
4. Исследовать растворимость в растворителях с различной диэлектрической проницаемостью, сравнить полученные результаты с литературными данными;
Поскольку слабые кислоты в кислоте дождь падает на скалу, они нейтрализуются основаниями на листьях, в грязи и в скалах. Однако многие из этих оснований, например, в скалах, не являются возобновляемыми. После столетия кислотного дождя скалы нейтрализуют все основание в породах, кислотный дождь просто входит в экосистему, и ничто ее не нейтрализует.
Фенолфталеин: общий лабораторный показатель
Молекула фенолфталеина прозрачна в присутствии кислоты и розового в присутствии основания. Это отличный показатель для нахождения точки эквивалентности в кислотно-щелочном титровании для простых кислот. В Разделе 5 Раздела 8 титрования были введены как способ объединения двух растворов вместе, чтобы иметь контролируемую стехиометрическую реакцию. Он требует наличия раствора известной концентрации, обычно в бюретке, которая будет реагировать с раствором неизвестной концентрации в стакане под ним. Любая реакция будет работать для титрования, но чтобы иметь возможность сказать, когда реакция будет выполнена, должна быть видимая конечная точка.
5.
Сделать вывод о проделанной работе.
1. Литературный обзор
1.1 Внешний вид и физические свойства фенолфталеина
Фенолфталеин (Ди-n-диоксидифенилфталид, 2,2-бис(n- гидроксифенил)фталид) – белый или слегка желтоватый кристаллический порошок; при перекристаллизации из разбавленного этилового спирта образуются бесцветные, ромбические иглы . Фенолфталеин не имеет запаха, не устойчив на воздухе. Молекулярная масса равна 318,3 г/моль. Фенолфталеин плавится при температуре 250 0 С (258 0 С) и при более высоких температурах возгоняется .
Фенолфталеин, как средство для похудения
Для реакций с кислотной основой индикаторы могут предоставлять именно этот тип информации с изменением цвета, чтобы указать конечную точку. Поэтому реакции нейтрализации кислотной основы являются одним из наиболее распространенных типов реакций, используемых в анализах титрования. Таким образом, титрование может быть использовано для определения количества кислоты или основания в неизвестном растворе.
При титровании сильных кислот с сильными основаниями конечная точка достигается, когда рН будет ровно 7, потому что раствор должен быть просто чистым водным раствором с нейтральными электролитами в нем. После того, как кислота исчезнет, любая база, которую мы добавим в колбу, не будет нейтрализована, и рН раствора начнет расти. Однако даже небольшая доля капли из бюретки избыточного сильного основания приведет к изменению рН Один или такой индикатор, фенолфталеин, прозрачен и бесцветен в кислотных растворах, но в основных растворах становится темно-розовым, если рН выше 2.
Фенолфталеин растворим в этаноле, диэтиловом эфире, хлороформе, ацетоне, петролейном эфире, бензоле, толуоле и плохо в воде .
1.2 Применение фенолфталеина
Фенолфталеин – один из наиболее широко используемых индикаторов, особенно при объёмном определении слабых кислот.
Он обладает рядом преимуществ: не чувствителен к повышенным температурам, ошибка от присутствия белковых веществ и коллоидов незначительная. Его можно широко использовать даже в растворах содержащих спирт, только окраска щелочного раствора отличается от фиолетового тона, характерного для водного раствора. В концентрированных спиртовых растворах основная форма имеет сине- фиолетовую окраску. Фенолфталеин можно использовать при титровании органических кислот в спиртовых растворах или для определения кислотности спиртов и сложных эфиров. Хейорт и Хам предлагают использовать многонатрийгликолят для установления титра оснований в присутствии фенолфталеина. Удовлетворительные результаты получаются при титровании 210 -6 - 3010 -6 г органических кислот в объёме 2,710 -6 - 4010 -6 л в присутствии фенолфталеина. Согласно исследованиям Мика, концентрация индикатора играет очень важную роль в микроацидиметрии. Фенолфталеин входит в состав многих смешанных индикаторов. Благодаря своим качествам он пригоден для калориметрического определения рН с использованием буферных растворов или по методу Михаэлиса без буферных растворов. Окрашенная форма подчиняется закону Бера в широкой области концентраций.
Кислотные индикаторы входят во многие типы
Тот факт, что Фенолфталеин меняет цвет немного выше 0, как правило, приводит к очень небольшой ошибке в эксперименте. В дополнение к фенолфталеину другие показатели включают бромотимол синий и метиловый оранжевый. Для растворов, которые лишь незначительно отличаются от их конечной точки, бромтимоловый синий является хорошим показателем. Чуть ниже значения рН 7 раствор имеет желтый цвет, который становится синим чуть выше рН. Когда конечная точка титрования будет довольно кислым, используется метиловый оранжевый.
Фенолфталеин можно использовать также как реагент в качественном анализе. По данным Сакса, некоторые нерастворимые гидроокиси металлов, например свинца, кадмия, цинка, магния и пр., при опрыскивании фенолфталеином дают окраску, которая объясняется адсорбцией индикатора. Другая группа реакций основывается на том, что в щелочной среде фенолфталеин восстанавливается цинком до бесцветного фенолфталеина. Это лейкосоединение окисляется некоторыми веществами, и тогда снова появляется красный цвет фенолфталеина. Подобный эффект наблюдается при очень небольших количествах цианид - ионов (0,01-0,05 мг/л) в присутствии следов сульфата меди. При очень малых количествах меди (10 -4 - 10 -5 %) введение в систему перекиси водорода приводит к увеличению скорости процесса окисления лейкосоединения .
Одно из производных фенолфталеина – фенолфталеинфосфат – используется при определении активности фермента фосфатазы. Фенолфталеинфосфат сам по себе не обладает свойствами индикатора, но разрушается под действием фермента; фосфатные группы отщепляются под действием субстрата, и появляется красная окраска фенолфталеина .
В медицине фенолфталеин применяется как слабительное, и препарат носит название - пурген.
1.3 Химические свойства
Интервал перехода окраски фенолфталеина находиться в пределах от рН 8,2 (бесцветный) до рН 9,8 (пурпурный). Для определения интервала перехода применяют серию буферных растворов со следующими значениями рН:7,8-8,0-8,2-8,4-9,0-9,6-9,8-10,0-10,2. Значения рН, при которых проявляются первое розовое окрашивание, зависит от концентрации индикатора. Интенсивность пурпурной окраски постепенно усиливается вплоть до рН 9,8: рН 1/2 9,53 .
Процесс образования окрашенного дианиона хиноидной структуры(III), который образуется в результате взаимодействия фенолфталеина с разбавленным раствором щёлочи (рН8,5), можно представить следующим образом:
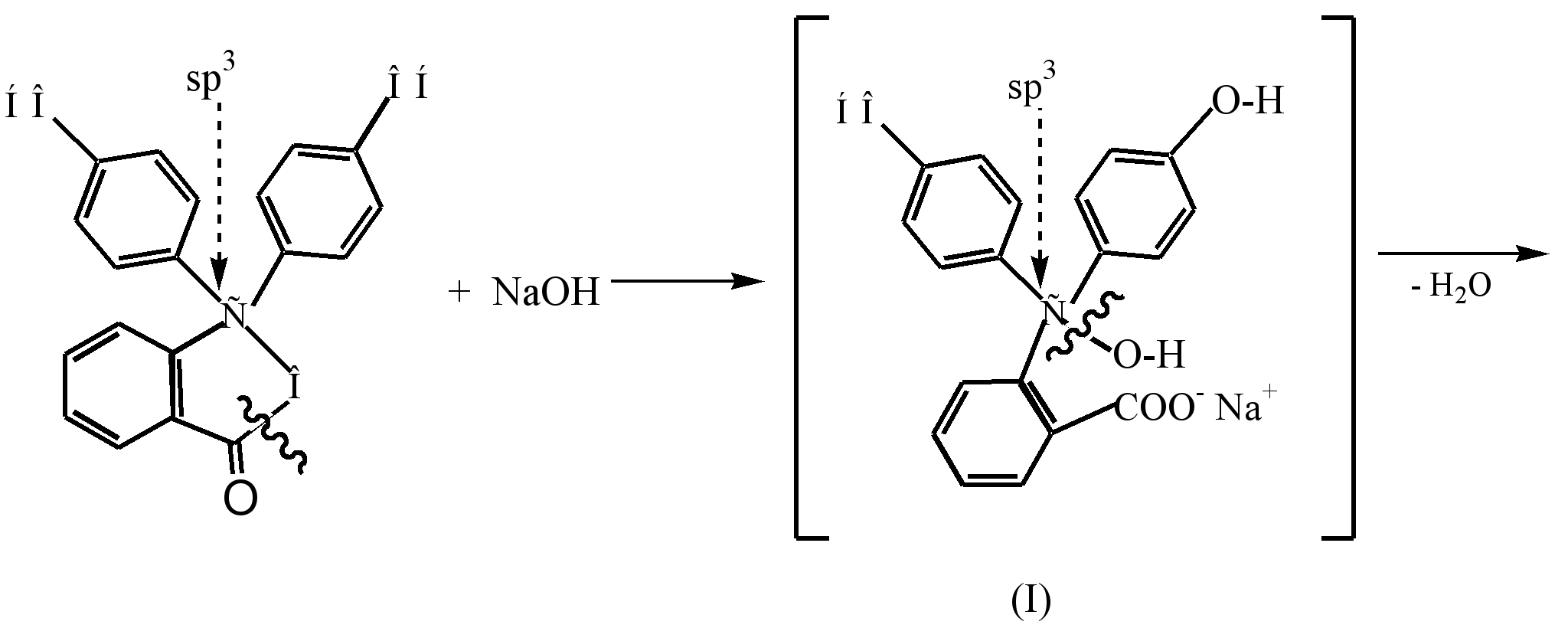

Под действием щёлочи в бесцветном фенолфталеине происходит размыкание (гидролиз) ?-лактонного кольца, и возникший бесцветный спирт (I) самопроизвольно отщепляет молекулу воды с образованием мононатриевой соли (II) жёлтого цвета. Дальнейшее взаимодействие со щёлочью приводит к образованию динатриевой соли (III) и к углублению окраски до малиновой, что обусловлено удлинением цепи сопряжения .
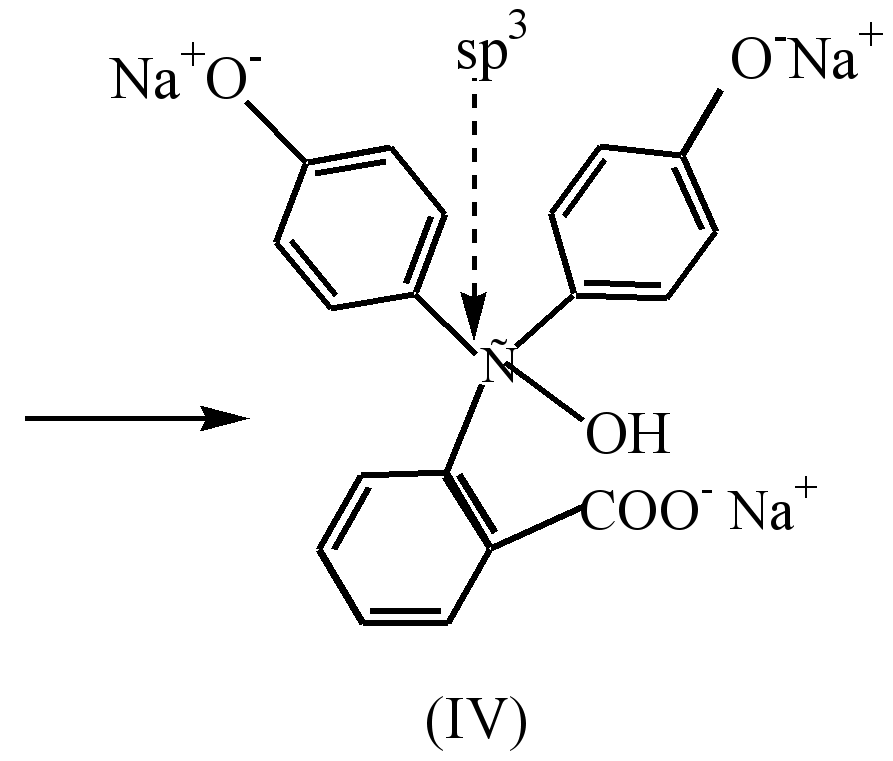
В сильнощелочной среде (рН10) наблюдается обесцвечивание раствора в результате перехода динатриевой соли (III) в тринатриевую соль (IV), в которой кольца не сопряжены между собой.
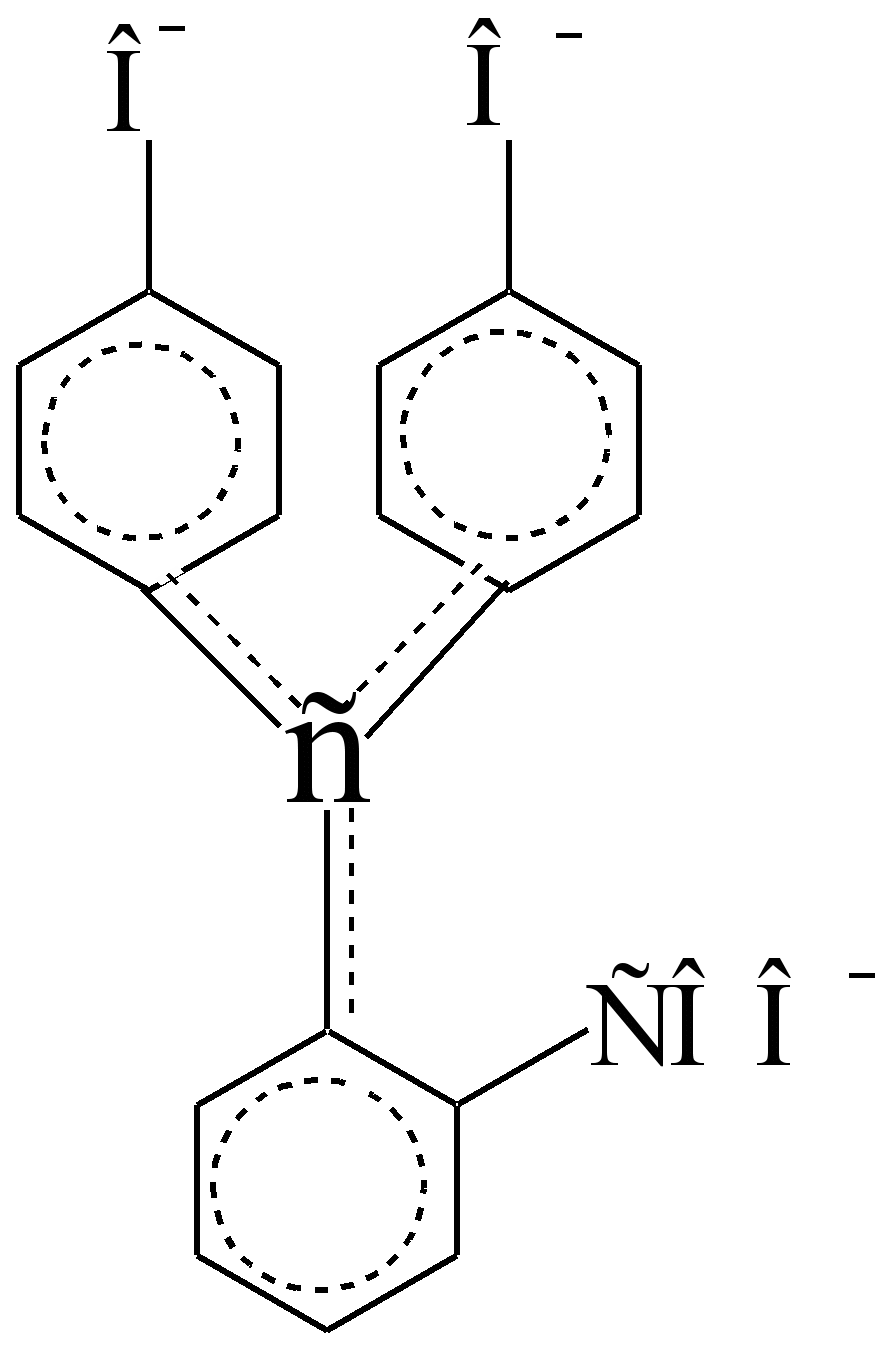
В кислой среде он бесцветен, так как слабые бензольные хромофоры изолированы, автономны и в?,? – взаимодействие (сопряжение) друг с другом не вступают:
Они разобщены С sp 3 – атомом углерода, который является изолятором, а не проводником? – электронов. В щелочной среде лактонный цикл разрывается, один из фенольных гидроксилов ионизирует, а С sp 3 - атом приобретает С sp 2 – конфигурацию, становясь проводником? – электронов между бензольными хромофорами, сверх того ещё поляризованными ауксохромами – СОО - и –О - . В концентрированной серной кислоте индикатор окрашивается в оранжевый цвет. Интенсивность окраски пурпурных щелочных растворов при стоянии уменьшается отчасти из-за образования бесцветного карбоксильного основания (это обратимое превращение), отчасти из-за необратимого окисления воздухом
Хромофор фенолфталеина
(щелочная форма, 1 = 553 нм, 1 = 9000)
1.4 Получение фенолфталеина
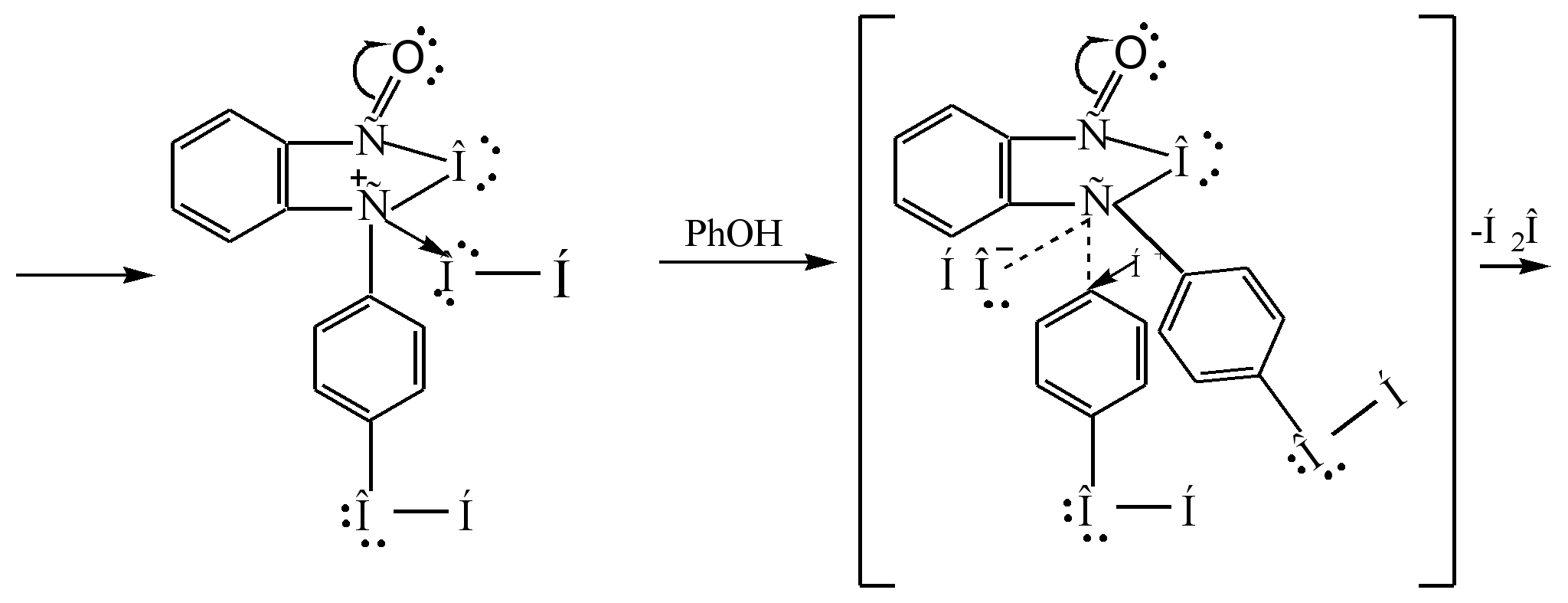
Основным способом получения фенолфталеина является конденсация фенола с фталевым ангидридом. Данная реакция является частным случаем ацилирования по Фриделю-Крафтсу. Реакция протекает при нагревании с кислотным катализатором (концентрированная серная кислота или хлорида цинка):
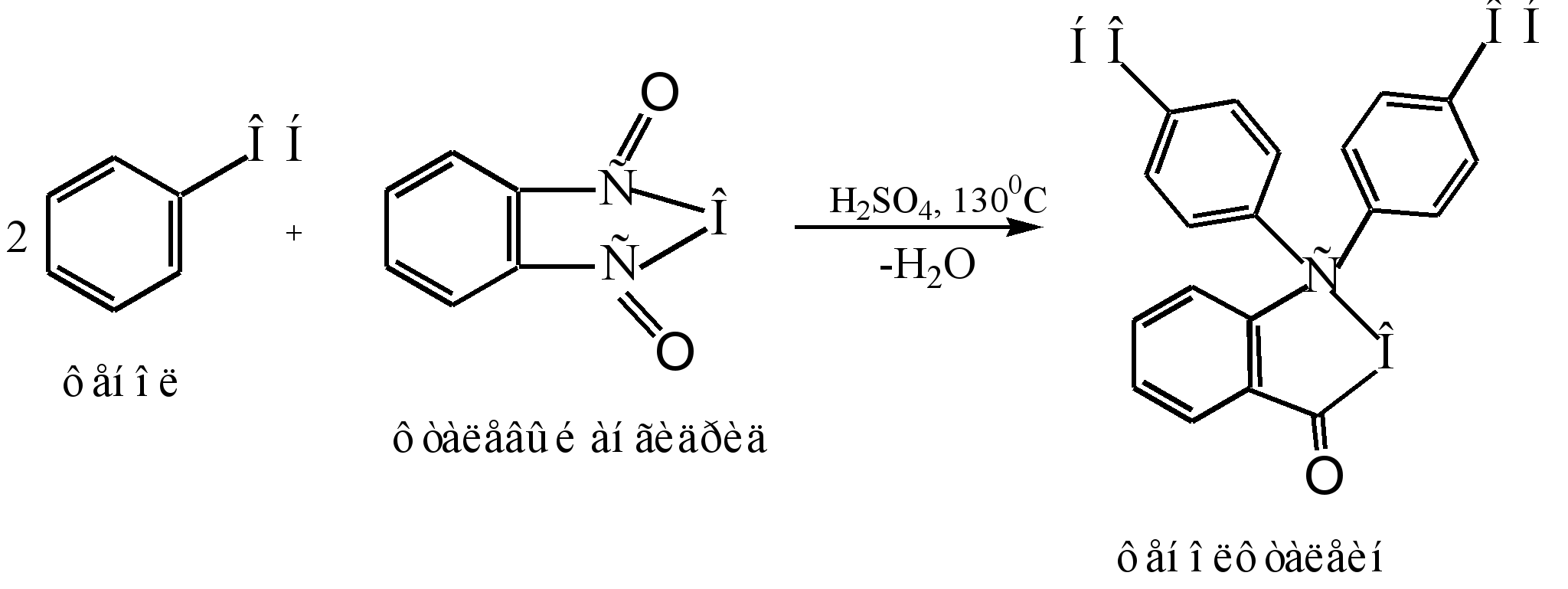
Механизм реакции можно представить следующим образом :

Сигма - комплекс
фенолфталеин
1.4.1 Методики получения фенолфталеина
Проанализировав литературные источники по данному вопросу было обнаружено, что во всех методических пособиях приводится одна и та же методика получения фенолфталеина. Она основывается на реакции представленной выше. Методика полностью подходит к нашим лабораторным условиям.
Для синтеза понадобится следующие реактивы, посуда и оборудование:
Фталевый ангидрид-5г; фенол- 10г; серная кислота- 2мл; гидроксид натрия- 4-5%; уксусная кислота (концентрированная); соляная кислота (концентрированная); этиловый спирт (абсолютный).
Колба круглодонная (50мл) – 1 шт; стакан (100мл) – 1 шт.; чашка фарфоровая – 1 шт.; колбы конические (250мл) – 2 шт.; термометр; прибор для перегонки с водяным паром; баня песчаная.
Ход синтез :
Смесь 5г фталевого ангидрида, 10г фенола и 2мл серной кислоты помещают в колбу и нагревают на песчаной бане в течении 1,5 часа, строго соблюдая температуру 125 – 130 С 0 (термометр в плаве и периодически перемешивая содержимое). Горячую смесь выливают в колбу со 100мл кипящей воды, отгоняют с водяным паром, не вступивший в реакцию фенол. Во избежание разбрызгивания и связанной с этим потерей вещества жидкость нужно всё время перемешивать. Окончание перегонки можно заметить по изменению мутности отгона: если отгон стекает мутноватый, значит перегонку следует продолжить, если отгон прозрачный, то перегонку можно прекращать. Раствору дают охладиться, после чего декантируют на воронку Бюхнера, стараясь по возможности не переносить осадок на фильтр. Затем продукт промывают декантацией двумя небольшими порциями холодной воды, присоединяют то, что всё-таки попало на фильтр, к основной массе твёрдого вещества в стакан, растворяют в небольшом количестве тёплого 4-5% гидроксида натрия и отделяют фильтрованием непрореагировавший фталевый ангидрид. К тёмно- красному фильтрату прибавляют уксусную кислоту до полного осаждения фенолфталеина, затем прибавляют 1-2 капли соляной кислоты и оставляют на 1 час.
Выделившийся фенолфталеин в виде желтоватого песка отсасывают на воронке Бюхнера. Сырой продукт переносят в стакан и растворяют при нагревании приблизительно в 10мл спирта. Горячий раствор отсасывают и промывают осадок на фильтре горячим спиртом. Фильтруют через смоченный спиртом фильтр от выделившихся капелек масла. Фильтрат переносят в фарфоровую чашку и нагревают на горячей песчаной бане для удаления значительной части спирта. Смесь в чашке оставляют стоять в течение 30 минут. Выделившиеся бесцветные или светло-желтые кристаллы отсасывают и высушивают на воздухе между листами фильтровальной бумаги.
1.4.2 Физические свойства используемых при синтезе веществ
Таблица 1
Физические свойства веществ используемых при синтезе
| Название | Формула | внешний вид | Т пл, 0 С | Т кип, 0 С | ратсворимость |
|
| В воде | в другом |
|||||
| Фенолфталеин | С 20 Н 14 О 4 | Бесцветные или песчаного цвета ромбические иглы, без запаха, не устойчив на воздухе | 261 | возго- няется | Труднорастворим(0,0002 г в 100 г воды) | Хорошо этаноле, умеренно в диэтиловом эфире, также растворим в щелочных растворах. |
| Фенол | С 6 Н 5 ОН | Бесцветные или розоватые ромбические иглы | 41-43 | 182 | В холодной – умеренно В горячей - хорошо | Хорошо в этаноле, в эфире, хлороформе, глицерине, сероуглероде |
| Фталевый ангидрид | С 8 Н 4 О 3 | Белые ромбические иглы | 130,8 | Возг 284,3 | плохо | В этаноле, в эфире, хлороформе |
| Серная кислота | H 2 SO 4 | Бесцветная, вязкая жидкость, с неприятным запахом | 10,37 | 330 | | реагирует |
| Гидроксид натрия | NaOH | Белые расплывающиеся, ромбические кристаллы | 320 | 1378 | Растворим с выделением тепла | В спирте, глицерине, феноле, эфире, ацетоне |
| уксусная кислота | СН 3 СООН | Бесцветная жидкость, с резким неприятным запахом | 16,6 | 118,1 | | В этаноле, эфире |
| Соляная кислота | HCI | Желтоватая жидкость, дымит на воздухе, с неприятным запахом | -15,35 | - | хорошо | В спирте |
1.4.3 Методика перегонки с водяным паром
Так как по ходу выполнения синтеза необходимо будет провести отгон не прореагировавшего фенола с помощью перегонки с водяным паром, необходимо рассмотреть методику её выполнения.
Перегонку производят в приборе, состоящем из парообразователя с предохранительной трубкой, перегонной колбы Кляйзена (250 мл), термометра, прямого холодильника Либиха, аллонжа, приёмника. Парообразователь и перегонная колба, соединяемые через тройник на один из отростков которого надета резиновая трубка с зажимом Гофмана, и нагревают на песчаной бане.
Ход перегонки (отгонки): в перегонную колбу со 100 мл кипящей воды помещают горячий плав. Нагревая парообразователь и перегонную колбу, собирают дистиллят, содержащий не прореагировавший фенол. О его наличии свидетельствует мутность отгона. Отгонку прекращают по окончании стекания мутного отгона, то есть до появления прозрачного отгона .
Рис.1
Прибор для перегонки с водяным паром
1- предохранительная трубка; 2 – пароподводящая трубка; 3 – тройник; 4 – зажим; 5 – парообразователь; 6 – колба Кляйзена; 7 – термометр; 8 –холодильник Либиха; 9 – аллонж; 10 – приёмник; 11 – колбонагреватель; 12 – плитка.
1.4.4 Методика перекристаллизации из горячего спирта
Экспериментально перекристаллизацию осуществляют следующим образом: Вещество помещают в круглодонную колбу и добавляют к нему немного растворителя. Смесь нагревают с обратным холодильником на водяной бане обогреваемой на плитке.
Для большинства жидкостей характерна склонность к перегреву, и поэтому они закипают с сильными толчками. Во избежание этого в колбу до начала нагрева вносят кипелки.Через обратный холодильник небольшими порциями постепенно добавляют растворитель до полного растворения вещества.
После полного растворения вещества нагревание прекращают и дают смеси остыть вместе с водой в бане. Выпавшее вещество отфильтровывают.
В большинстве случаев двухступенчатая перекристаллизация является надёжным способом очистки вещества .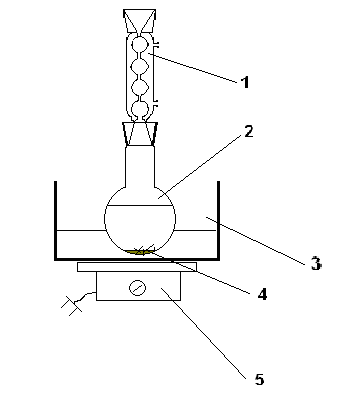
Рис.2
Прибор для перекристализации
1- обратный холодильник; 2 – круглодонная колба; 3 – водяная баня; 4 – кипелки; 5 – плитка.
1.5 Техника безопасности при выполнении синтеза
1.5.1 Основные опасности при работе с концентрированными кислотами
1.Сильные неорганические кислоты при попадании на кожу вызывают химические ожоги.При химических ожогах, вызванных попаданием на кожу концентрированных кислот, промывают обожжённое место сильной струёй воды, а затем 1%-м раствором гидрокарбоната натрия (находится в аптечке). При попадании кислоты в глаза их следует сразу промыть 1%-м раствором гидрокарбоната натрия и дистиллированной водой комнатной температуры. Обратиться за помощью к врачу.
2.Ввиду того, что концентрированная соляная кислота парит хлороводородом, с ней необходимо работать под хорошо действующей тягой и приспущенной шторкой тяги. При отравлении парами хлороводорода необходимо немедленно выйти на свежий воздух.
3.Разлившуюся кислоту необходимо обваловать песком и нейтрализовать твёрдым карбонатом натрия до прекращения выделения газа. Песок после полной нейтрализации промыть большим объёмом водопроводной водой, проверить на полноту отмывки (сделать пробу на Cl - с помощью AgNO 3) и, просушив в сушильном шкафу, вернуть в ящик с песком .
1.5.2 Основные опасности при перегонке с водяным паром
Основные опасности при перегонке связаны с использованием электрических нагревательных приборов (электроплитки, колбонагреватели).1.Шнур (нельзя использовать плитки со шнуром в тряпичной обмотке), вилка и корпус электроплитки не должны иметь видимых повреждений.
2.Недопустимо проверять руками температуру теплоизлучающей поверхности.
3.Включать и выключать электроплитку из сети следует, вставляя и вынимая вилку, держа одной рукой за розетку, другой за вилку. Для регулировки нагрева использовать переключатель.
4.В случае термического ожога необходимо делать длительные примочки обожжённого места 0,5%-м раствором перманганата калия, затем закрыть его стерильной повязкой и обратиться к врачу. При ожоге 3 и 4 степени сразу наложить стерильную повязку и обратиться к врачу .
1.5.3 Основные опасности при перекристаллизации из горячего спирта
1.Общий объём прилитого спирта не должен превышать 200 мл и должен занимать не более 1/3 объёма колбы.2.Размер водяной бани должны быть больше размера теплоизлучающей поверхности плитки .
1.5.4 Особенности работы с веществами, используемыми при синтезе
Большинство химических веществ в той или иной мере токсичны. Меры предосторожности при работе с ними направлены на предотвращение случаев проникновения этих веществ в организм через рот, лёгкие и кожу.В ходе синтеза будет использовано потенциально опасные вещества: фенол, серная кислота, уксусная кислота и соляная кислота.
Фенол – бесцветное (розоватое), кристаллическое вещество, с характерным запахом. ПДК в воздухе рабочей зоны 0,3 мг/м 3 . Класс опасности второй. Все работы с фенолом проводятся в вытяжном шкафу. Токсическое действие: нервный яд, обладает сильным местным раздражающим и прижигающим действием, вызывает общее тяжёлое отравление. Возможен смертельный исход. Положение осложняется тем, что вещество вызывает местную анестезию. Первая помощь: при попадании на одежду немедленно её сменить, при попадании на кожу смыть растительным маслом или раствором с массовой долей этанола 10 – 40 %.
Соляная кислота относится ко второму классу опасности (ПДК в воздухе рабочей зоны 5 мг/м 3 в пересчёте на HCl), все работы с концентрированной соляной кислотой также должны проводиться в вытяжном шкафу ввиду того, что она выделяет пары хлороводорода. При отравлении парами хлороводорода необходимо выйти на свежий воздух, прочие опасности указаны выше.
Серная кислота ( = 1,84 г/см 3) – ПДК рз = 1 мг/м 3 . Класс опасности второй. Примерно через 5 с начинается энергичное обезвоживание тканей, куда попала капля. Первая помощь: промывание кожи проточной водой с последующей нейтрализацией.
Уксусная кислота – ПДК рз = 5 мг/м 3 . Класс опасности третий7. Пары раздражают верхние дыхательные пути, на кожу действуют растворы с массовой долей вещества свыше 30 %, на глаза свыше 2 %. Первая помощь: (см. серная кислота и соляная кислота) .
1.6 Характеристика растворителей
Особое место в характеристике растворителей занимает диэлектрическая проницаемость. Преимущество последней по сравнению с другими критериями связаны с простотой электростатических моделей сольватации, и поэтому диэлектрическая проницаемость стала полезной мерой полярности растворителей. В этой связи важно чётко знать, что именно отражает макроскопическая проницаемость растворителя, называемая также относительной диэлектрической проницаемостью:
r = 0 /
0 – диэлектрическая проницаемость вакуума.
Диэлектрическая проницаемость определяется, помещая растворитель между двумя заряженными пластинами конденсатора. В присутствии растворителя напряжённость электрического поля между пластинами Е снижается по сравнению с напряжённостью Е 0 , измеренной в вакууме, и отношение Е 0 / представляет собой диэлектрическую проницаемость растворителя. Если молекулы растворителя не обладают собственным постоянным дипольным моментом, то под влиянием внешнего поля внутримолекулярные заряды разделяются, индуцируя диполь .
В электрическом поле молекулы с постоянным или индуцированным диполем ориентируются определённым образом; это явление называют поляризацией. Чем выше степень поляризации, тем сильнее падение напряженности электрического поля. Следовательно, диэлектрическая проницаемость непосредственно связана со способностью растворителя к разделению зарядов и ориентации собственных диполей .
1.6.1 Классификация растворителей по физическим свойствам.
Диэлектрическая проницаемость (ДП) раствора е относится к важнейшим факторам из числа оказывающих наиболее сильное влияние на характеристики протекающего в растворе процесса.
Значения ДП индивидуальных растворителей разнятся в весьма значительных пределах - от?1,8 (алканы) до 170-180 (N-алкиламиды алифатических карбоновых кислот). Терминология, лежащая в основе градации растворителей по ДП, не во всем определенна и последовательна. Растворители с высокими ДП называют полярными и даже высоко полярными, хотя, строго говоря, термин „полярный" относится к ди-польному моменту µ молекулы растворителя, т.е. характеризует не макро- а микросвойство растворителя.
Впрочем, как вытекает из теории, связывающей с µ, в общем случае наблюдается симбатность изменения этих величин. Кроме того, для характеристики растворителей по наличию либо отсутствию дипольного момента у их молекул введена терминология „дипольные" (µ0) и „аполярные" (µ = 0) растворители.
К низкополярным относят растворители, ДП которых находится в интервале = l,8ч12, к среднеполярным - растворители с = 12ч50, к высокополярным - с > 50. Относительность этого деления заключается не только и даже не столько в этих достаточно произвольно выбранных интервалах, но и в обстоятельстве гораздо более существенном.
Несмотря на достаточно четко устанавливаемую теорией связь между ДП и дипольным моментом индивидуальной жидкости, следует предостеречь от категорически однозначного параллелизма между величинами и µ. Дело в том, что антипараллельная (но не цепочная) ассоциация диполей приводит к падению дипольного момента ассоциатов по сравнению с дипольным моментом одиночной молекулы и, следовательно, к падению ДП жидкости. Вот почему ДП жидкостей, образованных молекулами с относительно большим дипольным моментом, может быть достаточно низка.
Существенное влияние на полярность растворителя оказывают его структурные особенности. Структурированные растворители, как правило, обладают высокой ДП.
Диэлектрическая проницаемость наряду с образованием гомомоле-кулярных химических связей - один из важнейших факторов, определяющих свойства индивидуальных жидкостей, которые зависят от энергии межмолекулярного взаимодействия. Последняя определяется реактивным взаимодействием, энергия которого зависит от статической ДП (), ДП, экстраполированной на бесконечно большую длину волны ( ) и принимаемой равной? 1,1 n D , а также дипольного момента µ и молярного объема?:
E R = 
Значения энергий реактивного взаимодействия дипольных молекул ряда растворителей приведены в табл.1.
Как подчеркивает М. И. Шахпаронов, реактивное поле полярных молекул не приводит к образованию химических структур (гомомолекулярных ассоциатов), существование которых определяется химическими взаимодействиями. Устойчивость же последних уменьшается с повышением энергии реактивного поля.
Энергия реактивного поля объясняет ряд физических особенностей растворителей, и поэтому может быть небесполезным классифицировать растворители по значению - Er .
Очевидно, что все растворители, чьи молекулы не обладают ди-польным моментом, будут составлять класс безреактивных жидкостей. Растворители с энергией реактивного поля в интервале - Er = 0ч5 кДжмоль -1 составляют класс низкореактивных, в интервале - Er =5ч15 кДж моль -1 - среднереактивных и, наконец, растворители с – E R 25 кДж моль -1 составляют класс высокореактивных растворителей.
Как правило, высокореактивные жидкости хорошо растворяют как неэлектролиты, так и электролиты, причем последние в них диссоциированы лучше по сравнению с другими классами (по данной системе классификации) растворителей. Объясняется это тем, что у высокореактивных растворителей сочетаются высокие значения ДП и дипольного момента.
Таблица 2
Энергия реактивного поля некоторых растворителей при 298,15 К.
| Растворитель | -E R , кДж моль -1 | растворитель | -E R , кДж моль -1 |
| Анилин | 2,9 | Метилэтилкетон | 3,4 |
| Ацетон | 9,1 | Муравьиная кислота | 5,2 |
| Ацетонитрил | 20,9 | Нитробензол | 17,1 |
| Бутиловый спирт | 2,9 | Нитрометан | 17,5 |
| Вода | 18,6 | Пиридин | 5,7 |
| Гексен-1 | 0,15 | Пропиленкарбонат | 43,8 |
| N,N-диметилацетамид | 15,8 | Пропиловый спирт | 3,6 |
| Диметилсульфоксид | 6,4 | Толуол | 0,05 |
| Диметилформамид | 19,5 | Уксусная кислота | 3,7 |
| Диоксан | 0,07 | Тетрагидрофуран | 2,9 |
| 1,2 – дихлорэтан | 4,2 | Хлорбензол | 1,8 |
| о – Ксилол | 0,12 | Этилацетат | 2,45 |
| n – Ксилол | 0,05 | Этиленгликоль | 8,9 |
| N-метилацетамид | 24,1 | Этиловый спирт | 4,7 |
| Метилформиат | 4,0 |
По вязкости (точнее, по коэффициенту вязкости ) жидкости подразделяют на низковязкие с 10 -2 Па с.
По удельной электропроводимости жидкости подразделяют на „проводящие” жидкости с порядка 10 2 - 10 -1 Cмм -1 и выше; “умеренно проводящие" – с порядка 10 -1 – 10 -4 и с 10 -4 Смм -1 относят к “непроводящим".
Упоминается также классификация растворителей по температурам кипения, в рамках которой растворители подразделяются на низкокипящие (1 50 0 С).
Для классификации растворителей по их способности к испарению предложена относительная шкала, основанная на теплотах испарения. Поэтому различают легколетучие (относительная летучесть 35) растворители. Если ориентироваться непосредственно на теплоты испарения, то к легколетучим следует отнести растворители, характеризующиеся теплотой испарения Н исп Таблица 3
Классификация растворителей по диэлектрической проницаемости
| СИЛЬНО ПОЛЯРНЫЕ |
|||
| РАСТВОРИТЕЛЬ |  r r
| РАСТВОРИТЕЛЬ | r |
| Вода | 78,30 | ДМФА | 36,71 |
| Этиленгликоль | 37,7 | Бензонитрил | 26,20 |
| Метанол | 32,66 | Нитробензол | 34,78 |
| ДМСО | 46,45 | Глицерин | 51,7 |
| СЛАБО ПОЛЯРНЫЕ |
|||
| ТГФ | 7,58 | Уксусный ангидрид | 20,7 |
| Диэтиловый эфир | 4,20 | Бутанон – 2 | 18,51 |
| Ацетон | 20,70 | Пентанон – 2 | 15,38 |
| Этанол | 24,55 | Пиридин | 12,91 |
| Уксусная кислота | 6,17 | Метилацетат | 6,68 |
| Пропанол – 1 | 20,45 | Циклогексанон | 16,10 |
| Бутанол – 1 | 17,51 | Хиналин | 8,95 |
| Изоамиловый спирт | 15,19 | Хлороформ | 4,81 |
| Анилин | 6,71 | Амиловый спирт | 13,9 |
| НЕПОЛЯРНЫЕ |
|||
| 1,4 - диоксан | 2,21 | Циклогексан | 2,02 |
| Трихлорэтилен | 3,42 | Н – пентан | 1,84 |
| Бензол | 2,27 | Дисульфид углерода | 2,64 |
| Толуол | 2,38 | Диэтиламин | 3,78 |
| Тетрахлорметан | 2,23 | диэтилкарбонат | 2,82 |
| Триэтиламин | 2,42 | ||
| н – гептан | 1,92 | ||
| н – гексан | 1,88 | ||
1.6.2 Системы классификации растворителей, основанные на их химических свойствах
Большинство систем классификации растворителей по химическим признакам в явной либо неявной формах учитывает их кислотно-основные свойства. Поэтому самая общая система классификации растворителей предусматривает подразделение их на два обширных класса - донорные
(основные) и акцепторные (кислотные), дефиниция которых, как очевидно, предопределяет выделение еще класса индифферентных растворителей. Условность отнесения каждого конкретного растворителя к какому-либо из этих классов, хотя бы потому, что способность молекулы растворителя отдавать или принимать от партнера электронную пару зависит от свойств как растворителя, так и растворенного соединения. Вот почему эта классификация предусматривает характерное поведение растворителя в реакциях либо процессах сольватации.
Общим признаком донорных растворителей является преимущественная сольватация катионов как частиц, характеризующихся дефицитом электронов. Аналогично акцепторные растворители преимущественно сольватируют анионы как частицы с избытком электронов.
Разнообразие донорных растворителей определяется относительно большим числом элементов, атомы которых могут выступать в роли доноров электронной пары, и многообразием химических соединений этих элементов. Представители этого класса растворителей поэтому подразделяются на N-основания (амины либо амиды различных типов), 0-основания (простые и сложные эфиры, спирты, кетоны, реже - альдегиды), S-основания (тиоэфиры, тиоспирты, сульфоксиды), Р-основания (триалкил-, триарил-либо алкиларилфосфины) и т.п.
Акцепторные растворители подразделяются на протонные и апротонные.
Растворители, способные принимать участие в протолитическом равновесии, в зависимости от проявляемой ими функции часто называют также протофильными (основными) и протогенными (кислотными). Растворители, одинаково охотно проявляющие обе функции (спирты, кетоны), называют амфипротными.
Молекулы многих растворителей участвуют в сольватации посредством образования водородной (Н-) связи. В соответствии с этим предложена классификация растворителей по их способности к образованию Н-связи.
Первый класс в этой системе классификации составляют жидкости, в которых существует трехмерная сетка Н-связей. Растворители этого класса (вода, муравьиная кислота, серная кислота, гликоли) характеризуются весьма высокой ДП и относительно высокими вязкостью и энергией активации вязкого течения. Как правило, растворители этого класса хорошо растворяются друг в друге, образуя гетеромолекулярные ассоциаты через Н-связь.
Второй класс - жидкости с двухмерной сеткой Н-связей. Как правило, молекулы растворителей этого класса содержат одну гидроксильную группу (одноатомные спирты, одноосновные карбоновые кислоты, фонолы и т.п.). Стремление образовывать гетеромолекулярные ассоциаты у этой группы растворителей в общем выражено в меньшей степени, чем у представителей первого класса.
Третий класс объединяет жидкости, молекулы которых имеют в своем составе атомы азота, кислорода, серы, фтора и др., способные к образованию Н-связи с протонодонорами. В этот класс включаются эфиры, амины, кетоны, альдегиды и т. п.
В четвертый класс входят жидкости, молекулы которых могут быть протонодонорами. К ним относятся хлороформ, дихлорэтан и т.п.
Пятый класс объединяет жидкости, молекулы которых не способны при обычных условиях участвовать в образовании Н-связи. В эту группу входят алканы, четыреххлористый углерод, пергалогеналканы и т. п.
Паркер предложил классифицировать растворители по способности сольватировать ионы. В рамках этой классификации растворители делятся на группы.
Аполярные апротонные - жидкости с низкой ДП (
Диполярные апротонные - жидкости со сравнительно высокими значениями ДП ( > 15) и дипольными моментами (µ >2D),
не содержащие водорода, способного образовывать Н-связь. Представителями этой группы растворителей являются диоксид серы, нитробензол, нитрометан, ацетонитрил, пропиленкарбонат, ДМСО и др.
Протонные - жидкости, молекулы которых содержат группы, где атом водорода соединен с электроотрицательным атомом. Соединения, входящие в эту группу (карбоновые кислоты, спирты, фенолы и др.), отличаются четко выраженной способностью образовывать Н-связь.
Сольватирующая способность растворителей в общем повышается от первой группы к третьей.
Брёнстед предложил классифицировать растворители на основе сочетания диэлектрической проницаемости и протогенн о с т и. В соответствии с этими признаками он разделил растворители на восемь групп.
Примерами растворителей различных групп в рамках классификации Бре"нстеда могут служить: I - вода; II - серная кислота, муравьиная кислота; III - гидразин, ДМСО; IV - пропиленкарбонат, нитробензол, ацетонитрил, нитрометан; V - бутанол; VI - жидкие бромо- и иодоводород; VII - триэтиламин, пиридин; VIII - гексан, хлорбензол.
Классификация по Брёнстеду позволяет прогнозировать кислотно-основные свойства растворенных соединений в растворителях каждой из групп. Так, в растворителе группы II сила оснований существенно выше, чем в растворителе группы III; сила кислот в растворителях группы III в общем случае выше, чем в растворителях группы VII и т.д.
Таблица 4
Классификация растворителей по Брёнстеду.
| Свойство | Тип растворителя |
|||||||
| I | II | III | IV | V | VI | VII | VIII |
|
| ДП | + | + | + | + | - | - | - | - |
| Протогенность | + | + | - | - | + | + | - | - |
| Протофльность | + | - | + | - | + | - | + | - |
* Знаки + и – в первой строке отвечают высокой и низкой ДП, в остальных строках - наличию или отсутствию данного свойства.
Также предложена классификация растворителей, основанная на учете восьми физических характеристик: функции Кирквуда, мольной рефракции, параметра растворимости Гильдебранда, показателя преломления, температуры кипения, дипольного момента, а также энергий высшей заполненной и низшей незаполненной молекулярных орбиталей. По сочетанию этих свойств предложено подразделять растворители на девять групп:
1) апротонные диполярные (например, ацетонитрил, нитрометан, ацетон, 1,2-дихлорэтан);
2) апротонные высокодиполярные (ДМСО, ДМФА, ДМАА, пропиленкарбонат, нитробензол);
3) апротонные высокодиполярные и высокополяризуемые (сульфолан, ГМФТА);
4) ароматические неполярные (бензол, толуол);
ароматические относительно полярные (хлорбензол, о-дихлорбензол, ацетофенон);
электронодонорные (триэтиламин, простые эфиры, диоксан);
растворители с Н-связью (спирты, карбоновые кислоты);
сильно ассоциированные растворители с Н-связью (формамид,
диэтиленгликоль, вода);
растворители с неопределенной функцией (сероуглерод, хлороформ) .
1.7 Обзор методики определения растворимости твёрдых веществ
1.7.1 Гравиметрическое определение растворимости
Метод заключается в определении массы вещества растворившегося в определённой массе растворителя (удельная растворимость Р` ) и расчёте растворимости как массы вещества способной раствориться в 100 граммах данного растворителя. Метод является оценочным.На технохимических весах отвешивают навеску исследуемого вещества (g 1 ` ). Отвешивают навеску растворителя (g р). Определяют массу сухого фильтра (g 2). Всыпают навеску вещества в растворитель, если вещество растворилось полностью, то необходимо добавлять его до прекращения растворения, отметить полную навеску вещества, всыпанного в растворитель (g 1). Отфильтровать не растворившееся вещество через фильтр и определить массу влажного фильтра с остатками вещества (g 3). Просушить фильтр с остатками вещества до постоянной массы (g 4). Рассчитать удельную растворимость по формуле:
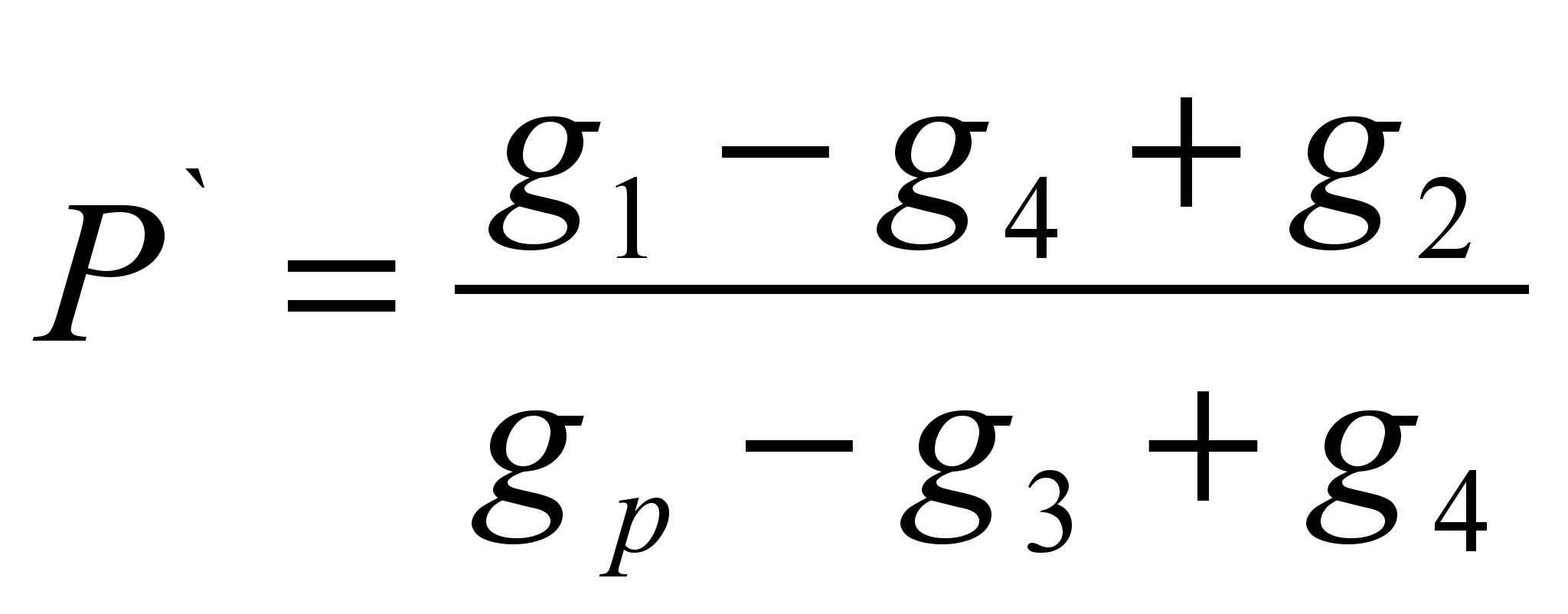
Р = Р` · 100 (г/100 г)
Таблица 5
Растворимость фенолфталеина в некоторых растворителях
| растворитель | растворимость | r |
| Сильно полярные |
||
| Вода | 0,0002 | 78,30 |
| Метиловый спирт | 19,42 | 52,66 |
| Слабо полярные |
||
| Этиловый спирт | 17,29 | 24,55 |
| Ацетон | 16,98 | 20,70 |
| хлороформ | 2,97 | 4,81 |
| Не полярные |
||
| ксилол | 0,19 | 2,43 |
| толуол | 0,17 | 2,38 |
| бензол | 0,16 | 2,27 |
1.7.2 Электрохимический метод.
1.Собирают установку для определения сопротивления объёма раствора электролита по схеме (см. рис. 3).
2.В измерительный сосуд наливают до метки водный раствор хлорида калия определённой концентрации и выдерживают сосуд с электродами в термостате при заданной температуре. Через 15-20 минут подключают сосуд в точках В и Д к установке.
3.С помощью магазина сопротивлений и подвижного контакта С балансируют мост, добиваясь или наименьшего звука в телефоне, или минимума амплитуды синусоиды на экране асцилографа. К точке компенсации подходят то с одного конца реохорда, то с другого. Измерение и последующий расчёт R x:
R x = R 1 
Повторяют 3-4 раза при различных сопротивлениях R 1 . Подвижный контакт при этом не должен приближаться к концам реохорда. Если отклонения в измерениях составляют менее 0,5%, то результаты считают удовлетворительными и приступают к вычислению постоянной сосуда по формуле:
K =  /
w
=
R x
/
w
=
R x
Где R x – сопротивление раствора; -
удельная электропроводность.
4.Небольшое количество соли заливают 100 мл воды и, плотно закрыв колбу пробкой, непрерывно взбалтывают её в течении 20 минут. Полученную суспензию отсасывают через стеклянный фильтр, а осадок используют для приготовления насыщенного раствора. Полученный раствор сливают в сосуд для измерения электрической проводимости и после термостатирования измеряют сопротивление раствора.
=
k
/
R x  = /
C
= /
C
Где С – нормальность раствора, кг экв /м 3 .
Поскольку в насыщенном растворе концентрация соли невелика, то = . На основе уравнения:
С = ( р - в ) /
Где р – удельная электрическая проводимость раствора соли.
Произведение растворимости для одновалентного электролита:
![]() = (С ) 2
= (С ) 2
6.Результаты занести в таблицу:
| соль | t, C 0 | , см/м | Сопротивление, Ом | K | | | С | L |
|||
| R 1 | R 2(AC) | R 3(CB) | R X |
||||||||
Таблица 6
Удельная электропроводность раствора KCI
| t, C 0 | 1 N KCI | 0.1 N | 0.02 N | 0.01 N |
| 10 4 , Ом -1 см -1 |
||||
| 0 | 654,1 | 71,5 | 15,21 | 7,76 |
| 10 | 831,9 | 93,3 | 19,94 | 10,20 |
| 14 | 906,3 | 102,5 | 21,93 | 11,21 |
| 16 | 944,1 | 107,2 | 22,94 | 11,73 |
| 18 | 982,2 | 111,9 | 23,97 | 12,25 |
| 20 | 1020,7 | 116,7 | 25,01 | 12,78 |
| 22 | 1055,4 | 121,5 | 26,06 | 13,32 |
| 24 | 1098,4 | 126,4 | 27,12 | 13,86 |
| 25 | 1118,0 | 128,8 | 27,65 | 14,13 |
| 26 | 1137,7 | 131,8 | 28,19 | 14,41 |
| 28 | 136,2 | 29,27 | 14,96 |
|
| 30 | 141,2 | 30,36 | 15,52 |
|
| 32 | 146,2 | 31,46 | 16,09 |
|
| 34 | 151,3 | 32,56 | 16,67 |
|
| 36 | 156,4 | 33,68 | ||
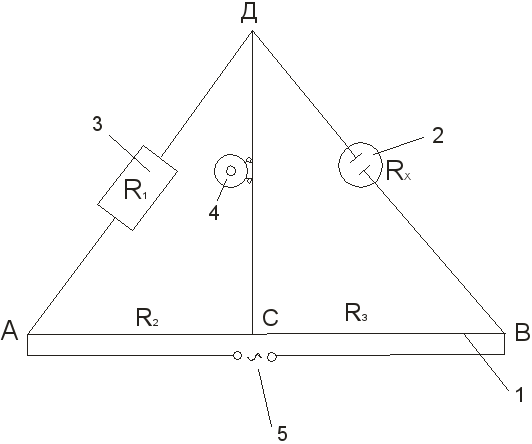
Рис.3 Схема установки для определения электрической проводимости:
1 – проволока, натянутая на линейку; 2 – измерительный сосуд с электродами; 3 – реостат; 4 – низкоомный телефон; 5 – источник тока.
1.7.3
Фотоэлектрокалометрический метод.
В основе метода лежит закон адитивности оптической плотности при соблюдении основного закона светопоглощения.
Ход работы
1.Выбор оптимальных светофильтров.
1.1. В мерную колбу на 25 мл поместить:
Перемешать растворы и измерить оптические плотности относительно выбранного растворителя при различных светофильтрах в наиболее применимых для этого кюветах. Размер кюветы указать. Методику работы на ФЭК смотрите в паспорте прибора.
1.2. Полученные данные занести в таблицу:
1.3. На миллиметровой бумаге построить кривые светопоглощения А = f(, нм) и определить, светофильтры с какой длиной волны лучше всего использовать при работе.
2. Построение графиков.
2.1. Приготовить серии стандартных растворов. Измерить оптическую плотность каждой приготовленной серии стандартных растворов при выбранных ранее светофильтрах.
2.2. Экспериментальные данные занести в таблицу (см. ниже) для каждой серии растворов отдельно, провести статистическую обработку полученных результатов.
2.3. По табличным данным на миллиметровой бумаге построить графики А = f(C вещества) и вычислить растворимость фенолфталеина в растворителях.
Изучив, литературу по вопросу растворимости фенолфталеина, были подобранны методики, указанные выше. И сравнив их по возможности применения в наших лабораторных условиях, по продолжительности проведения, по простоте выполнения была выбрана методика гравиметрического определения растворимости.
2. Экспериментальная часть
2.1 Синтез фенолфталеина
Синтез проводился по методике указанной в литературном обзоре (пункт 1.4.1).
| Действие | наблюдение |
| 1.Отвесил: 5 г –фталевого ангидрида (х.ч.д.а) | Белый кристаллический порошок Розоватые, расплывающиеся кристаллы |
| 2.Поместил реагенты в плоскодонную коническую колбу (на 100 мл), размешал находящимся в ней термометром. | Образовалась кашеобразная масса, происходит небольшой разогрев смеси (t ? 37 0 C). |
| 3.Поставил колбу греется на песчаную баню (температура в пределах 125 – 130 0 С). Нагревал в течении 1,5 часа. | При температуре 45 0 С происходит расплавление фенола, фталевый ангидрид (белые хлопья) плавают в буроватом плаве. После проведения нагревания в течении 30 минут (t ? 130 0 C) образовался однородный буро – малиновый плав. После 1 часа нагревания – однородный расплав кроваво-красного цвета. Через 1,5 часа нагревание прекратил. |
| 4. Перелил горячий расплав в колбу с кипящей водой и произвёл отгон не прореагировавшего фенола с водяным паром (рисунок установки см. в соответствующем разделе литературного обзора). | В колбе с кипящей водой после приливания горячего расплава стали плавать светло жёлтого цвета неоформленные кусочки фенолфталеина, происходит небольшое помутнение воды, t ? 99 0 С. Происходит выделение мутного отгона (V = 50 мл). После 15 минут перегонки начал капать прозрачный дистиллят. |
| 5.Декантировал раствор с фенолфталеином на воронку Бюхнера, не перенося осадок на фильтр. Промыл осадок тремя порциями холодной воды, по 100 мл каждая. | Температура раствора 26 0 С, в растворе (V?170мл) крупинковидные кусочки фенолфталеина, чуть желтоватого цвета. |
| 6.Растворил в 15 мл тёплого раствора гидроксида натрия (? = 5 %) отфильтрованный фенолфталеин. | T NaOH ?42 0 С, произошло окрашивание раствора – тёмно-красный цвет. |
| 7.Провёл фильтрование тёмно – красного раствора. | Температура раствора? 35 0 С. После окончания фильтрования на фильтре осел тонкий, розово-белый, мелкокристаллический слой вещества (скорее всего это не прореагировавший фталевый ангидрид). |
| 8.К фильтрату (V? 50 мл) прибавил 5 мл уксусной кислоты (к.), порциями по 1 мл, перемешивая. | Произошло изменение окраски раствора от тёмно-красного до серо-белого, мутного (хлопьевидного) раствора. Разогревания раствора не произошло. Температура раствора? 31 0 С. |
| 9.Прибавил 2 капли соляной кислоты (к.) | Визуальных изменений не произошло |
| 10.Оставил стоять на 1 час. | Произошло оседание хлопьев на дне стакана, сверху над осадком прозрачный раствор, хлопья серовато- белого цвета. |
| 11.Отфильтровал полученный осадок. | На фильтре бело-сероватая кашица. M вл? 5.07 г. |
Всего получено 5,07 г влажного препарата.
2.2 Перекристаллизация из горячего спирта
Перекристаллизация проводилась по методике, указанной в литературном обзоре (пункт 1.4.4). Была проведена одна повторность. Рисунок прибора изображён в пункте 1.4.4 литературного обзора.
| Действие | Наблюдение |
| Навеску фенолфталеина (5,07 г) поместил в колбу и прилил 50 мл 96% этанола. | Небольшая часть феолфталеина растворилась. Спирт слегка помутнел. |
| Колбу нагрел до слабого кипения. Добавил спирт до полного растворения фенолфталеина (по 0,5 мл). V ETOH = 7 мл. | фенолфталеин растворился полностью. Спирт мутноват. t смеси = 85 о С. |
| Смесь медленно охладил до комнатной температуры. | t смеси = 19 о С. Из раствора выпало много белых кристаллов в виде мелких кристаллов. Раствор прозрачный. |
| Выпавшие кристаллы отсосал и, промыв на фильтре ледяной водой, высушил между листами фильтровальной бумаги. | фенолфталеин получен в виде воздушных кристаллов бело-серого цвета, мелкозернистый. m(фенолфталеина)= 4,08 г. Выход перекристаллизации составил 83,5%. |
Расчёт перекристаллизации:
Выход перекристаллизации:
W,% = (m(фенолфталеин) перекр сух 100 %) / m(фенолфталеина) вл
W,% =  % = 83,5 %
% = 83,5 %
Расчёт выхода синтеза:
Для получения 0,0388 моль фенолфталеина (теорет.) или m = 0,0338 моль 318 г/моль = 10,7 г.
Выход от теоретического:
W =  100 % = 40, 5 %
100 % = 40, 5 %
Таким образом, получено в принципе достаточное количество фенолфталеина (около 4,08 г) для проведения дальнейших исследований. Синтез проведён с приемлемым выходом продукта.
2.3 Определение растворимости
Определение растворимости фенолфталеина проводилось методом гравиметрии (см. пункт 1.7.1).
В качестве растворителей были выбраны хлороформ, бензол и ксилол. так как по литературным данным (см.таблицу 5) в них фенолфталеин имеет приемлемую растворимость для имеющейся массы фенолфталеина. Не использовал воду, так как фенолфталеин имеет очень маленькую растворимость (порядка 10 -4 г в 100 г). Также не использовал этанол, потомучто фенолфталеин имеет очень хорошую растворимость в спирте и потребуется большой расход вещества. Определение проводилось при 21 ± 1 о С (температура жидкой фазы). Настаивание длилось 30 ± 1 мин, при интенсивном перемешивании.
Расчётные формулы:
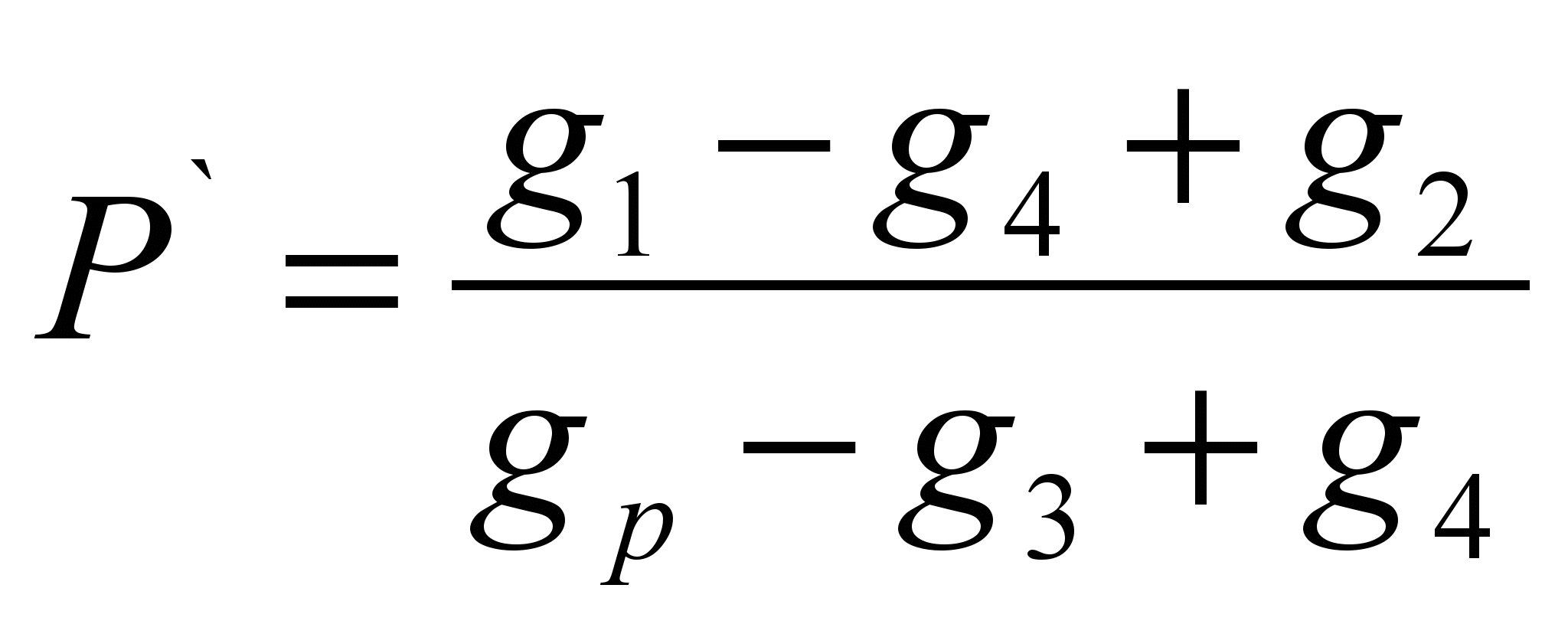 ; Р = Р` · 100 (г/100 г)
; Р = Р` · 100 (г/100 г)
Где,g 1 – навеска фенолфталеина, г;
G 2 – масса сухого фильтра, г;
G 3 – масса влажного фильтра с остатками фенолфталеина, г;
G 4 – масса сухого фильтра с остатками фенолфталеина, г;
G p – навеска растворителя, г;
Р – растворимость, г/100 г раств;
Р`- удельная растворимость, г/1 г раств.
Результаты определения:
Р (фенолфталеин / хлороформ) = (3,0 ± 0,03) г / 100 г хлороформа; ? = 1 %.
Р (фенолфталеин / ксилол) = (0,22 ± 0,01) г / 100 г ксилола; ? = 6 %.
Р (фенолфталеин / бензол) = (0,19 0,01) г/ 100 г бензола; = 6 %.
По данным эксперимента, построена сводная таблица и график.
Таблица 7
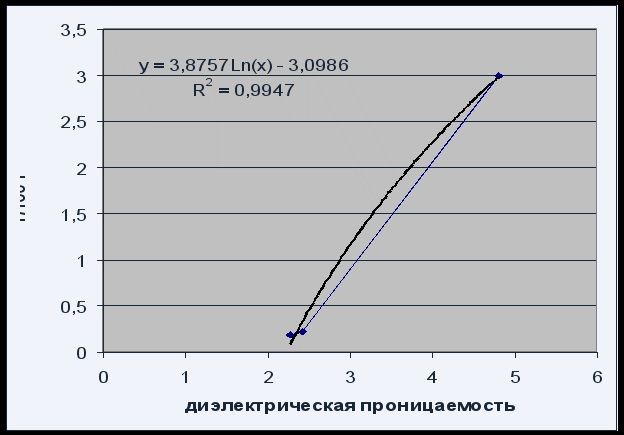
Рис.4 Зависимость растворимости от диэлектрической проницаемости растворителя
Зависимость растворимости от диэлектрической проницаемости растворителя, может быть описана логарифмическим уравнением Р = 3,8757 Ln(x) – 3.0986 с удовлетворительным качеством R 2 = 0,995.
В связи с тем, что растворимость фенолфталеина увеличивается с увеличением диэлектрической проницаемости растворителя (увеличением его полярности), можно говорить о том, что фенолфталеин полярное соединение.
Заключение
В ходе выполнения работы, было проанализировано 26 литературных источников. Описаны общее положение получения с помощью реакции взаимодействия фенола и фталевого ангидрида. Проведён обзор методик синтеза (найдена одна методик, в разных литературных источниках методика отличалась по массе загрузки реагентов) фенолфталеина. Проведение синтеза по данной методике не осложнено побочными процессами. Определены основные опасности при проведении синтеза и в обращении с используемыми веществами. Подобранны методики по определению растворимости. В качестве растворителей для определения растворимости были выбраны хлороформ, ксилол и бензол.
Осуществлён синтез фенолфталеина с выходом 40,5 %. Условия синтеза, очистки и выделения были соблюдены в точном соответствии с данными методики.
Растворимость фенолфталеина (по данным гравиметрического определения) составила: 3,00 ± 0,03 г/100г хлороформа, 0,22± 0,01 г/100г ксилола, 0,19 ± 0,01 г/100г бензола.
Увеличение растворимости фенолфталеина при увеличении диэлектрической проницаемости растворителя, подтверждает, что фенолфталеин иполярное соединение.
Список использованной литературы
1.Агрономов А.Е. лабораторные работы по органической химии. – М.: Просвещение, 1977. 230 с.2.Астахова Л.И., Кривенько А.П. Практикум по органической химии. – М.: Мир, 1990. 180 с.
3.Бишот Э. Индикаторы. – М.: Мир, 1976. 356 с.
4.Бюлер К., Пирсон Д. Органические синтезы. М.: Высш. Шк., 1973. 340 с.
5.Герасимов Я.И. Термодинамика растворов. – М.: Изд – во МГУ, 1980. 170 с.
6.Гитис С. С. Практикум по органической химии /С. С. Гитис, А. И. Глаз, А. И. Иванов. – М.: ВШ,1991.
7.Голодников Г.В. Практикум по органической химии. – М.: Химия, 1978. 160с.
8.Грандберг И. И. Практические работы и семинарские занятия по органической химии: Пособие для студ. вузов. – 4-е изд., перераб. и доп. – М.: Дрофа, 2001.
9.Иванов В. Г. Практикум по органической химии: Учеб. Пособие для студ. высш. пед. учеб. заведений /В. Г. Иванов, О. Н. Гева, Ю. Г. Гаверова. – М.: Издательский центр «Академия», 2000.
10.Карапетьянц М.Х. Введение в теорию химических процессов. – М.: Высш. Шк., 1975. 280 с.
11.Кирилин В.А. Термодинамика растворов. – М.: Энергия, 1980. 80 с.
12.Коган В.Б. Справочник по растворимости. – М.: Л. Изд-во Академия наук, 1961. 300 с.
13.Левина Р. Я. Практические работы по органической химии. – М.: Химия, 1980.
14.Органикум: Практические работы по органической химии. – М.: Мир,1979 – Т.2.
15.Петров А. А. Органическая химия: Учебник для вузов /А. А. Петров, Х. В. Бальян, А. Т. Трощенко. – 5-е изд., перераб. и доп. – СПб.: Иван Фёдоров, 2002.
16.Райхард К. Растворители и эффекты среды в органической химии. – М.: Мир, 1991. 182 с.
17.Руководство к лабораторным занятиям по органической химии: Пособие для вузов /Н. Н. Артемьева, В. Л. Белобородова, С. Э. Зурабян и др.; Под ред. Н. А. Тюкавкиной. – 2-е изд., перераб. и доп. – М.: Дрофа, 2002.
18.Свойства органических соединений: справочник /Под ред. А. А. Потехина. – Л.: Химия, 1984.
19.Смолина Т. А. Практические работы по органической химии: малый практикум /Т. А. Смолина, Н. В. Васильева, Н. Б. Куплетская. – 2-е изд., перераб. – М.: Просвещение, 1986.
20.Справочник химика /Под ред. Б. Н. Никольского и др. – Л.: Химия, 1964.
21.Стромберг А. Г. Физическая химия: Учеб. для хим. спец. вузов /А. Г. Стромберг, Д. П. Семченко; Под ред. А. Г. Стромберга. – 5-е изд., испр. – М.: ВШ, 2003.
22.Травень В. Ф. Органическая химия: Учебник для вузов. – М.: ИКЦ «Академкнига», 2004. – Т.1.
23.Физическая химия. В 2 кн. Кн. 1. Строение вещества. Термодинамика: Учеб. для вузов /К. С. Краснов, Н. К. Воробьёв, И. И. Годнев и др.; Под ред. К. С. Краснова – 3-е изд., испр. – М.: ВШ, 2001.
24.Фиалков Ю.А. Растворитель как средство управления химическим процессом. - Л.: Химия, 1990. 240 с.
25.Химический энциклопедический словарь /Под ред. И. Л. Кнунянца и др. – М.: Советская энциклопедия, 1983.
26.Храмкина М.Н. Практикум по органическому синтезу. – М.: Изд-во МГУ, 1985. 473 с.
Эмпирическая формула Фенолфталеина: C20H14O4 .
Что такое Фенолфталеин?
Согласно Википедии, 4,4′-диоксифталофенон или 3,3-бис-(4-гидроксифенил)фталид представляет собой кислотно-основный индикатор .
Такие вещества как лакмус, фенолфталеин, метилоранж широко используются в химии для определения кислотности растворов.
В неизмененном виде средство представляет собой прозрачные кристаллы, которые плохо растворяются в воде, но зато хорошо растворимы в спиртах и диэтиловом эфире . Синтезировать вещество можно из фенола и фталевого ангидрида с помощью реакции конденсации, с использованием хлорида цинка как катализатора (еще можно использовать концентрированную серную кислоту ).
Данное вещество в кислой среде (рН от 0 до 3) приобретает ярко выраженный оранжевый оттенок. В слабокислой и нейтральной средах (рН от 4 до 7) раствор не изменит своей окраски. С помощью Фенолфталеина можно распознать щелочную среду. Так как средство приобретает малиновый цвет в растворе, рН которого от 8 до 10 (щелочной р-р). Если значения водородного показателя от 11 до 14, то индикатор никак не повлияет на окраску препарата. Фенолфталеин используют для титрования различных водных растворов в аналитической химии , обычно применяется вещество, растворенное в спирте.
Также Фенолфталеин получил широкое применение в медицине. Что такое Пурген ? Это – синоним Фенолфталеина. В прошлом веке вещество активно использовалось в качестве слабительного средства. Препарат активно стимулирует перистальтику кишечника. Сейчас Пурген-слабительное используют редко, в связи с его способностью накапливаться в организме и неблагоприятно влиять на работу почек.
Фармакологическое действие
Слабительное.
Фармакодинамика и фармакокинетика
Фенолфталеин, что это такое?
Пурген – это мощное слабительное средство. Механизм его действия основан на усилении перистальтики кишечника. Происходит это благодаря способности вещества угнетать натрий-калий АТФазу , стимулируя аденилциклазу и повышая биосинтез . Вещество стимулирует синапсы и нервные окончания стенок кишечника, нарушается водно-электролитный баланс в ЖКТ , накапливается жидкость.
После первого приема эффект от средства наступает в течение суток. Вещество имеет свойство кумулироваться в организме, оказывает раздражающее действие на почки, обладает проканцерогенными свойствами.
Показания к применению
Препараты, содержащие данное вещество используют в качестве слабительного средства при хронических .
Противопоказания
Слабительное Пурген противопоказано:
- при заболеваниях почек;
- пациентам с кишечной непроходимостью ;
- при на Фенолфталеин;
- при обнаружении у больного комплекса симптомов “острый живот ”.
Лекарство нельзя использовать длительно. Особую осторожность необходимо соблюдать при лечении средством пожилых лиц.
Побочные действия
Таблетки пурген могут вызвать:
- учащенное сердцебиение, вследствие нарушения водно-электролитного баланса ;
- альбуминурию ;
- коллапс ;
- снижение уровня калия в крови;
- изменение цвета мочи от желтого к розовому или коричневому;
- кожные высыпания и .
Инструкция на Пурген (Способ и дозировка)
Слабительное выпускают в виде таблеток, различной дозировки или порошка для приема внутрь.
Инструкция по применению Фенолфталеина
В среднем, суточная дозировка для взрослого составляет 100 мг.
Детям назначают по 50-200 мг средства в день, в зависимости от их возраста и веса.
Максимальное количество вещества, которое можно принять в течение 24 часов – 300 мг.
Курс лечения назначает специалист. Препараты, содержащие данный компонент нельзя принимать в течение длительного времени.
Передозировка
Лекарство может вызвать геморроидальные кровотечения , значительное снижение , вплоть до коллапса , появление белка в моче. При передозировке средством рекомендуется обратиться к врачу.
Взаимодействие
Фенолфталеин может привести к задержке калия в организме, если параллельно проводится терапия калийсберегающими диуретиками .
Условия продажи
Рецепт не требуется.
Условия хранения
Хранят препараты на основе Фенолфталеина в защищенном от детей, сухом, темном месте, при комнатной температуре.
Срок годности
Порошок имеет неограниченный срок годности, таблетки можно хранить в течение 10 лет (если производителем на упаковке не указано иначе).
Особые указания
Сейчас лекарства, содержащие фенолфталеин, в медицине используют редко. Чаще всего отдают предпочтение другим современным, безопасным слабительным средствам.
Детям
Вещество назначают с осторожностью. Нужна коррекция дозировки, в зависимости от возраста и веса ребенка.
Пожилым
У лиц преклонного возраста эффект от приема данного средства наступает в течение 24- 72 часов.
Для похудения
В начале прошлого века вещество использовали, чтобы сбросить вес. Сейчас появились другие препараты, обладающие аналогичным эффектом. Многие девушки в погоде за идеальной фигурой злоупотребляют слабительными, чего делать не следует. Это может быть опасно для вашего здоровья.
Препараты, в которых содержится (Аналоги)
Совпадения по коду АТХ 4-го уровня:
Экс Лакс, Пурген, Пургофен, Пургил, Феналоин, Лаксатол, Лаксоил.
Цена Пургена, где купить
Цена слабительного в виде порошка Фенолфталеина в оптовой продаже составляет порядка 1700 рублей за 1 кг.
Купить в Москве средство практически невозможно, так как препараты на его основе уже давно не поступают в аптеки.
Цена Фенолфталеина может различаться, в зависимости от производителя.
