ฟีนอล์ฟทาลีนคืออะไร. อันตรายหลักในการกลั่นด้วยไอน้ำ
(เอกสาร)
n2.doc
หน่วยงานกลางเพื่อการศึกษา
การทดลองทั่วไป 1: การไทเทรต
ทำไมคุณจึงควรแน่ใจว่าดวงตาของคุณยังมีรอยอยู่เมื่อเติมน้ำสองสามหยดสุดท้าย
- สารละลายมาตรฐานนี้มีความเข้มข้นเท่าใด
- จุดประสงค์ของการล้างบีกเกอร์และกรวยด้วยน้ำคืออะไร?
- วัตถุประสงค์ของการล้างภายในขวดปริมาตรด้วยน้ำคืออะไร?
วิธีการตกผลึกใหม่จากแอลกอฮอล์ร้อน
จากตาราง กำหนดปริมาตรการไทเทรตเฉลี่ยสำหรับการทดสอบนี้ และใช้ค่านี้ในการคำนวณส่วนที่เหลือของคุณ ใช้ตัวอย่างก่อนหน้านี้ กำหนดความเข้มข้นของกรดอะซิติกในตัวอย่างน้ำส้มสายชู โปรดจำไว้ว่าคุณมีข้อมูลต่อไปนี้: ปริมาตรเถา ปริมาตรของสารละลายโซเดียมไฮดรอกไซด์, ความเข้มข้นของสารละลายโซเดียมไฮดรอกไซด์ กำหนดความเข้มข้นของสารละลายโซเดียมไฮดรอกไซด์โดยไม่ทราบความเข้มข้น
สถานะ สถาบันการศึกษาการศึกษาวิชาชีพที่สูงขึ้น
ปอมเมอเรเนียน มหาวิทยาลัยของรัฐตั้งชื่อตาม M.V. Lomonosov
ภาควิชาเคมี
งานหลักสูตร
การสังเคราะห์ฟีนอฟทาลีน
การศึกษาความสามารถในการละลายในตัวทำละลายที่มีอิเล็กทริกอนุญาตต่างกัน
สมบูรณ์:
กรดและเบสเข้มข้นสามารถทำให้เกิดแผลไหม้ได้ ขอแนะนำให้ใช้ถุงมือและแว่นตาเมื่อคุณทำงานกับกรดหรือเบส ตรวจสอบให้แน่ใจว่าบิวเรตต์ปิดอยู่ ค่อยๆ เติมสารละลายกรดออกซาลิกมาตรฐานลงในบิวเรตต์จนเต็มบิวเรต วางบีกเกอร์ที่สะอาดไว้ใต้บิวเรตต์ และค่อยๆ ใส่สารละลายกรดออกซาลิกลงไป เพื่อให้แน่ใจว่าไม่มีฟองอากาศในบิวเรต ด้านบนของโซลูชันควรอยู่ระหว่างเครื่องหมาย 0 ถึง 1 cm3 บันทึกค่าเป็นทศนิยมตำแหน่งที่สอง ใช้ปิเปตตวงสารละลาย 20 ซม.3 ในขวดทรงกรวย เติมฟีนอฟทาลีนอินดิเคเตอร์ 3-4 หยดลงในขวดทรงกรวย ทำการทดลองไทเทรตอย่างคร่าวๆ โดยเติมกรดออกซาลิกอย่างรวดเร็วลงในขวดทรงกรวยและหมุนขวดทรงกรวยอย่างต่อเนื่อง หยุดทันทีที่สีของสารละลายเปลี่ยนไปและหลังจากหมุนแล้วก็จะเปลี่ยนไป หากยังเปลี่ยนสีไม่คงอยู่เมื่อหมุนขวดแก้ว ให้เติมกรดออกซาลิกเพิ่มจนกว่าจะไม่มีสีเหลืออยู่ ทำซ้ำขั้นตอนที่ 4-7 ด้วยขวดทรงกรวยอันที่สอง เติมกรดออกซาลิกลงในขวดทรงกรวยอย่างรวดเร็วจนกว่าคุณจะเติมน้อยกว่าปริมาตรการไทเทรตรวมของคุณ 2 cm3 บน ช่วงเวลานี้ไม่ควรมีการเปลี่ยนสีที่คงทน ค่อยๆ เติมกรดออกซาลิก น้ำวนระหว่างแต่ละหยด และถ้าจำเป็น ให้ล้างด้านข้างของขวดด้วยน้ำ เมื่อสารละลายเปลี่ยนสีและยังคงเป็นสีใหม่ ให้สังเกตปริมาตรบนบิวเรต โปรดจำไว้ว่าปริมาตรที่ไทเทรต: - เพื่อความแม่นยำ ให้ทำซ้ำขั้นตอนที่ 9-11 จนกว่าคุณจะได้ค่าที่อ่านได้สามครั้งโดยมีค่าความแตกต่างไม่เกิน 0.1 cm3
- ทำเครื่องหมายหนึ่งในแก้ว \\.
- ใช้ปิเปตตวงน้ำ 100 cm3 ลงในบีกเกอร์
- เพิ่มประมาณ 4 g \\ ลงในแก้วแล้วคนให้เข้ากัน
- ติดบิวเรตต์เข้ากับขาตั้งรีทอร์ทและวางกรวยขนาดเล็กไว้ด้านบน
- สารละลายโซเดียมไฮดรอกไซด์เมื่อเติมฟีนอล์ฟทาลีนมีสีอะไร?
- สีอะไรเมื่อเติมกรดเพียงพอ?
นักศึกษาชั้นปีที่ 3
ภาควิชาเคมี
อัลเฟรอฟ วลาดิมีร์ อิวาโนวิช
ตรวจสอบแล้ว:
รองศาสตราจารย์ แคนด์ เคมี วิทยาศาสตร์
Levandovskaya T.V.
รองศาสตราจารย์ แคนด์ เทคโนโลยี วิทยาศาสตร์
ชาจิน่า เอ็น.บี.
อาร์คันเกลสค์
1. การทบทวนวรรณกรรม………………………………………………..5
ลักษณะและคุณสมบัติทางกายภาพของฟีนอฟทาลีน………….5
การประยุกต์ใช้ฟีนอล์ฟทาลีน………………………………………………...6
คุณสมบัติทางเคมี………………………………………………...8
การได้รับฟีนอฟทาลีน…………………………………………11
1.4.2 คุณสมบัติทางกายภาพสารที่ใช้ในการสังเคราะห์….15
ใช้ตัวอย่างก่อนหน้านี้ กำหนดความเข้มข้นของสารละลายโซเดียมไฮดรอกไซด์ โปรดจำไว้ว่าคุณมีข้อมูลต่อไปนี้: ปริมาตรของสารละลายโซเดียมไฮดรอกไซด์ในปริมาตรของสารละลายกรดออกซาลิก ความเข้มข้นของสารละลายกรดออกซาลิก สมการเคมีที่ดุลแล้วสำหรับปฏิกิริยานี้
คำนวณมวลของกรดออกซาลิกที่นักเรียนต้องละลายเพื่อสร้างสารละลายมาตรฐานที่ต้องการ เขาเชื่อว่าสารละลายกรดออกซาลิก 40 ซม. 3 จะทำให้สารละลายโซเดียมไฮดรอกไซด์เป็นกลาง 35 ซม. 3
- เราต้องการกรดออกซาลิกจำนวนมาก
- อย่างไรก็ตาม เรายังไม่ทราบจำนวนโมล
1.4.3 ขั้นตอนการกลั่นด้วยไอน้ำ……………………….16
1.4.4 วิธีการตกผลึกใหม่จากแอลกอฮอล์ร้อน………….18
1.5 ข้อควรระวังเพื่อความปลอดภัย………………………………………………20
1.5.1 อันตรายหลักเมื่อทำงานกับกรดเข้มข้น………………………………………………………………..20
1.5.2 อันตรายหลักในการกลั่นด้วยไอน้ำ……..21
- เขียนสมการเคมีที่สมดุลสำหรับปฏิกิริยา
- คำนวณความเข้มข้นของกรด
ฝนกรดนี้มักถูกบันทึกไว้เป็นครั้งแรกในศตวรรษที่ 19 แต่ไม่ถึงศตวรรษที่ 20 ความเป็นกรดนี้แพร่หลายในระดับอันตรายที่เราเชื่อมโยงกับคำว่า "ฝนกรด" ตัวการสำคัญคือถ่านหินที่มีกำมะถันเป็นสิ่งเจือปน เมื่อเผาในโรงไฟฟ้า กำมะถันนี้จะรวมตัวกับออกซิเจนเพื่อสร้างก๊าซซัลเฟอร์ไดออกไซด์ ซึ่งลอยขึ้นทางปล่องไฟและกระจายออกไปในชั้นบรรยากาศ
1.5.3 อันตรายหลักระหว่างการตกผลึกซ้ำจากแอลกอฮอล์ร้อน…………………………………….21
22
1.6 ลักษณะของตัวทำละลาย………………………………….24
1.6.1 การจำแนกประเภทของตัวทำละลายตามคุณสมบัติทางกายภาพ…25
กรดซัลฟิวริกเป็นกรดที่แรงมาก และเมื่อน้ำควบแน่นจากอากาศจนเกิดเป็นเม็ดฝน กรดจะละลายลงไปในน้ำ แล้วฝนก็ตกลงมาสะสมในร่างกาย น้ำจืดเพิ่มความเป็นกรด ภาคตะวันออกเฉียงเหนือของสหรัฐอเมริกาได้รับความเดือดร้อนมากที่สุดเนื่องจากหุบเขาโอไฮโอรวมถึงพื้นที่โอไฮโอและเพนซิลเวเนียเป็นสถานที่ที่มีการขุดถ่านหินมากที่สุดในช่วงครึ่งศตวรรษที่ผ่านมา เนื่องจากสภาพอากาศแปรปรวน ก๊าซไอเสียเหล่านี้จึงเข้าสู่ชั้นบรรยากาศในหุบเขาโอไฮโอ แต่มีฝนตกลงมาทางตอนเหนือของรัฐนิวยอร์กและนิวอิงแลนด์
1.6.2 ระบบการจำแนกประเภทของตัวทำละลายตามพวกเขา คุณสมบัติทางเคมี………………………………………………..30
1.7 ภาพรวมของวิธีการหาค่าความสามารถในการละลายของของแข็ง…………………………………………………………………..35
1.7.1 วิธีกราวิเมตริก…………………………………….35
1.7.2 วิธีเคมีไฟฟ้า……………………………………37
1.7.3 วิธีโฟโตอิเล็กโทรแคลอริเมตริก……………………..41
ความเป็นกรดของฝนที่เพิ่มขึ้นสามารถทำลายล้างได้ สิ่งสกปรกที่เป็นโลหะในดินซึ่งมักจะจับตัวแน่นกับสารประกอบอื่น ๆ สามารถถูกชะล้างลงสู่ทะเลสาบและลำธารได้ด้วยฝนกรด ครั้งหนึ่ง บ่อหลายแห่งในนิวอิงแลนด์พิสูจน์แล้วว่าไม่สามารถรองรับปลาเทราท์ลำธารได้เพราะเหตุนี้ พืชยังไวต่อค่า pH ของดินอีกด้วย สารอาหารที่เป็นประโยชน์ยังสามารถถูกชะล้างออกจากดิน ทำให้พืชไม่สามารถอยู่รอดได้ในดิน ในพื้นที่ที่ได้รับผลกระทบหนักสามารถพบต้นไม้ตายได้หลายสิบต้นดังที่แสดงไว้ด้านบน
2. ส่วนทดลอง………………………………………………43
2.1 การสังเคราะห์ฟีนอฟทาลีน………………………………………………...43
2.2 การตกผลึกซ้ำจากแอลกอฮอล์ร้อน………………………..45
2.3 การหาค่าความสามารถในการละลาย……………………………………….47
สรุป……………………………………………………………………50
รายการบรรณานุกรม…………………………………………….51
อาคารและรูปปั้นได้รับความเสียหายจากฝนกรดซึ่งกินหินโดยเฉพาะหินปูน การสึกกร่อนที่เพิ่มขึ้นของประติมากรรม หลุมฝังศพ และแม้แต่อาคารบางแห่งทำให้เกิดความสูญเสียครั้งใหญ่ งานศิลปะบางชิ้นถูกทำลายจนหมดสิ้น
การปล่อยมลพิษได้ลดลงอย่างมากตั้งแต่นั้นมา และฝนกรดก็ลดลงด้วย อย่างไรก็ตาม ปัญหายังไม่หมดไป และยังเหลืออีกหลายอย่างที่ต้องทำเกี่ยวกับปัญหาสิ่งแวดล้อมที่ร้ายแรงนี้ มาดูกรดไฮโดรคลอริกซึ่งเป็นองค์ประกอบหลักของกรดในกระเพาะอาหาร และโซเดียมไฮดรอกไซด์ซึ่งมักเรียกกันว่า "น้ำด่าง" และใช้ในสบู่ อย่างไรก็ตาม ไฮโดรเนียนและไฮดรอกไซด์เกือบทั้งหมดรวมตัวกันเพื่อสร้างโมเลกุลของน้ำ เหลือไว้เพียงคลอไรด์-วิวเวอร์และโซเดียมไอออน
บทนำ
ฟีนอล์ฟทาลีนเป็นหนึ่งในตัวบ่งชี้ความเป็นกรด-เบสที่ใช้กันอย่างแพร่หลายในวิชาเคมี มันอยู่ในสีย้อมไตรอารีมีเทนที่เรียกว่าพทาลีน
จุดประสงค์ของงานนี้คือการสังเคราะห์ฟีนอฟทาลีนและการศึกษาความสามารถในการละลายในตัวทำละลายที่มีค่าคงที่ไดอิเล็กตริกต่างกัน เพื่อให้บรรลุเป้าหมายนี้ จำเป็นต้องแก้ไขงานต่อไปนี้:
ถ้าปริมาณของกรดไฮโดรคลอริกเท่ากันทุกประการกับปริมาณของโซเดียมไฮดรอกไซด์ หน่วยเป็นโมล ไฮโดรเนียมแต่ละชนิดจะต้องมีไฮดรอกไซด์เพื่อทำปฏิกิริยาโดยปล่อยให้สารละลายที่เป็นกลางอยู่ในขณะนั้น ตอนนี้ควรเป็นน้ำบริสุทธิ์หนึ่งแก้วที่มีค่า pH 7 และเกลือแกงธรรมดาที่ละลายอยู่ในนั้น เราเริ่มต้นด้วยสารที่มีฤทธิ์กัดกร่อนสูงมาก 2 ชนิด และลงท้ายด้วยผลิตภัณฑ์ที่อ่อนโยน
โดยทั่วไปแล้ว เมื่อกรดและเบสทำปฏิกิริยากัน พวกมันจะทำให้กันและกันเป็นกลาง และค่า pH ของสารละลายจะเข้าใกล้ค่านี้ มันถูกเรียกว่า ".". เมื่อเติมกรดแก่และเบสแก่ในปริมาณที่เท่ากันเท่านั้น ค่า pH จึงจะแม่นยำ แต่ในหลายกรณี กรดอ่อนและเบสอ่อนรวมกัน อย่างไรก็ตามค่า pH จะเข้าใกล้ 7 แต่สารละลายจะไม่เป็นกลาง ในกรณีของฝนกรดมักจะใช้หินและดินเป็นหลักโดยเฉพาะหินคาร์บอเนตที่พบในบางพื้นที่ของประเทศ
1. วิเคราะห์วรรณกรรมในเรื่องนี้
2. เลือกวิธีการสังเคราะห์และเลือกวิธีที่เหมาะสมที่สุด
3. เพื่อดำเนินการสังเคราะห์ การแยก และการทำให้บริสุทธิ์ของผลิตภัณฑ์
4. ตรวจสอบความสามารถในการละลายในตัวทำละลายที่มีค่าคงที่ไดอิเล็กตริกต่างกัน เปรียบเทียบผลลัพธ์ที่ได้กับข้อมูลวรรณกรรม
เมื่อกรดอ่อนในฝนกรดตกลงบนหิน พวกมันจะถูกทำให้เป็นกลางโดยเบสบนใบไม้ ในโคลน และในหิน อย่างไรก็ตาม ฐานรากเหล่านี้จำนวนมาก เช่น ฐานในหิน ไม่สามารถหมุนเวียนได้ หลังจากเกิดฝนกรดมานับศตวรรษ หินจะทำให้เบสทั้งหมดในหินเป็นกลาง ฝนกรดจะเข้าสู่ระบบนิเวศเท่านั้นและไม่มีอะไรทำให้เบสเป็นกลาง
ฟีนอล์ฟทาลีน: ตัวบ่งชี้ในห้องปฏิบัติการทั่วไป
โมเลกุลฟีนอฟทาลีนมีความโปร่งใสเมื่อมีกรดและสีชมพูเมื่อมีเบส นี่เป็นตัวบ่งชี้ที่ยอดเยี่ยมสำหรับการค้นหาจุดสมมูลในการไทเทรตกรด-เบสสำหรับกรดอย่างง่าย ในส่วนที่ 5 ของส่วนที่ 8 มีการแนะนำการไทเทรตเพื่อเป็นวิธีการรวมสารละลายสองชนิดเข้าด้วยกันเพื่อให้มีปฏิกิริยาปริมาณสารสัมพันธ์ที่ควบคุมได้ ต้องใช้สารละลายที่ทราบความเข้มข้น ซึ่งมักจะอยู่ในบิวเรตต์ ซึ่งจะทำปฏิกิริยากับสารละลายที่ไม่ทราบความเข้มข้นในบีกเกอร์ข้างใต้ ปฏิกิริยาใดๆ จะใช้สำหรับการไทเทรต แต่เพื่อให้สามารถบอกได้ว่าปฏิกิริยาเสร็จสิ้นเมื่อใด จะต้องมีจุดสิ้นสุดที่มองเห็นได้
5.
ทำการสรุปเกี่ยวกับงานที่ทำ
1. การทบทวนวรรณกรรม
1.1 ลักษณะและคุณสมบัติทางกายภาพของฟีนอฟทาลีน
ฟีนอล์ฟทาลีน (Di-n-dioxydiphenylphthalide, 2,2-bis(n-hydroxyphenyl)phthalide) เป็นผงผลึกสีขาวหรือสีเหลืองเล็กน้อย เมื่อตกผลึกใหม่จากเอทานอลเจือจาง จะเกิดเม็ดขนมเปียกปูนไม่มีสี ฟีนอล์ฟทาลีนไม่มีกลิ่นและไม่เสถียรในอากาศ น้ำหนักโมเลกุล 318.3 กรัม/โมล ฟีนอล์ฟทาลีนละลายที่อุณหภูมิ 250 0 C (258 0 C) และที่มากกว่านั้น อุณหภูมิสูงประเสริฐ
ฟีนอล์ฟทาลีนสำหรับการลดน้ำหนัก
สำหรับปฏิกิริยาของกรดเบส อินดิเคเตอร์สามารถให้ข้อมูลประเภทนี้ได้ด้วยการเปลี่ยนสีเพื่อระบุจุดสิ้นสุด ดังนั้น ปฏิกิริยาการทำให้เป็นกลางของกรดเป็นปฏิกิริยาประเภทหนึ่งที่พบได้บ่อยที่สุดในการสอบวิเคราะห์การไทเทรต ดังนั้นจึงสามารถใช้การไทเทรตเพื่อหาปริมาณกรดหรือเบสในสารละลายที่ไม่รู้จักได้
เมื่อทำการไทเทรตกรดแก่กับเบสแก่ จุดสิ้นสุดจะมาถึงเมื่อ pH เท่ากับ 7 เนื่องจากสารละลายควรเป็นสารละลายในน้ำบริสุทธิ์ที่มีอิเล็กโทรไลต์เป็นกลางอยู่ในนั้น เมื่อกรดหมดไป เบสที่เราเติมลงในขวดจะไม่ถูกทำให้เป็นกลางและค่า pH ของสารละลายจะเริ่มสูงขึ้น อย่างไรก็ตาม แม้แต่หยดเล็กน้อยจากบิวเรตของเบสแก่ที่มากเกินไปก็จะเปลี่ยนค่า pH ได้ ฟีนอฟทาลีนหนึ่งหรือตัวบ่งชี้ดังกล่าวจะใสและไม่มีสีในสารละลายกรดแต่จะกลายเป็นสีชมพูเข้มในสารละลายพื้นฐานหากค่า pH สูงกว่า 2
ฟีนอล์ฟทาลีนละลายได้ในเอธานอล ไดเอทิลอีเทอร์ คลอโรฟอร์ม อะซิโตน ปิโตรเลียมอีเทอร์ เบนซิน โทลูอีน และในน้ำได้น้อย
1.2 การใช้ฟีนอฟทาลีน
ฟีนอล์ฟทาลีนเป็นหนึ่งในอินดิเคเตอร์ที่ใช้กันอย่างแพร่หลาย โดยเฉพาะอย่างยิ่งในการหาปริมาตรของกรดอ่อน
มีข้อดีหลายประการ: ไม่ไวต่ออุณหภูมิสูง ข้อผิดพลาดจากการมีอยู่ของสารโปรตีนและคอลลอยด์นั้นไม่มีนัยสำคัญ สามารถใช้กันอย่างแพร่หลายแม้ในสารละลายที่มีแอลกอฮอล์ เฉพาะสีของสารละลายอัลคาไลน์เท่านั้นที่แตกต่างจากโทนสีม่วงของสารละลายที่เป็นน้ำ ในสารละลายแอลกอฮอล์เข้มข้น รูปแบบหลักมีสีน้ำเงินม่วง ฟีนอล์ฟทาลีนสามารถใช้ในการไทเทรตกรดอินทรีย์ในสารละลายแอลกอฮอล์ หรือเพื่อหาค่าความเป็นกรดของแอลกอฮอล์และเอสเทอร์ เฮยอร์ตและแฮมเสนอการใช้โพลีโซเดียมไกลโคเลตเพื่อกำหนดระดับเบสเมื่อมีฟีนอล์ฟทาลีน ได้ผลลัพธ์ที่น่าพอใจโดยการไตเตรทกรดอินทรีย์ 210 -6 - 3010 -6 กรัมในปริมาณ 2.710 -6 - 4010 -6 ลิตร ต่อหน้าฟีนอฟทาลีน จากการวิจัยของ Mick ความเข้มข้นของอินดิเคเตอร์มีบทบาทสำคัญมากในการวัดกรดไมโคร ฟีนอล์ฟทาลีนเป็นส่วนประกอบของอินดิเคเตอร์หลายชนิด เนื่องจากคุณสมบัติของมันจึงเหมาะสำหรับการวัดค่าความร้อนของ pH โดยใช้สารละลายบัฟเฟอร์หรือวิธีของ Michaelis โดยไม่ใช้สารละลายบัฟเฟอร์ รูปแบบสีเป็นไปตามกฎของเบียร์ในความเข้มข้นที่หลากหลาย
ตัวบ่งชี้กรดมีหลายประเภท
การที่ฟีนอล์ฟทาลีนเปลี่ยนสีได้สูงกว่า 0 เล็กน้อยมักจะส่งผลให้เกิดข้อผิดพลาดน้อยมากในการทดลอง นอกจากฟีนอฟทาลีนแล้ว อินดิเคเตอร์อื่นๆ ได้แก่ โบรโมไทมอลบลูและเมทิลออเรนจ์ สำหรับสารละลายที่แตกต่างจากจุดสิ้นสุดเพียงเล็กน้อย โบรโมไทมอลบลูเป็นตัวบ่งชี้ที่ดี ต่ำกว่าค่า pH 7 สารละลายมีสีเหลืองและเปลี่ยนเป็นสีน้ำเงินเหนือค่า pH เมื่อจุดสิ้นสุดของการไทเทรตค่อนข้างเป็นกรด จะใช้เมทิลออเรนจ์
ฟีนอล์ฟทาลีนยังสามารถใช้เป็นรีเอเจนต์ในการวิเคราะห์เชิงคุณภาพได้อีกด้วย จากข้อมูลของแซคส์ ไฮดรอกไซด์ของโลหะบางชนิดที่ไม่ละลายน้ำ เช่น ตะกั่ว แคดเมียม สังกะสี แมกนีเซียม ฯลฯ จะให้สีเมื่อฉีดพ่นด้วยฟีนอฟทาลีน ซึ่งอธิบายได้จากการดูดซับของอินดิเคเตอร์ ปฏิกิริยาอีกกลุ่มหนึ่งขึ้นอยู่กับข้อเท็จจริงที่ว่าในฟีนอฟทาลีนที่เป็นกลางที่เป็นด่างจะถูกรีดิวซ์โดยสังกะสีเป็นฟีนอฟทาลีนที่ไม่มีสี สารประกอบลิวโกนี้ถูกออกซิไดซ์โดยสารบางอย่าง จากนั้นสีแดงของฟีนอฟทาลีนก็ปรากฏขึ้นอีกครั้ง ผลที่คล้ายกันนี้สังเกตได้จากไอออนไซยาไนด์ในปริมาณเล็กน้อยมาก (0.01-0.05 มก./ล.) เมื่อมีร่องรอยของคอปเปอร์ซัลเฟต ที่ทองแดงในปริมาณที่น้อยมาก (10 -4 - 10 -5%) การนำไฮโดรเจนเปอร์ออกไซด์เข้าสู่ระบบทำให้อัตราของกระบวนการออกซิเดชันของสารประกอบ leuco เพิ่มขึ้น
หนึ่งในอนุพันธ์ของฟีนอฟทาลีน - ฟีนอฟทาลีนฟอสเฟต - ใช้ในการกำหนดกิจกรรมของเอนไซม์ฟอสฟาเตส ฟีนอล์ฟทาลีนฟอสเฟตนั้นไม่มีคุณสมบัติเป็นตัวบ่งชี้ แต่ถูกทำลายโดยการกระทำของเอนไซม์ กลุ่มฟอสเฟตจะถูกแยกออกภายใต้การกระทำของสารตั้งต้น และสีแดงของฟีนอฟทาลีนจะปรากฏขึ้น
ในทางการแพทย์ ฟีนอฟทาลีนใช้เป็นยาระบาย และเรียกยานี้ว่า purgen
1.3 คุณสมบัติทางเคมี
ช่วงการเปลี่ยนสีของฟีนอฟทาลีนมีตั้งแต่ pH 8.2 (ไม่มีสี) ถึง pH 9.8 (สีม่วงแดง) ในการกำหนดช่วงเวลาการเปลี่ยนแปลง จะใช้ชุดสารละลายบัฟเฟอร์ที่มีค่า pH ต่อไปนี้: 7.8-8.0-8.2-8.4-9.0-9.6-9.8-10.0-10.2 ค่า pH ที่สีชมพูแรกปรากฏขึ้นขึ้นอยู่กับความเข้มข้นของตัวบ่งชี้ ความเข้มของสีม่วงจะค่อยๆ เพิ่มขึ้นจนถึง pH 9.8: pH 1/2 9.53
กระบวนการสร้างไดแอนไอออนสีของโครงสร้างควินอยด์ (III) ซึ่งเกิดขึ้นจากอันตรกิริยาของฟีนอฟทาลีนกับสารละลายอัลคาไลเจือจาง (pH8.5) สามารถแสดงได้ดังนี้:
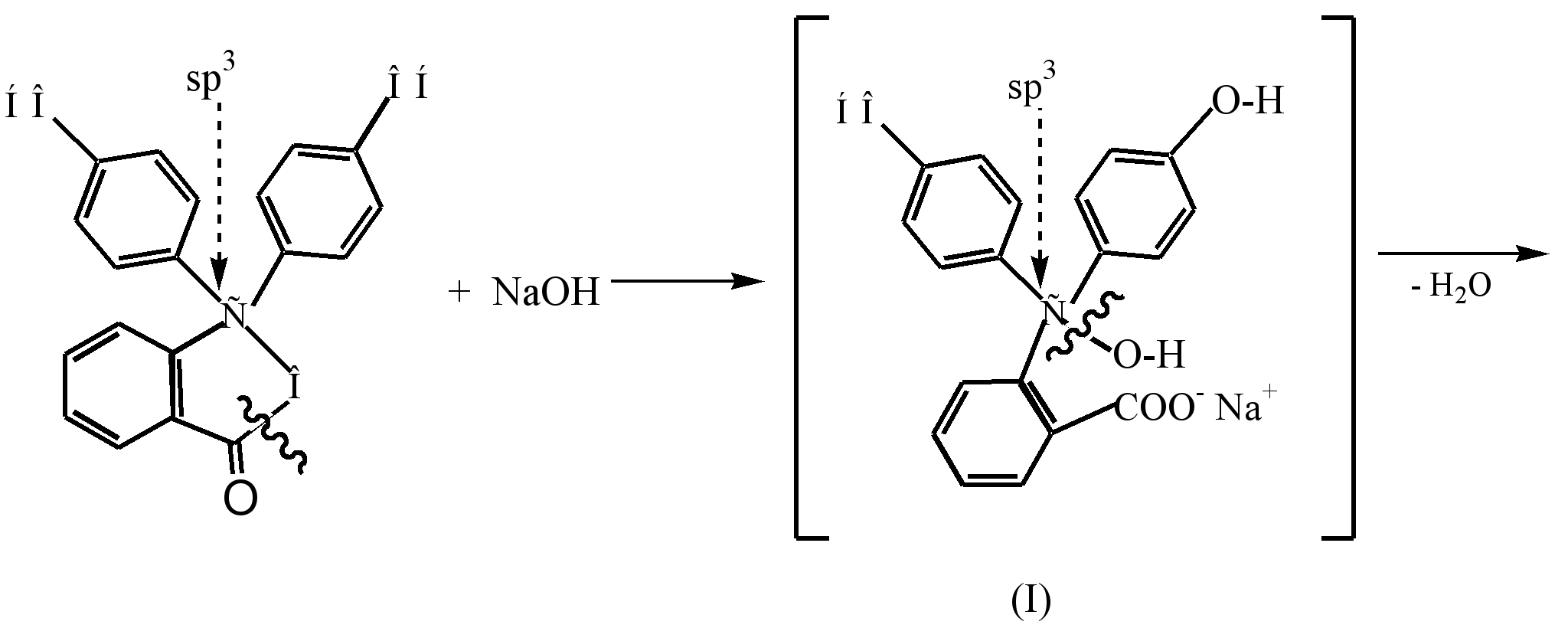

ภายใต้การกระทำของอัลคาไลในฟีนอฟทาลีนที่ไม่มีสี วงแหวน β-แลคโตนจะเปิดขึ้น (ไฮโดรไลซิส) และแอลกอฮอล์ไร้สี (I) ที่เกิดขึ้นจะแยกโมเลกุลของน้ำออกโดยธรรมชาติเพื่อสร้างเป็นเกลือโมโนโซเดียม (II) สีเหลือง. ปฏิสัมพันธ์เพิ่มเติมกับอัลคาไลนำไปสู่การก่อตัวของเกลือไดโซเดียม (III) และทำให้สีราสเบอร์รี่เข้มขึ้น ซึ่งเป็นผลมาจากการยืดตัวของห่วงโซ่การผันคำกริยา
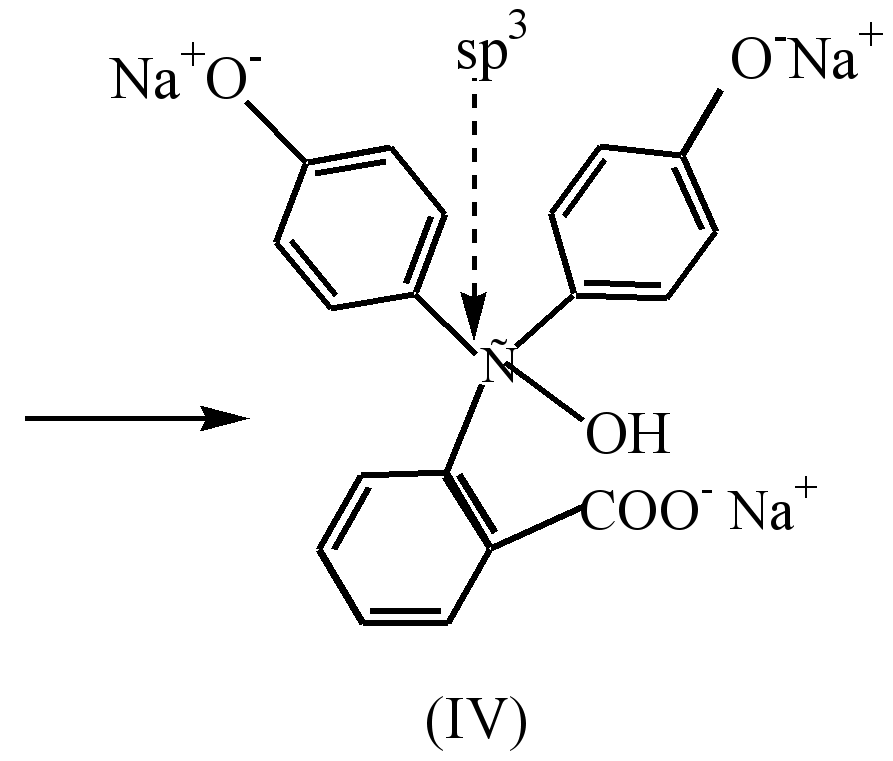
ในตัวกลางที่มีความเป็นด่างสูง (рН10) การเปลี่ยนสีของสารละลายจะสังเกตได้จากการเปลี่ยนของเกลือไดโซเดียม (III) เป็นเกลือไตรโซเดียม (IV) ซึ่งวงแหวนจะไม่ถูกผัน
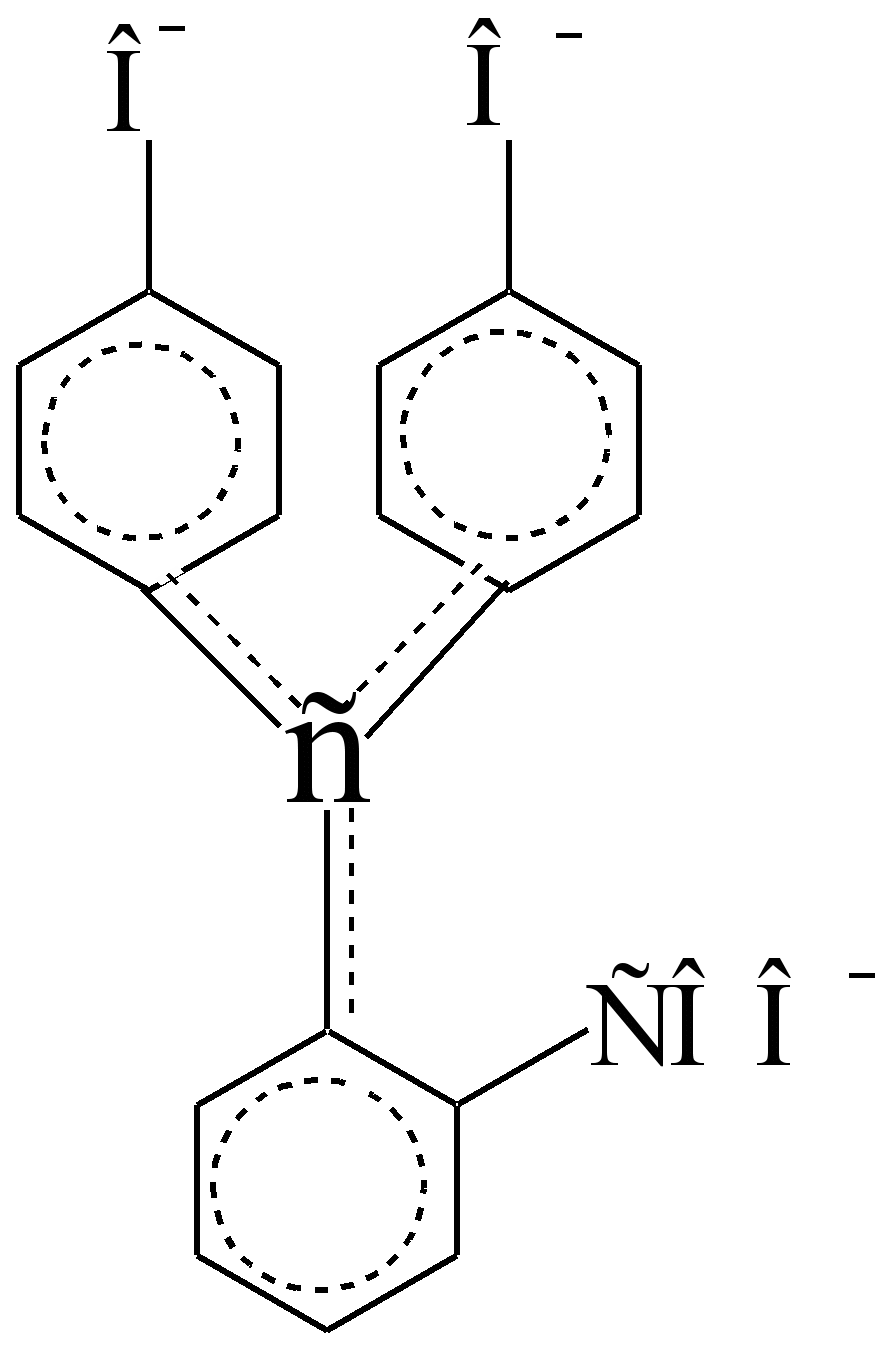
ในสภาพแวดล้อมที่เป็นกรด จะไม่มีสี เนื่องจากโครโมฟอร์ของเบนซีนที่อ่อนแอจะถูกแยกออก เป็นอิสระ และอยู่ใน ?,? - ปฏิสัมพันธ์ (จับคู่) ไม่เข้า:
พวกมันถูกแยกออกจากกันโดย C sp 3 - อะตอมของคาร์บอนซึ่งเป็นฉนวนไม่ใช่ตัวนำหรือไม่? – อิเล็กตรอน ในสภาพแวดล้อมที่เป็นด่าง วัฏจักรแลคโตนจะแตกออก หนึ่งในฟีนอลิกไฮดรอกซิลจะแตกตัวเป็นไอออน และอะตอมของ C sp 3 ได้รับโครงแบบของ C sp 2 ซึ่งกลายเป็นตัวนำ? - อิเล็กตรอนระหว่างโครโมโซมเบนซีน ยิ่งกว่านั้น ออโซโครมแบบโพลาไรซ์ - COO - และ -O - ในกรดซัลฟิวริกเข้มข้น ตัวบ่งชี้จะเปลี่ยน สีส้ม. ความเข้มสีของสารละลายอัลคาไลน์สีม่วงลดลงเมื่อยืนอยู่ ส่วนหนึ่งเกิดจากการก่อตัวของคาร์บอกซิลเบสที่ไม่มีสี (นี่คือการเปลี่ยนแปลงที่ผันกลับได้) ส่วนหนึ่งเกิดจากปฏิกิริยาออกซิเดชั่นทางอากาศที่ผันกลับไม่ได้
ฟีนอล์ฟทาลีนโครโมฟอร์
(รูปแบบด่าง, 1 = 553 นาโนเมตร, 1 = 9000)
1.4 การได้รับฟีนอฟทาลีน
วิธีการหลักในการได้รับฟีนอฟทาลีนคือการควบแน่นของฟีนอลด้วยพาทาลิกแอนไฮไดรด์ ปฏิกิริยานี้เป็นกรณีพิเศษของ Friedel-Crafts acylation ปฏิกิริยาจะเกิดขึ้นเมื่อได้รับความร้อนด้วยตัวเร่งปฏิกิริยาที่เป็นกรด (กรดซัลฟิวริกเข้มข้นหรือสังกะสีคลอไรด์):
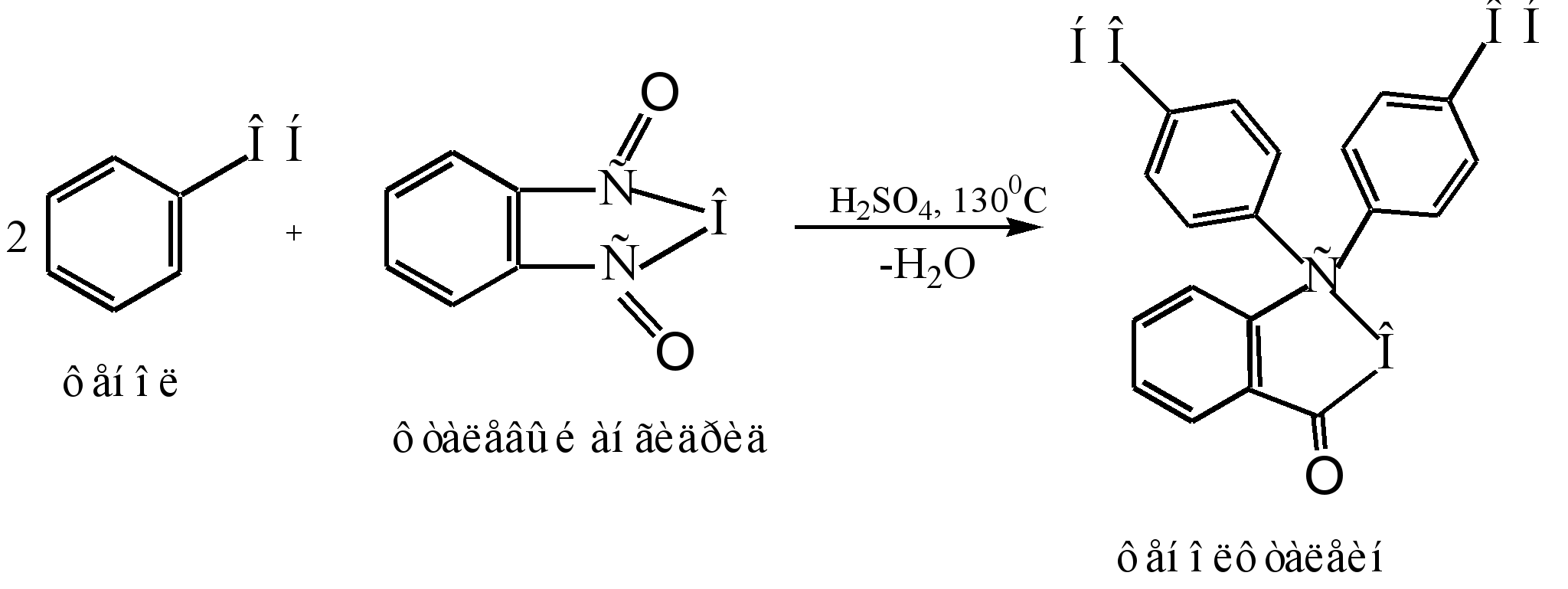
กลไกการเกิดปฏิกิริยาสามารถแสดงได้ดังนี้:

ซิกมา - ซับซ้อน
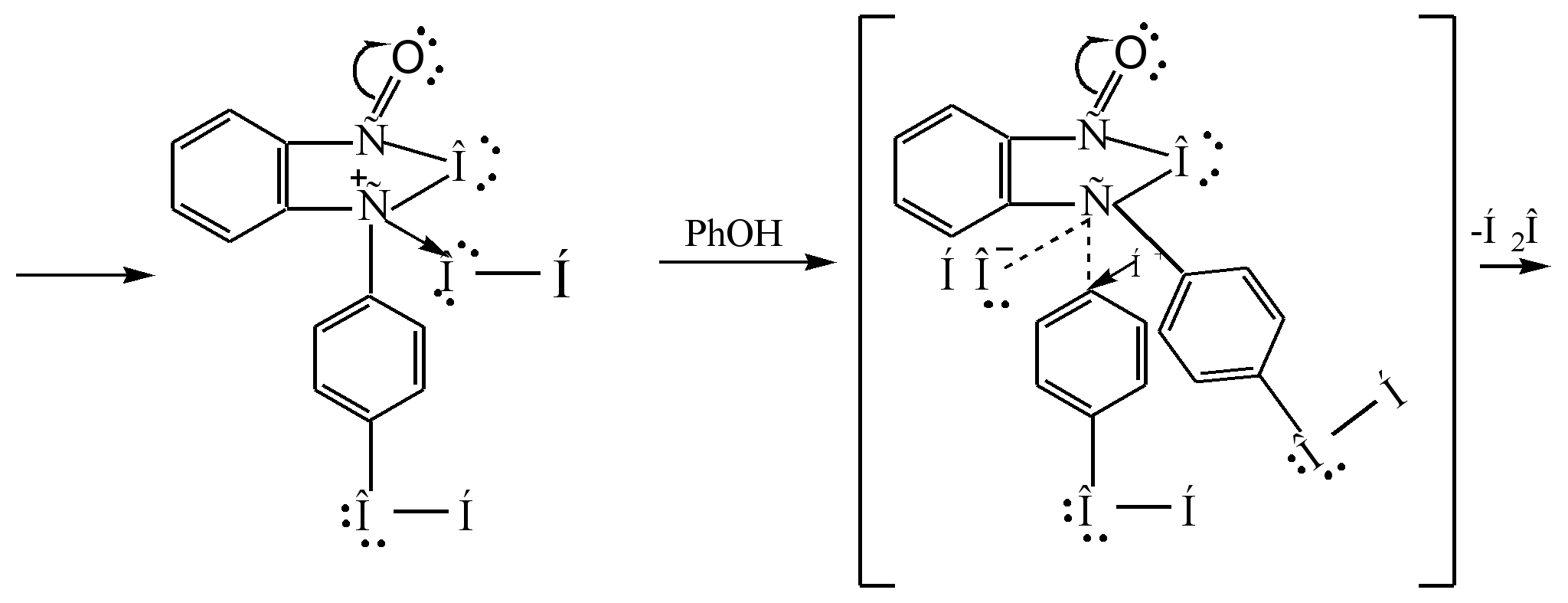
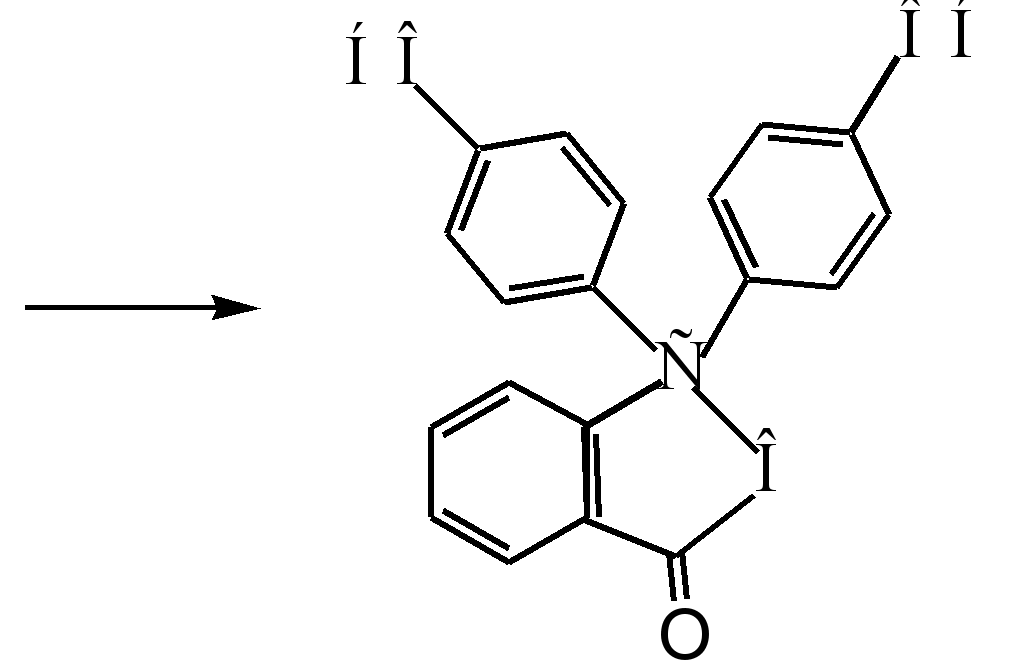
ฟีนอล์ฟทาลีน
1.4.1 วิธีการได้รับฟีนอฟทาลีน
หลังจากวิเคราะห์วรรณกรรมในประเด็นนี้แล้วพบว่าในคู่มือระเบียบวิธีทั้งหมดให้วิธีเดียวกันในการได้รับฟีนอฟทาลีน ขึ้นอยู่กับปฏิกิริยาที่นำเสนอข้างต้น เทคนิคนี้ได้รับการปรับให้เข้ากับสภาพห้องปฏิบัติการของเราอย่างเต็มที่
สำหรับการสังเคราะห์ คุณจะต้องใช้รีเอเจนต์ เครื่องใช้ และอุปกรณ์ต่อไปนี้:
พทาลิกแอนไฮไดรด์-5g; ฟีนอล - 10g; กรดกำมะถัน - 2 มล. โซเดียมไฮดรอกไซด์ - 4-5%; กรดอะซิติก (เข้มข้น); กรดไฮโดรคลอริก (เข้มข้น); เอทิลแอลกอฮอล์ (สัมบูรณ์)
ขวดก้นกลม (50 มล.) - 1 ชิ้น; แก้ว (100 มล.) - 1 ชิ้น; ถ้วยพอร์ซเลน - 1 ชิ้น; ขวดรูปกรวย (250 มล.) - 2 ชิ้น; เครื่องวัดอุณหภูมิ; เครื่องกลั่นไอน้ำ อ่างทราย
การสังเคราะห์ความก้าวหน้า:
ส่วนผสมของพาทาลิกแอนไฮไดรด์ 5 กรัม ฟีนอล 10 กรัม และกรดซัลฟิวริก 2 มล. ใส่ในขวดและอุ่นบนอ่างทรายเป็นเวลา 1.5 ชั่วโมง โดยสังเกตอุณหภูมิ 125 - 130 C 0 อย่างเคร่งครัด (เทอร์โมมิเตอร์ในการละลายและ กวนเนื้อหาเป็นระยะ) ส่วนผสมร้อนเทลงในขวดที่มีน้ำเดือด 100 มล. ฟีนอลที่ไม่ได้ทำปฏิกิริยาจะถูกกลั่นด้วยไอน้ำ เพื่อหลีกเลี่ยงการกระเด็นและการสูญเสียสารที่เกี่ยวข้อง ของเหลวจะต้องถูกคนตลอดเวลา จุดสิ้นสุดของการกลั่นสามารถเห็นได้จากการเปลี่ยนแปลงของความขุ่นของการกลั่น: หากการกลั่นมีเมฆมาก การกลั่นควรดำเนินต่อไป หากการกลั่นโปร่งใส การกลั่นจะหยุดลงได้ สารละลายจะได้รับอนุญาตให้เย็นลง หลังจากนั้นจึงเทลงในช่องทาง Buchner โดยพยายามไม่ให้ตะกอนตกตะกอนไปยังตัวกรองเท่าที่จะทำได้ จากนั้นผลิตภัณฑ์จะถูกล้างโดยการรินออกเป็นสองส่วนเล็กๆ น้ำเย็นเติมสิ่งที่เหลืออยู่บนตัวกรองลงในมวลของของแข็งในแก้ว ละลาย ในปริมาณที่น้อยโซเดียมไฮดรอกไซด์อุ่น 4-5% และพาทาลิกแอนไฮไดรด์ที่ไม่ได้ทำปฏิกิริยาจะถูกแยกออกโดยการกรอง เติมกรดอะซิติกลงในตัวกรองสีแดงเข้มจนกว่าฟีนอฟทาลีนจะตกตะกอนจนหมด จากนั้นจึงเติมกรดไฮโดรคลอริก 1-2 หยดและทิ้งไว้ 1 ชั่วโมง
ฟีนอล์ฟทาลีนที่ปล่อยออกมาในรูปของทรายสีเหลืองจะถูกดูดออกทางช่องทาง Buchner ผลิตภัณฑ์ดิบจะถูกถ่ายโอนไปยังบีกเกอร์และละลายโดยการให้ความร้อนในแอลกอฮอล์ประมาณ 10 มล. สารละลายร้อนจะถูกดูดออกและเค้กตัวกรองจะถูกล้างด้วยแอลกอฮอล์ร้อน กรองผ่านตัวกรองชุบแอลกอฮอล์จากหยดน้ำมันที่แยกออกมา ตัวกรองจะถูกถ่ายโอนไปยังจานกระเบื้องและอุ่นในอ่างทรายร้อนเพื่อขจัดแอลกอฮอล์ออกมาก ส่วนผสมในถ้วยตั้งทิ้งไว้ 30 นาที ผลึกสีเหลืองอ่อนหรือไม่มีสีที่แยกออกมาจะถูกดูดออกและทำให้แห้งในอากาศระหว่างแผ่นกระดาษกรอง
1.4.2 คุณสมบัติทางกายภาพของสารที่ใช้ในการสังเคราะห์
ตารางที่ 1
คุณสมบัติทางกายภาพของสารที่ใช้ในการสังเคราะห์
| ชื่อ | สูตร | รูปร่าง | T pl, 0 C | T ก้อน, 0 С | ความสามารถในการละลาย |
|
| ในน้ำ | ในที่แตกต่างกัน |
|||||
| ฟีนอล์ฟทาลีน | C 20 H 14 O 4 | ขนมเปียกปูนเข็มไม่มีสีหรือเป็นทราย ไม่มีกลิ่น ไม่คงตัวในอากาศ | 261 | อากาศ- นัตยา | ละลายได้น้อย (0.0002 กรัมในน้ำ 100 กรัม) | ดีในเอธานอล มีน้อยในไดเอทิลอีเทอร์ ละลายได้ในสารละลายด่างเช่นกัน |
| ฟีนอล | ค 6 เอช 5 OH | เข็มขนมเปียกปูนไม่มีสีหรือสีชมพู | 41-43 | 182 | ในความเย็น - ปานกลาง ร้อน - ดี | ดีในเอทานอล อีเธอร์ คลอโรฟอร์ม กลีเซอรีน คาร์บอนไดซัลไฟด์ |
| พทาลิกแอนไฮไดรด์ | ค 8 เอช 4 ออ 3 | เข็มขนมเปียกปูนสีขาว | 130,8 | วอซจี 284.3 | แย่ | ในเอทานอล ในอีเทอร์ คลอโรฟอร์ม |
| กรดซัลฟูริก | เอชทูเอสโอ4 | ของเหลวหนืดไม่มีสีมีกลิ่นไม่พึงประสงค์ | 10,37 | 330 | | ตอบสนอง |
| โซเดียมไฮดรอกไซด์ | นาโอ | ผลึกขนมเปียกปูนสีขาว | 320 | 1378 | ละลายได้ด้วยความร้อน | ในแอลกอฮอล์ กลีเซอรีน ฟีนอล อีเทอร์ อะซิโตน |
| กรดน้ำส้ม | CH 3 COOH | ของเหลวไม่มีสีมีกลิ่นฉุน | 16,6 | 118,1 | | ในเอทานอลอีเทอร์ |
| กรดไฮโดรคลอริก | ศปภ | ของเหลวสีเหลือง ควันในอากาศ มีกลิ่นไม่พึงประสงค์ | -15,35 | - | ดี | ในแอลกอฮอล์ |
1.4.3 ขั้นตอนการกลั่นด้วยไอน้ำ
เนื่องจากในระหว่างการสังเคราะห์จำเป็นต้องดำเนินการกลั่นฟีนอลที่ไม่ได้ทำปฏิกิริยาโดยใช้การกลั่นด้วยไอน้ำจึงจำเป็นต้องพิจารณาวิธีการดำเนินการ
การกลั่นจะดำเนินการในอุปกรณ์ที่ประกอบด้วยเครื่องกำเนิดไอน้ำพร้อมท่อนิรภัย ขวดกลั่น Claisen (250 มล.) เทอร์โมมิเตอร์ คอนเดนเซอร์ Liebig โดยตรง ส่วนประกอบทั้งหมด และตัวรับ เครื่องกำเนิดไอน้ำและขวดกลั่นซึ่งเชื่อมต่อผ่านแท่นทีไปยังหนึ่งในสาขาซึ่งสวมท่อยางที่มีแคลมป์ Hoffmann จะถูกทำให้ร้อนในอ่างทราย
ความคืบหน้าของการกลั่น (การกลั่น): ละลายร้อนในขวดกลั่นด้วยน้ำเดือด 100 มล. โดยการให้ความร้อนแก่เครื่องกำเนิดไอน้ำและขวดกลั่น สารกลั่นที่มีฟีนอลที่ไม่ได้ทำปฏิกิริยาจะถูกรวบรวม การปรากฏตัวของมันเป็นหลักฐานโดยความขุ่นของการกลั่น การกลั่นจะหยุดลงเมื่อสิ้นสุดการกลั่นที่ขุ่นมัว นั่นคือ จนกว่าจะมีการกลั่นที่ชัดเจน 
รูปที่ 1เครื่องกลั่นไอน้ำ
1- ท่อนิรภัย 2 - ท่อจ่ายไอน้ำ 3 - ที; 4 - ที่หนีบ; 5 - เครื่องกำเนิดไอน้ำ 6 - กระติกน้ำ Claisen; 7 - เครื่องวัดอุณหภูมิ; 8 – ตู้เย็น Liebig; 9 - ทั้งหมด; 10 - ตัวรับ; 11 - เสื้อคลุมให้ความร้อน; 12 - กระเบื้อง
1.4.4 วิธีการตกผลึกใหม่จากแอลกอฮอล์ร้อน
ในการทดลอง การตกผลึกซ้ำจะดำเนินการดังนี้: สารถูกใส่ในขวดก้นกลมและเติมตัวทำละลายเล็กน้อยลงไป ส่วนผสมถูกทำให้ร้อนภายใต้การไหลย้อนในอ่างน้ำร้อน
ของเหลวส่วนใหญ่มีแนวโน้มที่จะร้อนเกินไป ดังนั้นจึงเดือดด้วยแรงกระแทกที่รุนแรง เพื่อหลีกเลี่ยงปัญหานี้ จะมีการเติมน้ำเดือดลงในกระติกน้ำก่อนที่จะเริ่มให้ความร้อนผ่านรีฟลักซ์คอนเดนเซอร์ ตัวทำละลายจะค่อยๆ เติมทีละน้อยจนกว่าสารจะละลายหมด
หลังจากสารละลายหมด ความร้อนจะหยุดลงและปล่อยให้ส่วนผสมเย็นลงพร้อมกับน้ำในอ่าง สารที่ตกตะกอนจะถูกกรองออก
ในกรณีส่วนใหญ่ การตกผลึกซ้ำสองขั้นตอนคือ ด้วยวิธีที่เชื่อถือได้การทำให้บริสุทธิ์ของสาร 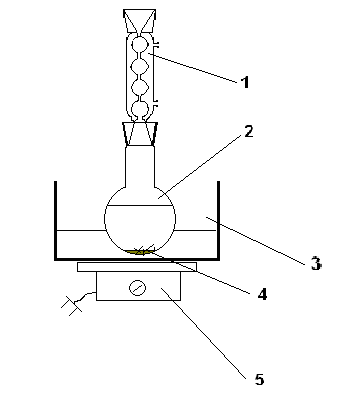
รูปที่ 2รีคริสตัลไลเซอร์
1- ตู้เย็นย้อนกลับ 2 - ขวดก้นกลม 3- อ่างอาบน้ำ; 4 - น้ำเดือด 5 - กระเบื้อง
1.5 ความปลอดภัยในการสังเคราะห์
1.5.1 อันตรายหลักเมื่อทำงานกับกรดเข้มข้น
1. กรดอนินทรีย์อย่างแรงทำให้เกิดการเผาไหม้ของสารเคมีหากสัมผัสกับผิวหนังสำหรับแผลไหม้จากสารเคมีที่เกิดจากการสัมผัสทางผิวหนัง กรดเข้มข้นล้างบริเวณที่ไหม้ด้วยน้ำไหลแรง แล้วตามด้วยสารละลายโซเดียมไบคาร์บอเนต 1% (พบได้ในชุดปฐมพยาบาล) หากกรดเข้าตา ควรล้างทันทีด้วยสารละลายโซเดียมไบคาร์บอเนต 1% และน้ำกลั่นที่อุณหภูมิห้อง ขอความช่วยเหลือจากแพทย์.
2. เนื่องจากกรดไฮโดรคลอริกเข้มข้นระเหยเป็นไอด้วยไฮโดรเจนคลอไรด์ จึงจำเป็นต้องทำงานร่วมกับมันภายใต้กระแสลมที่ออกฤทธิ์ดีและม่านลมลดลง ในกรณีที่เป็นพิษด้วยไอระเหยของไฮโดรเจนคลอไรด์ ให้ไปที่ที่มีอากาศบริสุทธิ์ทันที
3. กรดที่หกต้องถูกปกคลุมด้วยทรายและทำให้เป็นกลางด้วยโซเดียมคาร์บอเนตที่เป็นของแข็งจนกว่าการวิวัฒนาการของก๊าซจะหยุดลง ล้างทรายหลังจากการทำให้เป็นกลางอย่างสมบูรณ์ด้วยน้ำประปาปริมาณมาก ตรวจสอบความสมบูรณ์ของการซัก (ทำการทดสอบสำหรับ Cl - โดยใช้ AgNO 3) และหลังจากการอบแห้งในเตาอบ ให้กลับไปที่กล่องที่มีทราย
1.5.2 อันตรายหลักในการกลั่นด้วยไอน้ำ
อันตรายหลักระหว่างการกลั่นเกี่ยวข้องกับการใช้อุปกรณ์ทำความร้อนไฟฟ้า (เตาไฟฟ้า เครื่องทำความร้อนแบบแมนเทิล)1. สายไฟ (อย่าใช้กระเบื้องที่มีสายไฟในการม้วนเศษผ้า) ปลั๊กและตัวเตาไฟฟ้าไม่ควรมีความเสียหายที่มองเห็นได้
2. ไม่อนุญาตให้ตรวจสอบอุณหภูมิของพื้นผิวที่แผ่ความร้อนด้วยมือของคุณ
3. เปิดและปิดเตาไฟฟ้าจากเครือข่ายโดยการเสียบและถอดปลั๊กออกโดยถือเต้ารับด้วยมือข้างหนึ่งและอีกข้างหนึ่งจับปลั๊ก ใช้สวิตช์เพื่อปรับความร้อน
4. ในกรณีที่เกิดแผลไหม้จากความร้อนจำเป็นต้องทาโลชั่นระยะยาวในบริเวณที่ถูกไฟไหม้ด้วยสารละลายโพแทสเซียมเปอร์แมงกาเนต 0.5% จากนั้นปิดด้วยผ้าพันแผลที่ปราศจากเชื้อและปรึกษาแพทย์ สำหรับแผลไหม้ 3 และ 4 องศา ให้ใช้ผ้าพันแผลที่ปราศจากเชื้อทันทีและปรึกษาแพทย์
1.5.3 อันตรายหลักระหว่างการตกผลึกซ้ำจากแอลกอฮอล์ร้อน
1. ปริมาตรรวมของแอลกอฮอล์ที่เติมไม่ควรเกิน 200 มล. และไม่ควรเกิน 1/3 ของปริมาตรขวด2.อ่างน้ำควรมีขนาดเท่าไร โอเวอร์ไซส์พื้นผิวกระเบื้องที่แผ่ความร้อน
1.5.4 ลักษณะการทำงานกับสารที่ใช้ในการสังเคราะห์
ส่วนใหญ่ สารเคมีเป็นพิษในระดับหนึ่ง ข้อควรระวังเมื่อทำงานกับพวกเขามีวัตถุประสงค์เพื่อป้องกันกรณีการแทรกซึมของสารเหล่านี้เข้าสู่ร่างกายทางปาก ปอด และผิวหนังในระหว่างการสังเคราะห์ สารที่อาจเป็นอันตรายจะถูกใช้: ฟีนอล กรดซัลฟิวริก กรดอะซิติก และกรดไฮโดรคลอริก
ฟีนอลเป็นสารผลึกไม่มีสี (สีชมพู) มีกลิ่นเฉพาะตัว MPC ในอากาศของพื้นที่ทำงานคือ 0.3 มก./ม. 3 . ระดับความเป็นอันตราย II การทำงานกับฟีนอลทั้งหมดจะดำเนินการในตู้ดูดควัน พิษ: พิษต่อประสาท มีฤทธิ์กัดกร่อนเฉพาะที่อย่างรุนแรง ทำให้เกิดพิษรุนแรงโดยทั่วไป ผลร้ายแรงที่เป็นไปได้ สถานการณ์มีความซับซ้อนเนื่องจากสารทำให้เกิดการชาเฉพาะที่ การปฐมพยาบาล: ในกรณีที่สัมผัสกับเสื้อผ้าให้เปลี่ยนทันที ในกรณีที่สัมผัสกับผิวหนังให้ล้างออก น้ำมันพืชหรือสารละลายที่มีเอทานอลเป็นสัดส่วน 10 - 40%
กรดไฮโดรคลอริกจัดอยู่ในประเภทความเป็นอันตรายที่สอง (ขีดจำกัดความเข้มข้นสูงสุดในอากาศของพื้นที่ทำงานคือ 5 มก./ม. 3 ในแง่ของ HCl) การทำงานทั้งหมดกับกรดไฮโดรคลอริกเข้มข้นควรดำเนินการในตู้ดูดควันเนื่องจากข้อเท็จจริง ที่มันปล่อยไอไฮโดรเจนคลอไรด์ออกมา ในกรณีที่เป็นพิษด้วยไอระเหยของไฮโดรเจนคลอไรด์ จำเป็นต้องเคลื่อนย้ายไปยังที่ที่มีอากาศบริสุทธิ์ อันตรายอื่น ๆ ได้ระบุไว้ข้างต้น
กรดกำมะถัน ( \u003d 1.84 g / cm 3) - MAC pz \u003d 1 mg / m 3 ระดับความเป็นอันตราย II หลังจากผ่านไปประมาณ 5 วินาที เนื้อเยื่อจะเริ่มขาดน้ำอย่างรุนแรงโดยที่หยดได้ลดลง การปฐมพยาบาล: ล้างผิวหนัง น้ำไหลตามด้วยการวางตัวเป็นกลาง
กรดอะซิติก - MPC pz = 5 มก. / ม. 3 ระดับความเป็นอันตราย 37. ไอระเหยระคายเคืองต่อทางเดินหายใจส่วนบน สารละลายที่มีส่วนประกอบของสารมากกว่า 30% ออกฤทธิ์ต่อผิวหนัง และมากกว่า 2% ต่อดวงตา การปฐมพยาบาล: (ดู กรดซัลฟิวริก และ กรดไฮโดรคลอริก).
1.6 ลักษณะของตัวทำละลาย
การอนุญาตอิเล็กทริกตรงบริเวณสถานที่พิเศษในลักษณะของตัวทำละลาย ข้อได้เปรียบของเกณฑ์หลังนี้เหนือเกณฑ์อื่นๆ เกิดจากความเรียบง่ายของแบบจำลองการละลายด้วยไฟฟ้าสถิต ดังนั้นการอนุญาตจึงกลายเป็นการวัดค่าขั้วของตัวทำละลายที่มีประโยชน์ ในเรื่องนี้ สิ่งสำคัญคือต้องรู้อย่างชัดเจนว่าอะไรสะท้อนถึงการอนุญาตในระดับมหภาคของตัวทำละลาย เรียกอีกอย่างว่าการอนุญาตสัมพัทธ์:
ร = 0 /
0 – การอนุญาตสุญญากาศ
การอนุญาตถูกกำหนดโดยการวางตัวทำละลายระหว่างแผ่นตัวเก็บประจุที่มีประจุสองแผ่น ความตึงเครียด สนามไฟฟ้าระหว่างแผ่น E ลดลงเมื่อเทียบกับความตึง E 0 ที่วัดได้ในสุญญากาศ และอัตราส่วน E 0 / คือค่าการอนุญาตของตัวทำละลาย หากโมเลกุลของตัวทำละลายไม่มีโมเมนต์ไดโพลถาวรของตัวเอง ดังนั้นภายใต้อิทธิพลของสนามภายนอก ประจุภายในโมเลกุลจะถูกแยกออก ทำให้เกิดไดโพล
ที่ สนามไฟฟ้าโมเลกุลที่มีไดโพลถาวรหรือไดโพลเหนี่ยวนำจะถูกกำหนดทิศทางในลักษณะหนึ่ง ปรากฏการณ์นี้เรียกว่าโพลาไรเซชัน ยิ่งระดับโพลาไรเซชันสูงเท่าไร ความแรงของสนามไฟฟ้าก็จะยิ่งลดลงเท่านั้น ดังนั้น การอนุญาตจึงเกี่ยวข้องโดยตรงกับความสามารถของตัวทำละลายในการแยกประจุและปรับทิศทางไดโพลของมันเอง
1.6.1 การแบ่งประเภทของตัวทำละลายตามคุณสมบัติทางกายภาพ
ค่าคงที่ไดอิเล็กตริก (DP) ของสารละลาย e เป็นหนึ่งในปัจจัยที่สำคัญที่สุดในบรรดาปัจจัยที่มีค่ามากที่สุด อิทธิพลที่แข็งแกร่งเกี่ยวกับลักษณะของกระบวนการที่เกิดขึ้นในการแก้ปัญหา
ค่า DP ของตัวทำละลายแต่ละชนิดแตกต่างกันไปในช่วงกว้างมาก - ตั้งแต่ ?1.8 (แอลเคน) ถึง 170-180 (N-อัลคลาไมด์ของกรดอะลิฟาติกคาร์บอกซิลิก) คำศัพท์ที่เกี่ยวข้องกับการไล่ระดับสีของตัวทำละลายตาม DP นั้นไม่ได้กำหนดไว้อย่างสมบูรณ์และสอดคล้องกัน ตัวทำละลายที่มี DP สูงเรียกว่า โพลาร์ และแม้แต่สูง มีขั้ว แม้ว่าพูดอย่างเคร่งครัด คำว่า "ขั้ว" หมายถึงโมเมนต์ไดโพล µ ของโมเลกุลตัวทำละลาย กล่าวคือ ไม่ได้แสดงลักษณะเฉพาะของมาโคร แต่เป็นคุณสมบัติระดับจุลภาคของตัวทำละลาย
อย่างไรก็ตาม จากทฤษฎีที่เกี่ยวข้องกับ ถึง µ ในกรณีทั่วไป มีการเปลี่ยนแปลงเชิงสัญลักษณ์ในปริมาณเหล่านี้ นอกจากนี้ ในการระบุลักษณะของตัวทำละลายโดยการมีหรือไม่มีไดโพลโมเมนต์ในโมเลกุล คำศัพท์ "ไดโพล" (µ0) และตัวทำละลาย “apolar” (µ = 0)
ตัวทำละลายที่มีขั้วต่ำรวมถึงตัวทำละลายที่มี DP อยู่ในช่วง = l.8h12, ตัวทำละลายที่มีขั้วปานกลางที่มี = 12h50, ตัวทำละลายที่มีขั้วสูงที่มีค่า > 50 สัมพัทธภาพของการหารนี้ไม่เพียงและแม้แต่ไม่มากใน ช่วงเวลาที่ค่อนข้างเลือกโดยพลการเหล่านี้ แต่ในสถานการณ์ที่จำเป็นกว่ามาก
แม้จะมีการเชื่อมต่อระหว่าง DP และโมเมนต์ไดโพลของของเหลวแต่ละชนิด ซึ่งค่อนข้างชัดเจนตามทฤษฎี แต่ควรได้รับการเตือนเกี่ยวกับความขนานที่ชัดเจนอย่างชัดเจนระหว่างปริมาณ และ µ . ประเด็นคือความสัมพันธ์แบบขนาน (แต่ไม่ใช่สายโซ่) ของไดโพลนำไปสู่การลดลงของโมเมนต์ไดโพลของสารร่วมเมื่อเทียบกับโมเมนต์ไดโพลของโมเลกุลเดี่ยว และเป็นผลให้ความสามารถในการซึมผ่านของของเหลวลดลง นั่นเป็นเหตุผลว่าทำไม DP ของของเหลวที่เกิดจากโมเลกุลที่มีโมเมนต์ไดโพลค่อนข้างใหญ่จึงค่อนข้างต่ำ
คุณลักษณะทางโครงสร้างของตัวทำละลายมีผลอย่างมากต่อความเป็นขั้วของตัวทำละลาย ตามกฎแล้วตัวทำละลายที่มีโครงสร้างมีค่า DP สูง
การอนุญาตพร้อมกับการก่อตัวของพันธะเคมีของโมเลกุลเป็นหนึ่งในปัจจัยที่สำคัญที่สุดที่กำหนดคุณสมบัติของของเหลวแต่ละชนิดซึ่งขึ้นอยู่กับพลังงานของปฏิสัมพันธ์ระหว่างโมเลกุล อันหลังถูกกำหนดโดยปฏิกิริยาโต้ตอบซึ่งพลังงานขึ้นอยู่กับ DP แบบคงที่ (), DP, อนุมานเป็นความยาวคลื่นยาวไม่สิ้นสุด ( ) และนำมาเท่ากับ? 1.1 n D เช่นเดียวกับไดโพลโมเมนต์ µ และปริมาตรโมลาร์?:
ER = 
ค่าของพลังงานปฏิสัมพันธ์ปฏิกิริยาของโมเลกุลไดโพลของตัวทำละลายจำนวนหนึ่งแสดงไว้ในตารางที่ 1
ตามที่ M. I. Shakhparonov เน้นย้ำ สนามปฏิกิริยาของโมเลกุลขั้วโลกไม่ได้นำไปสู่การก่อตัวของโครงสร้างทางเคมี ความเสถียรของหลังลดลงตามพลังงานที่เพิ่มขึ้นของสนามปฏิกิริยา
พลังงานสนามปฏิกิริยาอธิบายลักษณะทางกายภาพของตัวทำละลายจำนวนหนึ่ง และดังนั้นจึงอาจเป็นประโยชน์ในการจำแนกตัวทำละลายตามค่า - เอ่อ .
เห็นได้ชัดว่า ตัวทำละลายทั้งหมดที่โมเลกุลไม่มีไดโพลโมเมนต์จะจัดอยู่ในกลุ่มที่ไม่ทำปฏิกิริยา ของเหลว ตัวทำละลายที่มีพลังงานสนามปฏิกิริยาในช่วงเวลา - เอ่อ = 0h5 kJmol -1 ประกอบขึ้นเป็นคลาสของปฏิกิริยาต่ำ ในช่วง - Er = 5h15 kJ mol -1 - ปฏิกิริยาปานกลาง และสุดท้าย ตัวทำละลายที่มี - E R 25 kJ mol -1 ประกอบเป็นคลาส ตัวทำละลายที่มีปฏิกิริยาสูง
ตามกฎแล้ว ของเหลวที่มีปฏิกิริยาสูงจะละลายทั้งที่ไม่ใช่อิเล็กโทรไลต์และอิเล็กโทรไลต์ได้ดี และของเหลวชนิดหลังจะแยกตัวได้ดีกว่าเมื่อเปรียบเทียบกับตัวทำละลายประเภทอื่น (ตามระบบการจำแนกประเภทนี้) สิ่งนี้อธิบายได้จากความจริงที่ว่าตัวทำละลายที่มีปฏิกิริยาสูงรวมค่า DP และโมเมนต์ไดโพลที่สูง
ตารางที่ 2
พลังงานสนามปฏิกิริยาของตัวทำละลายบางชนิดที่ 298.15 K
| ตัวทำละลาย | -ER , kJ โมล -1 | ตัวทำละลาย | -ER , kJ โมล -1 |
| สวรรค์ | 2,9 | เมทิลเอทิลคีโตน | 3,4 |
| อะซิโตน | 9,1 | กรดฟอร์มิก | 5,2 |
| อะซิโตไนไทรล์ | 20,9 | ไนโตรเบนซีน | 17,1 |
| บิวทิลแอลกอฮอล์ | 2,9 | ไนโตรมีเทน | 17,5 |
| น้ำ | 18,6 | ไพริดีน | 5,7 |
| เฮกเซน-1 | 0,15 | โพรพิลีนคาร์บอเนต | 43,8 |
| N,N-ไดเมทิลอะเซตาไมด์ | 15,8 | โพรพิลแอลกอฮอล์ | 3,6 |
| ไดเมทิลซัลฟอกไซด์ | 6,4 | โทลูอีน | 0,05 |
| ไดเมทิลฟอร์มาไมด์ | 19,5 | กรดน้ำส้ม | 3,7 |
| ไดออกเซน | 0,07 | เตตระไฮโดรฟูแรน | 2,9 |
| 1,2 - ไดคลอโรอีเทน | 4,2 | คลอโรเบนซีน | 1,8 |
| o - ไซลีน | 0,12 | เอทิลอะซิเตต | 2,45 |
| n - ไซลีน | 0,05 | เอทิลีนไกลคอล | 8,9 |
| เอ็น-เมทิลอะเซตาไมด์ | 24,1 | เอทานอล | 4,7 |
| รูปแบบเมทิล | 4,0 |
ตามความหนืด (แม่นยำยิ่งขึ้นโดยค่าสัมประสิทธิ์ความหนืด ) ของเหลวถูกแบ่งย่อยออกเป็นส่วนที่มีความหนืดต่ำด้วย 10 -2 Pa s
ตามค่าการนำไฟฟ้าเฉพาะ ของเหลวแบ่งออกเป็นของเหลว "นำไฟฟ้า" ด้วย ประมาณ 10 2 - 10 -1 Cmm -1 ขึ้นไป; "นำไฟฟ้าปานกลาง" - กับ ประมาณ 10 -1 - 10 -4 และด้วย 10 -4 Sm -1 เรียกว่า "ไม่นำไฟฟ้า"
การกล่าวถึงยังรวมถึงการจำแนกประเภทของตัวทำละลายตามจุดเดือด ซึ่งตัวทำละลายจะแบ่งออกเป็นตัวที่มีจุดเดือดต่ำ (150 0 C)
ในการจำแนกตัวทำละลายตามความสามารถในการระเหย ได้มีการเสนอมาตราส่วนสัมพัทธ์ตามความร้อนของการระเหย ดังนั้นตัวทำละลายที่ระเหยได้ (ความผันผวนสัมพัทธ์ 35) จึงแตกต่างกัน หากเรามุ่งความสนใจไปที่ความร้อนของการกลายเป็นไอโดยตรง ตัวทำละลายที่ระเหยง่ายควรถูกจัดประเภทเป็นตัวทำละลายที่มีลักษณะเฉพาะตามความร้อนของการกลายเป็นไอ H การใช้งาน ตารางที่ 3
การจำแนกประเภทของตัวทำละลายโดยค่าคงที่ไดอิเล็กตริก
| โพลาร์สูง |
|||
| ตัวทำละลาย |  ร ร | ตัวทำละลาย | ร |
| น้ำ | 78,30 | ทบ | 36,71 |
| เอทิลีนไกลคอล | 37,7 | เบนโซไนไตรล์ | 26,20 |
| เมทานอล | 32,66 | ไนโตรเบนซีน | 34,78 |
| สพม | 46,45 | กลีเซอรอล | 51,7 |
| ขั้วต่ำ |
|||
| ทีเอชเอฟ | 7,58 | อะซิติกแอนไฮไดรด์ | 20,7 |
| ไดเอทิลอีเทอร์ | 4,20 | บิวทาโนน - 2 | 18,51 |
| อะซิโตน | 20,70 | เพนทานอน - 2 | 15,38 |
| เอทานอล | 24,55 | ไพริดีน | 12,91 |
| กรดน้ำส้ม | 6,17 | เมทิลอะซิเตต | 6,68 |
| โพรพานอล - 1 | 20,45 | ไซโคลเฮกซาโนน | 16,10 |
| บิวทานอล - 1 | 17,51 | ควินนาลีน | 8,95 |
| ไอโซเอมิลแอลกอฮอล์ | 15,19 | คลอโรฟอร์ม | 4,81 |
| สวรรค์ | 6,71 | อะมิลแอลกอฮอล์ | 13,9 |
| ไม่มีขั้ว |
|||
| 1,4 - ไดออกเซน | 2,21 | ไซโคลเฮกเซน | 2,02 |
| ไตรคลอโรเอทิลีน | 3,42 | H - เพนเทน | 1,84 |
| น้ำมันเบนซิน | 2,27 | คาร์บอนไดซัลไฟด์ | 2,64 |
| โทลูอีน | 2,38 | ไดเอทิลามีน | 3,78 |
| คาร์บอนเตตระคลอไรด์ | 2,23 | ไดเอทิลคาร์บอเนต | 2,82 |
| ไตรเอทิลามีน | 2,42 | ||
| n-เฮปเทน | 1,92 | ||
| n-เฮกเซน | 1,88 | ||
1.6.2 ระบบการจำแนกตัวทำละลายตามคุณสมบัติทางเคมี
ระบบส่วนใหญ่ในการจำแนกตัวทำละลายตามลักษณะทางเคมี ไม่ว่าจะโดยชัดแจ้งหรือโดยปริยาย จะคำนึงถึงคุณสมบัติของกรด-เบส ดังนั้นที่สุด ระบบทั่วไปการจำแนกประเภทของตัวทำละลายจัดให้มีการแบ่งออกเป็นสองชั้นกว้าง ๆ - ผู้บริจาค
(พื้นฐาน) และตัวรับ (กรด) คำจำกัดความที่กำหนดล่วงหน้าการแยกตัวทำละลายที่ไม่แยแสอีกประเภทหนึ่ง เงื่อนไขของการกำหนดตัวทำละลายจำเพาะแต่ละตัวให้กับคลาสใดๆ เหล่านี้ หากเพียงเพราะความสามารถของโมเลกุลของตัวทำละลายในการบริจาคหรือรับคู่อิเล็กตรอนจากคู่หูนั้นขึ้นอยู่กับคุณสมบัติของทั้งตัวทำละลายและสารประกอบที่ละลาย นั่นคือสาเหตุที่การจำแนกประเภทนี้จัดให้มีลักษณะพฤติกรรมของตัวทำละลายในปฏิกิริยาหรือกระบวนการละลาย
คุณลักษณะทั่วไปของตัวทำละลายของผู้บริจาคคือการละลายไอออนบวกที่เด่นกว่าในรูปของอนุภาคที่มีลักษณะขาดดุลของอิเล็กตรอน ในทำนองเดียวกัน ตัวทำละลายตัวรับจะละลายประจุลบเป็นสปีชีส์ที่มีอิเล็กตรอนมากเกินไป
ความหลากหลายของตัวทำละลายผู้ให้ถูกกำหนดโดยองค์ประกอบจำนวนมากซึ่งอะตอมสามารถทำหน้าที่เป็นผู้ให้คู่อิเล็กตรอน และความหลากหลายของสารประกอบทางเคมีขององค์ประกอบเหล่านี้ ตัวแทนของตัวทำละลายประเภทนี้จึงแบ่งออกเป็น N-bases (เอมีนหรือเอไมด์ประเภทต่างๆ), 0-bases (อีเทอร์และเอสเทอร์, แอลกอฮอล์, คีโตน, อัลดีไฮด์น้อยกว่า), S-bases (ไทโออีเทอร์, ไทโอแอลกอฮอล์, ซัลฟอกไซด์) P-เบส (ไตรอัลคิล-, ไตรเอริล-หรืออัลคิลาริลฟอสฟีน) และอื่นๆ ในทำนองเดียวกัน
ตัวทำละลายตัวรับแบ่งออกเป็นโพรทิก และอาหารไม่ย่อย
ตัวทำละลายที่สามารถมีส่วนร่วมในสมดุลของโปรโตไลติก ขึ้นอยู่กับหน้าที่ที่พวกมันแสดง มักจะเรียกอีกอย่างว่าโปรโตฟิลิก (พื้นฐาน) และโปรโตเจนิก (กรด). ตัวทำละลายที่แสดงฟังก์ชันทั้งสองอย่างเท่าๆ กัน (แอลกอฮอล์ คีโตน) เรียกว่าแอมฟิโพรติก
โมเลกุลของตัวทำละลายจำนวนมากมีส่วนร่วมในการละลายโดยการสร้างพันธะไฮโดรเจน (H-) ด้วยเหตุนี้จึงเสนอการจำแนกประเภทของตัวทำละลายตามความสามารถในการสร้างพันธะ H
ชั้นหนึ่งในระบบการจำแนกประเภทนี้ประกอบด้วยของเหลวซึ่งมีเครือข่ายสามมิติของพันธะ H อยู่ ตัวทำละลายของคลาสนี้ (น้ำ กรดฟอร์มิก กรดซัลฟิวริก ไกลคอล) มีลักษณะเฉพาะคือ DP ที่สูงมาก และความหนืดค่อนข้างสูง และพลังงานกระตุ้นการไหลแบบหนืด ตามกฎแล้ว ตัวทำละลายของชั้นนี้ละลายได้ดีในกันและกัน
ชั้นที่สองคือของเหลวที่มีเครือข่ายสองมิติของพันธะ H ตามกฎแล้ว โมเลกุลตัวทำละลายของชั้นนี้มีกลุ่มไฮดรอกซิลหนึ่งกลุ่ม (โมโนไฮดริกแอลกอฮอล์ กรดคาร์บอกซิลิกโมโนเบสิก โฟนอล ฯลฯ) ความปรารถนาที่จะสร้างสารร่วมเฮเทอโรโมเลกุลในกลุ่มตัวทำละลายนี้โดยทั่วไปจะเด่นชัดน้อยกว่าในตัวแทนของชั้นหนึ่ง
ชั้นที่สามประกอบด้วยของเหลวที่มีอะตอมของไนโตรเจน ออกซิเจน กำมะถัน ฟลูออรีน ฯลฯ ซึ่งสามารถสร้างพันธะ H กับผู้ให้โปรตอนได้ ชั้นนี้ประกอบด้วยอีเทอร์ เอมีน คีโตน อัลดีไฮด์ เป็นต้น
ชั้นที่สี่รวมถึงของเหลวที่โมเลกุลสามารถเป็นผู้บริจาคโปรตอนได้ ซึ่งรวมถึงคลอโรฟอร์ม ไดคลอโรอีเทน และอื่นๆ ในทำนองเดียวกัน
ชั้นที่ห้ารวมถึงของเหลวที่โมเลกุลไม่สามารถมีส่วนร่วมในการก่อตัวของพันธะ H ภายใต้สภาวะปกติ กลุ่มนี้รวมถึงแอลเคน คาร์บอนเตตระคลอไรด์ เปอร์ฮาโลแอลเคน เป็นต้น
Parker เสนอให้จำแนกตัวทำละลายตามความสามารถในการละลายไอออน ในการจำแนกประเภทนี้ ตัวทำละลายจะถูกแบ่งออกเป็นกลุ่มต่างๆ
Apolar aprotic - ของเหลวที่มี DP ต่ำ (
Dipolar aprotic - ของเหลวที่มีค่า DP ค่อนข้างสูง ( > 15) และโมเมนต์ไดโพล (µ > 2D) ,
ไม่มีไฮโดรเจนที่สามารถสร้างพันธะ H ได้ ตัวแทนของตัวทำละลายกลุ่มนี้ ได้แก่ ซัลเฟอร์ไดออกไซด์, ไนโตรเบนซีน, ไนโตรมีเทน, อะซีโตไนไทรล์, โพรพิลีนคาร์บอเนต, DMSO เป็นต้น
Protic - ของเหลวที่มีโมเลกุลประกอบด้วยกลุ่มที่อะตอมไฮโดรเจนเชื่อมต่อกับอะตอมอิเล็กโทรเนกาติตี สารประกอบที่รวมอยู่ในกลุ่มนี้ (กรดคาร์บอกซิลิก แอลกอฮอล์ ฟีนอล ฯลฯ) มีความโดดเด่นด้วยความสามารถในการสร้างพันธะ H
พลังละลายของตัวทำละลายโดยทั่วไปเพิ่มขึ้นจากกลุ่มที่หนึ่งไปกลุ่มที่สาม
Bronsted เสนอให้จัดประเภทตัวทำละลายบนพื้นฐานของการรวมกันของการอนุญาตและการก่อกำเนิด ตามคุณลักษณะเหล่านี้ เขาแบ่งตัวทำละลายออกเป็นแปดกลุ่ม
ตัวอย่างของตัวทำละลายของกลุ่มต่าง ๆ ภายในการจัดประเภทของ Brensted ได้แก่: I - น้ำ; II - กรดซัลฟิวริก, กรดฟอร์มิก; III - ไฮดราซีน, DMSO; IV - โพรพิลีนคาร์บอเนต, ไนโตรเบนซีน, อะซีโตไนไทรล์, ไนโตรมีเทน; V - บิวทานอล; VI - โบรโม- ของเหลว และไฮโดรเจนไอโอดีน VII - triethylamine, pyridine; VIII - เฮกเซน, คลอโรเบนซีน
การจำแนกประเภทของเบรินสเต็ดทำให้สามารถทำนายคุณสมบัติของกรดเบสของสารประกอบที่ละลายในตัวทำละลายของแต่ละกลุ่มได้ ดังนั้นในตัวทำละลายของกลุ่ม II ความแข็งแรงของฐานจึงสูงกว่าตัวทำละลายของกลุ่ม III อย่างมีนัยสำคัญ ความแรงของกรดในตัวทำละลายกลุ่ม III โดยทั่วไปจะสูงกว่าในตัวทำละลายกลุ่ม VII เป็นต้น
ตารางที่ 4
การจำแนกประเภทตัวทำละลายของBrönsted
| คุณสมบัติ | ประเภทตัวทำละลาย |
|||||||
| ฉัน | ครั้งที่สอง | สาม | IV | วี | วี.ไอ | ปกเกล้าเจ้าอยู่หัว | VIII |
|
| พ | + | + | + | + | - | - | - | - |
| การเกิดโรค | + | + | - | - | + | + | - | - |
| มาตรการ | + | - | + | - | + | - | + | - |
* เครื่องหมาย + และ - ในบรรทัดแรกสอดคล้องกับ DP สูงและต่ำในบรรทัดอื่น ๆ - เพื่อให้มีหรือไม่มีคุณสมบัตินี้
นอกจากนี้ยังมีการเสนอการจัดประเภทของตัวทำละลายตามลักษณะทางกายภาพแปดประการ ได้แก่ ฟังก์ชันเคิร์กวูด การหักเหของโมลาร์ พารามิเตอร์ความสามารถในการละลายของ Hildebrand ดัชนีการหักเหของแสง จุดเดือด โมเมนต์ไดโพล ตลอดจนพลังงานของออร์บิทัลโมเลกุลที่เติมสูงสุดและต่ำสุดที่ไม่ได้บรรจุ จากการรวมกันของคุณสมบัติเหล่านี้ ขอเสนอให้แบ่งตัวทำละลายออกเป็นเก้ากลุ่ม:
1) aprotic dipolar (ตัวอย่างเช่น acetonitrile, nitromethane, acetone, 1,2-dichloroethane);
2) aprotic high dipolar (DMSO, DMF, DMAA, โพรพิลีนคาร์บอเนต, ไนโตรเบนซีน);
3) aprotic มีไดโพลาร์สูงและโพลาไรซ์สูงได้ (ซัลโฟเลน, HMFTA);
4) อะโรมาติกไม่มีขั้ว (เบนซิน, โทลูอีน);
อะโรมาติกค่อนข้างมีขั้ว (คลอโรเบนซีน, โอ-ไดคลอโรเบนซีน, อะซีโตฟีโนน);
ผู้บริจาคอิเล็กตรอน (triethylamine, ethers, dioxane);
ตัวทำละลายที่มีพันธะ H (แอลกอฮอล์, กรดคาร์บอกซิลิก);
ตัวทำละลายที่เกี่ยวข้องอย่างมากกับพันธะ H (ฟอร์มาไมด์
ไดเอทิลีนไกลคอล, น้ำ);
ตัวทำละลายที่มีฟังก์ชันที่ไม่ได้กำหนด (คาร์บอนไดซัลไฟด์, คลอโรฟอร์ม)
1.7 ภาพรวมของวิธีการหาค่าความสามารถในการละลายของของแข็ง
1.7.1 การหาค่าความสามารถในการละลายแบบกราวิเมตริก
วิธีการประกอบด้วยการหามวลของสารที่ละลายในตัวทำละลายจำนวนหนึ่ง (ความสามารถในการละลายจำเพาะ P ` ) และการคำนวณความสามารถในการละลายเป็นมวลของสารที่สามารถละลายได้ใน 100 กรัมของตัวทำละลายที่กำหนด วิธีการประมาณชั่งส่วนของสารทดสอบ (g 1 ` ). ชั่งน้ำหนักตัวอย่างตัวทำละลาย (g p) กำหนดน้ำหนักของตัวกรองแห้ง (g 2) เทสารส่วนที่ชั่งน้ำหนักแล้วลงในตัวทำละลาย ถ้าสารละลายหมดแล้ว จำเป็นต้องเติมจนกว่าการละลายจะหยุดลง ให้สังเกตน้ำหนักทั้งหมดของสารที่เทลงในตัวทำละลาย (g 1) กรองสารที่ไม่ละลายผ่านตัวกรองและกำหนดน้ำหนักของตัวกรองเปียกด้วยสารตกค้าง (g 3) กรองส่วนที่เหลือของสารให้แห้งด้วยน้ำหนักคงที่ (g 4) คำนวณการละลายเฉพาะโดยใช้สูตร:
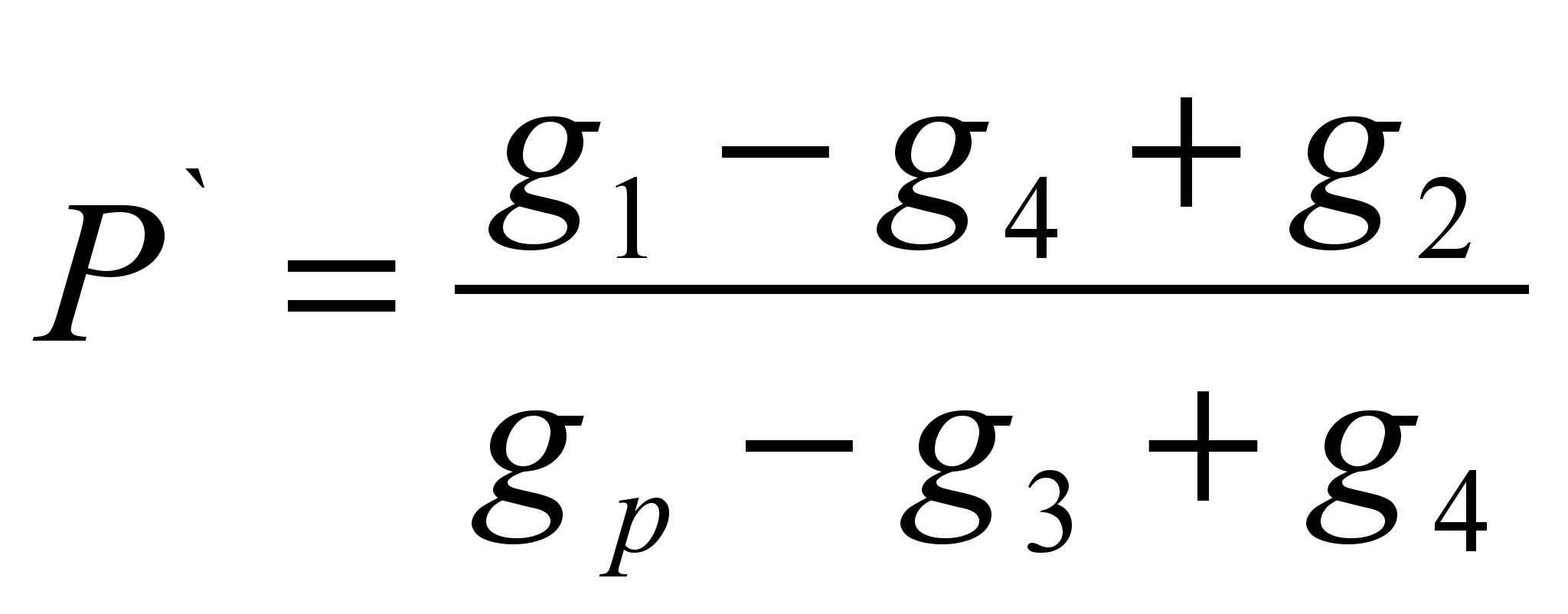
P \u003d P` 100 (ก. / 100 ก.)
ตารางที่ 5
การละลายของฟีนอฟทาลีนในตัวทำละลายบางชนิด
| ตัวทำละลาย | ความสามารถในการละลาย | ร |
| ขั้วโลกอย่างยิ่ง |
||
| น้ำ | 0,0002 | 78,30 |
| เมทิลแอลกอฮอล์ | 19,42 | 52,66 |
| ขั้วโลกที่อ่อนแอ |
||
| เอทานอล | 17,29 | 24,55 |
| อะซิโตน | 16,98 | 20,70 |
| คลอโรฟอร์ม | 2,97 | 4,81 |
| ไม่มีขั้ว |
||
| ไซลีน | 0,19 | 2,43 |
| โทลูอีน | 0,17 | 2,38 |
| น้ำมันเบนซิน | 0,16 | 2,27 |
1.7.2 วิธีการทางเคมีไฟฟ้า
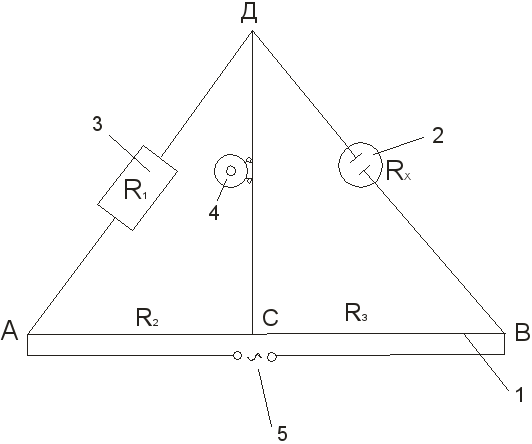
1. ประกอบการติดตั้งเพื่อกำหนดความต้านทานของปริมาตรของสารละลายอิเล็กโทรไลต์ตามแบบแผน (ดูรูปที่ 3)
2. สารละลายโพแทสเซียมคลอไรด์ในน้ำที่มีความเข้มข้นระดับหนึ่งจะถูกเทลงในภาชนะวัดจนถึงเครื่องหมาย และภาชนะที่มีอิเล็กโทรดจะถูกเก็บไว้ในเทอร์โมสตัทที่อุณหภูมิที่กำหนด หลังจากผ่านไป 15-20 นาที เรือจะเชื่อมต่อที่จุด B และ D กับการติดตั้ง
3. ด้วยความช่วยเหลือของกล่องต้านทานและหน้าสัมผัส C ที่เคลื่อนย้ายได้ สะพานจะมีความสมดุล ทำให้ได้เสียงที่เล็กที่สุดในโทรศัพท์ หรือความกว้างต่ำสุดของไซน์ไซด์บนหน้าจอออสซิลโลสโคป จุดชดเชยจะเข้าหาก่อนจากปลายด้านหนึ่งของรีโอคอร์ด จากนั้นจึงเข้าหาอีกด้านหนึ่ง การวัดและการคำนวณที่ตามมาของ R x:
R x = R 1 
ทำซ้ำ 3-4 ครั้งที่ความต้านทานต่างกัน R 1 . ในกรณีนี้ หน้าสัมผัสที่กำลังเคลื่อนที่ไม่ควรเข้าใกล้ส่วนท้ายของรีโอคอร์ด หากค่าเบี่ยงเบนในการวัดน้อยกว่า 0.5% ผลลัพธ์จะถือว่าเป็นที่น่าพอใจและดำเนินการคำนวณค่าคงที่ของเรือโดยใช้สูตร:
K=  /
ว =
อาร์เอ็กซ์
/
ว =
อาร์เอ็กซ์
โดยที่ R x คือความต้านทานของสารละลาย -
การนำไฟฟ้าจำเพาะ
4. เทเกลือจำนวนเล็กน้อยลงในน้ำ 100 มล. แล้วปิดขวดให้แน่นด้วยจุก เขย่าขวดอย่างต่อเนื่องเป็นเวลา 20 นาที สารแขวนลอยที่เกิดขึ้นจะถูกดูดออกผ่านตัวกรองแก้ว และตะกอนจะถูกใช้เพื่อเตรียมสารละลายอิ่มตัว สารละลายที่ได้จะถูกเทลงในภาชนะสำหรับวัดค่าการนำไฟฟ้า และหลังจากควบคุมอุณหภูมิแล้ว จะทำการวัดความต้านทานของสารละลาย
=
เค /
อาร์เอ็กซ์  = /
ค
= /
ค
โดยที่ C คือค่าปกติของสารละลาย kg equiv / m 3
เนื่องจากความเข้มข้นของเกลือในสารละลายอิ่มตัวต่ำ ดังนั้น = ขึ้นอยู่กับสมการ:
ค = ( ร - ใน ) /
ที่ไหน รคือการนำไฟฟ้าของสารละลายเกลือ
ผลิตภัณฑ์ความสามารถในการละลายสำหรับอิเล็กโทรไลต์โมโนวาเลนต์:
![]() = (ค)2
= (ค)2
6. ป้อนผลลัพธ์ในตาราง:
| เกลือ | เสื้อ, C0 | , ซม./ม | ความต้านทาน, โอห์ม | เค | | | ค | แอล |
|||
| R1 | R2(ไฟฟ้ากระแสสลับ) | R3(CB) | อาร์ เอ็กซ์ |
||||||||
ตารางที่ 6
ค่าการนำไฟฟ้าจำเพาะของสารละลาย KCI
| เสื้อ, C0 | 1 เอ็น เคซีไอ | 0.1 น | 0.02 น | 0.01 น |
| 10 4 , โอห์ม -1 cm -1 |
||||
| 0 | 654,1 | 71,5 | 15,21 | 7,76 |
| 10 | 831,9 | 93,3 | 19,94 | 10,20 |
| 14 | 906,3 | 102,5 | 21,93 | 11,21 |
| 16 | 944,1 | 107,2 | 22,94 | 11,73 |
| 18 | 982,2 | 111,9 | 23,97 | 12,25 |
| 20 | 1020,7 | 116,7 | 25,01 | 12,78 |
| 22 | 1055,4 | 121,5 | 26,06 | 13,32 |
| 24 | 1098,4 | 126,4 | 27,12 | 13,86 |
| 25 | 1118,0 | 128,8 | 27,65 | 14,13 |
| 26 | 1137,7 | 131,8 | 28,19 | 14,41 |
| 28 | 136,2 | 29,27 | 14,96 |
|
| 30 | 141,2 | 30,36 | 15,52 |
|
| 32 | 146,2 | 31,46 | 16,09 |
|
| 34 | 151,3 | 32,56 | 16,67 |
|
| 36 | 156,4 | 33,68 | ||
รูปที่ 3โครงการติดตั้งเพื่อกำหนดค่าการนำไฟฟ้า:
1 - ลวดยืดเหนือไม้บรรทัด 2 – ภาชนะวัดพร้อมอิเล็กโทรด 3 - รีโอสแตท; 4 - โทรศัพท์ความต้านทานต่ำ 5 - แหล่งที่มาปัจจุบัน
1.7.3
วิธีโฟโตอิเล็กโทรคาโลเมตริก
วิธีการนี้ขึ้นอยู่กับกฎการบวกของความหนาแน่นของแสง ซึ่งอยู่ภายใต้กฎพื้นฐานของการดูดกลืนแสง
ความคืบหน้า
1. การเลือกตัวกรองแสงที่ดีที่สุด
1.1. ใส่ในขวดปริมาตร 25 มล.:
ผสมสารละลายและวัดความหนาแน่นของแสงเทียบกับตัวทำละลายที่เลือกด้วยตัวกรองแสงแบบต่างๆ ในคิวเวตที่เหมาะสมที่สุดสำหรับสิ่งนี้ ระบุขนาดคิวเวตต์ ดูขั้นตอนการทำงานกับ FEC ในหนังสือเดินทางของตราสาร
1.2. ป้อนข้อมูลที่ได้รับในตาราง:
1.3. บนกระดาษกราฟ ให้วาดเส้นกราฟการดูดกลืนแสง A \u003d f (, nm) และพิจารณาว่าฟิลเตอร์ใดที่ความยาวคลื่นใดเหมาะสมที่สุดเมื่อใช้งาน
2. การวางแผน
2.1. เตรียมชุดโซลูชันมาตรฐาน วัดความหนาแน่นของแสงของสารละลายมาตรฐานที่เตรียมไว้แต่ละชุดโดยใช้ตัวกรองที่เลือกไว้ก่อนหน้านี้
2.2. ป้อนข้อมูลการทดลองในตาราง (ดูด้านล่าง) สำหรับแต่ละชุดของโซลูชันแยกกัน ดำเนินการประมวลผลทางสถิติของผลลัพธ์
2.3. ใช้ข้อมูลแบบตารางบนกระดาษกราฟ พล็อต A = f (สาร C) และคำนวณความสามารถในการละลายของฟีนอฟทาลีนในตัวทำละลาย
หลังจากศึกษาเอกสารเกี่ยวกับความสามารถในการละลายของฟีนอฟทาลีนแล้ว ได้เลือกวิธีที่ระบุไว้ข้างต้น และหลังจากเปรียบเทียบในแง่ของความเป็นไปได้ในการใช้งานในสภาพห้องปฏิบัติการของเรา ในแง่ของระยะเวลา ในแง่ของความง่ายในการใช้งาน จึงได้เลือกวิธีการหาค่าการละลายแบบกราวิเมตริก
2. ส่วนการทดลอง
2.1 การสังเคราะห์ฟีนอฟทาลีน
การสังเคราะห์ดำเนินการตามวิธีการที่ระบุในการทบทวนวรรณกรรม (วรรค 1.4.1)
| การกระทำ | การสังเกต |
| 1.ชั่งน้ำหนัก: 5 g -phthalic anhydride (บริสุทธิ์ทางเคมี) | ผงผลึกสีขาว คริสตัลสีชมพูอ่อน |
| 2. ฉันใส่รีเอเจนต์ลงในขวดทรงกรวยก้นแบน (ต่อ 100 มล.) แล้วคนด้วยเทอร์โมมิเตอร์ในนั้น | มีมวลคล้ายโจ๊กเกิดขึ้น และส่วนผสมจะถูกให้ความร้อนเล็กน้อย (t ≥ 37 0 C) |
| 3. ฉันวางขวดบนอ่างทราย (อุณหภูมิอยู่ในช่วง 125 - 130 0 C) อุ่นเป็นเวลา 1.5 ชั่วโมง | ที่อุณหภูมิ 45 0 C ฟีนอลจะละลาย สารพาทาลิกแอนไฮไดรด์ (เกล็ดสีขาว) จะลอยเป็นสีน้ำตาลละลาย หลังจากให้ความร้อนเป็นเวลา 30 นาที (t ≥ 130 0 C) จะเกิดสีน้ำตาลแดงเข้มเป็นเนื้อเดียวกัน หลังจากให้ความร้อน 1 ชั่วโมง - สีแดงเลือดละลายเป็นเนื้อเดียวกัน ความร้อนหยุดลงหลังจาก 1.5 ชั่วโมง |
| 4. เขาเทละลายร้อนลงในขวดที่มีน้ำเดือด และกลั่นฟีนอลที่ยังไม่ทำปฏิกิริยาด้วยไอน้ำ (ดูภาพวาดการติดตั้งในส่วนที่เกี่ยวข้องของการทบทวนวรรณกรรม) | ในขวดที่มีน้ำเดือดหลังจากเทละลายร้อนแล้วชิ้นส่วนฟีนอฟทาลีนสีเหลืองอ่อนที่ไม่เป็นรูปเป็นร่างเริ่มลอยขึ้นทำให้น้ำขุ่นเล็กน้อย t ? 99 0 C. สารกลั่นที่มีเมฆมากจะถูกปล่อยออกมา (V = 50 มล.) หลังจากการกลั่น 15 นาที น้ำกลั่นใสๆ ก็เริ่มไหลออกมา |
| 5. เทสารละลายที่มีฟีนอฟทาลีนลงบนกรวย Buchner โดยไม่ถ่ายตะกอนไปยังตัวกรอง ฉันล้างตะกอนด้วยน้ำเย็นสามส่วน ครั้งละ 100 มล. | อุณหภูมิของสารละลายคือ 26 0 Сในสารละลาย (V? 170 มล.) ชิ้นฟีนอฟทาลีนที่มีลักษณะคล้ายเมล็ดพืชซึ่งมีสีเหลืองเล็กน้อย |
| 6. ละลายฟีนอฟทาลีนที่กรองแล้วในสารละลายโซเดียมไฮดรอกไซด์อุ่น 15 มล. (? = 5%) | T NaOH ?42 0 С, สีของสารละลายเกิดขึ้น - สีแดงเข้ม |
| 7. กรองสารละลายสีแดงเข้ม | อุณหภูมิของสารละลาย ? 35 0 C. หลังจากการกรอง จะมีชั้นผลึกบาง ๆ สีขาวอมชมพูของสารตกตะกอนบนตัวกรอง |
| 8. ในการกรอง (V? 50 มล.) เติมกรดอะซิติก (c.) 5 มล. ในส่วนของ 1 มล. คนให้เข้ากัน | สีของสารละลายเปลี่ยนไปจากสีแดงเข้มเป็นสีเทาขาว สารละลายขุ่น (เป็นขุย) วิธีแก้ปัญหาไม่อุ่นขึ้น อุณหภูมิของสารละลาย ? 31 0 ค. |
| 9. เติมกรดเกลือ 2 หยด (ค.) | การเปลี่ยนแปลงทางสายตาไม่ได้เกิดขึ้น |
| 10. ทิ้งไว้ 1 ชั่วโมง | มีการตกตะกอนของเกล็ดที่ด้านล่างของแก้วซึ่งเป็นสารละลายโปร่งใสเหนือตะกอนเป็นเกล็ดสีเทาอมขาว |
| 11. กรองตะกอนที่เกิดขึ้น | มีสารละลายสีขาวเทาบนตัวกรอง อ้าว? 5.07 |
ได้รับการเตรียมแบบเปียกทั้งหมด 5.07 กรัม
2.2 การตกผลึกซ้ำจากแอลกอฮอล์ร้อน
การตกผลึกซ้ำได้ดำเนินการตามวิธีการที่ระบุในการทบทวนวรรณกรรม (วรรค 1.4.4) มีการทำซ้ำหนึ่งครั้ง ภาพวาดของอุปกรณ์แสดงในวรรค 1.4.4 ของการทบทวนวรรณกรรม
| การกระทำ | การสังเกต |
| ส่วนของฟีนอฟทาลีนที่ชั่งน้ำหนักแล้ว (5.07 กรัม) ถูกใส่ในขวดและเติมเอทานอล 96% 50 มล. | ฟีออลทาลีนส่วนน้อยสลายไป แอลกอฮอล์ขุ่นเล็กน้อย |
| ขวดถูกทำให้ร้อนจนเดือด เติมแอลกอฮอล์จนกระทั่งฟีนอฟทาลีนละลายหมด (อย่างละ 0.5 มล.) เวโทห์ = 7 มล. | ฟีนอฟทาลีนละลายหมด แอลกอฮอล์มีเมฆมาก ส่วนผสม t = 85 o C |
| ของผสมถูกทำให้เย็นลงอย่างช้าๆ จนถึงอุณหภูมิห้อง | t ของส่วนผสม = 19 o C ผลึกสีขาวจำนวนมากหลุดออกมาจากสารละลายในรูปของผลึกขนาดเล็ก การแก้ปัญหามีความโปร่งใส |
| ผลึกที่ตกตะกอนถูกดูดออกและล้างบนตัวกรองด้วยน้ำเย็น ตากให้แห้งระหว่างแผ่นกระดาษกรอง | ฟีนอฟทาลีนได้รับในรูปของผลึกอากาศ ขาว-เทาเนื้อละเอียด m (ฟีนอล์ฟทาลีน) = 4.08 ก. อัตราการเกิดผลึกซ้ำคือ 83.5% |
การคำนวณการตกผลึกซ้ำ:
อัตราการเกิดผลึกซ้ำ:
W,% \u003d (m (ฟีนอฟทาลีน) แห้ง 100%) / m (ฟีนอฟทาลีน) เปียก
ว,% =  % = 83,5 %
% = 83,5 %
การคำนวณผลตอบแทนการสังเคราะห์:
เพื่อให้ได้ฟีนอฟทาลีน 0.0388 โมล (ตามทฤษฎี) หรือ m = 0.0338 โมล 318 กรัม/โมล = 10.7 กรัม
ผลลัพธ์จากทฤษฎี:
W=  100 % = 40, 5 %
100 % = 40, 5 %
ตามหลักการแล้ว เพียงพอฟีนอล์ฟทาลีน (ประมาณ 4.08 กรัม) เพื่อการวิจัยเพิ่มเติม การสังเคราะห์ดำเนินการโดยให้ผลผลิตที่ยอมรับได้
2.3 การกำหนดความสามารถในการละลาย
การหาค่าความสามารถในการละลายของฟีนอฟทาลีนทำได้โดยวิธีกราวิเมตรี (ดูข้อ 1.7.1)
เลือกคลอโรฟอร์ม เบนซีน และไซลีนเป็นตัวทำละลาย เนื่องจากตามข้อมูลวรรณกรรม (ดูตารางที่ 5) ฟีนอฟทาลีนในพวกมันมีความสามารถในการละลายที่ยอมรับได้สำหรับมวลฟีนอฟทาลีนที่มีอยู่ ฉันไม่ได้ใช้น้ำ เนื่องจากฟีนอฟทาลีนมีความสามารถในการละลายต่ำมาก (ประมาณ 10 -4 กรัมต่อ 100 กรัม) ฉันไม่ได้ใช้เอธานอลด้วย เพราะฟีนอฟทาลีนมีความสามารถในการละลายในแอลกอฮอล์ได้ดีมาก และจำเป็นต้องใช้สารนี้ในปริมาณมาก การวิเคราะห์ดำเนินการที่ 21 ± 1°C (อุณหภูมิเฟสของเหลว) การฉีดยาใช้เวลา 30 ± 1 นาทีโดยมีการกวนอย่างรุนแรง
สูตรการคำนวณ:
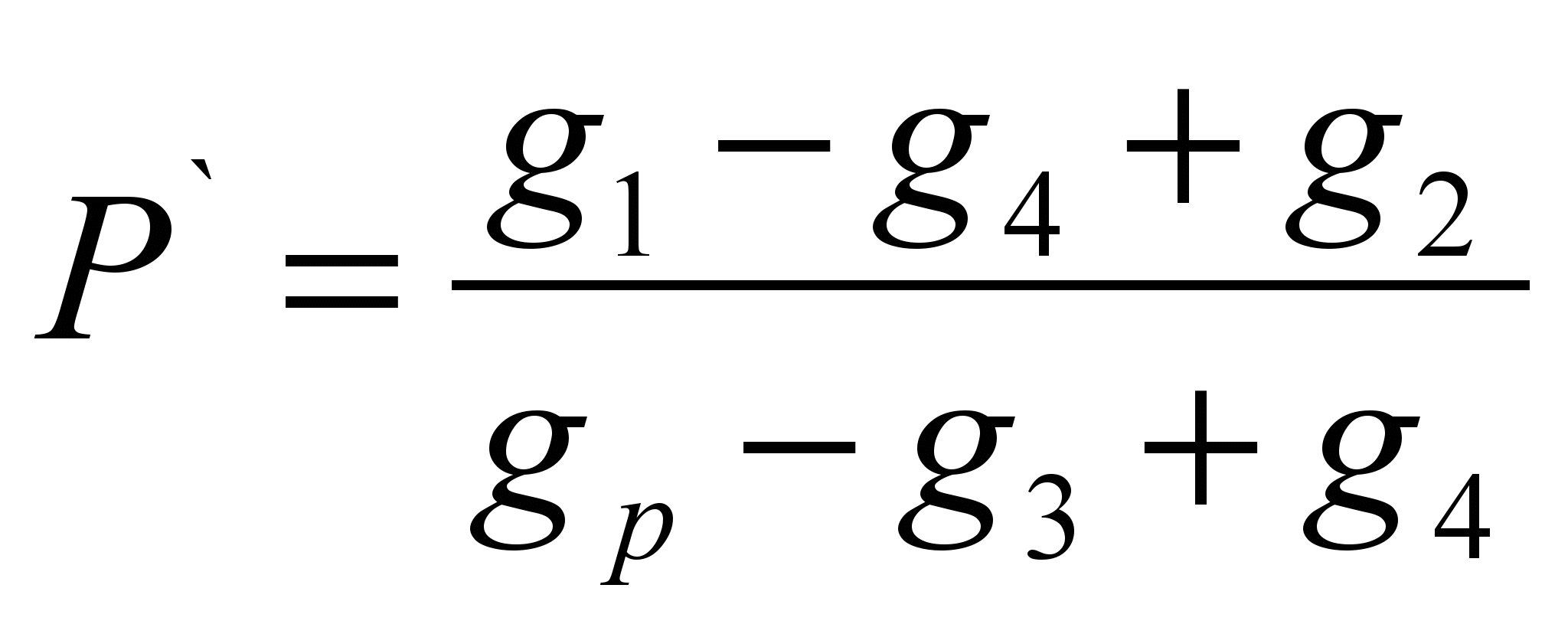 ; P \u003d P` 100 (ก. / 100 ก.)
; P \u003d P` 100 (ก. / 100 ก.)
ที่ไหน g 1 - ตัวอย่างของฟีนอฟทาลีน, g;
G 2 - น้ำหนักกรองแห้ง g;
G 3 - น้ำหนักของตัวกรองเปียกที่มีฟีนอฟทาลีนตกค้าง g;
G 4 - น้ำหนักกรองแห้งพร้อมฟีนอฟทาลีนตกค้าง g;
G p – ตัวอย่างตัวทำละลาย g;
Р – ความสามารถในการละลาย, g/100 g สารละลาย;
Р`- ความสามารถในการละลายเฉพาะ g/1 g sol
ผลลัพธ์คำจำกัดความ:
P (ฟีนอล์ฟทาลีน / คลอโรฟอร์ม) = (3.0 ± 0.03) g / 100 g คลอโรฟอร์ม; ? = 1%
P (ฟีนอฟทาลีน / ไซลีน) = (0.22 ± 0.01) g / 100 g ของไซลีน; ? = 6%
P (ฟีนอล์ฟทาลีน / เบนซิน) \u003d (0.19 0.01) g / 100 g ของเบนซิน = 6%
จากการทดลองได้สร้างตารางเดือยและกราฟ
ตารางที่ 7
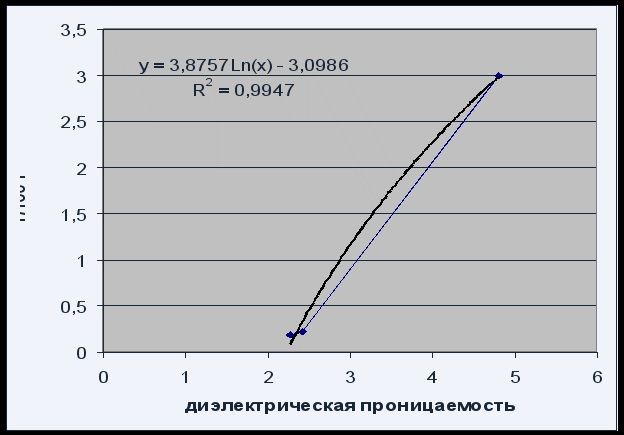
รูปที่ 4การขึ้นอยู่กับความสามารถในการละลายต่อการอนุญาตของตัวทำละลาย
การขึ้นอยู่กับความสามารถในการละลายต่อการอนุญาตของตัวทำละลายสามารถอธิบายได้ด้วยสมการลอการิทึม P = 3.8757 Ln(x) - 3.0986 โดยมีคุณภาพที่น่าพอใจที่ R 2 = 0.995
เนื่องจากความสามารถในการละลายของฟีนอฟทาลีนเพิ่มขึ้นเมื่อมีค่าคงที่ไดอิเล็กตริกของตัวทำละลายเพิ่มขึ้น (มีขั้วเพิ่มขึ้น) เราสามารถพูดได้ว่าฟีนอฟทาลีนเป็นสารประกอบที่มีขั้ว
บทสรุป
ในการทำงานมีการวิเคราะห์แหล่งวรรณกรรม 26 แหล่ง อธิบาย ตำแหน่งทั่วไปได้รับโดยใช้ปฏิกิริยาของปฏิกิริยาระหว่างฟีนอลและพาทาลิกแอนไฮไดรด์ การทบทวนวิธีการสังเคราะห์ได้ดำเนินการ (พบวิธีหนึ่ง ในแหล่งวรรณกรรมที่แตกต่างกัน วิธีที่แตกต่างกันในมวลของการโหลดรีเอเจนต์) ของฟีนอฟทาลีน การสังเคราะห์ตามวิธีนี้ไม่ซับซ้อนโดยกระบวนการข้างเคียง มีการกำหนดอันตรายหลักระหว่างการสังเคราะห์และการจัดการสารที่ใช้ เลือกวิธีการหาค่าความสามารถในการละลาย เลือกคลอโรฟอร์ม ไซลีน และเบนซีนเป็นตัวทำละลายเพื่อหาค่าความสามารถในการละลาย
ฟีนอล์ฟทาลีนถูกสังเคราะห์ด้วยผลผลิต 40.5% เงื่อนไขสำหรับการสังเคราะห์ การทำให้บริสุทธิ์ และการแยกถูกปฏิบัติตามอย่างเคร่งครัดตามข้อมูลของวิธีการ
ความสามารถในการละลายของฟีนอฟทาลีน (ตามการหาค่ากราวิเมตริก) คือ: 3.00 ± 0.03 ก./100 ก. ของคลอโรฟอร์ม, 0.22 ± 0.01 ก./100 ก. ของไซลีน, 0.19 ± 0.01 ก./100 ก. ของเบนซีน
ความสามารถในการละลายของฟีนอฟทาลีนที่เพิ่มขึ้นพร้อมกับค่าคงที่ไดอิเล็กตริกของตัวทำละลายที่เพิ่มขึ้นเป็นการยืนยันว่าฟีนอฟทาลีนเป็นสารประกอบที่มีขั้ว
รายชื่อวรรณกรรมที่ใช้แล้ว
1.Agronomov A.E. งานห้องปฏิบัติการเคมีอินทรีย์ – ม.: การตรัสรู้, 2520. 230 น.2. Astakhova L.I. , Krivenko A.P. อบรมเชิงปฏิบัติการเรื่องเคมีอินทรีย์. – ม.: มีร์, 2533. 180 น.
3. ตัวบ่งชี้ Bishot E. – ม.: มีร์, 2519. 356 น.
4. Buhler K., Pearson D. การสังเคราะห์สารอินทรีย์ M.: สูงกว่า สค. 2516. 340 น.
5. Gerasimov Ya.I. อุณหพลศาสตร์ของสารละลาย – ม.: Izd – v MGU, 1980. 170 p.
6. Gitis S. S. การประชุมเชิงปฏิบัติการเกี่ยวกับเคมีอินทรีย์ /S. S. Gitis, A. I. Glaz, A. I. Ivanov – ม.: VSh, 1991.
7.Golodnikov G.V. อบรมเชิงปฏิบัติการเรื่องเคมีอินทรีย์. – ม.: เคมี, 2521. 160s.
8. Grandberg I. I. งานปฏิบัติและการสัมมนาด้านเคมีอินทรีย์: คู่มือสำหรับนักเรียน มหาวิทยาลัย – แก้ไขครั้งที่ 4 และเพิ่มเติม – ม.: อีแร้ง, 2544.
9. Ivanov V. G. การประชุมเชิงปฏิบัติการเกี่ยวกับเคมีอินทรีย์: Proc. ค่าเผื่อสำหรับนักเรียน สูงขึ้น เท้า. หนังสือเรียน สถาบัน /V. G. Ivanov, O. N. Geva, Yu. G. Gaverova - ม.: สำนักพิมพ์ "สถานศึกษา", 2543.
10. การะเพียนต์ ม.ค. ความรู้เบื้องต้นเกี่ยวกับทฤษฎีกระบวนการทางเคมี - ม.: สูงกว่า สค. 2518. 280 น.
11. คิริลิน V.A. อุณหพลศาสตร์ของสารละลาย – ม.: พลังงาน, 1980. 80 p.
12. Kogan V.B. คู่มือการละลาย - M.: L. Publishing House of the Academy of Sciences, 1961. 300 น.
13. Levina R. Ya. การปฏิบัติงานด้านเคมีอินทรีย์ – ม.: เคมี, 2523.
14.Organicum: การปฏิบัติงานเกี่ยวกับเคมีอินทรีย์ - ม.: มีร์ 2522 - V.2
15. Petrov A. A. เคมีอินทรีย์: หนังสือเรียนสำหรับมหาวิทยาลัย /อ. A. Petrov, H. V. Balyan, A. T. Troshchenko – แก้ไขครั้งที่ 5 และเพิ่มเติม - เซนต์ปีเตอร์สเบิร์ก: Ivan Fedorov, 2545
16. Reichard K. ตัวทำละลายและผลกระทบปานกลางในเคมีอินทรีย์ – ม.: มีร์, 2534. 182 น.
17. คู่มือการศึกษาในห้องปฏิบัติการเคมีอินทรีย์: คู่มือสำหรับมหาวิทยาลัย /N. N. Artemyeva, V. L. Beloborodova, S. E. Zurabyan และคนอื่น ๆ ; เอ็ด N. A. Tyukavkina. - แก้ไขครั้งที่ 2 และเพิ่มเติม – ม.: อีแร้ง, 2545.
18. คุณสมบัติ สารประกอบอินทรีย์: หนังสืออ้างอิง / บรรณาธิการ. อ.โพเตขิณา. - L.: เคมี 2527
19. Smolina T. A. การปฏิบัติงานด้านเคมีอินทรีย์: การประชุมเชิงปฏิบัติการขนาดเล็ก /T. A. Smolina, N. V. Vasilyeva, N. B. Kupletskaya - แก้ไขครั้งที่ 2 – ม.: การตรัสรู้, 2529.
20. คู่มือนักเคมี / เอ็ด B. N. Nikolsky และคนอื่น ๆ - L.: เคมี, 2507
21. Stromberg A. G. เคมีเชิงฟิสิกส์: Proc. สำหรับเคมี ผู้เชี่ยวชาญ. มหาวิทยาลัย/อ. G. Stromberg, D.P. Semchenko; เอ็ด เอ.จี.สตรอมเบิร์ก - แก้ไขครั้งที่ 5, รายได้ – ม.: VSh, 2546.
22. Traven VF เคมีอินทรีย์: หนังสือเรียนสำหรับมหาวิทยาลัย - ม.: ICC "Akademkniga", 2547. - T.1.
23. เคมีเชิงฟิสิกส์ ใน 2 เล่ม หนังสือ. 1. โครงสร้างของสสาร อุณหพลศาสตร์: Proc. สำหรับมหาวิทยาลัย/ก. S. Krasnov, N. K. Vorobyov, I. I. Godnev และคนอื่น ๆ ; เอ็ด K. S. Krasnova - ฉบับที่ 3, รายได้ – ม.: VSh, 2544.
24. Fialkov Yu.A. ตัวทำละลายเป็นวิธีการควบคุม กระบวนการทางเคมี. - L.: เคมี, 2533. 240 น.
25.เคมีภัณฑ์ พจนานุกรมสารานุกรม/ เอ็ด I. L. Knunyants และอื่น ๆ - ม.: สารานุกรมโซเวียต, 1983.
26. ม.ครามกินา อบรมเชิงปฏิบัติการเรื่องการสังเคราะห์สารอินทรีย์ - ม.: สำนักพิมพ์แห่งมหาวิทยาลัยแห่งรัฐมอสโก, 2528. 473 น.
สูตรเชิงประจักษ์ของฟีนอล์ฟทาลีน: C20H14O4 .
ฟีนอล์ฟทาลีนคืออะไร?
ตามวิกิพีเดีย 4,4'-ไดออกซีพทาโลฟีโนน หรือ 3,3-บิส-(4-ไฮดรอกซีฟีนิล)พทาไลด์ แสดงถึง ตัวบ่งชี้กรดเบส .
สารต่างๆเช่น กระดาษลิตมัส ฟีนอฟทาลีน เมทิลออเรนจ์ มีการใช้กันอย่างแพร่หลายในวิชาเคมีเพื่อหาความเป็นกรดของสารละลาย
ในรูปแบบที่ไม่เปลี่ยนแปลง สารนี้เป็นผลึกใสที่ละลายได้น้อยในน้ำ แต่ละลายได้สูงในแอลกอฮอล์และ ไดเอทิลอีเทอร์ . เป็นไปได้ที่จะสังเคราะห์สารจาก ฟีนอล และ พทาลิกแอนไฮไดรด์ โดยปฏิกิริยาการควบแน่นโดยใช้ สังกะสีคลอไรด์ ยังไง ตัวเร่ง (ใช้แบบเข้มข้นก็ได้ กรดซัลฟูริก ).
สารนี้ในสภาพแวดล้อมที่เป็นกรด ( ค่าความเป็นกรดด่าง จาก 0 ถึง 3) จะได้โทนสีส้มที่เด่นชัด ในสภาพแวดล้อมที่เป็นกรดเล็กน้อยและเป็นกลาง ( ค่าความเป็นกรดด่าง จาก 4 ถึง 7) สารละลายจะไม่เปลี่ยนสี ด้วยความช่วยเหลือของฟีนอล์ฟทาลีน สภาพแวดล้อมที่เป็นด่างสามารถรับรู้ได้ เนื่องจากผลิตภัณฑ์ใช้สีแดงเข้มในสารละลาย ค่าความเป็นกรดด่าง ซึ่งมีตั้งแต่ 8 ถึง 10 ( สารละลายอัลคาไลน์). ถ้าค่า ค่าความเป็นกรดด่าง จาก 11 ถึง 14 ตัวบ่งชี้จะไม่ส่งผลต่อสีของยา ฟีนอล์ฟทาลีนใช้สำหรับ การไทเทรต หลากหลาย สารละลายที่เป็นน้ำใน การวิเคราะห์ทางเคมี มักใช้สารที่ละลายในแอลกอฮอล์
ฟีนอล์ฟทาลีนยังใช้กันอย่างแพร่หลายในทางการแพทย์ อะไร เพอร์เกน ? เป็นคำพ้องความหมายสำหรับ Phenolphthalein ในศตวรรษที่ผ่านมาสารนี้ถูกใช้เป็นยาระบาย ยากระตุ้นการเคลื่อนไหวของลำไส้อย่างแข็งขัน ตอนนี้ไม่ค่อยใช้ยาระบาย Purgen เนื่องจากความสามารถในการสะสมในร่างกายและส่งผลเสียต่อการทำงานของไต
ฤทธิ์ทางเภสัชวิทยา
ยาระบาย
เภสัชพลศาสตร์และเภสัชจลนศาสตร์
ฟีนอล์ฟทาลีน มันคืออะไร?
Purgen เป็นยาระบายที่มีประสิทธิภาพ กลไกการทำงานขึ้นอยู่กับ การบีบตัวของกล้ามเนื้อ ลำไส้ สิ่งนี้เกิดขึ้นเนื่องจากความสามารถของสารในการยับยั้ง โซเดียมโพแทสเซียม ATPase ,กระตุ้น อะดีนิลไซเคลส และการเลี้ยงดู การสังเคราะห์ทางชีวภาพ . สารกระตุ้นประสาทและปลายประสาทของผนังลำไส้ถูกรบกวน ความสมดุลของน้ำและอิเล็กโทรไลต์ ใน ระบบทางเดินอาหาร ของเหลวสะสม
หลังจากรับประทานครั้งแรก ผลของการรักษาจะเกิดขึ้นภายในหนึ่งวัน สารมีแนวโน้มที่จะสะสมในร่างกายมีผลระคายเคืองต่อไตได้ สารก่อมะเร็ง คุณสมบัติ.
ข้อบ่งชี้ในการใช้งาน
การเตรียมการที่มีสารนี้ใช้เป็นยาระบายเรื้อรัง
ข้อห้าม
ยาระบาย Purgen มีข้อห้าม:
- ด้วยโรคไต
- ผู้ป่วยด้วย ลำไส้อุดตัน ;
- เมื่ออยู่บนฟีนอล์ฟทาลีน
- เมื่อผู้ป่วยมีอาการที่ซับซ้อน " ช่องท้องเฉียบพลัน ”.
ไม่ควรใช้ยาเป็นเวลานาน ต้องใช้ความระมัดระวังเป็นพิเศษเมื่อรักษาผู้สูงอายุด้วยยา
ผลข้างเคียง
เม็ด Purgen อาจทำให้เกิด:
- ใจสั่นเนื่องจาก ความสมดุลของน้ำและอิเล็กโทรไลต์ ;
- ภาวะอัลบูมินนูเรีย ;
- ทรุด ;
- ลดระดับโพแทสเซียมในเลือด
- เปลี่ยนสีของปัสสาวะจากสีเหลืองเป็นสีชมพูหรือสีน้ำตาล
- ผื่นที่ผิวหนังและ
คำแนะนำสำหรับ Purgen (วิธีการและปริมาณ)
ยาระบายมีอยู่ในรูปของยาเม็ด ขนาดยาต่างๆ หรือผงสำหรับการบริหารช่องปาก
คำแนะนำการใช้ฟีนอล์ฟทาลีน
โดยเฉลี่ยแล้ว ปริมาณรายวันสำหรับผู้ใหญ่คือ 100 มก.
เด็กจะได้รับ 50-200 มก. ต่อวัน ขึ้นอยู่กับอายุและน้ำหนักของเด็ก
ปริมาณสูงสุดของสารที่สามารถรับได้ภายใน 24 ชั่วโมงคือ 300 มก.
หลักสูตรการรักษากำหนดโดยผู้เชี่ยวชาญ ไม่ควรเตรียมการที่มีส่วนประกอบนี้เป็นเวลานาน
ยาเกินขนาด
ยาอาจทำให้เกิด เลือดออกริดสีดวงทวาร ลดลงอย่างมีนัยสำคัญถึง ทรุด การปรากฏตัวของโปรตีนในปัสสาวะ ในกรณีที่ให้ยาเกินขนาด แนะนำให้ปรึกษาแพทย์
ปฏิสัมพันธ์
ฟีนอล์ฟทาลีนสามารถนำไปสู่การกักเก็บโพแทสเซียมในร่างกายหากทำการรักษาควบคู่กันไป ยาขับปัสสาวะที่ให้โพแทสเซียม .
เงื่อนไขในการขาย
ไม่จำเป็นต้องมีใบสั่งยา
สภาพการเก็บรักษา
เก็บยาที่มีส่วนผสมของฟีนอล์ฟทาลีนไว้ในที่แห้งและมืด ป้องกันเด็ก ที่อุณหภูมิห้อง
อายุการเก็บรักษา
ผงมีอายุการเก็บรักษาไม่ จำกัด แท็บเล็ตสามารถเก็บไว้ได้ 10 ปี (เว้นแต่ผู้ผลิตจะระบุไว้เป็นอย่างอื่นบนบรรจุภัณฑ์)
คำแนะนำพิเศษ
ตอนนี้ยาที่มีฟีนอฟทาลีนไม่ค่อยถูกนำมาใช้ในทางการแพทย์ ส่วนใหญ่มักจะต้องการยาระบายที่ทันสมัยและปลอดภัยอื่น ๆ
เด็ก
สารถูกกำหนดด้วยความระมัดระวัง จำเป็นต้องปรับขนาดยาขึ้นอยู่กับอายุและน้ำหนักของเด็ก
ผู้สูงอายุ
คน อายุเยอะผลของการใช้วิธีการรักษานี้จะเกิดขึ้นภายใน 24-72 ชั่วโมง
สำหรับการลดน้ำหนัก
ในตอนต้นของศตวรรษที่ผ่านมาสารนี้ใช้เพื่อลดน้ำหนัก ขณะนี้มียาอื่น ๆ ที่มีผลคล้ายกัน ผู้หญิงหลายคนในอากาศสำหรับยาระบายการละเมิดรูปร่างที่สมบูรณ์แบบซึ่งไม่ควรทำ สิ่งนี้อาจเป็นอันตรายต่อสุขภาพของคุณ
การเตรียมการที่มี (แอนะล็อก)
ความบังเอิญในรหัส ATX ระดับที่ 4:
Ex Lax, Purgen, Purgofen, Purgil, Phenaloin, Laxatol, Laxoil
ราคา Purgen ซื้อได้ที่ไหน
ราคาของยาระบายในรูปของผงฟีนอล์ฟทาลีนในราคาขายส่งประมาณ 1,700 รูเบิลต่อ 1 กิโลกรัม
แทบจะเป็นไปไม่ได้เลยที่จะซื้อยาในมอสโกเนื่องจากยาไม่ได้ถูกส่งไปยังร้านขายยาเป็นเวลานาน
ราคาของฟีนอล์ฟทาลีนอาจแตกต่างกันไป ขึ้นอยู่กับผู้ผลิต
