น้ำและสารละลาย วิธีแสดงองค์ประกอบของสารละลาย น้ำ. สารละลายที่เป็นน้ำ
ตามความสามารถในการละลายในน้ำ สารทั้งหมดจะถูกแบ่งออกเป็นสามกลุ่ม: 1) ละลายได้สูง 2) ละลายได้เล็กน้อย และ 3) ไม่ละลายในทางปฏิบัติ หลังนี้เรียกว่าสารที่ไม่ละลายน้ำ อย่างไรก็ตามควรสังเกตว่าไม่มีสารที่ไม่ละลายน้ำอย่างแน่นอน หากคุณจุ่มแท่งแก้วหรือทองคำหรือเงินลงในน้ำ สิ่งเหล่านั้นจะยังคงละลายในน้ำในปริมาณเล็กน้อย แก้ว โลหะ และเกลือบางชนิดเป็นตัวอย่างของสาร (ของแข็ง) ที่ไม่ละลายในน้ำ สิ่งเหล่านี้ควรรวมถึงน้ำมันก๊าด น้ำมันพืช(สารของเหลว), ก๊าซมีตระกูล (สารที่เป็นก๊าซ)
ตัวอย่างของสารที่ละลายน้ำได้เล็กน้อย ได้แก่ ยิปซั่ม ลีดซัลเฟต (ของแข็ง) ไดเอทิลอีเทอร์ เบนซิน (ของเหลว) มีเทน ไนโตรเจน ออกซิเจน (สารที่เป็นก๊าซ)
สารหลายชนิดละลายได้ดีในน้ำ ตัวอย่างของสารดังกล่าว ได้แก่ น้ำตาล คอปเปอร์ซัลเฟต โซเดียมไฮดรอกไซด์ (ของแข็ง) แอลกอฮอล์ อะซิโตน (ของเหลว) ไฮโดรเจนคลอไรด์ แอมโมเนีย (สารที่เป็นก๊าซ)
จากตัวอย่างข้างต้น ความสามารถในการละลายขึ้นอยู่กับลักษณะของสารเป็นหลัก นอกจากนี้ยังขึ้นอยู่กับอุณหภูมิและความดันด้วย กระบวนการละลายนั้นถูกกำหนดโดยปฏิกิริยาของอนุภาคของสารที่ละลายน้ำได้และตัวทำละลาย มันเป็นกระบวนการที่เกิดขึ้นเอง
ขึ้นอยู่กับอัตราส่วนของความเด่นของจำนวนอนุภาคที่ผ่านเข้าไปในสารละลายและการกำจัดออกจากสารละลาย สารละลายจะแยกความแตกต่างระหว่างอิ่มตัว ไม่อิ่มตัว และอิ่มตัวยิ่งยวด ในทางกลับกัน สารละลายจะถูกแบ่งออกเป็นแบบเจือจางและมีความเข้มข้นโดยขึ้นอยู่กับปริมาณสัมพัทธ์ของตัวถูกละลายและตัวทำละลาย
สารละลายที่สารที่กำหนดที่อุณหภูมิที่กำหนดไม่ละลายอีกต่อไป กล่าวคือ สารละลายที่อยู่ในสมดุลกับตัวถูกละลายเรียกว่าอิ่มตัว และสารละลายที่ยังสามารถละลายสารที่กำหนดในปริมาณเพิ่มเติมได้เรียกว่าไม่อิ่มตัว .
อัตราส่วนมวลของสารที่ก่อตัว อิ่มตัว สารละลายที่อุณหภูมิที่กำหนดมวลของตัวทำละลายเรียกว่าความสามารถในการละลาย (7.3.1.) ของสารนี้หรือค่าสัมประสิทธิ์การละลาย (7.3.2.):
(7.3.1),  (7.3.2).
(7.3.2).
แนวคิดเรื่องการละลายไม่มีความหมายสำหรับสารที่ละลายซึ่งกันและกันได้อย่างสมบูรณ์ (เอทิลแอลกอฮอล์ - น้ำ)
ขึ้นอยู่กับความสามารถในการละลายของสารกับอุณหภูมิและธรรมชาติของตัวทำละลาย ความสามารถในการละลายของสารขึ้นอยู่กับลักษณะของตัวถูกละลายและตัวทำละลาย อุณหภูมิและความดันเป็นอย่างมาก ย้อนกลับไปในช่วงกลางสหัสวรรษที่แล้ว กฎเกณฑ์ถูกสร้างขึ้นโดยการทดลองว่าไลค์จะสลายไปเป็นไลค์ ดังนั้น สารที่มีพันธะประเภทไอออนิก (เกลือ ด่าง) หรือโควาเลนต์-ขั้ว (แอลกอฮอล์ อัลดีไฮด์) จึงละลายได้สูงในตัวทำละลายที่มีขั้ว โดยส่วนใหญ่อยู่ในน้ำ ในทางกลับกัน ความสามารถในการละลายของออกซิเจนในเบนซีนนั้นมีลำดับความสำคัญสูงกว่าในน้ำ เนื่องจากโมเลกุล O 2 และ C 6 H 6 นั้นไม่มีขั้ว
สำหรับของแข็งส่วนใหญ่ ความสามารถในการละลายจะเพิ่มขึ้นตามอุณหภูมิที่เพิ่มขึ้น
ถ้าสารละลายที่อิ่มตัวเมื่อถูกความร้อนถูกทำให้เย็นลงอย่างระมัดระวังจนไม่มีผลึกเกลือหลุดออกมา จะเกิดสารละลายที่มีความอิ่มตัวยิ่งยวดขึ้น สารละลายเรียกว่าอิ่มตัวยิ่งยวดหากมีตัวถูกละลายที่อุณหภูมิที่กำหนดมากกว่าสารละลายอิ่มตัว สารละลายอิ่มตัวยวดยิ่งไม่เสถียร และเมื่อสภาวะเปลี่ยนแปลง (เมื่อเขย่าหรือเติมเมล็ดพืชลงในสารละลายสำหรับการตกผลึก) จะเกิดการตกตะกอน ซึ่งเกินกว่าที่สารละลายอิ่มตัวจะยังคงอยู่
ความสามารถในการละลายของก๊าซในน้ำจะลดลงเมื่ออุณหภูมิเพิ่มขึ้นซึ่งต่างจากของแข็ง ซึ่งเป็นผลมาจากความเปราะบางของพันธะระหว่างโมเลกุลของสารที่ละลายกับตัวทำละลาย กฎสำคัญอีกข้อหนึ่งที่อธิบายความสามารถในการละลายของก๊าซในของเหลวคือกฎของเฮนรี่: ความสามารถในการละลายของก๊าซเป็นสัดส่วนโดยตรงกับความดันเหนือของเหลว
โซลูชั่นมีบทบาทสำคัญในธรรมชาติ วิทยาศาสตร์ และเทคโนโลยี น้ำเป็นพื้นฐานของชีวิตและมีสารที่ละลายอยู่เสมอ น้ำจืดจากแม่น้ำและทะเลสาบมีสารที่ละลายอยู่เล็กน้อย ในขณะที่น้ำทะเลมีเกลือที่ละลายอยู่ประมาณ 3.5%
เชื่อกันว่ามหาสมุทรดึกดำบรรพ์ (ในช่วงเวลาแห่งการกำเนิดของสิ่งมีชีวิตบนโลก) มีเกลือที่ละลายอยู่เพียง 1% เท่านั้น
“ในสภาพแวดล้อมนี้เองที่สิ่งมีชีวิตพัฒนาขึ้นเป็นครั้งแรก จากสารละลายนี้ พวกเขาดึงไอออนและโมเลกุลที่จำเป็นสำหรับการเจริญเติบโตและการพัฒนาต่อไป... เมื่อเวลาผ่านไป สิ่งมีชีวิตพัฒนาและเปลี่ยนแปลง ดังนั้นพวกมันจึงสามารถออกจากสภาพแวดล้อมทางน้ำได้ และเคลื่อนตัวขึ้นบกแล้วลอยขึ้นสู่อากาศ พวกเขาได้รับความสามารถเหล่านี้โดยการจัดเก็บสารละลายในน้ำในร่างกายในรูปของของเหลวที่มีไอออนและโมเลกุลที่สำคัญอยู่” คำเหล่านี้เป็นคำที่ Linus Pauling นักเคมีชาวอเมริกันผู้โด่งดังและผู้ได้รับรางวัลโนเบลใช้อธิบายบทบาทของสารละลาย ในธรรมชาติ ภายในเราแต่ละคน ในทุกเซลล์ในร่างกายของเรา มีความทรงจำเกี่ยวกับมหาสมุทรปฐมภูมิ สถานที่ที่สิ่งมีชีวิตกำเนิดขึ้น ซึ่งเป็นสารละลายที่เป็นน้ำที่สร้างชีวิตขึ้นมาเอง
ในสิ่งมีชีวิตใด ๆ สารละลายที่ผิดปกติจะไหลผ่านหลอดเลือดอย่างต่อเนื่อง - หลอดเลือดแดงหลอดเลือดดำและเส้นเลือดฝอยซึ่งเป็นพื้นฐานของเลือด สัดส่วนมวลของเกลือในนั้นจะเหมือนกับในมหาสมุทรปฐมภูมิ - 0.9% ทางกายภาพที่ซับซ้อน กระบวนการทางเคมีที่เกิดขึ้นในร่างกายคนและสัตว์ก็มีปฏิกิริยาโต้ตอบในสารละลายเช่นกัน กระบวนการย่อยอาหารเกี่ยวข้องกับการถ่ายโอนสารที่มีคุณค่าทางโภชนาการสูงไปเป็นสารละลาย สารละลายน้ำธรรมชาติเกี่ยวข้องโดยตรงกับกระบวนการก่อตัวของดินและการจัดหาสารอาหารให้กับพืช กระบวนการทางเทคโนโลยีดังกล่าวในสารเคมีและอุตสาหกรรมอื่นๆ เช่น การผลิตปุ๋ย โลหะ กรด และกระดาษ เกิดขึ้นในสารละลาย วิทยาศาสตร์สมัยใหม่ศึกษาคุณสมบัติของสารละลาย มาดูกันว่าทางออกคืออะไร?
 สารละลายแตกต่างจากสารผสมอื่นตรงที่อนุภาค ส่วนประกอบตั้งอยู่ในพวกมันอย่างสม่ำเสมอและในไมโครโวลุ่มใด ๆ ของส่วนผสมดังกล่าวองค์ประกอบจะเหมือนกัน
สารละลายแตกต่างจากสารผสมอื่นตรงที่อนุภาค ส่วนประกอบตั้งอยู่ในพวกมันอย่างสม่ำเสมอและในไมโครโวลุ่มใด ๆ ของส่วนผสมดังกล่าวองค์ประกอบจะเหมือนกัน
นั่นคือเหตุผลที่เข้าใจว่าสารละลายเป็นของผสมที่เป็นเนื้อเดียวกันซึ่งประกอบด้วยส่วนที่เป็นเนื้อเดียวกันตั้งแต่สองส่วนขึ้นไป แนวคิดนี้มาจากทฤษฎีฟิสิกส์ของการแก้ปัญหา
ผู้ที่นับถือทฤษฎีฟิสิกส์ของสารละลายซึ่งศึกษาโดยแวนต์ ฮอฟฟ์, อาร์เรเนียส และออสต์วัลด์ เชื่อว่ากระบวนการละลายเป็นผลมาจากการแพร่กระจาย
D.I. Mendeleev และผู้สนับสนุนทฤษฎีเคมีเชื่อว่าการละลายเป็นผลมาจากปฏิกิริยาทางเคมีของตัวถูกละลายกับโมเลกุลของน้ำ ดังนั้น การระบุวิธีแก้ปัญหาจะแม่นยำยิ่งขึ้น ระบบที่เป็นเนื้อเดียวกันซึ่งประกอบด้วยอนุภาคของสารที่ละลายตัวทำละลายรวมถึงผลิตภัณฑ์ที่มีปฏิสัมพันธ์กัน
เนื่องจากปฏิกิริยาทางเคมีของสารที่ละลายกับน้ำจึงเกิดสารประกอบขึ้น - ไฮเดรต ปฏิกิริยาทางเคมีมักมาพร้อมกับปรากฏการณ์ทางความร้อน ตัวอย่างเช่นการละลายของกรดซัลฟิวริกในน้ำจะปล่อยความร้อนจำนวนมหาศาลออกมาจนสารละลายสามารถเดือดได้ซึ่งเป็นสาเหตุที่กรดถูกเทลงในน้ำและไม่ใช่ในทางกลับกัน การละลายของสารเช่นโซเดียมคลอไรด์และแอมโมเนียมไนเตรตจะมาพร้อมกับการดูดซับความร้อน
M.V. Lomonosov พิสูจน์แล้วว่าสารละลายกลายเป็นน้ำแข็งที่อุณหภูมิต่ำกว่าตัวทำละลาย
www.site เมื่อคัดลอกเนื้อหาทั้งหมดหรือบางส่วน จำเป็นต้องมีลิงก์ไปยังแหล่งที่มาดั้งเดิม
สารละลายที่เป็นน้ำประกอบด้วยสารละลายอนินทรีย์อิ่มตัวที่มีความเข้มข้นต่ำ รวมถึงน้ำอะโรมาติกที่ไม่มีแอลกอฮอล์
ของเหลวของ Burov(สุรา Burovi, Solutio Aluminii subacetatis) เป็นสารละลายที่เป็นน้ำของอะลูมิเนียมอะซิเตตพื้นฐานที่มีความเข้มข้น 7.6-9.2% และมีความหนาแน่น (σ 20 ) 1.044-1.048 ก่อนหน้านี้ได้ของเหลวของ Burov โดยใช้ปฏิกิริยาการก่อตัวของอะลูมิเนียมออกไซด์ไฮเดรตแล้วจึงละลายในกรดอะซิติกในภายหลัง ใน ปีที่ผ่านมาของเหลวของ Burov ผลิตโดยวิธีอิเล็กโทรไลซิสที่พัฒนาขึ้นในปี 1951 โดย A.I. วิธีนี้ขึ้นอยู่กับกระบวนการละลายขั้วบวกของโลหะอลูมิเนียมในสารละลายกรดอะซิติก 8% โดยการส่งผ่าน กระแสไฟฟ้า(รูปที่ 52) เป็นผลให้เกิดปฏิกิริยาการก่อตัวของอะลูมิเนียมอะซิเตตขั้นพื้นฐานซึ่ง มุมมองทั่วไปสามารถแสดงได้ดังนี้:
2เอ l + 2H 2 O + 4CH 3 COOH → 3 H 2 + 2Al (OH) (CH 3 COO) 2
สารละลายลีดอะซิเตตพื้นฐาน น้ำส้มสายชูตะกั่ว(Solutio plumbi subacetatis). เป็นสารละลายในน้ำของลีดอะซิเตตพื้นฐานที่มีปริมาณตะกั่วโลหะ 16.7-17.4% และความหนาแน่น 1.225-1.230 เมื่อยืนอยู่ในอากาศ สารละลายจะขุ่นเนื่องจากการดูดซับคาร์บอนไดออกไซด์จากอากาศอย่างเข้มข้น ยานี้ได้มาจากปฏิกิริยาของลีดอะซิเตตและลีดออกไซด์เมื่อถูกความร้อน
ไม่ได้ใช้สารละลายลีดอะซิเตตพื้นฐานในตัวมันเอง โลชั่นตะกั่ว (Aqua Plumbi) เตรียมจากร้านขายยาตามสูตร: สารละลายตะกั่วอะซิเตตพื้นฐาน 2 ส่วนและน้ำ 98 ส่วน โลชั่นตะกั่วก็เหมือนกับของเหลวของ Burov ที่เป็นสารสมานแผลและต้านการอักเสบ
น้ำมะนาว. สารละลายแคลเซียมไฮดรอกไซด์(อควา แคลซิส แคลเซียม ไฮดรอกซีดัม โซลุตัม) น้ำมะนาวเป็นสารละลายแคลเซียมไฮดรอกไซด์ในน้ำอิ่มตัวที่มีความเข้มข้น 0.15-0.17% ได้มาจากปฏิกิริยาของปูนขาวที่ถูกเผา (แคลเซียมออกไซด์) ตามด้วยความอิ่มตัวของสารละลายแคลเซียมไฮดรอกไซด์ในความเย็น เพื่อจุดประสงค์นี้ ให้นำแคลเซียมออกไซด์ 1 ส่วนต่อน้ำกลั่นต้มสุกใหม่ 70 ส่วน ขั้นแรก ให้เทผงในปริมาณเล็กน้อย (ประมาณ 1/3) เพื่อให้ได้แคลเซียมไฮดรอกไซด์ จากนั้นน้ำที่เหลือจะผสมกับแคลเซียมไฮดรอกไซด์ที่มีมวลเหนียวจนได้สารละลายในน้ำที่อิ่มตัว ผลิตภัณฑ์สำเร็จรูปเป็นของเหลวใส ไม่มีสี มีปฏิกิริยาเป็นด่างสูง ใช้รับประทานผสมกับนมในการฝึกเด็กเพื่อเพิ่มความเป็นกรดของน้ำย่อยและท้องเสีย
สารละลายโพแทสเซียมอาร์เซไนต์ สารละลายสารหนูของฟาวเลอร์(สุรา Kalii arsenitis. สุรา arsenicalis Fowleri). สารละลายอย่างเป็นทางการ (GFC บทความหมายเลข 378) ซึ่งเป็นสารละลายในน้ำของอาร์เซนัสแอนไฮไดรด์ (ซึ่งสารเตรียมควรมี 0.97-1.03%) ผสมกับโพแทสเซียมคาร์บอเนต ปฏิกิริยาการก่อตัวของยามีรูปแบบ:
เช่น 2 O 3 + K 2 CO 3 1.5H 2 O → 2KAs O 2 +CO 2 + 1.5H 2 O
เพื่อให้ได้สารละลายโพแทสเซียมอาร์เซไนต์ โพแทสเซียมคาร์บอเนต 10 ส่วนจะถูกละลายในน้ำเดือด 10 ส่วนเติมสารหนูแอนไฮไดรด์ 10 ส่วนและของเหลวถูกทำให้ร้อนจนเดือด (จนกระทั่งละลายหมด) ถัดไปสารละลายจะเจือจางด้วยน้ำ 500 กรัมและในขณะที่กวนกรดไฮโดรคลอริกที่เจือจางจะถูกค่อยๆ เติมเข้าไปจนกว่าสารละลายจะเป็นกลางซึ่งจำเป็นเพื่อป้องกันการก่อตัวของเกลือสารหนูอื่น ๆ หลังจากการทำให้เป็นกลางจะมีการเติมแอลกอฮอล์ 90 ส่วน (โดยปริมาตร) และแอลกอฮอล์การบูร 10 ส่วน (โดยปริมาตร) ลงในสารละลาย สารละลายโพแทสเซียมอาร์เซไนต์คือยาที่อยู่ในรายชื่อ A มีการเติมการบูรไพไรต์ลงไปเพื่อวัตถุประสงค์ในการระบุทางประสาทสัมผัสที่ง่ายและรวดเร็ว
เก็บยาไว้ใต้กุญแจและกุญแจ (ตู้ A) ในขวดแก้วสีเข้มที่ปิดสนิท มันถูกกำหนดไว้สำหรับโรคโลหิตจาง, โรคประสาทอ่อน, อ่อนเพลียและมะเร็งเม็ดเลือดขาวเรื้อรัง
ยาแก้พิษสำหรับพิษจากโลหะ(แอนติโดทัม เมทัลลอรัม) เพื่อเป็นยาแก้พิษจากพิษโลหะหนักจึงใช้สารละลายขององค์ประกอบต่อไปนี้: ผลึกแมกนีเซียมซัลเฟต - 3.75 ส่วน, โซเดียมไบคาร์บอเนต - 12.5 ส่วน, โซดาไฟ (ในแง่ของ 100%) - 1 ส่วน, ไฮโดรเจนซัลไฟด์ - ตามต้องการ, น้ำ - 1,000 ชิ้นส่วน เทคโนโลยีในการเตรียมสารละลายมีดังนี้: 500 ส่วนของสารละลายโซเดียมไฮดรอกไซด์ 0.2% อิ่มตัวด้วยก๊าซไฮโดรเจนซัลไฟด์ซึ่งก่อนหน้านี้ผ่านการเดือดผ่านสารแขวนลอยของแคลเซียมคาร์บอเนตในน้ำ โซเดียมไบคาร์บอเนตและแมกนีเซียมซัลเฟตละลายในน้ำอีก 500 ส่วน (เตรียมสดใหม่และทำให้เย็นลงถึง 50°C) สารละลายถูกทำให้เย็นลง โดยผสมกับสารละลายแรก สารละลายที่รวมกันจะถูกทำให้เย็นลงที่อุณหภูมิ 2-3°C ต่ำกว่าศูนย์ และอิ่มตัวอีกครั้งด้วยไฮโดรเจนซัลไฟด์จนกระทั่งความเข้มข้นถึง 0.4% หลังจากนั้นสารละลายก็พร้อมใช้งาน ผลิตภัณฑ์สำเร็จรูปคือสารละลายสีเหลืองมะนาวที่มีโทนสีเขียวเล็กน้อยกลิ่นฉุนของไฮโดรเจนซัลไฟด์และมีรสฝาดรสเค็มขม
ไอออน SO 4 2 และ S 2 ในสารละลายซึ่งมีปฏิกิริยากับโลหะหนัก จะแปลงไอออนให้เป็นสารประกอบที่ไม่ละลายน้ำซึ่งร่างกายไม่ดูดซึม ซึ่งเป็นที่มาของการออกฤทธิ์ของยาในฐานะยาแก้พิษ
น้ำมีกลิ่นหอม(อควาอะโรมาติเค). เป็นสารละลายน้ำมันหอมระเหยที่มีความเข้มข้นน้อยในน้ำ เหล่านี้เป็นของเหลวใสหรือมีสีเหลือบเล็กน้อยมีกลิ่นของสารที่ละลาย ด้วยข้อยกเว้นที่หายาก (ผักชีฝรั่งและน้ำอัลมอนด์ขม) พวกมันไม่มีวัตถุประสงค์ทางการแพทย์ที่เป็นอิสระ และใช้เป็นสารแก้ไข (เพื่อแก้ไขกลิ่น)
น้ำอะโรมาติกแบบง่ายและน้ำกลั่นนั้นขึ้นอยู่กับวิธีการผลิต
น้ำอโรมาแบบง่ายๆ ได้มาจากการละลายโดยตรงของสิ่งที่เกี่ยวข้อง น้ำมันหอมระเหยในน้ำในอัตราส่วน 1:1000 (ยกเว้นน้ำกุหลาบซึ่งเตรียมในอัตราส่วน 1:4000 เนื่องจากกลิ่นหอมเข้มข้นของน้ำมันดอกกุหลาบ) ก่อนที่จะละลาย น้ำมันหอมระเหยจะถูกบด (กระจาย) ด้วยแป้งโรยตัว และละลายในน้ำอุ่น (สูงถึง 60° C) การดำเนินการทั้งสองมีความจำเป็นเพื่อปรับปรุงกระบวนการละลาย น้ำมันส่วนเกินในสารละลายจะถูกกรองผ่านตัวกรองแบบเปียก
เพื่อเพิ่มความเสถียรของน้ำอะโรมาติกธรรมดา แนะนำให้เติมสารลดแรงตึงผิวที่ทำหน้าที่เป็นตัวละลาย: Tweens, โฟม, เอทิลสเตียเรต และสารอื่นๆ ที่ปรับปรุงความสามารถในการละลาย
น้ำกลั่นที่มีกลิ่นหอม จัดทำโดยวิธีการกลั่นโดยการส่งไอน้ำ “ร้อน” ผ่านวัตถุดิบน้ำมันหอมระเหย กระบวนการกลั่นด้วยไอน้ำเป็นไปตามกฎของดาลตัน ซึ่งของเหลวที่ไม่สามารถผสมกันได้สองชนิดจะถูกกลั่นที่อุณหภูมิต่ำกว่าแต่ละชนิดแยกจากกัน เนื่องจากการก่อตัวของไอน้ำในสารผสมดังกล่าวเกิดขึ้นเมื่อผลรวมของความดันบางส่วนของส่วนประกอบของส่วนผสมคือ ความดันเท่ากันและบรรยากาศ
เพื่อให้ได้น้ำอะโรมาติก วัตถุดิบน้ำมันหอมระเหยจะถูกใส่ในลูกบาศก์การกลั่น โดยที่ไอน้ำจะถูกส่งผ่าน เพื่อกักน้ำมันหอมระเหยเข้ากับคอนเดนเซอร์ (รูปที่ 53)
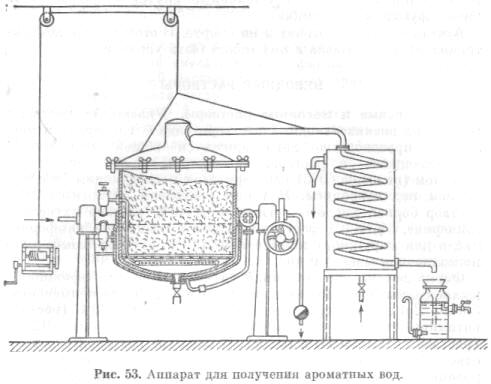
ในคอนเดนเซอร์ระบายความร้อน น้ำเย็นโดยไอของน้ำและน้ำมันหอมระเหยจะควบแน่นและไหลเข้าสู่ตัวรับในรูปของน้ำอะโรมาติกสำเร็จรูป หากในระหว่างการกลั่นน้ำมันหอมระเหยส่วนเกินเกิดขึ้นซึ่งไม่ละลายในน้ำก็จะถูกเทลงในเครื่องรับที่แยกจากกัน
ในบรรดาน้ำกลั่นอะโรมาติก น้ำอัลมอนด์ขม (Aqua Amygdalarum amararum) และน้ำผักชีฝรั่ง (Aqua Foeniculi) ซึ่งใช้ภายในเพื่อปรับปรุงการทำงานของลำไส้ มีการใช้กันอย่างแพร่หลายไม่มากก็น้อยในการปฏิบัติงานด้านเภสัชกรรม
น้ำอะโรมาติกก็เตรียมด้วยแอลกอฮอล์เช่นกัน ในกรณีนี้ความเข้มข้นของน้ำมันหอมระเหยอาจเพิ่มขึ้นได้
13.1. ความสามารถในการละลายของสารในน้ำ
สารละลายคือระบบที่เป็นเนื้อเดียวกันซึ่งประกอบด้วยสารตั้งแต่ 2 ชนิดขึ้นไป ซึ่งเนื้อหาสามารถเปลี่ยนแปลงได้ภายในขีดจำกัดที่กำหนดโดยไม่รบกวนความเป็นเนื้อเดียวกัน
น้ำโซลูชั่นประกอบด้วย น้ำ(ตัวทำละลาย) และ สารที่ละลายหากจำเป็น สถานะของสารในสารละลายที่เป็นน้ำจะถูกระบุด้วยตัวห้อย (p) เช่น KNO 3 ในสารละลาย - KNO 3 (p)
สารละลายที่มีตัวถูกละลายจำนวนเล็กน้อยมักเรียกว่า เจือจางและสารละลายที่มีปริมาณตัวถูกละลายสูง - เข้มข้นสารละลายที่สามารถละลายสารได้มากขึ้นเรียกว่า ไม่อิ่มตัวสารละลายที่สารหยุดละลายเมื่อใด เงื่อนไขที่กำหนด, – อิ่มตัวสารละลายหลังจะสัมผัสกันเสมอ (ในสมดุลต่างกัน) กับสารที่ไม่ละลายน้ำ (ตั้งแต่หนึ่งผลึกขึ้นไป)
ใน เงื่อนไขพิเศษตัวอย่างเช่น เมื่อระบายความร้อนสารละลายไม่อิ่มตัวที่ร้อนอย่างระมัดระวัง (โดยไม่คน) แข็งสารที่สามารถก่อตัวได้ อิ่มตัวมากเกินไปสารละลาย. เมื่อนำผลึกของสารมาใช้ สารละลายดังกล่าวจะถูกแบ่งออกเป็นสารละลายอิ่มตัวและตะกอนของสาร
ตาม ทฤษฎีเคมีของการแก้ปัญหา D.I. Mendeleev ประการแรกการละลายของสารในน้ำจะตามมาด้วย การทำลายพันธะเคมีระหว่างโมเลกุล (พันธะระหว่างโมเลกุลในสารโควาเลนต์) หรือระหว่างไอออน (ในสารไอออนิก) และด้วยเหตุนี้อนุภาคของสารจึงผสมกับน้ำ (ซึ่งพันธะไฮโดรเจนบางส่วนระหว่างโมเลกุลจะถูกทำลายไปด้วย) การแตกพันธะเคมีเกิดขึ้นเนื่องจากพลังงานความร้อนในการเคลื่อนที่ของโมเลกุลของน้ำ และสิ่งนี้ก็เกิดขึ้น ค่าใช้จ่ายพลังงานในรูปของความร้อน
ประการที่สอง เมื่ออยู่ในน้ำ อนุภาค (โมเลกุลหรือไอออน) ของสารจะถูกสัมผัส ความชุ่มชื้นเป็นผลให้ ให้ความชุ่มชื้น– สารประกอบที่มีองค์ประกอบไม่แน่นอนระหว่างอนุภาคของสารกับโมเลกุลของน้ำ (องค์ประกอบภายในของอนุภาคของสารนั้นจะไม่เปลี่ยนแปลงเมื่อละลาย) กระบวนการนี้มาพร้อมกับ เน้นพลังงานในรูปของความร้อนอันเนื่องมาจากการก่อตัวของพันธะเคมีใหม่ในไฮเดรต
โดยทั่วไปแล้ววิธีแก้ปัญหาก็คืออย่างใดอย่างหนึ่ง เย็นลง(หากใช้ความร้อนเกินกว่าที่ปล่อยออกมา) หรือร้อนขึ้น (มิฉะนั้น) บางครั้ง - ถ้าความร้อนเข้าและปล่อยออกมาเท่ากัน - อุณหภูมิของสารละลายยังคงไม่เปลี่ยนแปลง
ไฮเดรตจำนวนมากมีความเสถียรมากจนไม่ยุบตัวแม้ว่าสารละลายจะระเหยไปหมดแล้วก็ตาม ดังนั้นจึงทราบผลึกไฮเดรตที่เป็นของแข็งของเกลือ CuSO 4 · 5H 2 O, Na 2 CO 3 · 10H 2 O, KAl(SO 4) 2 12H 2 O เป็นต้น
ปริมาณของสารในสารละลายอิ่มตัวที่ ต= const แสดงลักษณะเชิงปริมาณ ความสามารถในการละลายของสารนี้ ความสามารถในการละลายมักจะแสดงเป็นมวลของตัวถูกละลายต่อน้ำ 100 กรัม เช่น 65.2 กรัม KBr/100 กรัม H 2 O ที่ 20 °C ดังนั้น หากเติมโพแทสเซียมโบรไมด์ที่เป็นของแข็ง 70 กรัมลงในน้ำ 100 กรัมที่อุณหภูมิ 20 °C เกลือ 65.2 กรัมจะเข้าไปในสารละลาย (ซึ่งจะอิ่มตัว) และ KBr ที่เป็นของแข็ง 4.8 กรัม (ส่วนเกิน) จะยังคงอยู่ที่ ด้านล่างของกระจก
ควรจำไว้ว่าเนื้อหาของตัวถูกละลายใน รวยสารละลาย เท่ากับ, วี ไม่อิ่มตัวสารละลาย น้อยและใน อิ่มตัวมากเกินไปสารละลาย มากกว่าความสามารถในการละลายได้ที่อุณหภูมิที่กำหนด ดังนั้น สารละลายที่เตรียมที่อุณหภูมิ 20 °C จากน้ำ 100 กรัม และโซเดียมซัลเฟต Na 2 SO 4 (ความสามารถในการละลาย 19.2 กรัม/100 กรัม H 2 O) ที่มี
เกลือ 15.7 กรัม – ไม่อิ่มตัว
เกลือ 19.2 กรัม – อิ่มตัว
เกลือ 2O.3 กรัม – อิ่มตัวยิ่งยวด
ความสามารถในการละลายของสารของแข็ง (ตารางที่ 14) มักจะเพิ่มขึ้นตามอุณหภูมิที่เพิ่มขึ้น (KBr, NaCl) และสำหรับสารบางชนิดเท่านั้น (CaSO 4, Li 2 CO 3) จะสังเกตเห็นสิ่งที่ตรงกันข้าม
ความสามารถในการละลายของก๊าซจะลดลงตามอุณหภูมิที่เพิ่มขึ้น และเพิ่มขึ้นตามความดันที่เพิ่มขึ้น ตัวอย่างเช่น ที่ความดัน 1 atm ความสามารถในการละลายของแอมโมเนียคือ 52.6 (20 °C) และ 15.4 g/100 g H 2 O (80 °C) และที่ 20 °C และ 9 atm จะเป็น 93.5 g/100 ก H 2 โอ
ตามค่าความสามารถในการละลายสารจะมีความโดดเด่น:
– ละลายน้ำได้สูงมวลในสารละลายอิ่มตัวเทียบได้กับมวลน้ำ (เช่น KBr - ที่ 20 °C ความสามารถในการละลาย 65.2 g/100 g H 2 O; สารละลาย 4.6 M) ก่อให้เกิดสารละลายอิ่มตัวที่มีโมลาริตีมากกว่า 0.1 ม.;
– ละลายได้เล็กน้อยซึ่งมีมวลในสารละลายอิ่มตัวน้อยกว่ามวลน้ำอย่างมีนัยสำคัญ (เช่น CaSO 4 - ที่ 20 °C ความสามารถในการละลาย 0.206 g/100 g H 2 O; 0.015 M สารละลาย) ทำให้เกิดสารละลายอิ่มตัวโดยมีโมลาริตี 0.1– 0.001 ม.;
– แทบไม่ละลายน้ำ,ซึ่งมีมวลในสารละลายอิ่มตัวเล็กน้อยเมื่อเทียบกับมวลของตัวทำละลาย (เช่น AgCl - ที่ 20 °C ความสามารถในการละลาย 0.00019 กรัมต่อ 100 กรัม H 2 O; 0.0000134 M สารละลาย) พวกมันก่อตัวเป็นสารละลายอิ่มตัวที่มีโมลาริตีน้อยกว่า 0.001 ม.
เรียบเรียงตามข้อมูลอ้างอิง ตารางการละลายกรดเบสและเกลือทั่วไป (ตารางที่ 15) ซึ่งระบุประเภทของความสามารถในการละลายสารที่ไม่รู้จักทางวิทยาศาสตร์ (ไม่ได้รับ) หรือสลายตัวด้วยน้ำทั้งหมด
ตำนานใช้ในตาราง:
“r” คือสารที่ละลายน้ำได้สูง
“m” คือสารที่ละลายน้ำได้เล็กน้อย
“n” คือสารที่ไม่ละลายน้ำในทางปฏิบัติ
“-” – ไม่ได้รับสาร (ไม่มีอยู่)
» – สารผสมกับน้ำได้ไม่จำกัด

บันทึก. ตารางนี้สอดคล้องกับการเตรียมสารละลายอิ่มตัวที่อุณหภูมิห้องโดยการเติมสาร (ในสถานะการรวมตัวที่เหมาะสม) ลงในน้ำ ควรคำนึงว่าการตกตะกอนของสารที่ละลายได้ไม่ดีโดยใช้ปฏิกิริยาการแลกเปลี่ยนไอออนนั้นไม่สามารถทำได้เสมอไป (สำหรับรายละเอียดเพิ่มเติม ดู 13.4)
หัวข้อ: น้ำและสารละลาย.
วางแผน:
- น้ำในธรรมชาติ คุณสมบัติของน้ำ
- โซลูชั่น
- วิธีแสดงองค์ประกอบของสารละลาย
- ไฮเดรตและคริสตัลไฮเดรต
- ความสามารถในการละลาย
- สารละลายอิ่มตัวยิ่งยวด
- ออสโมซิส
- ความดันไอ สารละลาย
- การแช่แข็งและการเดือดของสารละลาย
- สารละลายบัฟเฟอร์
น้ำเป็นสารที่พบได้ทั่วไปบนโลกเกือบสามชนิดพื้นผิวโลกส่วนที่สี่ปกคลุมไปด้วยน้ำ ก่อตัวเป็นมหาสมุทร ทะเล แม่น้ำ และทะเลสาบ มีน้ำจำนวนมากในรูปของไอก๊าซในบรรยากาศ มันอยู่ในรูปแบบของหิมะและน้ำแข็งจำนวนมหาศาล ตลอดทั้งปีบนยอดเขาสูงและในประเทศแถบขั้วโลก ในบาดาลของโลกยังมีน้ำที่ทำให้ดินและหินอิ่มตัว
น้ำธรรมชาติไม่เคยบริสุทธิ์อย่างสมบูรณ์ น้ำฝนเป็นน้ำที่บริสุทธิ์ที่สุด แต่ก็ยังมีสิ่งเจือปนต่างๆ ดูดซับมาจากอากาศจำนวนเล็กน้อยด้วย
ปริมาณสิ่งเจือปนในน้ำจืดมักจะอยู่ในช่วง 0.01 ถึง 0.1% (น้ำหนัก) น้ำทะเลประกอบด้วยสารที่ละลายได้ 3.5% (มวล) โดยมีมวลหลักคือโซเดียมคลอไรด์ (เกลือแกง)
น้ำที่มีเกลือแคลเซียมและแมกนีเซียมในปริมาณมากเรียกว่าน้ำกระด้าง ตรงกันข้ามกับน้ำอ่อน เช่น น้ำฝน น้ำกระด้างทำให้เกิดฟองสบู่เล็กน้อย และเกิดตะกรันบนผนังหม้อต้มน้ำ
เพื่อแยกน้ำธรรมชาติออกจากอนุภาคที่แขวนลอยอยู่นั้นจะถูกกรองผ่านชั้นของสารที่มีรูพรุนเช่นถ่านหินดินเหนียวอบ ฯลฯ เมื่อกรองน้ำปริมาณมากจะใช้ตัวกรองทรายและกรวด ตัวกรองยังดักจับแบคทีเรียส่วนใหญ่อีกด้วย นอกจากนี้เพื่อการฆ่าเชื้อโรค น้ำดื่มมันคือคลอรีน ในการฆ่าเชื้อในน้ำโดยสมบูรณ์ ต้องใช้คลอรีนไม่เกิน 0.7 กรัมต่อน้ำ 1 ตัน
การกรองสามารถขจัดสิ่งเจือปนที่ไม่ละลายน้ำออกจากน้ำได้เท่านั้น สารที่ละลายจะถูกกำจัดออกโดยการกลั่นหรือการแลกเปลี่ยนไอออน
น้ำมีความสำคัญมากในการดำรงชีวิตของพืช สัตว์ และมนุษย์ ตามแนวคิดสมัยใหม่ ต้นกำเนิดของชีวิตมีความเกี่ยวข้องกับทะเล ในสิ่งมีชีวิตใด ๆ น้ำเป็นสื่อกลางในกระบวนการทางเคมีที่เกิดขึ้นเพื่อให้แน่ใจว่าสิ่งมีชีวิตมีอายุการใช้งาน นอกจากนี้ตัวมันเองยังมีส่วนร่วมในปฏิกิริยาทางชีวเคมีจำนวนหนึ่งด้วย
คุณสมบัติทางกายภาพของน้ำ น้ำบริสุทธิ์เป็นของเหลวใสไม่มีสี ความหนาแน่นของน้ำในระหว่างการเปลี่ยนจากของแข็งเป็นของเหลวไม่ลดลงเกือบ
สำหรับสารอื่นๆ ทั้งหมดแต่เพิ่มขึ้น เมื่อน้ำร้อนตั้งแต่ 0 ถึง 4°C ความหนาแน่นของน้ำก็จะเพิ่มขึ้นเช่นกัน ที่อุณหภูมิ 4 °C น้ำจะมีความหนาแน่นสูงสุด และเมื่อมีการให้ความร้อนเพิ่มขึ้นเท่านั้นความหนาแน่นของน้ำจะลดลง
คุ้มค่ามากในชีวิตของธรรมชาติก็คือความจริงที่ว่าน้ำมีความจุความร้อนสูงผิดปกติ
เนื่องจากเมื่อน้ำแข็งละลาย ปริมาตรที่น้ำครอบครองลดลง ความดันจะทำให้อุณหภูมิหลอมละลายของน้ำแข็งลดลง ซึ่งเป็นไปตามหลักการของเลอ ชาเตอลิเยร์ ดังนั้นความดันที่เพิ่มขึ้นที่ O °C ทำให้เกิดการเปลี่ยนน้ำแข็งเป็นของเหลวซึ่งหมายความว่าจุดหลอมเหลวของน้ำแข็งลดลง
โมเลกุลของน้ำมีโครงสร้างเชิงมุม นิวเคลียสรวมอยู่ในรูปแบบองค์ประกอบ สามเหลี่ยมหน้าจั่วที่ฐานซึ่งมีโปรตอนสองตัว และที่ด้านบนสุดคือนิวเคลียสของอะตอมออกซิเจน ระยะห่างระหว่างนิวเคลียร์ OH อยู่ใกล้กับ 0.1 นาโนเมตร ระยะห่างระหว่างนิวเคลียสของอะตอมไฮโดรเจนอยู่ที่ประมาณ 0.15 นาโนเมตร จากอิเล็กตรอนแปดตัวที่ประกอบเป็นชั้นอิเล็กตรอนด้านนอกของอะตอมออกซิเจนในโมเลกุลของน้ำ คู่อิเล็กตรอนสองคู่จะก่อให้เกิดพันธะโควาเลนต์ OH และอิเล็กตรอนที่เหลืออีกสี่ตัวเป็นตัวแทนของคู่อิเล็กตรอนที่ไม่ได้ใช้ร่วมกันสองคู่
อะตอมออกซิเจนในโมเลกุลของน้ำอยู่ในสถานะ 5p 3 -ไฮบริด ดังนั้นมุมพันธะ HOH (104.3°) จึงอยู่ใกล้กับจัตุรมุข (109.5°) อิเล็กตรอนที่สร้างพันธะ OH จะถูกเลื่อนไปยังอะตอมออกซิเจนที่มีอิเลคโตรเนกาติตีมากขึ้น เป็นผลให้อะตอมไฮโดรเจนได้รับประจุบวกที่มีประสิทธิผล ดังนั้นจึงสร้างขั้วบวกสองขั้วบนอะตอมเหล่านี้ จุดศูนย์กลางประจุลบของคู่อิเล็กตรอนเดี่ยวของอะตอมออกซิเจนที่อยู่บนลูกผสม 5p 3 -ออร์บิทัลถูกแทนที่โดยสัมพันธ์กับนิวเคลียสของอะตอม และสร้างขั้วลบ 2 ขั้ว
น้ำหนักโมเลกุลของไอน้ำคือ 18 หน่วย แต่มีน้ำหนักโมเลกุล น้ำของเหลวซึ่งพิจารณาจากการศึกษาสารละลายในตัวทำละลายอื่นพบว่ามีค่าสูงกว่า สิ่งนี้เกิดขึ้นเนื่องจากในน้ำของเหลว โมเลกุลของน้ำแต่ละโมเลกุลจะรวมตัวกันเป็นมวลรวมที่ซับซ้อนมากขึ้น (กระจุก) ข้อสรุปนี้ได้รับการยืนยันโดยค่าอุณหภูมิหลอมเหลวและจุดเดือดที่สูงผิดปกติ การเชื่อมโยงกันของโมเลกุลของน้ำเกิดจากการก่อตัวของพันธะไฮโดรเจนระหว่างพวกมัน
ในโครงสร้างของน้ำ น้ำเป็นลำดับชั้นของโครงสร้างสามมิติปกติ ซึ่งขึ้นอยู่กับการก่อตัวคล้ายคริสตัลที่ประกอบด้วยโมเลกุล 57 โมเลกุลและมีปฏิกิริยาระหว่างกันผ่านพันธะไฮโดรเจนอิสระ สิ่งนี้นำไปสู่การปรากฏตัวของโครงสร้างอันดับสองในรูปแบบของ hexahedrons ที่ประกอบด้วยโมเลกุลของน้ำ 912 คุณสมบัติของกลุ่มขึ้นอยู่กับอัตราส่วนที่ออกซิเจนและไฮโดรเจนปรากฏบนพื้นผิว การจัดวางองค์ประกอบของน้ำจะตอบสนองต่ออิทธิพลภายนอกและสิ่งเจือปนใดๆ ซึ่งอธิบายถึงลักษณะปฏิสัมพันธ์ขององค์ประกอบที่มีความอ่อนไหวอย่างยิ่ง ในน้ำธรรมดา จำนวนรวมของโมเลกุลของน้ำแต่ละโมเลกุลและความสัมพันธ์แบบสุ่มคือ 60% (น้ำที่ถูกทำลาย) และ 40% เป็นกลุ่ม (น้ำที่มีโครงสร้าง)
ในน้ำแข็ง (น้ำแข็ง) อะตอมออกซิเจนของแต่ละโมเลกุลมีส่วนร่วมในการก่อตัวของพันธะไฮโดรเจนสองพันธะกับโมเลกุลของน้ำที่อยู่ใกล้เคียง การก่อตัวของพันธะไฮโดรเจนทำให้เกิดการจัดเรียงโมเลกุลของน้ำโดยที่โมเลกุลของน้ำจะสัมผัสกันด้วยขั้วตรงข้ามกัน โมเลกุลต่างๆ ก่อตัวเป็นชั้นๆ แต่ละโมเลกุลจะเชื่อมต่อกับโมเลกุลสามตัวที่อยู่ในชั้นเดียวกันและอีกหนึ่งโมเลกุลจากชั้นใกล้เคียงกัน โครงสร้างของน้ำแข็งเป็นของโครงสร้างที่มีความหนาแน่นน้อยที่สุดมีช่องว่างอยู่ซึ่งมีขนาดใหญ่กว่าขนาดของโมเลกุลเล็กน้อย
เมื่อน้ำแข็งละลาย โครงสร้างจะถูกทำลาย แต่ถึงแม้จะอยู่ในน้ำของเหลว พันธะไฮโดรเจนระหว่างโมเลกุลก็ยังคงอยู่: การเชื่อมโยงเกิดขึ้น - เศษของโครงสร้างน้ำแข็งซึ่งประกอบด้วยขนาดใหญ่กว่าหรือ จำนวนที่น้อยกว่าโมเลกุลของน้ำ อย่างไรก็ตาม ต่างจากน้ำแข็งตรงที่แต่ละมวลรวมดำรงอยู่ในช่วงเวลาสั้นมาก: การทำลายมวลรวมบางส่วนและการก่อตัวของมวลรวมอื่น ๆ เกิดขึ้นอย่างต่อเนื่อง ช่องว่างของมวลรวม "น้ำแข็ง" ดังกล่าวสามารถรองรับโมเลกุลของน้ำเดี่ยวได้ ในขณะเดียวกัน การอัดตัวของโมเลกุลของน้ำก็มีความหนาแน่นมากขึ้น นั่นคือเหตุผลที่เมื่อน้ำแข็งละลาย ปริมาตรที่น้ำครอบครองลดลงและความหนาแน่นเพิ่มขึ้น
เมื่อน้ำร้อนขึ้น ชิ้นส่วนโครงสร้างน้ำแข็งก็จะน้อยลงเรื่อยๆ ซึ่งทำให้ความหนาแน่นของน้ำเพิ่มขึ้นอีก ในช่วงอุณหภูมิตั้งแต่ 0 ถึง 4°C ผลกระทบนี้มีอิทธิพลเหนือการขยายตัวทางความร้อน ดังนั้นความหนาแน่นของน้ำจึงเพิ่มขึ้นอย่างต่อเนื่อง อย่างไรก็ตาม เมื่อได้รับความร้อนสูงกว่า 4°C อิทธิพลของการเคลื่อนที่ทางความร้อนที่เพิ่มขึ้นของโมเลกุลจะมีอิทธิพลเหนือกว่า และความหนาแน่นของน้ำจะลดลง ดังนั้นที่อุณหภูมิ 4°C น้ำจึงมีความหนาแน่นสูงสุด
เมื่อให้ความร้อนแก่น้ำ ความร้อนส่วนหนึ่งจะถูกใช้ในการทำลายพันธะไฮโดรเจน (พลังงานในการแตกพันธะไฮโดรเจนในน้ำจะอยู่ที่ประมาณ 25 กิโลจูล/โมล) สิ่งนี้อธิบายถึงความจุความร้อนสูงของน้ำ พันธะไฮโดรเจนระหว่างโมเลกุลของน้ำจะถูกทำลายอย่างสมบูรณ์ก็ต่อเมื่อน้ำเปลี่ยนเป็นไอน้ำเท่านั้น
แผนภาพสถานะของน้ำ (หรือแผนภาพเฟส) เป็นการแสดงความสัมพันธ์แบบกราฟิกระหว่างปริมาณที่แสดงลักษณะของระบบและการเปลี่ยนเฟสในระบบ (การเปลี่ยนจากของแข็งเป็นของเหลว จากของเหลวเป็นก๊าซ ฯลฯ) สำหรับระบบที่มีส่วนประกอบเดียว มักจะใช้แผนภาพเฟสเพื่อแสดงการพึ่งพากัน การแปลงเฟสอุณหภูมิและความดัน เรียกว่าแผนภาพสถานะในพิกัด PT
ที่อุณหภูมิที่สอดคล้องกับจุดนี้ "อุณหภูมิวิกฤต" ซึ่งเป็นค่าที่แสดงลักษณะเฉพาะ คุณสมบัติทางกายภาพของเหลวและไอจะเหมือนกัน ดังนั้นความแตกต่างระหว่างสถานะของเหลวและไอจะหายไป
การดำรงอยู่ของอุณหภูมิวิกฤติก่อตั้งขึ้นเมื่อปี พ.ศ. 2403 โดย D.I. Mendeleev โดยศึกษาคุณสมบัติของของเหลว เขาแสดงให้เห็นว่าที่อุณหภูมิสูงกว่าอุณหภูมิวิกฤติ สารไม่สามารถมีสถานะเป็นของเหลวได้ ในปี พ.ศ. 2412 แอนดรูว์ซึ่งศึกษาคุณสมบัติของก๊าซก็ได้ข้อสรุปที่คล้ายกัน
อุณหภูมิและความดันวิกฤตสำหรับ สารต่างๆแตกต่างกัน ดังนั้น สำหรับไฮโดรเจน = 239.9 °C = 1.30 MPa สำหรับคลอรีน = 144 °C = 7.71 MPa สำหรับน้ำ = 374.2 °C = 22.12 MPa
โมเลกุลของน้ำมีความทนทานต่อความร้อนสูง อย่างไรก็ตาม ที่อุณหภูมิสูงกว่า 1,000 °C ไอน้ำจะเริ่มสลายตัวเป็นส่วนประกอบของน้ำ ไฮโดรเจน และออกซิเจน กระบวนการสลายตัวของสารอันเป็นผลมาจากการให้ความร้อนเรียกว่าการแยกตัวด้วยความร้อน การแยกตัวของความร้อนของน้ำเกิดขึ้นพร้อมกับการดูดซับความร้อน ดังนั้นตามหลักการสมดุลของนักวิทยาศาสตร์ชาวฝรั่งเศส เลอ ชาเตอลิเยร์ ยิ่งอุณหภูมิสูงน้ำก็ยิ่งสลายตัวมากขึ้น อย่างไรก็ตาม แม้ที่อุณหภูมิ 2000 °C ระดับการแยกตัวเนื่องจากความร้อนของน้ำจะต้องไม่เกิน 2% กล่าวคือ ความสมดุลระหว่างน้ำที่เป็นก๊าซและผลิตภัณฑ์จากการแยกตัวของน้ำ - ไฮโดรเจนและออกซิเจน - ยังคงเคลื่อนไปทางน้ำ เมื่อทำความเย็นต่ำกว่า 1,000 °C สมดุลจะเปลี่ยนไปในทิศทางนี้เกือบทั้งหมด
น้ำเป็นสารที่มีปฏิกิริยามาก ออกไซด์ของโลหะและอโลหะหลายชนิดรวมกับน้ำเพื่อสร้างเบสและกรด เกลือบางชนิดก่อให้เกิดผลึกไฮเดรตกับน้ำ โลหะที่มีความว่องไวที่สุดจะทำปฏิกิริยากับน้ำเพื่อปล่อยไฮโดรเจนออกมา
น้ำยังมีความสามารถในการเร่งปฏิกิริยา ในกรณีที่ไม่มีความชื้นปฏิกิริยาธรรมดาบางอย่างจะไม่เกิดขึ้นจริง ตัวอย่างเช่น คลอรีนไม่ทำปฏิกิริยากับโลหะ ไฮโดรเจนฟลูออไรด์ไม่กัดกร่อนแก้ว โซเดียมไม่ออกซิไดซ์ในอากาศ
น้ำสามารถรวมตัวกับสารหลายชนิดที่อยู่ในสถานะก๊าซภายใต้สภาวะปกติ ทำให้เกิดสิ่งที่เรียกว่าก๊าซไฮเดรต ตัวอย่างคือสารประกอบของซีนอน คลอรีน และไฮโดรคาร์บอน ซึ่งตกตะกอนในรูปของผลึกที่อุณหภูมิ 0 ถึง 24 ° C (โดยปกติจะอยู่ที่ความดันสูงของก๊าซที่เกี่ยวข้อง) สารประกอบดังกล่าวเกิดขึ้นอันเป็นผลมาจากโมเลกุลของก๊าซ (“แขก”) เติมเต็มโพรงระหว่างโมเลกุลที่มีอยู่ในโครงสร้างของน้ำ (“โฮสต์”); สิ่งเหล่านี้เรียกว่าสารประกอบรวมหรือคลาเทรต
ในสารประกอบคลาเทรต มีเพียงพันธะระหว่างโมเลกุลที่อ่อนแอเท่านั้นที่เกิดขึ้นระหว่างโมเลกุล "แขก" และ "เจ้าบ้าน" โมเลกุลที่รวมอยู่ไม่สามารถออกจากตำแหน่งในช่องคริสตัลได้เนื่องจากปัญหาเชิงพื้นที่เป็นหลัก ดังนั้น คลาเทรตจึงเป็นสารประกอบที่ไม่เสถียรซึ่งสามารถดำรงอยู่ได้ที่อุณหภูมิค่อนข้างต่ำเท่านั้น
คลาเทรตใช้เพื่อแยกไฮโดรคาร์บอนและก๊าซมีตระกูล เมื่อเร็ว ๆ นี้ การก่อตัวและการทำลายแก๊สคลาเทรต (โพรเพนและอื่น ๆ ) ได้ถูกนำมาใช้อย่างประสบความสำเร็จในการแยกเกลือออกจากน้ำ กำลังปั๊มเข้า. น้ำเกลือที่ความดันสูง ก๊าซที่เกี่ยวข้องจะทำให้เกิดผลึกคลาเทรตคล้ายน้ำแข็ง และเกลือจะยังคงอยู่ในสารละลาย ผลึกที่มีลักษณะคล้ายหิมะจะถูกแยกออกจากสุราแม่และถูกล้าง จากนั้นเมื่ออุณหภูมิเพิ่มขึ้นเล็กน้อยหรือความดันลดลง clathrate จะสลายตัวและก่อตัว น้ำจืดและก๊าซต้นทางซึ่งถูกนำมาใช้อีกครั้งเพื่อให้ได้คลาเทรต ประสิทธิภาพสูงและสภาวะที่ไม่รุนแรงสำหรับกระบวนการนี้ทำให้กระบวนการนี้มีแนวโน้มว่าจะเป็นวิธีทางอุตสาหกรรมในการแยกเกลือออกจากน้ำทะเล
สารละลายคือระบบที่เป็นเนื้อเดียวกันของของแข็งหรือของเหลวที่ประกอบด้วยส่วนประกอบ (ส่วนประกอบตั้งแต่ 2 ชิ้นขึ้นไป) ปริมาณสัมพัทธ์อาจแตกต่างกันไปภายในขีดจำกัดที่กว้าง
สารละลายทุกชนิดประกอบด้วยสารที่ละลายและตัวทำละลาย เช่น สภาพแวดล้อมที่สารเหล่านี้กระจายอย่างสม่ำเสมอในรูปของโมเลกุลหรือไอออน โดยทั่วไปแล้ว ตัวทำละลายถือเป็นส่วนประกอบที่อยู่ในสถานะการรวมตัวเดียวกันกับสารละลายที่เกิดขึ้นในรูปแบบบริสุทธิ์ (ตัวอย่างเช่น ในกรณีของสารละลายเกลือที่เป็นน้ำ แน่นอนว่าตัวทำละลายคือน้ำ ). หากส่วนประกอบทั้งสองอยู่ในสถานะการรวมกลุ่มเดียวกันก่อนที่จะละลาย (เช่น แอลกอฮอล์และน้ำ) ส่วนประกอบที่มีปริมาณมากกว่าจะถือเป็นตัวทำละลาย
ความสม่ำเสมอของสารละลายทำให้คล้ายคลึงกับสารประกอบเคมีมาก การปล่อยความร้อนระหว่างการละลายของสารบางชนิดยังบ่งบอกถึงปฏิกิริยาทางเคมีระหว่างตัวทำละลายและตัวถูกละลาย ความแตกต่างระหว่างสารละลายและสารประกอบทางเคมีก็คือ องค์ประกอบของสารละลายอาจแตกต่างกันไปในขอบเขตที่กว้าง
นอกจากนี้ ในคุณสมบัติของสารละลาย เราสามารถตรวจจับคุณสมบัติต่างๆ ของส่วนประกอบแต่ละชิ้นได้ ซึ่งจะไม่ถูกสังเกตในกรณีของสารประกอบทางเคมี ความแปรปรวนขององค์ประกอบของสารละลายทำให้พวกเขาเข้าใกล้ส่วนผสมเชิงกลมากขึ้น แต่มีความแตกต่างอย่างมากจากความเป็นเนื้อเดียวกัน
ดังนั้นสารละลายจึงมีตำแหน่งกึ่งกลางระหว่างส่วนผสมเชิงกลและสารประกอบเคมี
การละลายของผลึกในของเหลวจะเกิดขึ้นดังนี้ เมื่อคริสตัลถูกใส่เข้าไปในของเหลวซึ่งสามารถละลายได้ โมเลกุลแต่ละตัวจะแตกออกจากพื้นผิว หลังเนื่องจากการแพร่กระจายมีการกระจายเท่า ๆ กันตลอดปริมาตรทั้งหมดของตัวทำละลาย การแยกโมเลกุลออกจากพื้นผิวของของแข็งนั้นเกิดขึ้นเองในด้านหนึ่ง การเคลื่อนไหวแบบสั่นและในทางกลับกันโดยการดึงดูดจากโมเลกุลของตัวทำละลาย
จากนั้นจึงสร้างสมดุลไดนามิกขึ้น โดยโมเลกุลจะละลายจำนวนเท่ากันกับที่ปล่อยออกมาจากสารละลายต่อหน่วยเวลา
สารละลายที่อยู่ในสภาวะสมดุลด้วย สารที่ละลายเรียกว่าสารละลายอิ่มตัว
สารละลายอิ่มตัวมีการใช้งานค่อนข้างน้อย ในกรณีส่วนใหญ่ สารละลายไม่อิ่มตัวจะถูกใช้ ซึ่งมีตัวถูกละลายน้อยกว่าสารละลายอิ่มตัวที่อุณหภูมิที่กำหนด ในกรณีนี้สารละลายที่มีสารละลายในปริมาณต่ำเรียกว่าเจือจางส่วนสารละลายที่มีปริมาณสูงเรียกว่าเข้มข้น
องค์ประกอบของสารละลาย (และโดยเฉพาะเนื้อหาของตัวถูกละลายในนั้น) สามารถแสดงได้ ในรูปแบบที่แตกต่างกันทั้งการใช้หน่วยไร้มิติ (เศษส่วนหรือเปอร์เซ็นต์) และผ่านความเข้มข้นของค่ามิติ
วิธีการแสดงองค์ประกอบของสารละลาย
|
ชื่อและสัญลักษณ์ |
คำนิยาม |
มิติ |
บันทึก |
|
|
เศษส่วนมวลของตัวถูกละลาย B, w (B) |
อัตราส่วนของมวลของตัวถูกละลาย B (mB) ต่อมวลของสารละลาย (mP) |
ปริมาณไร้มิติ |
|
เป็น 100 ส่วนโดยมวล สารละลายมี 20 วัตต์ รวมถึง NaOH |
|
เศษส่วนโมลของตัวถูกละลาย B, xB |
อัตราส่วนของปริมาณของสารตัวที่สอง (nB) ต่อจำนวนรวมของสารทั้งหมดที่รวมอยู่ในสารละลาย รวมถึงตัวทำละลาย (å พรรณี = nB + n1 + n2 + ... พรรณี) |
ปริมาณไร้มิติ |
xHCl = 0.02 หรือ xHCl = 2% - |
|
|
โมลาลิตีของสาร B ในสารละลาย Cm (B) |
อัตราส่วนของปริมาณตัวถูกละลาย B (nB) ต่อมวลของตัวทำละลาย (mB) ในหน่วยกิโลกรัม |
โมล/กก. = Mn |
|
C m (H 2 SO 4 ) = 0.1 โมล/กก C ม. (H 2 SO 4 ) = 0.1 Mn ในสารละลายจะมี H2 SO4 0.1 โมล ต่อ H2 O 1 กิโลกรัม สารละลายเรียกว่าเดซิโมลาร์ |
|
ความเข้มข้นของฟันกรามของสาร B, CB |
อัตราส่วนของปริมาณตัวถูกละลาย B (nB) ต่อปริมาตรของสารละลาย (VP) |
โมล/ลิตร = ม |
|
C(KCl) = 2 โมล/ลิตร สารละลาย 1 ลิตรประกอบด้วย KCl 2 โมล |
|
ความเข้มข้นของฟันกรามของสารเทียบเท่า B, Cec (B) |
อัตราส่วนของจำนวนเทียบเท่าของสารที่ละลาย B (neq) ต่อปริมาตรของสารละลาย (VP) |
โมล/ลิตร = n |
|
C eq (นา 2 CO 3 ) = 0.01 โมล/ลิตร C eq (นา 2 CO 3 ) = 0.01 n สารละลาย 1 ลิตรประกอบด้วยสารละลาย Na2 CO3 - เซนติโมลาร์ 0.01 โมลเทียบเท่า |
|
ผลคูณของความเข้มข้นของโมลาร์ที่เทียบเท่ากับสาร B (Ceq (B)) โดยปริมาตรของสารละลาย (VP) เท่ากับจำนวนเทียบเท่าของสารนี้ (neq (B)) ดังนั้นกฎการเทียบเท่า: nek (A) + nek (B) สำหรับการแก้ปัญหาจึงมีรูปแบบ: C eq (A)·V P (A) = C eq (B)·V P (B) สมการนี้มักใช้ในการคำนวณ โดยเฉพาะอย่างยิ่งในเคมีวิเคราะห์ |
||||
|
Titer ของสารละลายของสาร B |
ความเข้มข้นของสารละลายมาตรฐาน เท่ากับมวลสาร B (mB) บรรจุอยู่ในสารละลาย 1 มิลลิลิตร |
|
T(NaCl) = 0.0250 กรัม/มิลลิลิตร สารละลาย 1 มิลลิลิตรประกอบด้วย NaCl 0.0250 กรัม |
|
สารส่วนใหญ่ที่อยู่ในสถานะผลึกจะละลายในของเหลวโดยมีการดูดซับความร้อน อย่างไรก็ตาม เมื่อโซเดียมไฮดรอกไซด์ โพแทสเซียมคาร์บอเนต แอนไฮดรัส คอปเปอร์ ซัลเฟต และสารอื่นๆ ละลายในน้ำ อุณหภูมิจะเพิ่มขึ้นอย่างเห็นได้ชัด ความร้อนจะถูกปล่อยออกมาเมื่อของเหลวและก๊าซทั้งหมดละลายในน้ำ
ปริมาณความร้อนที่ดูดซับ (หรือปล่อยออกมา) เมื่อสารหนึ่งโมลละลายเรียกว่าความร้อนของสารละลายของสารนี้
ความร้อนของสารละลายจะมีค่าเป็นลบหากความร้อนถูกดูดซับระหว่างการละลาย และเป็นค่าบวกหากความร้อนถูกปล่อยออกมา ตัวอย่างเช่น ความร้อนของการละลายแอมโมเนียมไนเตรตคือ 26.4 กิโลจูล/โมล โพแทสเซียมไฮดรอกไซด์ +55.6 กิโลจูล/โมล เป็นต้น
กระบวนการละลายจะมาพร้อมกับการเพิ่มขึ้นอย่างมีนัยสำคัญของเอนโทรปีของระบบเนื่องจากอันเป็นผลมาจากการกระจายตัวของอนุภาคของสารหนึ่งไปยังอีกสารหนึ่งอย่างสม่ำเสมอจำนวนไมโครสเตตของระบบจึงเพิ่มขึ้นอย่างรวดเร็ว ดังนั้น แม้ว่าการละลายของผลึกส่วนใหญ่โดยธรรมชาติจะเป็นไปตามธรรมชาติของการดูดความร้อน แต่การเปลี่ยนแปลงพลังงานกิ๊บส์ของระบบระหว่างการละลายกลับเป็นลบ และกระบวนการดำเนินไปเองตามธรรมชาติ
เมื่อคริสตัลละลาย พวกมันจะถูกทำลายซึ่งต้องใช้พลังงาน ดังนั้นการละลายจึงต้องมาพร้อมกับการดูดซับความร้อนด้วย หากสังเกตผลตรงกันข้ามสิ่งนี้จะแสดงให้เห็นว่าพร้อมกันกับการละลายปฏิกิริยาบางอย่างเกิดขึ้นระหว่างตัวทำละลายและตัวถูกละลายในระหว่างที่พลังงานถูกปล่อยออกมาในรูปของความร้อนมากกว่าที่ถูกใช้ไปในการทำลายโครงตาข่ายคริสตัล
แท้จริงแล้ว บัดนี้เป็นที่ยอมรับแล้วว่าเมื่อสารหลายชนิดละลาย โมเลกุล (หรือไอออน) ของสารเหล่านั้นที่มีโมเลกุลของตัวทำละลายจะเกิดสารประกอบที่เรียกว่าโซลเวต (จากภาษาละตินแก้ปัญหา ละลาย); กระบวนการนี้เรียกว่าการแก้ปัญหา ในกรณีเฉพาะเมื่อตัวทำละลายคือน้ำ สารประกอบเหล่านี้เรียกว่าไฮเดรต และกระบวนการก่อตัวเรียกว่าไฮเดรชัน
ตามกฎแล้วไฮเดรตเป็นสารประกอบที่ไม่เสถียร ในหลายกรณีจะสลายตัวเมื่อสารละลายถูกระเหย แต่บางครั้งไฮเดรตจะเข้มข้นมากจนเมื่อตัวถูกละลายออกจากสารละลาย น้ำก็กลายเป็นส่วนหนึ่งของผลึก สารที่ผลึกประกอบด้วยโมเลกุลของน้ำเรียกว่าคริสตัลไฮเดรต และน้ำที่มีอยู่เรียกว่า p และ -กับ t a l l i z t i o i n o y.
องค์ประกอบของผลึกไฮเดรตมักจะแสดงไว้โดยสูตรที่แสดงปริมาณน้ำของการตกผลึกที่ผลึกไฮเดรตมีอยู่ ตัวอย่างเช่น คอปเปอร์ซัลเฟตคริสตัลไลน์ไฮเดรต (คอปเปอร์ซัลเฟต)
ความแข็งแรงของพันธะระหว่างสารกับน้ำของการตกผลึกในผลึกไฮเดรตจะแตกต่างกันไป หลายคนสูญเสียน้ำจากการตกผลึกที่อุณหภูมิห้องแล้ว ดังนั้น ผลึกโซดาใส (HarCO 3 - 10H 2 O) พวกเขา "อากาศ" ได้ง่ายสูญเสียน้ำที่ตกผลึกพวกมันหมองคล้ำและค่อยๆแตกเป็นผง ผลึกไฮเดรตอื่นๆ ต้องใช้ความร้อนสูงพอสมควรในการทำให้แห้ง
ความสามารถในการละลายคือความสามารถของสารในการละลายในตัวทำละลายเฉพาะ การวัดความสามารถในการละลายของสารภายใต้สภาวะที่กำหนดคือเนื้อหาในสารละลายอิ่มตัว ดังนั้น ความสามารถในการละลายสามารถแสดงได้ในลักษณะเดียวกับองค์ประกอบ เช่น เปอร์เซ็นต์ของมวลของตัวถูกละลายต่อมวลของสารละลายอิ่มตัว หรือปริมาณของตัวถูกละลายที่มีอยู่ในสารละลายอิ่มตัว 1 ลิตร ความสามารถในการละลายมักแสดงเป็นจำนวนหน่วยมวลของสารปราศจากน้ำที่ทำให้มวลตัวทำละลายอิ่มตัว 100 หน่วยภายใต้เงื่อนไขที่กำหนด บางครั้งความสามารถในการละลายที่แสดงในลักษณะนี้เรียกว่าสัมประสิทธิ์การละลาย
ความสามารถในการละลายของสารต่างๆ ในน้ำแตกต่างกันอย่างมาก หากสารมากกว่า 10 กรัมละลายในน้ำ 100 กรัม สารดังกล่าวมักจะเรียกว่าละลายได้สูง หากสารละลายน้อยกว่า 1 กรัมก็จะละลายได้เล็กน้อยและในที่สุดก็ไม่ละลายเลยหากสารน้อยกว่า 0.01 กรัมเข้าสู่สารละลาย
การละลายของของแข็งส่วนใหญ่จะมาพร้อมกับการดูดซับความร้อน สิ่งนี้อธิบายได้จากการใช้พลังงานจำนวนมากในการทำลายโครงผลึกของของแข็ง ซึ่งมักจะไม่ได้รับการชดเชยอย่างเต็มที่จากพลังงานที่ปล่อยออกมาระหว่างการก่อตัวของไฮเดรต (โซลเวต) การใช้หลักการของเลอ ชาเตอลิเยร์กับความสมดุลระหว่างสารที่มีสถานะเป็นผลึกกับสารละลายอิ่มตัว
เราได้ข้อสรุปว่าในกรณีที่สารละลายด้วยการดูดซับพลังงาน อุณหภูมิที่เพิ่มขึ้นน่าจะทำให้ความสามารถในการละลายของสารเพิ่มขึ้น
ในกรณีเช่นนี้ส่วนใหญ่ เมื่ออุณหภูมิเพิ่มขึ้น ความสามารถในการละลายร่วมกันของของเหลวจะเพิ่มขึ้นจนกระทั่งถึงอุณหภูมิที่ของเหลวทั้งสองผสมกันในสัดส่วนเท่าใดก็ได้
เมื่อของแข็งละลายในน้ำ ปริมาตรของระบบมักจะเปลี่ยนแปลงเพียงเล็กน้อยเท่านั้น ดังนั้นความสามารถในการละลายของสารในสถานะของแข็งจึงไม่ขึ้นอยู่กับความดัน
ของเหลวยังสามารถละลายในของเหลวได้ บางส่วนสามารถละลายซึ่งกันและกันได้ไม่จำกัด กล่าวคือ สามารถผสมกันในสัดส่วนใดก็ได้ เช่น แอลกอฮอล์และน้ำ ในขณะที่บางชนิดละลายร่วมกันได้ในระดับหนึ่งเท่านั้น
อุณหภูมิที่ความสามารถในการละลายร่วมกันของของเหลวที่จำกัดกลายเป็นอุณหภูมิไม่จำกัด เรียกว่าอุณหภูมิของสารละลายวิกฤต
กฎหมายการกระจายตามที่สารที่สามารถละลายในตัวทำละลายที่ละลายไม่ได้สองตัวถูกกระจายระหว่างกันเพื่อให้อัตราส่วนของความเข้มข้นในตัวทำละลายเหล่านี้มีค่าคงที่อุณหภูมิคงที่ไม่ว่าจะอย่างไรก็ตาม จำนวนทั้งหมดตัวถูกละลาย:
ค 1 / ค 2 = เค
ที่นี่ C 1 และ C 2 ความเข้มข้นของสารที่ละลายในตัวทำละลายตัวแรกและตัวที่สอง //( ที่เรียกว่าสัมประสิทธิ์การกระจาย
การละลายของก๊าซในน้ำเป็นกระบวนการคายความร้อน ดังนั้นความสามารถในการละลายของก๊าซจะลดลงตามอุณหภูมิที่เพิ่มขึ้น หากคุณทิ้งน้ำเย็นหนึ่งแก้วไว้ในห้องอุ่น ผนังด้านในจะถูกปกคลุมไปด้วยฟองก๊าซ - นี่คืออากาศที่ละลายในน้ำและถูกปล่อยออกมาเนื่องจากความร้อน การต้มสามารถกำจัดอากาศที่ละลายน้ำทั้งหมดออกจากน้ำได้
อย่างไรก็ตาม การละลายของก๊าซในของเหลวอินทรีย์มักมาพร้อมกับการดูดซับความร้อน ในกรณีเช่นนี้ ความสามารถในการละลายของก๊าซจะเพิ่มขึ้นตามอุณหภูมิที่เพิ่มขึ้น
กฎของเฮนรี่: มวลของก๊าซที่ละลายที่อุณหภูมิคงที่ในปริมาตรของของเหลวที่กำหนดจะเป็นสัดส่วนโดยตรงกับความดันย่อยของก๊าซ
กฎของเฮนรี่สามารถแสดงได้ด้วยสมการ
ค = เคพี
โดยที่ C ความเข้มข้นของมวลก๊าซในสารละลายอิ่มตัว p ความดันบางส่วนเค ค่าสัมประสิทธิ์สัดส่วน เรียกว่าค่าคงที่ของเฮนรี่ (หรือค่าสัมประสิทธิ์ของเฮนรี่)
ขอให้เราสังเกตผลลัพธ์ที่สำคัญของกฎของเฮนรี่: ปริมาตรของก๊าซที่ละลายที่อุณหภูมิคงที่ในปริมาตรของของเหลวที่กำหนดไม่ได้ขึ้นอยู่กับความดันย่อยของมันหากมีส่วนผสมของก๊าซหลายชนิดเหนือของเหลว ความสามารถในการละลายของก๊าซแต่ละชนิดจะถูกกำหนดโดยความดันบางส่วน.
สิ่งนี้จะต้องนำมาพิจารณาเมื่อคำนวณความสามารถในการละลายของก๊าซที่ผสมกับก๊าซอื่น ๆ ก๊าซไม่เป็นไปตามกฎของ Henry Pi เป็นอย่างดี แรงกดดันสูงและยิ่งไปกว่านั้นเฉพาะในกรณีที่ไม่ได้ทำปฏิกิริยาทางเคมีกับตัวทำละลาย ที่ความดันสูง เมื่อพฤติกรรมของก๊าซทั้งหมดแตกต่างอย่างชัดเจนจากอุดมคติ จะสังเกตเห็นการเบี่ยงเบนไปจากกฎของเฮนรี่ด้วย ในกรณีของก๊าซที่ไม่มีปฏิกิริยาทางเคมีกับตัวทำละลาย
ความสามารถในการละลายของสารส่วนใหญ่จะลดลงตามอุณหภูมิที่ลดลง ดังนั้นเมื่อสารละลายอิ่มตัวร้อนถูกทำให้เย็นลง ตัวถูกละลายส่วนเกินมักจะถูกปล่อยออกมา อย่างไรก็ตามหากดำเนินการทำความเย็นอย่างระมัดระวังและช้าๆ ในขณะที่ปกป้องสารละลายจากความเป็นไปได้ที่อนุภาคของสารที่ละลายจะเข้ามาจากภายนอก ก็อาจไม่ปล่อยออกจากสารละลาย ในกรณีนี้ สารละลายที่ได้จะมีตัวถูกละลายมากกว่าที่จำเป็นสำหรับการอิ่มตัวที่อุณหภูมิที่กำหนดอย่างมาก ปรากฏการณ์นี้ถูกค้นพบและศึกษาโดยละเอียดโดยนักวิชาการชาวรัสเซีย T. E. Lovitz (1794) ซึ่งเรียกว่าสารละลายดังกล่าวมีความอิ่มตัวสูง ในสภาวะสงบ พวกมันสามารถคงอยู่ไม่เปลี่ยนแปลงได้นานหลายปี แต่ทันทีที่คุณโยนผลึกของสารที่ละลายอยู่ในนั้นลงในสารละลาย ผลึกอื่นๆ จะเริ่มเติบโตรอบๆ ทันที และหลังจากนั้นไม่นาน สารที่ละลายส่วนเกินทั้งหมดจะตกผลึกออกมา บางครั้งการตกผลึกเริ่มต้นจากการเขย่าสารละลายแบบง่ายๆ รวมถึงการเสียดสีด้วยแท่งแก้วกับผนังของภาชนะที่มีสารละลายอยู่ ในระหว่างการตกผลึก ความร้อนจำนวนมากจะถูกปล่อยออกมาเพื่อให้ภาชนะที่มีสารละลายร้อนขึ้นอย่างเห็นได้ชัด สารละลายที่มีความอิ่มตัวสูงเกิดขึ้นได้ง่ายมากนา 2 SO 4 -10 H 2 O (เกลือของ Glauber)นา 2 B 4 0 7 - 10H 2 O (บอแรกซ์), นา 2 S 2 03-5 H 2 0 (โซเดียม ไธโอซัลเฟต)
จากที่กล่าวมาข้างต้นว่าสารละลายอิ่มตัวยวดยิ่งเป็นระบบที่ไม่เสถียรซึ่งสามารถดำรงอยู่ได้เฉพาะในกรณีที่ไม่มีอนุภาคของแข็งของสารที่ละลายอยู่ในระบบเท่านั้น ความเป็นไปได้ของการมีอยู่ของสารละลายดังกล่าวในระยะยาวนั้นอธิบายได้จากความยากลำบากในการปรากฏครั้งแรกของผลึก "เมล็ด" ที่เล็กที่สุดซึ่งเรียกว่าศูนย์การตกผลึกซึ่งการตกผลึกจะแพร่กระจายไปยังมวลทั้งหมดของสารละลาย
การแก้ปัญหาคือระบบที่เป็นเนื้อเดียวกัน อนุภาคของตัวถูกละลายและตัวทำละลายมีการเคลื่อนที่ด้วยความร้อนแบบสุ่มและมีการกระจายเท่าๆ กันตลอดปริมาตรทั้งหมดของสารละลาย หากคุณใส่สารละลายเข้มข้นของสาร เช่น น้ำตาล ลงในกระบอก และค่อยๆ เทสารละลายน้ำตาลที่เจือจางมากขึ้นลงไปทับอย่างระมัดระวัง ในตอนแรกน้ำตาลและน้ำจะกระจายไม่สม่ำเสมอตลอดสารละลาย
 - อย่างไรก็ตาม หลังจากผ่านไประยะหนึ่ง โมเลกุลของน้ำตาลและน้ำจะกระจายเท่าๆ กันอีกครั้งทั่วทั้งปริมาตรของของเหลว สิ่งนี้เกิดขึ้นเนื่องจากโมเลกุลของน้ำตาลเคลื่อนที่แบบสุ่มทะลุผ่านทั้งจากสารละลายเข้มข้นไปเป็นสารละลายเจือจางและเข้าไป ทิศทางย้อนกลับ- แต่ในเวลาเดียวกัน ในช่วงเวลาใดๆ ก็ตาม โมเลกุลน้ำตาลจำนวนมากจะเคลื่อนจากสารละลายที่มีความเข้มข้นมากกว่าไปเป็นสารละลายที่มีความเข้มข้นน้อยกว่าจากสารละลายเจือจางไปยังสารละลายที่มีความเข้มข้น ในทำนองเดียวกัน โมเลกุลของน้ำเคลื่อนที่ไปในทิศทางที่ต่างกัน แต่ในเวลาเดียวกัน โมเลกุลของน้ำจะเคลื่อนที่จากสารละลายเจือจางซึ่งมีน้ำมากกว่า ไปสู่สารละลายเข้มข้นมากกว่าที่จะถูกถ่ายโอนไปในทิศทางตรงกันข้ามในเวลาเดียวกัน ดังนั้นจึงมีการเคลื่อนที่โดยตรงของน้ำตาลจากสารละลายเข้มข้นไปเป็นสารละลายเจือจาง และน้ำจากสารละลายเจือจางไปเป็นสารละลายเข้มข้น สารแต่ละชนิดจะถูกถ่ายโอนไปยังจุดที่ความเข้มข้นลดลง กระบวนการเคลื่อนที่ของสารที่เกิดขึ้นเองซึ่งนำไปสู่การปรับความเข้มข้นของสารให้เท่ากันเรียกว่าการแพร่กระจาย
- อย่างไรก็ตาม หลังจากผ่านไประยะหนึ่ง โมเลกุลของน้ำตาลและน้ำจะกระจายเท่าๆ กันอีกครั้งทั่วทั้งปริมาตรของของเหลว สิ่งนี้เกิดขึ้นเนื่องจากโมเลกุลของน้ำตาลเคลื่อนที่แบบสุ่มทะลุผ่านทั้งจากสารละลายเข้มข้นไปเป็นสารละลายเจือจางและเข้าไป ทิศทางย้อนกลับ- แต่ในเวลาเดียวกัน ในช่วงเวลาใดๆ ก็ตาม โมเลกุลน้ำตาลจำนวนมากจะเคลื่อนจากสารละลายที่มีความเข้มข้นมากกว่าไปเป็นสารละลายที่มีความเข้มข้นน้อยกว่าจากสารละลายเจือจางไปยังสารละลายที่มีความเข้มข้น ในทำนองเดียวกัน โมเลกุลของน้ำเคลื่อนที่ไปในทิศทางที่ต่างกัน แต่ในเวลาเดียวกัน โมเลกุลของน้ำจะเคลื่อนที่จากสารละลายเจือจางซึ่งมีน้ำมากกว่า ไปสู่สารละลายเข้มข้นมากกว่าที่จะถูกถ่ายโอนไปในทิศทางตรงกันข้ามในเวลาเดียวกัน ดังนั้นจึงมีการเคลื่อนที่โดยตรงของน้ำตาลจากสารละลายเข้มข้นไปเป็นสารละลายเจือจาง และน้ำจากสารละลายเจือจางไปเป็นสารละลายเข้มข้น สารแต่ละชนิดจะถูกถ่ายโอนไปยังจุดที่ความเข้มข้นลดลง กระบวนการเคลื่อนที่ของสารที่เกิดขึ้นเองซึ่งนำไปสู่การปรับความเข้มข้นของสารให้เท่ากันเรียกว่าการแพร่กระจาย
เมื่อทำการวัดความดันออสโมติกของสารละลายต่างๆ พบว่าขนาดของความดันออสโมติกขึ้นอยู่กับความเข้มข้นของสารละลายและอุณหภูมิ แต่ไม่ขึ้นอยู่กับลักษณะของตัวถูกละลายหรือลักษณะของตัวทำละลาย ในปี 1886 Van't Hoff แสดงให้เห็นว่าสำหรับสารละลายที่ไม่ใช่อิเล็กโตรไลต์ที่มีความเข้มข้นต่ำ การขึ้นอยู่กับแรงดันออสโมติกต่อความเข้มข้นของอุณหภูมิของสารละลายจะแสดงโดยสมการ (กฎของ van't Hoff):
ป = ซีอาร์ที
ที่นี่ Р แรงดันออสโมติกของสารละลาย, kPa; C ความเข้มข้นของโมลาร์ (โมลาริตี), โมล/ลิตร;ร ค่าคงที่ก๊าซสากล 8.314 J/(mol-K); อุณหภูมิแท็บโซลูตของสารละลาย
ที่อุณหภูมิที่กำหนด ความดันไออิ่มตัวเหนือของเหลวแต่ละชนิดจะคงที่ ประสบการณ์แสดงให้เห็นว่าเมื่อสารละลายในของเหลว ความดันไออิ่มตัวของของเหลวนี้จะลดลง
ดังนั้นความดันไออิ่มตัวของตัวทำละลายเหนือสารละลายจึงต่ำกว่าความดันไออิ่มตัวของตัวทำละลายบริสุทธิ์ที่อุณหภูมิเดียวกันเสมอ ความแตกต่างระหว่างค่าเหล่านี้มักเรียกว่าการลดลงของความดันไอเหนือสารละลาย (หรือการลดลงของความดันไอของสารละลาย) อัตราส่วนของขนาดของการลดลงนี้ต่อความดันไออิ่มตัวเหนือตัวทำละลายบริสุทธิ์เรียกว่าการลดลงสัมพัทธ์ของความดันไอเหนือสารละลาย
ให้เราแสดงความดันไออิ่มตัวของตัวทำละลายเหนือตัวทำละลายบริสุทธิ์ด้วย p 0 และเหนือสารละลายผ่านแม่น้ำ จากนั้นการลดลงสัมพัทธ์ของความดันไอเหนือสารละลายจะเป็นเศษส่วน: (Po P)/Po
ในปี พ.ศ. 2430 Raoult นักฟิสิกส์ชาวฝรั่งเศสได้ศึกษาวิธีแก้ปัญหาของของเหลวและสารที่ไม่ระเหยต่างๆ ในสถานะของแข็ง ได้กำหนดกฎที่เกี่ยวข้องกับการลดลงของความดันไอเหนือสารละลายเจือจางของอิเล็กโทรไลต์ที่ไม่ระเหยที่มีความเข้มข้น:
การลดลงโดยสัมพัทธ์ของความดันไออิ่มตัวของตัวทำละลายเหนือสารละลายจะเท่ากับเศษส่วนโมลของตัวถูกละลาย
การแสดงออกทางคณิตศาสตร์ของกฎของราอูลต์คือสมการ:
(.ปอ ป)/ปอ = นิ
ที่นี่ N2 เศษส่วนโมลของตัวถูกละลาย ปรากฏการณ์ของการลดลงของความดันไออิ่มตัวเหนือสารละลายเป็นไปตามหลักการของเลอ ชาเตอลิเยร์
สารแต่ละชนิดมีลักษณะเฉพาะด้วยอุณหภูมิการเปลี่ยนผ่านจากสถานะการรวมตัวหนึ่งไปยังอีกสถานะหนึ่งที่กำหนดไว้อย่างเคร่งครัด (จุดเดือด จุดหลอมเหลว อุณหภูมิการระเหิด ฯลฯ) ดังนั้น น้ำ ที่ความดันบรรยากาศปกติ (101.3 กิโลปาสคาล) จึงตกผลึกที่อุณหภูมิ 0°C และเดือดที่ 100°C
สถานการณ์แตกต่างด้วยวิธีแก้ปัญหา การปรากฏตัวของตัวถูกละลายจะเพิ่มจุดเดือดและลดจุดเยือกแข็งของตัวทำละลาย และยิ่งสารละลายมีความเข้มข้นมากเท่าไรก็ยิ่งมีความเข้มข้นมากขึ้นเท่านั้น ในกรณีส่วนใหญ่ มีเพียงตัวทำละลายเท่านั้นที่ตกผลึกจากสารละลาย (ระหว่างการแช่แข็ง) หรือเดือดออกไป (ระหว่างการเดือด) ซึ่งส่งผลให้ความเข้มข้นของสารละลายเพิ่มขึ้นเมื่อแข็งตัวหรือเดือด ส่งผลให้จุดเดือดเพิ่มขึ้นมากขึ้นและอุณหภูมิในการตกผลึกลดลง ดังนั้นสารละลายจึงตกผลึกและเดือดไม่ได้ที่อุณหภูมิที่กำหนด แต่อยู่ในช่วงอุณหภูมิที่แน่นอน อุณหภูมิที่สารละลายที่กำหนดเริ่มตกผลึกและเริ่มเดือดเรียกว่าอุณหภูมิในการตกผลึกและจุดเดือด
ความแตกต่างระหว่างอุณหภูมิจุดเดือดของสารละลาย (tถึง ) และ ตัวทำละลายบริสุทธิ์(ตตกลง ) เรียกว่าการเพิ่มขึ้นของจุดเดือดของสารละลาย (Δtถึง - ความแตกต่างระหว่างอุณหภูมิเยือกแข็งของตัวทำละลายบริสุทธิ์ (tออนซ์) สารละลาย (t Z ) เรียกว่าจุดเยือกแข็งที่ลดลงของสารละลาย (Δtซี)
Δt k = t k ตกลง; Δt Z = เสื้อ OZ เสื้อ Z .
ของเหลวใด ๆ เริ่มเดือดที่อุณหภูมิซึ่งความดันของไออิ่มตัวถึงความดันภายนอก ตัวอย่างเช่น น้ำภายใต้ความดัน 101.3 kPa จะเดือดที่ 100°C เพราะที่อุณหภูมินี้ ความดันไอน้ำจะเท่ากับ 101.3 kPa พอดี หากคุณละลายสารที่ไม่ระเหยในน้ำ ความดันไอของมันจะลดลง หากต้องการเพิ่มความดันไอของสารละลายที่ได้ให้เป็น 101.3 kPa คุณต้องให้ความร้อนสารละลายให้สูงกว่า 100°C ตามมาว่าจุดเดือดของสารละลายจะสูงกว่าจุดเดือดของตัวทำละลายบริสุทธิ์เสมอ การลดลงของจุดเยือกแข็งของสารละลายอธิบายได้ในลักษณะเดียวกัน
การเพิ่มขึ้นของจุดเดือดและการลดลงของจุดเยือกแข็งของสารละลายนั้นสอดคล้องกับหลักการของเลอชาเตอลิเยร์ พิจารณาขั้นตอนการแช่แข็งสารละลาย ให้มีความสมดุลระหว่างสถานะของเหลวและของแข็ง เช่น ความสมดุลระหว่างน้ำกับน้ำแข็งที่อุณหภูมิ 0°C สามารถแสดงได้ด้วยสมการ:
เอช 2 โอ (เค) เอช + + โอ้
หากคุณละลายสารใดๆ ในน้ำในปริมาณที่กำหนด ความเข้มข้นของโมเลกุลของน้ำในของเหลวจะลดลง และกระบวนการหนึ่งจะเริ่มเพิ่มขึ้น นั่นก็คือ การละลายของน้ำแข็ง เพื่อสร้างสมดุลใหม่ จำเป็นต้องลดอุณหภูมิลง
ตามกฎข้อที่สองของ Raoult: สำหรับสารละลายเจือจางที่ไม่ใช่อิเล็กโทรไลต์ จุดเดือดที่เพิ่มขึ้นและจุดเยือกแข็งที่ลดลงจะเป็นสัดส่วนกับความเข้มข้นของสารละลาย
∆T K = E·S ม. (B); ΔТ З = К·С ม. (V)
ที่นี่ ซ.ม (B) - ความเข้มข้นของโมลาล; E และ K เป็นค่าคงที่ ebullioscopic และ cryoscopic ขึ้นอยู่กับลักษณะของตัวทำละลายเท่านั้น แต่ไม่ขึ้นอยู่กับลักษณะของสารที่ละลาย สำหรับน้ำ ค่าคงที่การแช่แข็ง K เท่ากับ 1.86 ค่าคงที่ ebullioscopic E เท่ากับ 0.52 วิธีการ ebullioscopic และ cryoscopic ในการหามวลโมเลกุลของสารจะขึ้นอยู่กับการวัดอุณหภูมิของการเดือดและการแช่แข็งของสารละลาย
สารละลายบัฟเฟอร์สารละลายความเข้มข้นของไฮโดรเจนไอออน (pH) ซึ่งไม่เปลี่ยนแปลงเมื่อเติมในปริมาณที่จำกัด กรดแก่หรือด่าง (ดูค่า pH) บี.อาร์. ประกอบด้วยส่วนผสมของสารละลายกรดอ่อนกับเกลือของกรดแก่ หรือในทางกลับกัน เบสอ่อนกับเกลือของกรดแก่ เช่น CH 3 COOH+CH 3 บัฟเฟอร์ COONa อะซิเตต, NH 4 บัฟเฟอร์แอมโมเนีย OH+NHCl บางครั้งบี.อาร์. สามารถทำหน้าที่เป็นส่วนผสมของสารละลายของเกลือที่เป็นกรดหรือกรดและเบสสองชนิดของกรดอ่อนโพลีเบสิกและเบสแก่ ตัวอย่างเช่น ฟอสเฟต B.r. สามารถประกอบด้วยคู่ดังต่อไปนี้: 1) H 3 ปอ 4 +โซเดียม 2 ปอ 4 ; 2) NaH 2 PO 4 + นา 2 HPO 4 ; 3) นา 2 HPO 4 + นา 3 PO 4 และคาร์บอเนตจาก 1) H 2 CO 3 +NaHCO 3 ; 2) NaHCO 3 + นา 2 CO 3 - การกระทำของบี.อาร์. ถูกกำหนดโดยการมีอยู่ของระบบสมดุลสองระบบที่เชื่อมต่อถึงกัน: การแยกตัวออกจากกันและการไฮโดรไลซิส เพื่อกำหนดขอบเขตการดำเนินการของบี.อาร์. มีการแนะนำแนวคิดเรื่องความจุบัฟเฟอร์ โดยวัดจากปริมาณกรดหรือเบสแก่ (ในหน่วย g-equiv) ที่ต้องเติมลงใน B.R. 1 ลิตรเพื่อเปลี่ยน pH ทีละหนึ่ง ความจุบัฟเฟอร์สูงสุดสอดคล้องกับเนื้อหาของส่วนประกอบในปริมาณที่เท่ากัน ในน้ำธรรมชาติที่มีแร่ธาตุต่ำ บัฟเฟอร์ส่วนใหญ่ถูกสร้างขึ้นโดยคาร์บอเนต กล่าวคือ กรดคาร์บอนิกอิสระและเกลือเบสแก่ (Ca, Mg, Na) ในน้ำทะเล บัฟเฟอร์บอเรตก็มีส่วนร่วมในการก่อตัวของบัฟเฟอร์เช่นกัน ความจุบัฟเฟอร์ของน้ำทะเลที่ 0โอ C สูงกว่าสารละลาย NaCl ถึง 11 เท่าโดยมีความเข้มข้น 35โอ้ และสูงกว่าน้ำกลั่นถึง 9 เท่า ตอนอายุ 30โอ ส่วนเกินคือ 25 และ 19 เท่าตามลำดับ ความจุบัฟเฟอร์ที่เพิ่มขึ้นของน้ำทะเลตามอุณหภูมิสัมพันธ์กับการแยกตัวและการไฮโดรไลซิสที่เพิ่มขึ้นของส่วนประกอบที่ประกอบเป็นความจุบัฟเฟอร์ น้ำกลั่นมีความสามารถในการบัฟเฟอร์สูงกว่าสารละลาย NaCl เล็กน้อย เนื่องจากความสามารถในการละลายของ CO ได้ดีกว่า 2 - เนื่องจากค่า pH ไม่ได้ขึ้นอยู่กับความเข้มข้นของส่วนประกอบ แต่ขึ้นอยู่กับอัตราส่วนเมื่อเจือจาง B.r. มันคงที่ ในเวลาเดียวกัน แม้ว่าน้ำธรรมชาติจะมีความจุบัฟเฟอร์สูง แต่กระบวนการสังเคราะห์ด้วยแสง (ดู) หรือการหายใจส่งผลกระทบอย่างมากต่อค่า pH เนื่องจากสิ่งนี้จะเปลี่ยนความสัมพันธ์ระหว่างความเข้มข้นของ CO 2 และ НСО 3 - บี.อาร์. มีบทบาทสำคัญในสิ่งมีชีวิต สามารถเพิ่มได้ว่าค่า pH คงที่อย่างเคร่งครัดในอวัยวะต่าง ๆ ของสัตว์และมนุษย์ที่สูงกว่านั้นตามกฎแล้วจะไม่ได้รับการดูแลโดยฝ่ายใดฝ่ายหนึ่ง แต่ ทั้งระบบเช่น B.r. ในเลือด โซลูชั่นบัฟเฟอร์ขึ้นอยู่กับคาร์บอเนตและฟอสเฟต น้ำเสียที่เป็นกรดหรือด่างที่เข้าสู่อ่างเก็บน้ำสามารถทำให้เป็นกลางได้ด้วยระบบบัฟเฟอร์คาร์บอเนตของน้ำธรรมชาติ นอกจากนี้ยังช่วยรักษาค่า pH ของน้ำให้คงที่เมื่อแนะนำรีเอเจนต์ระหว่างการบำบัดน้ำ ในระหว่างการบำบัดน้ำเสียทางชีวภาพ (ดู) ค่า pH ที่เหมาะสมสำหรับการทำงานปกติของกระบวนการชีวิตของจุลินทรีย์จะถูกรักษาไว้โดยการมีระบบบัฟเฟอร์ (ระบบคาร์บอเนต แอมโมเนียม และฟอสเฟต) นอกจากนี้ บี.อาร์. ใช้กันอย่างแพร่หลายในการวิเคราะห์ทางเคมีของน้ำ
น้ำและสารละลายหน้า 8
