การแช่แข็งของสารละลาย สารละลายจะแข็งตัวที่อุณหภูมิต่ำกว่าตัวทำละลายบริสุทธิ์
สารละลายเดือดมากกว่า อุณหภูมิสูงยังไง ตัวทำละลายบริสุทธิ์;
ข้อพิสูจน์จากกฎของราอูลต์
แนวทางแก้ไขที่ปฏิบัติตามกฎของ Raoult อย่างเคร่งครัดถือเป็นแนวทางที่ดี สำหรับการแก้ปัญหาที่แท้จริงของสารที่ไม่ใช่อิเล็กโทรไลต์ กฎของราอูลต์จะถูกสังเกตได้แม่นยำยิ่งขึ้น ยิ่งสารละลายนี้เจือจางมากขึ้นเท่านั้น เมื่อความเข้มข้นของตัวถูกละลายเพิ่มขึ้น สารละลายส่วนใหญ่จะเบี่ยงเบนไปจากกฎของราอูลต์
การลดลงโดยสัมพัทธ์ของความดันไออิ่มตัวของตัวทำละลายเหนือสารละลายจะเท่ากับเศษส่วนโมลของตัวถูกละลาย
สารละลายของอิเล็กโทรไลต์ (กรด เบส เกลือ) ไม่เป็นไปตามกฎของราอูลต์ ยิ่งไปกว่านั้น แม้จะเจือจางไปแล้วก็ตาม สาเหตุของปรากฏการณ์นี้จะมีการหารือในภายหลัง
ผลที่ตามมาที่สำคัญสองประการตามมาจากกฎของราอูลต์:
ลองดูรายละเอียดเพิ่มเติม
การต้มคือ กระบวนการทางกายภาพการเปลี่ยนสถานะของเหลวเป็นสถานะก๊าซหรือไอ ซึ่งฟองก๊าซก่อตัวตลอดปริมาตรทั้งหมดของของเหลว
ของเหลวจะเดือดเมื่อความดันไออิ่มตัวเท่ากับความดันภายนอก หากความดันภายนอก (เช่น บรรยากาศ) ไม่เปลี่ยนแปลงและของเหลวนั้นเป็นสารเดี่ยวและมีความบริสุทธิ์ทางเคมี มันจะเดือดในภาชนะที่ให้ความร้อนแบบเปิดที่อุณหภูมิคงที่จนกระทั่งเฟสของเหลวหายไปอย่างสมบูรณ์
ดังนั้น ที่ความดันบรรยากาศ 101.325 kPa จุดเดือดของน้ำบริสุทธิ์ (กลั่น) คือ 100 o C หรือ 373.16 K
หากสารไม่ระเหยบางชนิดละลายใน H 2 O ความดันไออิ่มตัวจะลดลง เพื่อให้สารละลายที่ได้เดือดจำเป็นต้องให้ความร้อนที่อุณหภูมิสูงกว่า 373.16 K เนื่องจากภายใต้เงื่อนไขดังกล่าวเท่านั้น ความดันไออิ่มตัวของตัวทำละลายจะเท่ากับความดันบรรยากาศอีกครั้ง
การแช่แข็งหรือการตกผลึก เป็นปรากฏการณ์ทางกายภาพที่มาพร้อมกับการเปลี่ยนของเหลวให้เป็นของแข็ง นอกจากนี้โครงสร้างผลึกยังเกิดขึ้นตลอดปริมาตรของของเหลวทั้งหมด
กระบวนการแช่แข็งเริ่มต้นเมื่อความดันไออิ่มตัวเหนือของเหลวเท่ากับความดันไออิ่มตัวเหนือผลึกแข็ง
หากความดันภายนอก (บรรยากาศ) ยังคงคงที่และของเหลวไม่มีสิ่งเจือปนแปลกปลอม ในระหว่างกระบวนการตกผลึก อุณหภูมิของของเหลวที่เย็นลงจะยังคงคงที่จนกว่าเฟสของเหลวจะเปลี่ยนเป็นของแข็งโดยสมบูรณ์
ที่ความดันบรรยากาศเท่ากับ 101.325 kPa น้ำกลั่นจะแข็งตัวที่ 0 o C (273.16 K) ความดันไออิ่มตัวของน้ำเหนือน้ำแข็งและของเหลวในกรณีนี้คือ 613.3 Pa
สำหรับสารละลายที่เป็นน้ำ ความดันไออิ่มตัวของตัวทำละลายที่ 0 o C จะน้อยกว่า 613.3 Pa และจะยังคงไม่เปลี่ยนแปลงเหนือน้ำแข็ง น้ำแข็งที่ตกลงในสารละลายดังกล่าวจะละลายอย่างรวดเร็วเนื่องจากการควบแน่นของไอน้ำส่วนเกินที่อยู่ด้านบน
การลดอุณหภูมิลงเท่านั้นจึงจะสามารถทำให้ความดันไออิ่มตัวเหนือเฟสของเหลวและของแข็งเท่ากันได้อีกครั้ง และกระบวนการตกผลึกก็เริ่มต้นขึ้น
เป็นที่ยอมรับจากการทดลองว่าการเพิ่มขึ้นของจุดเดือด (Dt bp) และจุดเยือกแข็งที่ลดลงของสารละลาย (Dt sub) เมื่อเปรียบเทียบกับตัวทำละลายบริสุทธิ์จะเป็นสัดส่วนโดยตรงกับความเข้มข้นของโมลาลของสารที่ละลาย ในทางคณิตศาสตร์สามารถเขียนได้ดังนี้:
ไม่เป็นไร สารละลาย – อย่าต้ม p-body = Dt เบล = เอม
รอง r-tel – t รอง วิธีแก้ปัญหา = รอง Dt = กม
โดยที่ m คือความเข้มข้นของโมลาลของสารที่ละลาย E และ K เป็นค่าคงที่ ebullioscopic (ละติน ebbulio - เดือดออกไป) และค่าคงที่ของการแช่แข็ง (กรีก "krios" - เย็น) ตามลำดับค่าซึ่งขึ้นอยู่กับลักษณะของตัวทำละลายเท่านั้น (ตารางที่ 7)
ตารางที่ 7.ค่าคงที่ Ebullioscopic E และ Cryoscopic K ของตัวทำละลายบางชนิด (องศา/โมล)
ข้าว. 7.12. ลดความดันไอของน้ำเหนือสารละลาย
เส้นทึบแสดงขอบเขตของสนามเฟสของน้ำบริสุทธิ์ จำได้ว่าอยู่แถวนั้น. 1 แสดงสมดุลของของเหลวและไอ หลังจากเติมตัวถูกละลายที่ไม่ระเหยลงในน้ำแล้ว ความดันไอจะอยู่เหนือสารละลาย (เส้นประ 2 ) ลดลงที่อุณหภูมิใดๆ
ของเหลวใดๆ ก็ตามจะแข็งตัว (แข็งตัว) เมื่อเปรียบเทียบความดันไอด้านบนกับความดันไอเหนือสถานะของแข็ง (ในกรณีของน้ำ เหนือน้ำแข็ง) ดังนั้นอุณหภูมิเยือกแข็งของสารละลาย ที รอง จะมีอุณหภูมิต่ำกว่าจุดเยือกแข็ง T เกี่ยวกับรอง ตัวทำละลายบริสุทธิ์ - น้ำ
F.M. Raul (1883) ทดลองว่าอุณหภูมิเยือกแข็งลดลง (มิฉะนั้น - ภาวะซึมเศร้าเยือกแข็ง)
รอง DT = T เกี่ยวกับรอง - ที รอง ,
ที่เกิดจากตัวถูกละลายที่แตกต่างกันในปริมาณโมลเดียวกันจะเหมือนกันสำหรับตัวทำละลายที่กำหนด ดังนั้น สำหรับ 0.1ม สารละลายที่เป็นน้ำสำหรับสารบางชนิดจะสังเกตอุณหภูมิการแข็งตัวดังต่อไปนี้:
สาร ที รอง , หรือ ซี
ไฮโดรเจนเปอร์ออกไซด์ H 2 O 2 - 0.186
เมทิลแอลกอฮอล์ CH 3 OH - 0.181
เอทิลแอลกอฮอล์ C 2 H 5 OH - 0.183
ซูโครส C 12 H 22 O 11 - 0.186
เดกซ์โทรส C6H12O6 - 0.188
ที่ความเข้มข้นของตัวถูกละลายต่างกัน รอง DT เป็นสัดส่วนกับความเข้มข้นของโมลาล ม :
รอง DT = เค ซีร์ ม (7.1)
ปัจจัยสัดส่วน เค cr ในสมการ (7.1) เรียกว่า ค่าคงที่ของการแช่แข็งแสดงถึงการลดลงของจุดเยือกแข็งของฟันกราม ค่านี้เป็นตัวเลขเท่ากับการลดลงของจุดเยือกแข็งของสารละลายที่มีสารละลาย 1 โมลในตัวทำละลาย 1 กิโลกรัม โดยมีเงื่อนไขว่าสารละลายนั้นมีคุณสมบัติในอุดมคติ ค่าคงที่ของการแช่แข็งเป็นคุณลักษณะของตัวทำละลาย ค่าของมันไม่ได้ขึ้นอยู่กับลักษณะของตัวถูกละลาย
ความเข้มข้นของโมลาลสามารถแสดงในรูปของมวลของตัวถูกละลาย ( ข)และตัวทำละลาย ( ก)มีหน่วยเป็นกรัม (ดูข้อ 7.3)
ที่ไหน ม - มวลโมลของสารที่ละลาย (กรัม/โมล) เราได้รับสมการนี้แทนนิพจน์นี้เป็นสมการ (7.1)
สถานการณ์ที่สำคัญมากประการหนึ่งตามมาจากสมการนี้ กล่าวคือ เมื่อทราบองค์ประกอบที่แน่นอนของสารละลายเจือจาง และการวัดอุณหภูมิเยือกแข็งของตัวทำละลายบริสุทธิ์และสารละลาย คุณสามารถคำนวณมวลโมลของสารที่ละลายได้:
สมการ (7.2) เป็นพื้นฐาน แช่แข็ง(หรือ ไครโอเมตริก)วิธีการหามวลโมลาร์ของสารโดยการลดจุดเยือกแข็งของสารละลาย วิธีการไครโอเมตริกถูกนำมาใช้กันอย่างแพร่หลายในการปฏิบัติงานในห้องปฏิบัติการ รวมถึงในร้านขายยาด้วย
โดยมีหลักการดังนี้ ขั้นแรก ให้วัดอุณหภูมิหลอมเหลว (หรือจุดเยือกแข็ง) ของตัวอย่างที่แม่นยำ กตัวทำละลายที่เลือก จากนั้นจึงเติมสารทดสอบส่วนที่ชั่งน้ำหนักอย่างถูกต้องลงในตัวทำละลาย ขและวัดจุดหลอมเหลวของส่วนผสมที่ได้ (หรือจุดเยือกแข็งหากสารที่เลือกเป็นตัวทำละลายมีจุดหลอมเหลวต่ำ) น้ำหนักของตัวถูกละลายต้องน้อยกว่าน้ำหนักของตัวทำละลายมากจึงจะเจือจางสารละลายได้ มูลค่าที่ได้รับ รอง DT ถูกแทนที่ด้วยสมการ (7.2) และช่วยคำนวณมวลโมลของสารที่กำลังศึกษาอยู่ ในกรณีที่ง่ายที่สุด น้ำกลั่นสามารถใช้เป็นตัวทำละลายได้ อย่างไรก็ตาม เนื่องจากค่าคงที่ของการแช่แข็งและจุดเยือกแข็งต่ำมีค่าน้อย ซึ่งต้องใช้การแช่แข็งหรือสารผสมในการทำความเย็นแบบพิเศษ น้ำจึงถูกใช้เพื่อการประมาณมวลโมลาร์โดยประมาณของสารเท่านั้น ตามกฎแล้ว โดยเฉพาะอย่างยิ่งเมื่อศึกษาสารอินทรีย์ที่ซับซ้อนซึ่งมีมวลโมลขนาดใหญ่ สารอื่นจะถูกเลือกเป็นตัวทำละลาย ในกรณีนี้ การบูรที่มีค่าคงที่ของการแช่แข็งสูงมีความสำคัญเป็นพิเศษ เงื่อนไขหลักสำหรับการวัดด้วยไครโอเมตริกคือความสามารถในการละลายโดยสมบูรณ์ของสารทดสอบในตัวทำละลายที่เลือก ด้านล่างนี้คือค่าคงที่ของการแช่แข็งของสารบางชนิด (ที่ความดันบรรยากาศปกติ):
สาร T pl o C การแช่แข็ง
คงที่ เค cr
เบนซิน 5.5 5.12
กรดอะซิติก 16.8 3.90
ไซโคลเฮกเซน 6.5 20
การบูร 178.5 39.7
นอกจากนี้ยังใช้วิธีแช่แข็งเพื่อกำหนดความบริสุทธิ์ของสารอีกด้วย ขึ้นอยู่กับข้อเท็จจริงที่ว่าการมีอยู่ของสิ่งเจือปนแม้เพียงเล็กน้อยจะช่วยลดจุดหลอมเหลวของตัวอย่างของสารที่อยู่ระหว่างการศึกษา ดังนั้นในทางเคมี (เช่นเดียวกับในร้านขายยา) หนึ่งในเกณฑ์สำหรับความบริสุทธิ์ของสารคือการบรรลุอุณหภูมิหลอมเหลวสูงสุดซึ่งจะไม่เพิ่มขึ้นอีกหลังจากการดำเนินการทำให้บริสุทธิ์เพิ่มเติม
การใช้งานที่สำคัญอีกประการหนึ่งของเอฟเฟกต์การแช่แข็งคือการเตรียมส่วนผสมในการทำความเย็น ด้วยอัตราส่วนน้ำ (หรือหิมะ) และเกลืออนินทรีย์บางชนิด คุณก็จะได้รับ อุณหภูมิต่ำ, เก็บรักษาไว้เป็นเวลานาน ตัวอย่างเช่นส่วนผสมที่ประกอบด้วยหิมะ 100 กรัมและ CaCl 2 · 6H 2 O 143 กรัม ช่วยให้คุณได้อุณหภูมิ -55 o C
ในพื้นที่ที่มีสภาพอากาศหนาวเย็น สารป้องกันการแข็งตัว เช่น แอลกอฮอล์ กลีเซอรีน หรือเอทิลีนไกลคอล จะถูกเติมลงในน้ำที่ใช้ในหม้อน้ำรถยนต์ เพื่อป้องกันไม่ให้กลายเป็นน้ำแข็งในฤดูหนาว น้ำแข็งที่แข็งตัวบนถนนและทางเท้าละลายได้ง่ายเมื่อโรย เกลือแกงหรือขี้เถ้าซึ่งขึ้นอยู่กับผลของการแช่แข็งด้วย คุณเพียงแค่ต้องจำไว้ว่าการใช้เกลือมากเกินไปเพื่อจุดประสงค์เหล่านี้อาจทำให้เกิดความเค็มในอ่างเก็บน้ำและดินใกล้เคียงบนตลิ่ง และส่งผลให้เกิดการรบกวนสิ่งแวดล้อม
การแช่แข็งคือการเปลี่ยนเฟสที่ของเหลวเปลี่ยนเป็นของแข็ง จุดเยือกแข็งของของเหลวคืออุณหภูมิที่ความดันไออิ่มตัวเหนือของเหลวเท่ากับความดันไออิ่มตัวเหนือผลึกสถานะของแข็งที่ตกลงมาจากของเหลว
ที่อุณหภูมินี้และความดันไออิ่มตัวที่สอดคล้องกัน อัตราการตกผลึกจะเท่ากับอัตราการหลอมเหลว และทั้งสองเฟสนี้สามารถอยู่ร่วมกันได้เป็นเวลานาน
นอกจากนี้ M.V. Lomonosov สังเกตว่าสารละลายเจือจางจะแข็งตัวที่อุณหภูมิต่ำกว่าตัวทำละลายบริสุทธิ์ ดังนั้นน้ำทะเลจะแข็งตัวไม่อยู่ที่ 273 K แต่ที่อุณหภูมิต่ำกว่าเล็กน้อย การทดลองจำนวนมากแสดงให้เห็นว่าการเปลี่ยนแปลงอุณหภูมิเยือกแข็งของสารละลายถือได้ว่าเป็นกฎทั่วไป
ราอูลต์ศึกษากระบวนการแช่แข็งและการเดือดอย่างละเอียดและนำเสนอในรูปแบบของกฎหมาย ซึ่งต่อมาเรียกว่ากฎข้อที่สองของราอูลต์
ลองพิจารณาที่มาที่ง่ายที่สุดของกฎหมายนี้ รูปที่ 2 แสดงแผนภาพที่แสดงการขึ้นต่อกันของความดันไออิ่มตัวกับอุณหภูมิเหนือตัวทำละลายบริสุทธิ์และเหนือสารละลาย
เส้นโค้ง 0A คือการขึ้นอยู่กับความดันไออิ่มตัวของน้ำบริสุทธิ์กับอุณหภูมิ
Curve BC, DE - การขึ้นอยู่กับความดันไออิ่มตัวของน้ำเหนือสารละลายที่มีความเข้มข้นต่างกันของสารที่ละลาย
0D - แสดงการขึ้นต่ออุณหภูมิของความดันไออิ่มตัวของน้ำเหนือน้ำแข็ง
จากรูปที่ 2 เห็นได้ชัดว่าความดันไอเหนือสารละลายที่ 273 K ต่ำกว่าเหนือน้ำ แต่ไม่เท่ากับความดันไอเหนือน้ำแข็งที่อุณหภูมิเดียวกัน เฉพาะที่อุณหภูมิต่ำกว่า 273 K (T'z) เท่านั้นที่ความดันไอเหนือสารละลายจะลดลงมากจนเท่ากับความดันไอเหนือน้ำแข็ง ซึ่งสอดคล้องกับจุด B ที่ความเข้มข้นของสารละลายสูงกว่า เส้นโค้งที่แสดงการขึ้นต่อกันของความดันไอน้ำเหนือสารละลายที่มีอุณหภูมิจะอยู่ใต้เส้นโค้ง BC แต่ขนานไปกับมัน
มาแนะนำกันดีกว่า สัญกรณ์ถัดไป:
Р 0 А – ความดันไอเหนือตัวทำละลายบริสุทธิ์ที่ 273 K
P A – ความดันไอเหนือสารละลายที่อุณหภูมิเยือกแข็ง T’z
จาก สามเหลี่ยมมุมฉากเรากำหนด FOC
จากรูปที่ 2 ชัดเจนว่า อุณหภูมิเยือกแข็งของสารละลายลดลงอยู่ที่ไหน
เราได้รับค่าเหล่านี้แทนค่าเหล่านี้ลงในสมการข้างต้น

 (3)
(3)
จากกฎข้อแรกของ Raoult สำหรับสารละลายที่มีความเข้มข้นสูงที่เรามี
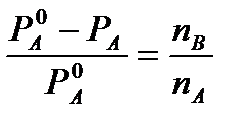
 และ
และ  (4)
(4)
โดยที่ n A, n B, m A ยังคงการกำหนดตำแหน่งไว้ก่อนหน้านี้ (ดูด้านบน) หากเราแสดงมวลโมลของตัวทำละลายด้วย M 0 A แสดงว่า

เราได้รับสมการนี้แทนนิพจน์นี้เป็นสมการ (4)

คูณและหารด้านขวาของนิพจน์นี้ด้วย 1,000 แล้ว
 (5)
(5)
ให้เรารวมปริมาณคงที่ทั้งหมดในสมการ (5) ให้เป็นค่าคงที่เดียว K (  ) เราจะได้นิพจน์ต่อไปนี้
) เราจะได้นิพจน์ต่อไปนี้
 (6)
(6)
การแสดงออก  แสดงถึงโมลาลิตี้ของสารละลายเซนต์
แสดงถึงโมลาลิตี้ของสารละลายเซนต์
เมื่อแทนนิพจน์นี้เป็นสมการ (6) เราจะได้สมการสุดท้าย
 (7)
(7)
นี่คือนิพจน์ทางคณิตศาสตร์ของกฎข้อที่สองของ Raoult: จุดเยือกแข็งที่ลดลงหรือจุดเดือดที่เพิ่มขึ้นของสารละลายจะเป็นสัดส่วนโดยตรงกับความเข้มข้นของโมล
ค่าสัมประสิทธิ์ K ในสมการ (7) เรียกว่าค่าคงที่ของการแช่แข็ง ซึ่งแสดงการลดลงของอุณหภูมิเยือกแข็งของสารละลายโดยกรามคือ ลักษณะเฉพาะส่วนบุคคลตัวทำละลาย (K H2O = 1.86°) และมีขนาดเท่ากับ E (K° kg mol -1)
วิธีการวิจัยที่ใช้การวัดการลดลงของจุดเยือกแข็งของสารละลายเรียกว่าการแช่แข็งด้วยความเย็น เช่นเดียวกับ ebullioscopic ช่วยให้คุณสามารถคำนวณมวลโมลาร์ของสารที่ละลายได้

รูปที่ 3 แสดงอุปกรณ์ที่ออกแบบมาเพื่อวัดจุดเยือกแข็งของสารละลาย
 |
ออสโมซิสและความดันออสโมติก.
คุณสมบัติทางชีววิทยาที่สำคัญมากของสารละลายคือการออสโมซิส
โดยธรรมชาติแล้ว สารละลายมักจะถูกแยกออกจากตัวทำละลายด้วยเมมเบรนที่สามารถซึมผ่านได้เฉพาะกับอนุภาคของตัวทำละลายเท่านั้น ในกรณีนี้ ตัวถูกละลายไม่สามารถแพร่กระจายไปยังตัวทำละลายได้ และจะสังเกตเฉพาะการเปลี่ยนตัวทำละลายไปเป็นสารละลายเท่านั้น กล่าวคือ ตัวทำละลายจะเคลื่อนที่ทั้งสองทิศทาง แต่จะเข้าไปในสารละลายมากกว่าในเล็กน้อย ทิศทางย้อนกลับ.
กลไกของการออสโมซิสเป็นเรื่องง่ายที่จะจินตนาการได้จากการกลั่นด้วยความร้อน ปล่อยให้เมมเบรนแบบกึ่งซึมผ่านได้ที่มีรูพรุนขนาดเล็กแยกตัวทำละลายและสารละลายที่มีความเข้มข้น C ใน (รูปที่ 4)

ในรูพรุนที่ถูกจำกัดด้านหนึ่งด้วยตัวทำละลาย และอีกด้านหนึ่งด้วยสารละลาย การระเหยจะเกิดขึ้น เนื่องจากความยืดหยุ่นของไออิ่มตัวที่เพิ่มขึ้นตามกฎของ Raoult ความดันไอจากเฟสไอจึงเข้มข้นจากด้านตัวทำละลายและผ่านเข้าไปในสารละลาย
ผลจากการออสโมซิสทำให้ปริมาตรของสารละลายเพิ่มขึ้นและความเข้มข้นของสารละลายจะค่อยๆลดลง ตัวทำละลายที่เจาะเข้าไปในสารละลายผ่านเมมเบรนจะเพิ่มคอลัมน์ของเหลว h ดังนั้นจึงเพิ่มความดันอุทกสถิต (ดูรูปที่ 5) ในเวลาเดียวกันจำนวนโมเลกุลของตัวทำละลายที่เคลื่อนที่ผ่านเมมเบรนในทิศทางตรงกันข้ามจะเพิ่มขึ้นเช่น จากสารละลายสู่ตัวทำละลาย ความดันอุทกสถิตและการเจือจางของสารละลายจะค่อยๆ ไปถึงค่าที่จำนวนโมเลกุลของตัวทำละลายที่เคลื่อนที่ในทั้งสองทิศทางจะเท่ากันและสมดุลออสโมติกจะเกิดขึ้น ความดันอุทกสถิตส่วนเกินที่พัฒนาขึ้นอันเป็นผลมาจากออสโมซิสซึ่งวัดโดยคอลัมน์ของสารละลายความสูง h ซึ่งทำให้เกิดสมดุลออสโมติกเรียกว่าแรงดันออสโมติก
![]() ข้าว. 5
ข้าว. 5
เมมเบรนที่ทำจากคอลโลเดียน กระดาษแก้ว เหล็ก-ซินออกไซด์ทองแดง ฯลฯ สามารถซึมผ่านได้กับสารละลายหลายชนิด
กฎแรงดันออสโมติก.
การศึกษากฎแรงดันออสโมติกเผยให้เห็นความคล้ายคลึงที่สมบูรณ์กับกฎของแก๊ส สำหรับสารละลายเจือจางของโนอิเล็กโตรไลต์ สามารถกำหนดสูตรได้ดังนี้:
ที่อุณหภูมิคงที่ ความดันออสโมติกจะเป็นสัดส่วนโดยตรงกับความเข้มข้นของโมลของตัวถูกละลาย (เปรียบเทียบกับกฎบอยล์-มาริโอต)

ที่ความเข้มข้นของฟันกรามคงที่ แรงดันออสโมติกจะเป็นสัดส่วนโดยตรงกับอุณหภูมิสัมบูรณ์ (เปรียบเทียบกับกฎของเกย์-ลูสแซก):

จากกฎทั้งสองนี้ ตามมาว่าที่ความเข้มข้นและอุณหภูมิโมลเท่ากัน สารละลายของอิเล็กโตรไลต์ต่างกันจะสร้างแรงดันออสโมติกเท่ากัน กล่าวคือ สารละลายอิเล็กโทรไลต์ที่เท่ากันนั้นเป็นไอโซโทนิก (เปรียบเทียบกับกฎของอาโวกาโดร)
Van't Hoff เสนอกฎแบบครบวงจรสำหรับแรงดันออสโมติกในสารละลาย (คล้ายกับกฎก๊าซแบบครบวงจรของ Mendeleev-Claiperon): แรงดันออสโมติกของสารละลายเจือจางของอิเล็กโทรไลต์ที่ไม่ใช่อิเล็กโทรไลต์เป็นสัดส่วนโดยตรงกับความเข้มข้นของโมลาร์ ค่าสัมประสิทธิ์สัดส่วน และอุณหภูมิสัมบูรณ์:
เนื่องจาก c=n/V โดยที่ n คือจำนวนโมลของผู้ที่ไม่ใช่อิเล็กโทรไลต์ และ V คือปริมาตรของสารละลาย จากนั้น  หรือ
หรือ ![]()
เจือจางสารละลายที่ไม่ใช่อิเล็กโทรไลต์
สมบัติเชิงคอลลิจิคัลของสารละลาย
แรงดันไอน้ำอิ่มตัว
ความสมดุลของ "ไอของเหลว-ไอส่วนบุคคล" อธิบายได้ด้วยค่าคงที่สมดุล
K p = p เกี่ยวกับเรา คู่ /a ของ f (1)
ดังนั้น เนื่องจากกิจกรรมของของเหลวแต่ละชนิด a o x = 1 ความดันไออิ่มตัวจึงเท่ากับ
p o คู่ = K p (2)
และขึ้นอยู่กับอุณหภูมิเท่านั้น
เนื่องจากกิจกรรมของตัวทำละลายเท่ากับผลคูณของ o x เศษส่วนโมลของมัน N 1 หรือ (1 - N 2) โดยที่ N 2 คือเศษส่วนโมลาร์ของสารที่ละลาย ค่าคงที่สมดุลจะเท่ากับ:
K พี =พี 1 o =(พี 1 /a o x ยังไม่มีข้อความ 1)=(พี 1 /1-N 2) (3)
จากที่นี่เราได้รับ กฎของราอูลต์ (1886):
พี 1 = พี 1 โอ (1-N 2) = พี 1 o ยังไม่มีข้อความ 1 (4)
(หน้า 1 o -p 1)/หน้า 1 o)=ยังไม่มี 2 (5)
ความดันไออิ่มตัวของสารละลายเท่ากับความดันเหนือตัวทำละลายบริสุทธิ์คูณด้วยเศษส่วนโมลของตัวทำละลาย
การลดลงโดยสัมพัทธ์ของความดันไออิ่มตัวของตัวทำละลายเหนือสารละลายบริสุทธิ์จะเท่ากับเศษส่วนโมลของตัวถูกละลาย
ดังนั้นความดันไอจึงขึ้นอยู่กับปริมาณตัวถูกละลายอยู่แล้ว กฎของราอูลต์สามารถใช้เพื่อหามวลโมลาร์ของตัวถูกละลายได้:
Dp/p 1 ° =N 2 =n 2 /n 1 +n 2 µm 2 M 1 /m 1 M 2 (6)
จุดเดือดของสารละลาย
ของเหลวจะเดือดเมื่อความดันไออิ่มตัวเท่ากับความดันภายนอก เนื่องจากตามกฎของ Raoult ความดันไอเหนือสารละลายมีค่าน้อยกว่าความดันไอเหนือตัวทำละลายบริสุทธิ์ จุดเดือดของสารละลายจึงสูงกว่าจุดเดือดของตัวทำละลายบริสุทธิ์
การทดลองแสดงให้เห็นว่าสำหรับสารละลายเจือจางที่ไม่ใช่อิเล็กโทรไลต์:
โดยที่ DT คือการเพิ่มขึ้นของจุดเดือดของสารละลายเมื่อเปรียบเทียบกับตัวทำละลายบริสุทธิ์ b คือโมลาลิตี ([E] = K. Kg/mol) E คือค่าคงที่ ebullioscopic (จาก ebbulio (lat.) - เดือด) ขึ้นอยู่กับเท่านั้น เกี่ยวกับคุณสมบัติของตัวทำละลาย (อุณหภูมิ จุดเดือด T o และความร้อนจำเพาะของการระเหย L 1):
E=RT หรือ 2 /1000L 1 (8)
จุดเดือดของตัวทำละลายบริสุทธิ์มีค่าที่แน่นอนที่ความดันภายนอกคงที่ จุดเดือดของสารละลายไม่คงที่ - เพิ่มขึ้นเมื่อเดือดเนื่องจากการระเหยของตัวทำละลายทำให้ความเข้มข้นของสารละลายเพิ่มขึ้น ในขณะเดียวกันความดันไออิ่มตัวจะลดลงตลอดเวลา ดังนั้นจุดเดือดของสารละลายจึงถือเป็นอุณหภูมิที่สอดคล้องกับลักษณะของฟองไอฟองแรกในนั้น
จุดเยือกแข็งของสารละลาย
เหนือสารละลาย ความดันไอของตัวทำละลายจะต่ำกว่าความดันไอเหนือตัวทำละลายบริสุทธิ์ ความดันไอเหนือเฟสของแข็งและของเหลวก็จะน้อยลงเช่นกัน สิ่งนี้สามารถเกิดขึ้นได้ที่จุดเยือกแข็งที่ต่ำกว่าของสารละลายเท่านั้น เมื่อเทียบกับตัวทำละลายบริสุทธิ์ การลดลงของจุดเยือกแข็งของสารละลายที่ไม่ใช่อิเล็กโทรไลต์สัมพันธ์กับจุดเยือกแข็งของตัวทำละลายบริสุทธิ์นั้นแปรผันตามโมลาลิตีของสารละลาย:
โดยที่ K คือค่าคงที่ของการแช่แข็ง (จากภาษากรีก "krios" - เย็น) ขึ้นอยู่กับคุณสมบัติของตัวทำละลายเท่านั้น:
K=RT หรือ 2 /1000L 1, (10)
โดยที่ T o, L * 1 คือจุดเยือกแข็งและความร้อนจำเพาะของการหลอมรวมของตัวทำละลายบริสุทธิ์
เนื่องจากความเข้มข้นของสารที่ละลายจะเพิ่มขึ้นตามการแข็งตัวของตัวทำละลาย จุดเยือกแข็งของสารละลายจึงไม่คงที่และลดลงในระหว่างกระบวนการ ดังนั้นอุณหภูมิการก่อตัวของผลึกแรกจึงถือเป็นอุณหภูมิเยือกแข็งของสารละลาย
ตารางที่ 2 แสดงค่า E และ K สำหรับตัวทำละลายบางชนิด
ตารางที่ 2.
ผลึกตัวทำละลายจะอยู่ในสมดุลกับสารละลายเฉพาะเมื่อความดันไออิ่มตัวเหนือผลึกและเหนือสารละลายเท่ากัน เนื่องจากความดันไอของตัวทำละลายเหนือสารละลายจะต่ำกว่าความดันไอของตัวทำละลายบริสุทธิ์เสมอ อุณหภูมิที่สอดคล้องกับสภาวะนี้จะต่ำกว่าจุดเยือกแข็งของตัวทำละลายบริสุทธิ์เสมอ ในกรณีนี้ การลดลงของอุณหภูมิเยือกแข็งของสารละลาย ΔT ไม่ได้ขึ้นอยู่กับลักษณะของสารที่ละลาย และถูกกำหนดโดยอัตราส่วนของจำนวนอนุภาคของตัวทำละลายและสารที่ละลายเท่านั้น
แสดงให้เห็นว่าอุณหภูมิเยือกแข็งที่ลดลงของสารละลาย ΔT จะเป็นสัดส่วนโดยตรงกับความเข้มข้นของโมลาลของสารละลาย:
กฎข้อที่สองของราอูลต์: จุดเดือดที่เพิ่มขึ้นและการลดลงของสารละลาย Tzam จะเป็นสัดส่วนกับจำนวนอนุภาคของสารที่ละลายและไม่ขึ้นอยู่กับธรรมชาติของมัน
สิ้นสุดการทำงาน -
หัวข้อนี้เป็นของส่วน:
การบรรยายครั้งที่ 5 สมดุลเฟส สารละลายที่ไม่ใช่อิเล็กโทรไลต์
สถานะของก๊าซของสารมีลักษณะเฉพาะคือปฏิกิริยาระหว่างอนุภาคที่อ่อนแอและมีระยะห่างระหว่างอนุภาคมาก ดังนั้น ก๊าซจึงผสม... ความดันรวมของส่วนผสมของก๊าซเท่ากับผลรวมของความดันบางส่วนของส่วนประกอบทั้งหมด...
หากคุณต้องการ วัสดุเพิ่มเติมในหัวข้อนี้หรือคุณไม่พบสิ่งที่คุณกำลังมองหาเราขอแนะนำให้ใช้การค้นหาในฐานข้อมูลผลงานของเรา:
เราจะทำอย่างไรกับเนื้อหาที่ได้รับ:
หากเนื้อหานี้มีประโยชน์สำหรับคุณ คุณสามารถบันทึกลงในเพจของคุณบนโซเชียลเน็ตเวิร์ก:
| ทวีต |
หัวข้อทั้งหมดในส่วนนี้:
การบรรยายครั้งที่ 5 สมดุลเฟส สารละลายที่ไม่ใช่อิเล็กโทรไลต์
ความสมดุลของเฟส
ในการบรรยายครั้งล่าสุด เราพิจารณาถึงสมดุลเคมี ค่าคงที่สมดุล ความสัมพันธ์ของมันกับอื่นๆ ปริมาณและปัจจัยที่มีอิทธิพลต่อการเปลี่ยนแปลงของสมดุล
ระบบสององค์ประกอบ
สารละลายคือระบบที่เป็นเนื้อเดียวกันซึ่งประกอบด้วยส่วนประกอบตั้งแต่ 2 ชิ้นขึ้นไป ซึ่งองค์ประกอบสามารถเปลี่ยนแปลงได้อย่างต่อเนื่องภายในขีดจำกัดที่กำหนดโดยไม่มีการเปลี่ยนแปลงคุณสมบัติของมันอย่างกะทันหัน
การก่อตัวของสารละลายเป็นกระบวนการทางกายภาพและเคมีที่ซับซ้อน กระบวนการสลายจะมาพร้อมกับการเพิ่มขึ้นของเอนโทรปีของระบบเสมอ เมื่อวิธีแก้ปัญหาเกิดขึ้น มักจะเกิดการปลดปล่อยทั้งสองอย่างออกมา
ความสามารถในการละลาย
กระบวนการละลายเกี่ยวข้องกับการแพร่กระจาย กล่าวคือ การกระจายตัวของอนุภาคของสารหนึ่งระหว่างอนุภาคของสารอีกสารหนึ่งโดยธรรมชาติ เมื่อเติมตัวถูกละลายลงในตัวทำละลาย กระบวนการละลายจะเกิดขึ้น
ความสามารถในการละลายของก๊าซในของเหลว
ความสามารถในการละลายของก๊าซในของเหลวขึ้นอยู่กับปัจจัยหลายประการ: ธรรมชาติของก๊าซและของเหลว ความดัน อุณหภูมิ ความเข้มข้นของสารที่ละลายในของเหลว (โดยเฉพาะความสามารถในการละลายของก๊าซ)
สารละลายที่ไม่ใช่อิเล็กโทรไลต์
พิจารณาคุณสมบัติของสารละลายโดยใช้ตัวอย่างของสารละลายเจือจางซึ่งผลกระทบทางความร้อนและปริมาตรเท่ากับ 0 (สารละลายในอุดมคติ) ในสารละลายดังกล่าวอนุภาคจะมีขนาดใหญ่
การลดลงโดยสัมพัทธ์ของความดันไออิ่มตัวเหนือสารละลายจะเท่ากับเศษส่วนโมลของตัวถูกละลาย
ของเหลวใด ๆ เริ่มเดือดที่อุณหภูมิซึ่งความดันไออิ่มตัวถึงความดันภายนอก T ต้ม - T ที่แรงดันไอน้ำ = 101.3 kPa น้ำเดือดที่ 100 C
แรงดันออสโมติก
ถ้าสารละลายสองชนิดที่มีความเข้มข้นต่างกันถูกแยกออกจากกันด้วยฉากกั้นแบบกึ่งซึมผ่านได้ซึ่งช่วยให้โมเลกุลของตัวทำละลายทะลุผ่านได้แต่ป้องกันไม่ให้อนุภาคของตัวถูกละลายผ่านไปได้ ฉันจะสังเกต
