Congelamento de soluções. As soluções congelam a uma temperatura mais baixa que o solvente puro.
As soluções fervem a mais de alta temperatura como solvente puro;
Corolários da lei de Raoult
Soluções que obedecem estritamente à lei de Raoult são ideais. Para soluções reais de não eletrólitos, a lei de Raoult é observada com mais precisão, quanto mais diluída for essa solução. À medida que a concentração do soluto aumenta, a maioria das soluções apresenta desvios da lei de Raoult.
A diminuição relativa na pressão de vapor saturado do solvente acima da solução é igual à fração molar do soluto.
Soluções de eletrólitos (ácidos, bases, sais) não obedecem à lei de Raoult. Além disso, mesmo nos casos em que estão diluídos. A razão deste fenômeno será discutida mais adiante.
Duas consequências importantes decorrem da lei de Raoult:
Vamos examiná-los com mais detalhes.
Ferver é processo físico a transição de um líquido para o estado gasoso ou vapor, no qual se formam bolhas de gás em todo o volume do líquido.
Um líquido entra em ebulição quando sua pressão de vapor saturado se torna igual à pressão externa. Se a pressão externa (por exemplo, atmosférica) não mudar, e o próprio líquido for uma substância individual e quimicamente pura, então ele ferve em um recipiente aberto e aquecido a uma temperatura constante até que a fase líquida desapareça completamente.
Assim, a uma pressão atmosférica de 101,325 kPa, o ponto de ebulição da água purificada (destilada) é 100 o C ou 373,16 K.
Se alguma substância não volátil for dissolvida em H 2 O, sua pressão de vapor saturado diminuirá. Para que a solução resultante ferva é necessário aquecê-la a uma temperatura superior a 373,16 K, pois somente nessas condições a pressão de vapor saturado do solvente voltará a ser igual à pressão atmosférica.
Congelamento ou cristalização é um fenômeno físico acompanhado pela transformação de um líquido em sólido. Além disso, estruturas cristalinas são formadas em todo o volume do líquido.
O processo de congelamento começa quando a pressão de vapor saturado acima do líquido se torna igual à pressão de vapor saturado acima de seus cristais sólidos.
Se a pressão externa (atmosférica) permanecer constante e o líquido não contiver impurezas estranhas, durante o processo de cristalização a temperatura do líquido resfriado permanecerá constante até que a fase líquida se transforme completamente em sólido.
À pressão atmosférica igual a 101,325 kPa, a água destilada congela a 0 o C (273,16 K). A pressão de vapor saturado da água acima do gelo e do líquido, neste caso, é 613,3 Pa.
Para uma solução aquosa, a pressão de vapor saturado do solvente a 0 o C será inferior a 613,3 Pa, e acima do gelo permanece inalterada. O gelo colocado em tal solução derreterá rapidamente devido à condensação do excesso de vapor acima dele.
Somente diminuindo a temperatura a pressão de vapor saturado acima das fases líquida e sólida pode ser equalizada novamente e o processo de cristalização iniciado.
Foi estabelecido experimentalmente que o aumento do ponto de ebulição (Dt bp) e a diminuição do ponto de congelamento da solução (Dt sub) em comparação com um solvente puro é diretamente proporcional à concentração molal da substância dissolvida. Matematicamente, isso pode ser escrito da seguinte forma:
não pare. solução - ferva. p-corpo = fardo Dt. =Em
deputado r-tel – t deputado solução = deputado Dt = Km
onde m é a concentração molar da substância dissolvida; E e K são, respectivamente, constantes ebulioscópicas (latim ebbulio - ferver) e crioscópicas (grego "krios" - frio), cujos valores dependem apenas da natureza do solvente (Tabela 7).
Tabela 7. Constantes ebulioscópicas E e crioscópicas K de alguns solventes (graus/mol)
Arroz. 7.12. Reduzindo a pressão de vapor da água acima da solução
As linhas sólidas expressam os limites dos campos de fase da água pura. Lembre-se que a linha 1 exibe o equilíbrio líquido-vapor. Depois de adicionar um soluto não volátil à água, a pressão de vapor acima da solução (linha tracejada 2 ) diminui em qualquer temperatura.
Qualquer líquido irá congelar (solidificar) quando a pressão de vapor acima dele for comparada com a pressão de vapor acima da fase sólida (no caso da água, acima do gelo). Portanto, a temperatura de congelamento da solução Deputado T será menor que a temperatura de congelamento T sobre deputado solvente puro - água.
F.M Raul (1883) estabeleceu experimentalmente que uma diminuição na temperatura de congelamento (caso contrário - depressão congelante)
Deputado do DT = T sobre deputado - Deputado T ,
causado por diferentes solutos tomados nas mesmas quantidades molares é o mesmo para um determinado solvente. Então, por 0,1m soluções aquosas Para algumas substâncias são observadas as seguintes temperaturas de solidificação:
Substância Deputado T , oC
Peróxido de hidrogênio H 2 O 2 - 0,186
Álcool metílico CH 3 OH - 0,181
Álcool etílico C 2 H 5 OH - 0,183
Sacarose C 12 H 22 O 11 - 0,186
Dextrose C6H12O6 - 0,188
Em diferentes concentrações de soluto Deputado do DT proporcional à sua concentração molar eu :
Deputado do DT = K cr m (7.1)
Fator de proporcionalidade K cr na equação (7.1), chamada constante crioscópica, representa a diminuição molar no ponto de congelamento. Este valor é numericamente igual à diminuição do ponto de congelamento de uma solução contendo 1 mol de substância dissolvida em 1 quilograma de solvente, desde que a solução tenha propriedades ideais. A constante crioscópica é uma característica do solvente, seu valor não depende da natureza do soluto;
A concentração molal pode ser expressa em termos da massa do soluto ( b) e solvente ( UM) em gramas (ver cláusula 7.3):
Onde M - massa molar da substância dissolvida (g/mol). Substituindo esta expressão na equação (7.1), obtemos
Uma circunstância muito importante decorre desta equação, a saber: conhecendo a composição exata da solução diluída e medindo as temperaturas de congelamento do solvente puro e da solução, pode-se calcular a massa molar da substância dissolvida:
A equação (7.2) é a base crioscópico(ou criométrico)método determinação da massa molar de substâncias diminuindo o ponto de congelamento de suas soluções O método criométrico é amplamente utilizado na prática laboratorial, inclusive na farmácia.
Seu princípio é o seguinte. Primeiro, a temperatura de fusão (ou congelamento) de uma amostra precisa é medida UM solvente selecionado. Em seguida, uma porção pesada com precisão da substância de teste é adicionada ao solvente. b e mede-se o ponto de fusão da mistura resultante (ou o ponto de congelamento se a substância escolhida como solvente tiver um ponto de fusão baixo). O peso do soluto deve ser muito menor que o peso do solvente para que a solução seja diluída. Valor recebido Deputado do DT é substituído na equação (7.2) e com sua ajuda é calculada a massa molar da substância em estudo. No caso mais simples, água destilada pode ser usada como solvente. Porém, devido ao pequeno valor da constante crioscópica e ao baixo ponto de congelamento, que requer o uso de criostatos ou misturas especiais de resfriamento, a água é utilizada apenas para uma estimativa aproximada da massa molar das substâncias. Via de regra, principalmente no estudo de substâncias orgânicas complexas com grande massa molar, outras substâncias são escolhidas como solventes. Neste caso, a cânfora com a sua grande constante crioscópica é de particular importância. A principal condição para a determinação criométrica é a completa solubilidade da substância em estudo no solvente selecionado. Abaixo estão as constantes crioscópicas de algumas substâncias (à pressão atmosférica normal):
Substância T pl o C Crioscópica
constante K cr
Benzeno 5,5 5,12
Ácido acético 16,8 3,90
Ciclohexano 6,5 20
Cânfora 178,5 39,7
O método crioscópico também é usado para determinar a pureza das substâncias. Isto se baseia no fato de que a presença mesmo de uma pequena impureza reduz o ponto de fusão de uma amostra da substância em estudo. Portanto, na química (assim como na farmácia), um dos critérios para a pureza de uma substância é atingir uma temperatura máxima de fusão que não aumente ainda mais após operações adicionais de purificação.
Outra aplicação importante do efeito crioscópico é a preparação de misturas refrigerantes. Com uma certa proporção de água (ou neve) e alguns sais inorgânicos, você pode obter baixas temperaturas, mantido por bastante tempo. Por exemplo, uma mistura composta por 100 g de neve e 143 g de CaCl 2 6H 2 O permite obter uma temperatura de -55 o C.
Em áreas de clima frio, substâncias anticongelantes como álcool, glicerina ou etilenoglicol são adicionadas à água utilizada nos radiadores dos automóveis para evitar que congelem no inverno. O gelo congelado nas estradas e calçadas derrete facilmente quando borrifado sal de cozinha ou cinzas, que também se baseiam no efeito crioscópico. Basta lembrar que o uso excessivo de sal para esses fins pode causar salinização de reservatórios próximos e dos solos de suas margens e, consequentemente, distúrbios ambientais.
O congelamento é uma transição de fase em que um líquido se transforma em sólido. O ponto de congelamento de um líquido é a temperatura na qual a pressão de vapor saturado acima do líquido é igual à pressão de vapor saturado acima dos cristais da fase sólida que dele caem.
A esta temperatura e à correspondente pressão de vapor saturado, a taxa de cristalização é igual à taxa de fusão e ambas as fases podem coexistir por um longo tempo.
Também M.V. Lomonosov notou que uma solução diluída congela a uma temperatura inferior à de um solvente puro. Assim, a água do mar não congela a 273 K, mas a uma temperatura ligeiramente mais baixa. Numerosas experiências mostraram que tal mudança na temperatura de congelamento de uma solução pode ser considerada uma regra geral.
Os processos de congelamento e ebulição foram estudados detalhadamente por Raoult e apresentados na forma de uma lei, que mais tarde foi chamada de segunda lei de Raoult.
Consideremos a derivação mais simples desta lei. A Figura 2 mostra um diagrama que expressa a dependência da pressão de vapor saturado da temperatura acima do solvente puro e acima da solução.
A curva 0A é a dependência da pressão de vapor saturado da água pura com a temperatura.
Curva BC, DE – dependência da pressão de vapor saturado da água em soluções com diferentes concentrações da substância dissolvida
0D – expressa a dependência da pressão de vapor saturado da água sobre o gelo com a temperatura.
A partir da Figura 2 fica claro que a pressão de vapor acima da solução a 273 K é menor do que acima da água, mas não é igual à pressão de vapor acima do gelo na mesma temperatura. Somente em temperaturas abaixo de 273 K (T'z) a pressão de vapor acima da solução diminui tanto que se torna igual à pressão de vapor acima do gelo. Isso corresponde ao ponto B. Em concentrações mais altas da solução, as curvas que expressam a dependência da pressão do vapor d'água acima da solução com a temperatura estão localizadas abaixo da curva BC, mas paralelas a ela.
Vamos apresentar próxima notação:
Р 0 À – pressão de vapor acima de um solvente puro a 273 K
P A – pressão de vapor acima da solução em sua temperatura de congelamento T’z
De triângulo retângulo Nós determinamos o FOC
Na Figura 2 fica claro que, onde está a diminuição da temperatura de congelamento da solução.
Substituindo esses valores na equação acima, obtemos

 (3)
(3)
Da primeira lei de Raoult para soluções altamente diluídas temos
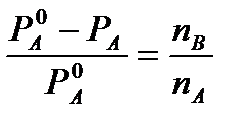
 E
E  (4)
(4)
onde n A, n B, m A mantêm as designações atribuídas anteriormente (ver acima). Se denotarmos a massa molar do solvente por M 0 A, então

Substituindo esta expressão na equação (4) obtemos

Multiplique e divida o lado direito desta expressão por 1000, então
 (5)
(5)
Vamos combinar todas as quantidades constantes na equação (5) em uma constante K (  ), obtemos a seguinte expressão
), obtemos a seguinte expressão
 (6)
(6)
Expressão  representa a molalidade da solução St.
representa a molalidade da solução St.
Substituindo esta expressão na equação (6), obtemos a equação final.
 (7)
(7)
Esta é a expressão matemática da segunda lei de Raoult: uma diminuição no ponto de congelamento ou um aumento no ponto de ebulição de uma solução é diretamente proporcional à sua concentração molar.
O coeficiente K na equação (7) é chamado de constante crioscópica, mostra a diminuição molar na temperatura de congelamento da solução, é características individuais solvente (K H2O = 1,86º) e tem a mesma dimensão que E (Kº kg mol -1)
Um método de pesquisa baseado na medição da diminuição do ponto de congelamento das soluções é denominado crioscópico. Assim como o ebulioscópico, permite calcular a massa molar da substância dissolvida

A Figura 3 mostra um dispositivo projetado para medir o ponto de congelamento de soluções.
 |
OSMOSE E PRESSÃO OSMÓTICA.
Uma propriedade biologicamente importante das soluções é a osmose.
Na natureza, as soluções são frequentemente separadas do solvente por membranas que são permeáveis apenas às partículas do solvente. Neste caso, o soluto não pode difundir-se no solvente, e apenas a transição do solvente para a solução será observada, ou seja, o solvente se moverá em ambas as direções, mas ainda assim um pouco mais dele irá para a solução do que para direção reversa.
O mecanismo de osmose é fácil de imaginar com base na destilação isotérmica. Deixe uma membrana semipermeável com microporos separar o solvente e a solução com concentração C em (Fig. 4)

Num poro limitado de um lado por um solvente e do outro por uma solução, ocorre a evaporação. Devido ao aumento da elasticidade do vapor saturado de acordo com a lei de Raoult, a pressão do vapor da fase vapor concentra-se no lado do solvente, passando para a solução.
Como resultado da osmose, o volume da solução aumenta e sua concentração diminui gradativamente; o solvente que penetra na solução através da membrana aumenta a coluna líquida he, portanto, aumenta a pressão hidrostática (ver Fig. 5). Ao mesmo tempo, o número de moléculas de solvente que se movem através da membrana na direção oposta aumentará, ou seja, da solução ao solvente. Gradualmente, a pressão hidrostática e a diluição da solução atingirão valores nos quais o número de moléculas de solvente movendo-se em ambas as direções se equalizará e ocorrerá o equilíbrio osmótico. O excesso de pressão hidrostática desenvolvido como resultado da osmose, medido por uma coluna de solução de altura h, na qual o equilíbrio osmótico é estabelecido, é denominado pressão osmótica.
![]() arroz. 5
arroz. 5
Membranas feitas de colódio, celofane, cobre-sinóxido de ferro, etc. são semipermeáveis a muitas soluções.
LEIS DA PRESSÃO OSMÓTICA.
O estudo das leis da pressão osmótica revelou sua completa analogia com as leis dos gases. Para soluções diluídas de não eletrólitos, elas podem ser formuladas da seguinte forma:
a temperatura constante, a pressão osmótica é diretamente proporcional à concentração molar do soluto (analogia com a lei de Boyle-Mariotte):

em concentração molar constante, a pressão osmótica é diretamente proporcional à temperatura absoluta (analogia com a lei de Gay-Lussac):

Destas duas leis segue-se que nas mesmas concentrações e temperaturas molares, soluções de diferentes não eletrólitos criam a mesma pressão osmótica, ou seja, soluções equimolares de não eletrólitos são isotônicas (analogia com a lei de Avogadro).
Van't Hoff propôs uma lei unificada para a pressão osmótica em soluções (semelhante à lei unificada dos gases de Mendeleev-Claiperon): A pressão osmótica de soluções diluídas de não eletrólitos é diretamente proporcional à concentração molar, coeficiente de proporcionalidade e temperatura absoluta:
já que c = n/V, onde n é o número de moles de não eletrólito e V é o volume da solução, então  ou
ou ![]()
Soluções diluídas de não eletrólitos.
Propriedades coligativas de soluções
Pressão de vapor saturado
O equilíbrio “líquido-vapor individual” é descrito pela constante de equilíbrio
K p =p sobre nós. par /a ou f (1)
Conseqüentemente, como a atividade do líquido individual a o x = 1, a pressão de vapor saturado é igual a
p o par = K p (2)
e depende apenas da temperatura.
Como a atividade do solvente é igual ao produto a o x sua fração molar N 1 ou (1 - N 2), onde N 2 é a fração molar da substância dissolvida, a constante de equilíbrio é igual a:
K p =p 1 o =(p 1 /a o x N 1)=(p 1 /1-N 2) (3)
A partir daqui obtemos Lei de Raoult (1886):
p 1 = p 1 o (1-N 2) = p 1 o N 1 (4)
(p 1 o -p 1)/p 1 o)=N 2 (5)
A pressão de vapor saturado de uma solução é igual à sua pressão acima de um solvente puro multiplicada pela fração molar do solvente.
A diminuição relativa na pressão de vapor saturado do solvente sobre uma solução pura é igual à fração molar do soluto.
Assim, a pressão de vapor já depende do teor de soluto. A lei de Raoult pode ser usada para determinar a massa molar de um soluto:
Dp/p 1 ° =N 2 =n 2 /n 1 +n 2 ≈m 2 M 1 /m 1 M 2 (6)
Ponto de ebulição das soluções
Um líquido entra em ebulição quando a pressão de vapor saturado se torna igual à pressão externa. Como, de acordo com a lei de Raoult, a pressão de vapor acima da solução é menor que a pressão de vapor acima do solvente puro, o ponto de ebulição da solução é superior ao ponto de ebulição do solvente puro.
Experimentos mostraram que para soluções diluídas de não eletrólitos:
onde DT é o aumento do ponto de ebulição da solução em comparação com um solvente puro, b é a molalidade ([E] = K. Kg/mol) E é a constante ebulioscópica (de ebbulio (lat.) - fervura), dependendo apenas nas propriedades do solvente (sua temperatura de ebulição T o e calor específico de evaporação L 1):
E=RT o 2 /1000L 1 (8)
O ponto de ebulição de um solvente puro tem um certo valor a uma pressão externa fixa. O ponto de ebulição de uma solução não é constante - aumenta à medida que ferve, pois devido à evaporação do solvente a concentração da solução aumenta. Ao mesmo tempo, a pressão do vapor saturado diminui constantemente. Portanto, o ponto de ebulição de uma solução é considerado a temperatura correspondente ao aparecimento da primeira bolha de vapor nela.
Ponto de congelamento de soluções
Acima de uma solução, a pressão de vapor do solvente é inferior à pressão de vapor acima do solvente puro. A pressão de vapor acima das fases sólida e líquida também será menor. Isso só pode acontecer em um ponto de congelamento mais baixo da solução em comparação com um solvente puro. A diminuição do ponto de congelamento de soluções não eletrolíticas em relação ao ponto de congelamento de um solvente puro é proporcional à molalidade da solução:
onde K é a constante crioscópica (do grego “krios” - frio), dependendo apenas das propriedades do solvente:
K=RT o 2 /1000L 1, (10)
onde T o, L * 1 é o ponto de congelamento e o calor específico de fusão de um solvente puro.
Como a concentração da substância dissolvida aumenta com a solidificação do solvente, o ponto de congelamento da solução não é constante e diminui durante o processo. Portanto, a temperatura de formação do primeiro cristal é considerada a temperatura de congelamento da solução.
A Tabela 2 mostra os valores de E e K para alguns solventes.
Tabela 2.
Os cristais do solvente estarão em equilíbrio com a solução somente quando a pressão do vapor saturado acima dos cristais e acima da solução for a mesma. Como a pressão de vapor do solvente acima da solução é sempre inferior à pressão acima do solvente puro, a temperatura correspondente a esta condição será sempre inferior ao ponto de congelamento do solvente puro. Neste caso, a diminuição do ponto de congelamento da solução ΔT não depende da natureza da substância dissolvida e é determinada apenas pela razão entre o número de partículas do solvente e da substância dissolvida.
Pode-se mostrar que a diminuição na temperatura de congelamento de uma solução ΔT é diretamente proporcional à concentração molar da solução:
Segunda lei de Raoult: Um aumento no ponto de ebulição e uma diminuição na solução de Tzam são proporcionais ao número de partículas da substância dissolvida e não dependem de sua natureza.
Fim do trabalho -
Este tópico pertence à seção:
Aula nº 5. Equilíbrio de fases. Soluções não eletrolíticas
O estado gasoso de uma substância é caracterizado pela fraca interação entre as partículas e grandes distâncias entre elas. Portanto, os gases se misturam... A pressão total de uma mistura gasosa é igual à soma das pressões parciais de todos os componentes...
Se você precisar material adicional sobre este tema, ou não encontrou o que procurava, recomendamos utilizar a busca em nosso banco de dados de obras:
O que faremos com o material recebido:
Se este material foi útil para você, você pode salvá-lo em sua página nas redes sociais:
| Tuitar |
Todos os tópicos nesta seção:
Aula nº 5. Equilíbrio de fases. Soluções não eletrolíticas.
Equilíbrio de fases.
Na última aula vimos o equilíbrio químico, a constante de equilíbrio, a sua relação com etc. quantidades e fatores que influenciam a mudança no equilíbrio.
Sistemas de dois componentes.
Uma solução é um sistema homogêneo que consiste em dois ou mais componentes, cuja composição pode mudar continuamente dentro de certos limites sem mudanças bruscas em suas propriedades.
A formação de uma solução é um processo físico e químico complexo. O processo de dissolução é sempre acompanhado por um aumento na entropia do sistema; Quando as soluções são formadas, muitas vezes há uma liberação de
Solubilidade
O processo de dissolução está associado à difusão, ou seja, à distribuição espontânea de partículas de uma substância entre partículas de outra. Quando um soluto é adicionado a um solvente, o processo de dissolução
Solubilidade de gases em líquidos
A solubilidade dos gases em líquidos depende de uma série de fatores: a natureza do gás e do líquido, pressão, temperatura, concentração de substâncias dissolvidas no líquido (especialmente a solubilidade dos gases).
Soluções não eletrolíticas.
As propriedades das soluções são consideradas a partir do exemplo das soluções diluídas, em cuja formação os efeitos térmicos e de volume são iguais a 0 (soluções ideais). Em tais soluções, a partícula está localizada a uma grande distância
A diminuição relativa na pressão de vapor saturado acima de uma solução é igual à fração molar do soluto.
Qualquer líquido começa a ferver a uma temperatura na qual a pressão de vapor saturado atinge a pressão externa. T fervura - T na qual a pressão do vapor = 101,3 kPa A água ferve a 100 C,
Pressão osmótica
Se duas soluções com concentrações diferentes são separadas por uma partição semipermeável que permite a passagem de moléculas de solvente, mas impede a passagem de partículas de soluto, observarei
