Hidrocarbonetos alifáticos. Tipos de solventes.
Substâncias como solventes são regularmente utilizadas tanto na vida cotidiana quanto na indústria. Eles definitivamente serão necessários no processo. trabalho de reparação em casa, e não há nada a dizer sobre grandes empresas de produção, alguns processos simplesmente não são possíveis sem o uso de solventes.
O que é um solvente e qual a sua finalidade?
Um solvente é um líquido que evapora rapidamente Substância química ou uma mistura de diversas substâncias de natureza orgânica, que tem a capacidade de dissolver substâncias orgânicas viscosas, formando assim uma mistura homogênea.
Basicamente, o solvente destina-se a revestimentos de tintas e vernizes, nomeadamente para lhes dar a consistência desejada antes da utilização. Alguns corantes não podem ser utilizados sem solvente, por exemplo, aqueles que possuem alta concentração e são armazenados em recipientes especiais.

Um solvente de alta qualidade, com base na sua finalidade, deve atender aos seguintes requisitos:
- fácil de misturar com tinta até ficar homogêneo;
- após a aplicação da tinta ou verniz, o solvente deve evaporar rapidamente;
- quando misturado com o concentrado de corante, o solvente não deve começar a reagir com eles;
- as propriedades do solvente não devem mudar quando em contato com a água.
Em suma, a finalidade do solvente pode ser caracterizada da seguinte forma: garantir a comodidade de aplicação do corante na superfície e posterior desaparecimento rápido e imperceptível. Também são utilizados antes do início dos trabalhos de pintura, desengorduramento de superfícies de trabalho e também após a conclusão da limpeza da ferramenta.
Cada item da linha de tintas e vernizes exige a utilização de um determinado tipo de solvente. É necessário garantir que o solvente corresponda ao tipo de tinta para conseguir a formação de uma substância homogênea que não se desintegre em seus componentes e possibilite sua distribuição na área desejada.
Tipos de solventes
Os solventes são divididos em dois tipos:
- orgânico;
- inorgânico.

Os solventes orgânicos são os mais populares em comparação aos inorgânicos e, de acordo com suas características físicas, apresentam-se nos seguintes tipos:
- difícil de volatilizar, por exemplo terebintina. São aplicáveis para esmaltes e vernizes;
- moderadamente volátil, por exemplo querosene. Eles são mais frequentemente usados para corantes a óleo e acrílicos;
- altamente volátil, por exemplo gasolina, aguarrás, solvente. São utilizados para esmaltes, vernizes, tintas acrílicas e oleosas. Ao interagir com este grupo de solventes, você deve ser extremamente cuidadoso e ter cuidado porque substâncias altamente voláteis são extremamente explosivas.
Na maioria das vezes são substâncias líquidas móveis e com odor forte, o que é uma das principais desvantagens.
Não incluído na lista solventes orgânicos inclui:
- água;
- amônia líquida;
- enxofre, fósforo e outros sais.

Os solventes orgânicos, ao contrário dos inorgânicos, apresentam uma série de desvantagens graves, incluindo um odor persistente que não desaparece por muito tempo e vapores tóxicos inflamáveis, que também podem levar a intoxicações graves.
Mas, infelizmente, os corantes solúveis em água, mais procurados no exterior, ainda não são muito procurados em nosso país devido à perda de qualidade durante o armazenamento no rigoroso clima russo.
Revisão dos solventes mais utilizados em nosso país, suas propriedades
Os solventes orgânicos, apesar de suas propriedades nada seguras, são amplamente utilizados na Rússia, o que não pode ser dito sobre seus equivalentes inorgânicos. Os solventes são divididos em três grupos:
- Hidrocarbonetos;
- álcool;
- ésteres.
A seguir veremos os recursos e propriedades dos mais comuns deles. Os solventes de hidrocarbonetos incluem:
- O espírito branco é um líquido oleoso e incolor. É extremamente inflamável e tem um odor semelhante ao do querosene. Suas propriedades dissolventes não são muito altas, mas, apesar de tudo, o aguarrás ainda é muito procurado devido ao seu relativo baixo custo e não toxicidade.
- Benzeno de petróleo. Um líquido que não tem cor, evapora rapidamente e não é solúvel em água. Também possui odor forte, como todas as substâncias do grupo orgânico. O benzeno do petróleo é compatível com compostos de hidrocarbonetos. Libera vapores tóxicos e inflamáveis e torna-se explosivo em contato com o ar.
- Terebintina. É dividido em goma e coto. Zhivichny é o melhor. É um líquido amarelo claro e de cheiro forte usado para diluir massas e tintas e vernizes à base de óleo.
- Gasolina. Produto do refino do petróleo, possui propriedades inflamáveis e evapora facilmente. Quando uma certa quantidade de vapor no ar é atingida, ele pode detonar.

Os solventes de álcool incluem o seguinte:
- Etanol. É líquido, não tem cor, mas tem um cheiro reconhecível. Não deve conter várias partículas estranhas. Seus vapores podem causar intoxicações graves se grandes quantidades entrarem no trato respiratório. Não só é altamente inflamável quando exposto ao fogo ou faísca, mas também pode inflamar-se simplesmente quando exposto a altas temperaturas.
- Álcool butílico. Utilizado como diluente para vernizes de nitrocelulose. O revestimento adquire brilho, fica mais liso e também menos suscetível ao branqueamento.
- Álcool metílico (metanol). Substância líquida transparente, geralmente contendo uma mistura de éteres e acetona. É extremamente venenoso.
- Etilenoglicol. Líquido transparente, viscoso e inodoro. Forma um composto homogêneo com água. Evapora por muito tempo, o que o torna indispensável no trabalho com nitro vernizes, cujo revestimento é brilhante, liso e fácil de polir.
Os ésteres são representados pelo seguinte grupo de solventes:
- Acetato de metila. Uma substância líquida, móvel, de rápida evaporação, com propriedades inflamáveis e tóxicas. Ferve a uma temperatura de 56-58 graus.
- Acetato de etila. Não evapora tão rapidamente, ferve a uma temperatura de 77-82 graus e tem um cheiro agradável.
- Acetato de butilo. É líquido, tem tonalidade amarelada, evapora por muito tempo e por isso é utilizado caso seja necessário aumentar o tempo de secagem do revestimento.
- Acetato de amila. Transparente, líquido, tem cheiro agradável, evapora lentamente. Assim como o acetato de butila é usado para retardar a secagem.
- Acetona. Possui odor característico e muito desagradável, é extremamente volátil e inflamável.
- Misturas de solventes. Para diluir vernizes nitro concentrados até o grau de viscosidade desejado, são utilizadas misturas de solventes do grupo dos ésteres. Em que propriedades de qualidade o revestimento depende diretamente dos elementos da composição. Por exemplo, se contiver maior número solventes que evaporam rapidamente, o revestimento pode ficar turvo, mas se você fizer uma mistura de substâncias que retardam o tempo de secagem, o revestimento ficará brilhante, liso e sem turvação.
Visão geral dos solventes numerados
A variedade de solventes é tão grande que, para distingui-los, alguns deles passaram a receber números que permitem navegar pelos nomes e fazer uma escolha. Vejamos os mais comuns deles:
- O solvente 4 (R-4) é amplamente utilizado. Na verdade, é uma mistura que contém acetona e tolueno. O P-4 é utilizado principalmente para vernizes e tintas alquídicas, bem como esmaltes à base de polímeros clorados. Os componentes presentes no solvente são selecionados de modo a proporcionar Influência positiva na consistência e formação do revestimento de substâncias formadoras de filme.
Se necessário, também pode ser utilizado para desengordurar a superfície antes da aplicação do revestimento, mas se possível, é preferível utilizar outro solvente para esse fim. R-4 é extremamente volátil.

É inflamável; ao trabalhar com ele, deve-se ter cuidado e utilizar equipamentos de proteção individual.
- Ainda mais popular é o solvente 646, indispensável tanto na vida cotidiana quanto na indústria. É aplicável tanto para dissolução quanto como desengraxante, e é utilizado em diversas áreas, inclusive em oficinas de automóveis. O Solvente 646 possui excelentes características de qualidade. Inclui toda uma lista desses componentes, graças aos quais se torna multifuncional e pode dissolver diversos compostos químicos.
O solvente 646 tem coloração amarelada e odor pungente e evapora rapidamente. Contém hidrocarbonetos aromáticos, cetonas, álcoois e éteres. Ao usá-lo você precisa ter muito cuidado porque... por causa dele ótima atividadeÉ fácil estragar as camadas anteriores de tinta. Às vezes, por causa dessa propriedade, o solvente 646 é até substituído por outros mais fracos.
Sem ele é impossível fabricar e utilizar diversos tipos de tintas e vernizes. O solvente 646 é usado durante a produção deste produto ou diluído até a consistência desejada antes do uso. Também é indispensável para diluir certas massas.
A tinta diluída com solvente 646 torna-se brilhante e lisa quando seca. Os revestimentos de esmalte e verniz em que foi utilizado, quando aplicados, fixam-se com facilidade e rapidez, formando um filme. Quando o solvente 646 evapora, o odor desaparece.
Outra vantagem pela qual o consumidor se apaixonou por este solvente é o preço, que, apesar de todas as suas características positivas, é bastante baixo, bem como a sua disponibilidade - você pode comprar o solvente 646 em todos os supermercados de construção.
- O solvente 2 (RS-2) também possui boas propriedades. É um líquido transparente com uma tonalidade amarelo pálido. Evapora rapidamente. Contém xileno e aguarrás. Eles são usados para dissolver vernizes a óleo, tintas betuminosas e esmaltes pentaftálicos. Emite vapores extremamente tóxicos. Ao trabalhar com o RS-2, você deve sempre proteger a pele, o trato respiratório e os olhos. Os vapores também têm um efeito prejudicial no sistema nervoso, órgãos internos, sangue e medula óssea, entrando no corpo não apenas pelo trato respiratório, mas também pela pele.
Além dos efeitos internos, uma substância também pode ter efeitos externos, por exemplo, causando erupção na pele após contato prolongado.
A substância é inflamável; se o vapor se acumular no ar, poderá ocorrer uma explosão.
Áreas de uso de solventes
Conforme observado acima, o solvente de tinta é necessário para os seguintes trabalhos:
- diluição de esmalte e tintas espessadas ou altamente concentradas;
- limpar objetos ou roupas com tinta manchada;
- ferramentas de limpeza utilizadas para aplicação de revestimentos de tintas e vernizes.
Os solventes são usados em muitos campos. É diferente para cada tipo. Por exemplo, a acetona é utilizada com sucesso na síntese de policarbonatos, resinas epóxi e poliuretanos. É utilizado para dissolver óleos, resinas naturais, poliacrilatos, borracha clorada, bem como gorduras, ceras e borracha.
O espírito branco é adequado para qualquer material de tinta e verniz. Adequado para tintas a óleo, vernizes, esmaltes, primers, mastiques automotivos. Eles desengorduram superfícies e limpam ferramentas.

Querosene, gasolina e outros hidrocarbonetos são usados para dissolver gorduras, óleos, parafinas e ceras.
Solventes pertencentes ao grupo dos ésteres, por exemplo acetato de etila, acetato de butila, dissolvem resinas sintéticas polares, cerrisina.
Solventes do grupo dos álcoois, etílico, butílico, metílico e outros, são utilizados para a produção de vernizes, bem como para dissolução de resinas de poliéster e nitrocelulose.
Regras para trabalhar com solventes
Quase todos os solventes orgânicos têm vários graus de impacto na saúde humana, dependendo do tipo. Para não sofrer com vapores tóxicos ao trabalhar com eles, você deve seguir rigorosamente as precauções de segurança:
- utilizar equipamentos de proteção individual durante o trabalho, como luvas, respirador, óculos de segurança, etc.;
- se a substância entrar em contato com a pele, deve ser lavada imediatamente antes que tenha tempo de agir ou tenha efeito mínimo;
- garantir o acesso a uma quantidade suficiente de ar fresco;

- É necessário controlar a temperatura do ambiente, pois alguns solventes tornam-se explosivos quando em contato com o ar quente;
- A inflamabilidade e a inflamabilidade destas substâncias também devem ser levadas em consideração; trabalhar perto de chamas abertas é inaceitável, ou simplesmente a presença de objetos quentes nas proximidades também é perigosa;
- Os solventes devem ser armazenados em local fresco, em pequenos frascos ou latas, que devem ter rótulos;
- Todos os recipientes devem ser posicionados com as rolhas voltadas para cima, não devem ser colocados de lado ou com as rolhas voltadas para baixo;
O artigo é dedicado a diversos aspectos do uso de solventes em processos tecnológicos de fabricação de equipamentos eletrônicos e muito mais.
informações gerais
Solventes são compostos químicos individuais ou suas misturas capazes de converter várias substâncias em solução. Por sua vez, as soluções são homogêneas sistemas homogêneos, consistindo em dois ou mais componentes, cuja composição pode mudar continuamente dentro de certos limites. O componente predominante é chamado de solvente, os demais são chamados de solutos. Existem soluções gasosas, líquidas e sólidas. Os gases incluem ar, gases naturais inflamáveis, etc. Na prática, muitas vezes temos que lidar com soluções líquidas.
Normalmente, os solventes são usados como meios para conduzir reações químicas ou para fins tecnológicos. A formação de soluções altera significativamente as condições para a ocorrência de reações químicas entre os componentes. Além disso, muitos processos só podem ocorrer em soluções. Os solventes criam um ambiente homogêneo, proporcionando contato entre as partículas reagentes (íons, moléculas), e também influenciam o mecanismo das reações químicas, sua velocidade, estabelecimento do equilíbrio, etc. Nas reações exotérmicas, os solventes, ao diluir as substâncias reagentes, ajudam a remover o excesso aquecer. Como ferramenta tecnológica, os solventes são amplamente utilizados em diversos campos da tecnologia (na produção de vernizes e tintas, explosivos, produtos farmacêuticos, perfumes, agricultura, etc.). Os solventes são amplamente utilizados na maioria das micro e macrotecnologias utilizadas na produção de equipamentos eletrônicos.
Como todos os compostos químicos, os solventes são divididos em inorgânicos e orgânicos. O solvente inorgânico mais importante é a água. Solventes inorgânicos menos conhecidos são haletos de baixo ponto de fusão (por exemplo, BrF3), oxohaletos (por exemplo, cloreto de sulfurila, cloreto de tionila), solventes contendo nitrogênio (amônia líquida), etc.
Os solventes podem ser classificados de acordo com a sua propriedades físicas.
Os solventes com ponto de ebulição inferior a 100 °C são classificados como de baixo ponto de ebulição e aqueles com ponto de ebulição acima de 150 °C são classificados como de alto ponto de ebulição.
De acordo com o grau de volatilidade, os solventes são divididos em altamente voláteis, moderadamente voláteis e difíceis de voláteis.
Dependendo da viscosidade, os solventes são divididos em baixa viscosidade (menos de 2 mPa-s), média viscosidade (2-10 mPa-s) e alta viscosidade (mais de 10 mPa-s).
De acordo com a presença/ausência de momento dipolar e o valor da constante dielétrica, os solventes polares e apolares são diferenciados. Dependendo da constante dielétrica e das propriedades doador-aceitador, distinguem-se quatro grupos de solventes.
1. Solventes próticos (água, álcoois, ácidos carboxílicos, etc.). Eles são doadores de prótons e possuem alta constante dielétrica (ε > 15).
2. Solventes bipolares apróticos (algumas amidas apróticas, cetonas, sulfóxidos). Eles têm uma alta constante dielétrica, mas não possuem propriedades doadoras-aceitadoras.
3. Solventes doadores de elétrons (éteres).
4. Solventes apolares com baixa constante dielétrica (ε< 15). Это сероуглерод, углеводороды. Такие растворители не обладают донорно-акцепторными свойствами ни по отношению к протонам, ни по отношению к электронам.
Dependendo das propriedades ácido-base, os solventes podem ser ácidos (ácido acético), básicos (piridina), neutros (benzeno).
Existem muitas opções para classificar solventes, assim como para quaisquer compostos químicos.
Molécula Milagrosa
Sem hesitar, podemos dizer que o solvente mais comum na Terra é a água. Às vezes até dizem que seria mais correto chamar nosso planeta de Água. A razão é simples: a água ocupa cerca de 70% da superfície do globo. A quantidade de água na Terra é estimada em 1,39T0 18 toneladas. Os cientistas, para provar que a vida (vida orgânica) é possível em um ou outro canto do Universo, procuram ali vestígios de água. E eles encontram! Moléculas de água foram descobertas no espaço interestelar. A água faz parte dos cometas e da maioria dos planetas sistema solar. O que é essa molécula incrível, maravilhosa e até certo ponto insubstituível?
A chamada fórmula bruta da água (H 2 0) é conhecida até por um estudante pobre. A estereometria, ou mais precisamente, a planimetria desta molécula é dada abaixo.
L. Salem no livro “The Wonderful Molecule” usa uma comparação de uma molécula de água com um pêssego ao qual estão ligados dois damascos. O pêssego localizado no centro é um átomo de oxigênio. Os dois pequenos damascos nas laterais são átomos de hidrogênio. Os átomos de hidrogênio e oxigênio estão localizados nos cantos Triângulo isósceles. Para estimar o tamanho de uma molécula de água, basta fornecer o comprimento Conexões ON. É igual a 0,0957nm.
Como os átomos de hidrogênio e oxigênio têm eletronegatividades diferentes e as ligações químicas O-H estão localizadas em um ângulo diferente de 180° (104,5°), a molécula de água é polar (dipolo). Além disso, também é polarizável. Essas propriedades determinam em grande parte o comportamento da água ao interagir com outros compostos químicos.
A água tem uma constante dielétrica muito alta. À temperatura ambiente ε = 78,3. A água absolutamente pura é um isolante bastante bom: a resistência de isolamento volumétrica específica da água a 0°C é 1,47-10 ohm-m, a 50°C - 18,9 10 -6 ohm-m. Pode-se até dizer que é um excelente isolante, mas isso é dificultado pelo fato de que uma pequena fração das moléculas de água (cerca de 1 em 5-10 -9) sofre dissociação eletrolítica de acordo com o esquema:
![]()
A concentração de íons H + (na verdade H 3 0 +) e a concentração associada de íons OH + são caracterizadas pelo índice de hidrogênio (pH do ambiente). Na prática, as características de condutividade da água são muito mais influenciadas pelos sais, ácidos e bases nela dissolvidos - companheiros constantes da água não idealmente pura, mas real. Mesmo uma pequena concentração desses componentes é suficiente para que a água, como num passe de mágica, passe de dielétrico a condutor.
A água é um composto químico, sem mencionar o qual é impossível explicar o significado de conceitos como hidrofilicidade e hidrofobicidade. Hidrofilicidade e hidrofobicidade são características da interação entre uma substância e a água. Se uma substância e a água têm estrutura próxima uma da outra e interagem fortemente entre si, por exemplo formando ligações de hidrogênio, então elas falam de hidrofilicidade. Quando a interação entre uma substância e a água é fraca, ela é considerada hidrofóbica. Uma medida da intensidade da interação intermolecular é a tensão superficial na fronteira entre uma substância e a água. As moléculas de água, tendo um grande momento dipolar, interagem fortemente entre si para formar ligações de hidrogênio. Mesmo no vapor de água a baixas temperaturas e pressões moderadas existe cerca de 1% de dímeros de água.
A água é um excelente solvente. Dissolve bem substâncias polares e substâncias que se dissociam em íons. Do ponto de vista da reatividade, a água é uma substância bastante inerte. Mas algumas substâncias, dissolvendo-se na água, reagem com ela. Assim, os gases NH 3 e S0 2, dissolvendo-se em água, transformam-se em íons NH 4 + e S0 3 2+.
Solventes orgânicos
A água é o solvente inorgânico mais comum. Mas entre os solventes orgânicos não há candidatos a uma posição de liderança. Só podemos destacar um grupo dos chamados solventes de petróleo, que recentemente foram abreviados como nefrases. Frações estreitas de destilação direta ou frações isoladas de produtos de reciclagem de petróleo são usadas como solventes de petróleo.
A maioria dos solventes de origem petrolífera têm nomes historicamente estabelecidos, muitas vezes completamente alheios à sua composição e à natureza química dos compostos incluídos na sua composição. Em alguns casos, os nomes desses solventes não apenas não informam, mas até desinformam os usuários sobre sua composição. Um exemplo real é o espírito branco. Livre do conhecimento Em inglês eles se esforçam para corrigir o “erro” e chamam isso de “álcool branco”. Até certo ponto eles estão certos. Na verdade, traduzido literalmente do inglês, espírito branco significa “álcool branco”. Mas esse nome, aparentemente, reflete apenas uma semelhança externa. A composição química do white spirit é muito ampla: hidrocarbonetos saturados, hidrocarbonetos naftênicos, pequena quantidade compostos aromáticos, etc. Mas, infelizmente, falta o componente álcool.
No esforço de agilizar e unificar os nomes dos solventes de origem petrolífera, surgiu o nome nefras. Com base na sua composição de hidrocarbonetos, as nefrases são divididas nos seguintes tipos:
- nefras C - solventes de composição mista, nos quais estão presentes hidrocarbonetos de todas as classes;
- nefras A - solventes com predominância de hidrocarbonetos alifáticos e reduzido teor de hidrocarbonetos aromáticos (não mais que 2,5%);
- nefras I - solventes com predominância de hidrocarbonetos isoparafínicos;
- nefras P - solventes com predominância de hidrocarbonetos parafínicos;
- nefras N - solventes com predominância de hidrocarbonetos naftênicos;
- As nefrases AP são solventes com predominância de hidrocarbonetos aromáticos.
Como as nefrases não são solventes individuais, elas não possuem um ponto de ebulição fixo. Eles fervem em uma determinada faixa de temperatura. Este intervalo também é indicado em seu nome.
Assim, por exemplo, um solvente de acordo com esta classificação é denominado A 130/150. Isso significa que o solvente é uma mistura de hidrocarbonetos com predominância de compostos alifáticos e reduzido teor de compostos aromáticos, fervendo na faixa de temperatura de 130 a 150°C.
EM símbolo As gasolinas solventes BR-1 (SZ 80/120) e BR-2 (S2 80/120) amplamente utilizadas na produção de equipamentos eletrônicos têm mais um valor. O fato é que o grupo dos solventes do tipo misto (C), dependendo do teor de compostos aromáticos, é dividido em subgrupos:
- 0 - menos de 0,1%;
- 1 - de 0,1% a 0,5%;
- 2 - de 0,5% a 2,5%;
- 3 - de 2,5% a 5,0%;
- 4 - de 5,0% a 25,0%;
- 5 - de 25,0% a 50,0%.
Dizem que as gasolinas BR-1 e BR-2 são intercambiáveis. Na verdade, a sua composição faccional é próxima. Mas se estes solventes forem utilizados para lavar ou desengordurar algo que seja excessivamente sensível aos solventes activos, deve ser dada preferência a estes últimos. Contém menos hidrocarbonetos aromáticos. Além disso, é menos tóxico. Se a seletividade não for o principal requisito para um solvente, então a resposta será obviamente diferente.
Pensamentos semelhantes surgem em relação ao espírito branco. O solvente nacional contém muito mais compostos aromáticos do que o seu homólogo estrangeiro (até 16%). A aguardente purificada de compostos aromáticos quase não tem odor, mas seu poder de dissolução é muito menor.
Ao contrário dos solventes de petróleo, os solventes orgânicos individuais são caracterizados por constantes de suas propriedades físicas. Embora os solventes técnicos também sejam caracterizados por uma certa faixa dentro da qual essas propriedades variam. Mas esta faixa é muito menor que a dos solventes de petróleo. Quase todas as classes conhecidas são ricas em solventes compostos orgânicos: hidrocarbonetos saturados; hidrocarbonetos clorados; compostos aromáticos; álcoois; éteres e ésteres; cetonas, etc. As propriedades físicas de alguns dos solventes orgânicos mais comuns são fornecidas na Tabela 1.
Termodinâmica de soluções
Soluções de compostos de baixo peso molecular e/ou de alto peso molecular são sistemas reversíveis. Eles obedecem à regra de fases de Gibbs e podem ser descritos por diagramas de fases convencionais.
A dissolução é um processo espontâneo e é acompanhada por uma diminuição do potencial isobárico-isotérmico (ΔG):
Onde ΔH- mudança no conteúdo de calor (entalpia) do sistema, ΔS- mudança na entropia do sistema, T - temperatura absoluta, R- pressão.
A solubilidade dos compostos químicos em solventes é determinada pela afinidade termodinâmica, cuja medida é a diferença entre os potenciais isobárico-isotérmicos da solução e a soma dos potenciais isobárico-isotérmicos dos componentes:
Quanto maior o valor absoluto de ΔG da mistura, maior a afinidade entre os componentes, melhor será a solubilidade.
Se nos afastarmos das equações, podemos dizer que durante a dissolução prevalece o princípio “semelhante se dissolve em semelhante”. O valor máximo de ΔG da mistura será se o soluto e o solvente forem tão semelhantes quanto possível entre si. Regra geral: as substâncias hidrofílicas dissolvem-se melhor em solventes hidrofílicos e as substâncias hidrofóbicas dissolvem-se melhor em solventes hidrofóbicos. Portanto, as tentativas de dissolver a cola de papel de parede na gasolina estarão sempre fadadas ao fracasso. A termodinâmica argumenta contra isso.
Equilíbrio hidrofílico-hidrofóbico
Um dia, um tecnólogo que eu conhecia se aproximou de mim, intrigado com o comportamento ilógico, em sua opinião, do verniz alquídico melamínico. A ilogicidade se expressava no fato de que era necessário reduzir sua viscosidade, mas não queria se dissolver. Quando questionado com o que você tentou dissolvê-lo, a resposta foi: “O que é recomendado no rótulo - aguarrás”. Como você pode ter certeza de que o verniz não quer se dissolver naquilo em que deveria se dissolver? Não há necessidade de inventar nada novo para resolver o problema. A solução já existe; você precisa tentar replicá-la virtualmente, limitando-se apenas ao fato de poder utilizar apenas os recursos internos do sistema.
Quando questionado sobre o que você fez com esse verniz, a resposta foi: “O verniz era usado anteriormente para impregnar transformadores”. A presença de transformadores no verniz provavelmente não poderia levar a consequências tão “graves”. Depois de esclarecer a dúvida, descobriu-se que se tratava de impregnação a vácuo de transformadores. Nesta fase, a razão para um fenómeno tão inesperado já estava 90% clara para mim. E depois que olhei quais solventes foram usados inicialmente no verniz, 90% já havia se transformado em 100%.
As moléculas do ligante polimérico (oligomérico) dos vernizes alquídicos melamínicos contêm fragmentos hidrofóbicos e hidrofílicos. Portanto, esses vernizes utilizam uma mistura de solventes (aguarrás ou seus análogos e butanol). O primeiro é responsável pela dissolução dos fragmentos hidrofóbicos do ligante, e o segundo é responsável pela dissolução dos hidrofílicos.
Em condições normais, é predominantemente o solvente mais volátil que evapora. EM nesse caso- espírito branco ou seus análogos. Portanto, os fabricantes recomendam diluir o verniz com aguarrás ao engrossar. Mas se o verniz for exposto ao vácuo, um solvente menos volátil, o butanol, também evapora. E adicionar apenas aguarrás não é mais suficiente para dissolver o verniz espessado. Os grupos hidrofílicos do verniz aglutinante também requerem um solvente de natureza química semelhante a eles.
Resumindo, podemos dizer que os polímeros ou oligómeros (os ligantes da maioria das tintas e vernizes) contêm fragmentos hidrofóbicos e hidrofílicos nas suas cadeias moleculares. Metil, etil e outros radicais hidrocarbonetos são responsáveis pelas propriedades hidrofóbicas. Hidroxila, carboxila e outros grupos polares são hidrofílicos. Portanto, os solventes também devem incluir componentes com propriedades predominantemente hidrofóbicas (aguarrás, tolueno, solvente, etc.) e componentes com afinidade por água (etanol, celosolve de etila, acetona, acetato de etila, etc.). E a sua combinação é determinada pela natureza química do verniz de ligação. Para a obtenção de alguns vernizes, o conjunto de solventes universais “registrados” (Tabela 2) é insuficiente. Portanto, você terá que inventar suas próprias combinações exclusivas de componentes solventes. O equilíbrio hidrofílico-hidrofóbico também pode ser realizado dentro das moléculas de um solvente.
Problemas semelhantes ocorrem em tecnologias para limpeza de contaminação de conjuntos de circuitos impressos. No caso geral, estes últimos também diferem na sua polaridade e, consequentemente, na hidrofilicidade/hidrofobicidade. Na conhecida mistura álcool-gasolina, o primeiro componente é responsável pela dissolução de contaminantes hidrofílicos (principalmente resíduos de colofónia), e o segundo componente é responsável pela dissolução de contaminantes hidrofóbicos (gorduras, etc.). No álcool isopropílico (a base de muitos líquidos de limpeza fabricados no exterior), o equilíbrio hidrofílico-hidrofóbico é realizado principalmente dentro de uma molécula.
Soluções de polímero
Soluções de polímeros e seus análogos de baixo peso molecular (oligômeros) serão de interesse principalmente para especialistas envolvidos na aplicação de revestimentos poliméricos e vedação de equipamentos eletrônicos com materiais poliméricos.
Tabela 1. Propriedades físicas de alguns solventes orgânicos individuais
Tabela 2. Receita de alguns solventes e diluentes “registrados”
As soluções poliméricas possuem uma série de características em comparação com soluções de compostos de baixo peso molecular devido às propriedades específicas das macromoléculas: tamanhos grandes, uma ampla gama de flexibilidade, um grande conjunto de conformações (configurações espaciais), capacidade de alterar conformações ao mudar de temperatura ou mudar de solvente, etc. As soluções poliméricas são caracterizadas por alta viscosidade, difusão lenta, possuem tixotropia, etc. , por um lado, complica o trabalho com eles e, por outro lado, oferece muito mais oportunidades potenciais.
Uma característica do processo de dissolução de compostos de alto peso molecular é o seu inchaço. A taxa de difusão das macromoléculas é muito menor que a taxa de difusão das moléculas do solvente. Portanto, estas últimas penetram mais rapidamente na fase polimérica do que as macromoléculas no solvente. Como resultado, o volume do polímero aumenta bastante. O inchaço nem sempre termina em dissolução. Se o polímero e o solvente se misturam até certo ponto, no final do processo formam-se duas fases: uma solução saturada do polímero no solvente e uma solução saturada do solvente no polímero. Com uma mudança nas condições, como a temperatura, a dissolução limitada pode tornar-se ilimitada e vice-versa.
Polímeros de estrutura espacial (tridimensional) em Melhor cenário possível só pode inchar. Disponibilidade ligações químicas impede que as macromoléculas se separem umas das outras e entrem em solução.
Na prática, ao preparar soluções poliméricas, as especificidades de sua dissolução são levadas em consideração sem introduzir todo o solvente na solução de uma só vez. Caso contrário, uma casca inchada se formará na superfície do polímero, impedindo a penetração adicional do solvente. Acho que quem tentou preparar adesivos para papel de parede à base de amido, carboximetilcelulose e outros polímeros solúveis em água de uma só vez enfrentou esse problema.
O equilíbrio de fases no sistema polímero-solvente é estabelecido pela regra de fases de Gibbs:
onde C é o número de graus de liberdade no sistema, K é o número de componentes, F é o número de fases.
A regra das fases determina o estado do sistema no momento de equilíbrio, independentemente do caminho ao longo do qual o sistema se aproximou desse estado. O número de graus de liberdade C indica quantas variáveis que determinam o estado do sistema podem ser alteradas arbitrariamente sem alterar o número de fases.
Desta equação segue-se que em sistemas de dois componentes o número máximo de graus de liberdade é três. Isto significa que o estado do sistema polímero-solvente é completamente determinado pela temperatura, pressão e concentração do polímero. Como o equilíbrio em sistemas condensados é quase independente da pressão, a regra das fases pode ser escrita de forma simplificada:
Um sistema monofásico possui dois graus de liberdade. Se houver duas fases, o sistema terá apenas um grau de liberdade. Isto significa que uma mudança na temperatura leva automaticamente a uma mudança na concentração em ambas as fases.
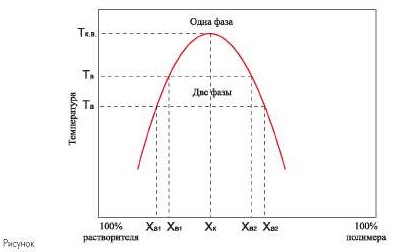
A figura mostra uma curva típica de equilíbrio de fase em um sistema polímero-solvente de dois componentes.
A curva de equilíbrio de fase separa a região de dissolução ilimitada da região de dissolução limitada.
Na região de dissolução limitada, por exemplo no ponto “a”, o número de fases é 2 e o número de graus de liberdade é 1. O estado do sistema é determinado exclusivamente pela temperatura ou concentração. No ponto “a” a solução polimérica é caracterizada pela temperatura Ta e composição das fases: fase 1 - x a1 e fase 2 - x a2. À medida que a temperatura aumenta, as concentrações das soluções em ambas as fases começam a se aproximar e os volumes das fases também mudam. Quando a temperatura Tkv (crítica superior) é atingida, as composições de ambas as fases são equalizadas e ocorre uma transição de um sistema bifásico para um sistema monofásico - uma solução homogênea do polímero no solvente. O resfriamento de um sistema monofásico levará novamente à delaminação. Essa transição pode ser realizada um número ilimitado de vezes.
Os diagramas de fases para sistemas reais de polímero-solvente não são tão simples. Não existe uma fronteira nítida entre as áreas de dissolução ilimitada e limitada. Devido à polidispersidade dos polímeros, a curva de equilíbrio de fases representa praticamente um conjunto de curvas correspondentes a frações individuais de polímeros. A separação de fases em soluções poliméricas pode ocorrer não apenas com a diminuição, mas também com o aumento da temperatura.
Ao contrário das soluções de compostos de baixo peso molecular, as soluções de polímeros, mesmo em concentrações muito baixas, são meios bastante viscosos. Mas esta não é a principal diferença. A capacidade das moléculas do polímero se deformarem sob a influência de um campo de força externo e se orientarem em um fluxo leva ao fato de que a viscosidade se torna um valor variável.
O fluxo de líquidos de baixo peso molecular e suas soluções obedece à lei de Newton:
onde τ é a tensão de cisalhamento, Pa; η - coeficiente de viscosidade, Pa•s; γ - taxa de cisalhamento (gradiente da taxa de cisalhamento), s -1.
Em fluidos newtonianos, a viscosidade η não depende da tensão de cisalhamento (velocidade). Em sistemas estruturados, na maioria dos casos, a viscosidade depende da tensão de cisalhamento. As soluções poliméricas são geralmente líquidos não newtonianos. Sua viscosidade diminui com o aumento do gradiente de velocidade. Quanto mais rápido esse líquido flui, menor será sua viscosidade. A explicação é muito simples. Na região de baixas concentrações, macromoléculas individuais são orientadas ao longo do fluxo. Na região de altas concentrações, as estruturas que surgem quando as macromoléculas interagem entre si são destruídas. Em taxas de fluxo muito baixas ou muito altas, as soluções poliméricas também obedecem à lei de Newton.
A viscosidade efetiva das soluções poliméricas depende da concentração, do peso molecular do polímero, da sua distribuição de peso molecular, da temperatura e da natureza do solvente.
São conhecidos vários tipos de viscosidade: cinemática, dinâmica, relativa, específica, reduzida e também característica para polímeros. A viscosidade intrínseca é a viscosidade reduzida extrapolada para concentração zero de polímero.
Na prática, a viscosidade dos polímeros é mais frequentemente avaliada medindo-se não valores absolutos, mas o tempo de fluxo do fluido através de um orifício calibrado. Na produção de tintas e vernizes, os tecnólogos costumam operar com a chamada viscosidade conforme VZ-4. Medir essa viscosidade se resume a medir o tempo de fluxo (em segundos) de um determinado volume de tinta e verniz de um funil comum através de um orifício calibrado. Como a tecnologia de aplicação de tintas e vernizes permite mudanças na viscosidade em uma faixa bastante ampla, a precisão de tais medições é suficiente. Para tintas e vernizes altamente viscosos, são utilizados funis aquecidos.
Medições mais precisas são realizadas durante o controle de temperatura em um viscosímetro capilar, por exemplo VPZh-1, VPZh-2, VPZh-4. Neste caso, torna-se possível passar de segundos para valores absolutos viscosidade
Soluções ao contrário
A maioria dos polímeros utilizados na prática em sua forma pura não possuem propriedades altamente elásticas. Tais propriedades podem aparecer quando se adicionam compostos especiais de baixo peso molecular,
chamados plastificantes. O sistema polímero-plastificante, na verdade, é uma solução muito concentrada em que o teor de plastificante varia na faixa de frações de um por cento a dezenas de por cento. Estas são soluções peculiares com sinal oposto - uma solução de um líquido em um sólido (solução sólida).
Quase todos os polímeros podem ser plastificados. Para garantir o conjunto necessário de propriedades operacionais, o sistema polímero-plastificante deve manter suas propriedades por muito tempo. Isto é conseguido através da utilização de substâncias com Temperatura alta ponto de ebulição e volatilidade muito baixa.
Os plastificantes são classificados de acordo com sua natureza química e grau de compatibilidade com o polímero. A cânfora foi utilizada pela primeira vez como plastificante, e o primeiro plástico plastificado foi o celulóide (Inglaterra, 2ª metade do século XIX). Hoje em dia, os ésteres de ácido ftálico (aproximadamente 80% do volume total) são mais amplamente utilizados como plastificantes. Também são utilizados ésteres de ácidos dicarboxílicos alifáticos, ésteres de ácido fosfórico, poliésteres de baixo peso molecular, parafinas cloradas, líquidos organossilícios, parafinas, produtos químicos de madeira, etc.
A essência da plastificação é aumentar a flexibilidade e mobilidade das macromoléculas na presença de um componente de baixo peso molecular. Via de regra, um pré-requisito para a plastificação é a compatibilidade termodinâmica do plastificante com o polímero, ou seja, a formação de uma verdadeira solução do plastificante no polímero. Ao utilizar um plastificante que tenha afinidade termodinâmica pelo polímero, ocorre a formação espontânea de sua verdadeira solução no polímero (o polímero incha no plastificante).
Caso o plastificante não tenha afinidade com o polímero, sua introdução no polímero pode ser feita à força - em misturadores. Neste caso, forma-se um sistema coloidal termodinamicamente instável e sujeito à separação. Externamente, isso se manifesta no aparecimento de gotículas de plastificante na superfície do produto. Com uma combinação bem-sucedida de polímero-plastificante, tais processos ocorrem em uma velocidade muito lenta, e como resultado os produtos mantêm suas propriedades de desempenho por várias décadas.
Com base na natureza de sua interação com os polímeros, os plastificantes podem ser divididos em dois grupos: polares e apolares. Os primeiros são capazes de solvatar os grupos polares do polímero, reduzindo sua interação intermolecular e, consequentemente, a temperatura de transição vítrea. A diminuição da temperatura de transição vítrea é proporcional ao número de moles do plastificante introduzido (regra de Zhurkov). Plastificantes não polares não mudam significativamente energia interna sistemas. Eles agem como uma espécie de lubrificante. Portanto, eles também são chamados de amaciantes.
Um tipo especial de plastificação é a plastificação de um polímero com um polímero. A elasticidade de um polímero rígido pode ser aumentada adicionando-lhe um polímero elástico. Condição necessária- afinidade termodinâmica de polímeros. Um exemplo de tal sistema termodinamicamente estável: “cloreto de polivinila - borracha de nitrila butadieno”.
Aspirações de água
Existem compostos químicos chamados isocianatos. Os isocianatos contêm grupos funcionais -NCO. Estes são compostos extremamente quimicamente ativos e também tóxicos. Alta atividade química e alta toxicidade, via de regra, coexistem. Na produção de equipamentos eletrônicos, os isocianatos são utilizados como endurecedor do verniz alquídico-uretano UR-231 - dietileno glicoluretano (DGU), na fabricação de compostos, etc.
A alta atividade química dos isocianatos é encontrada uso pratico e em outras áreas. Assim, para modificar poliolefinas com diisocianatos, foi sintetizado um composto químico de nome muito longo: 1,1-1,6-hexametileno-3,3,3 1,3 1-tetraquis-(2-oxietil)-bisureia (doravante referida como bisuréia). O aditivo foi obtido pela interação do diisocianato de 1,6-hexametileno e dietanolamina conforme a reação:
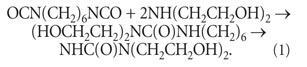
Este suplemento acabou acidentalmente nas mãos de médicos. Descobriu-se que possui propriedades crioprotetoras únicas. Também sabemos pelo curso escolar de física que, ao contrário da maioria dos compostos químicos, quando a água congela, ela não diminui de volume, mas aumenta. É graças a isso que o gelo não afunda, mas flutua. É graças a isso que a vida é preservada nos reservatórios, etc. Por outro lado, graças a esta mesma propriedade da água, quando qualquer ser vivo congela, os cristais de gelo destroem irreversivelmente as células orgânicas. Mas os objetos biológicos (sangue, medula óssea, órgãos humanos, etc.) podem ser preservados por muito tempo congelando-os à temperatura do nitrogênio líquido (-196 °C) na presença de crioprotetores. Na prática, o dimetilsulfóxido, um composto bastante tóxico e ineficaz, é mais frequentemente usado para isso. Descobriu-se que a biureia possui excelentes propriedades crioprotetoras. E o mais importante, apesar da extrema toxicidade dos compostos químicos utilizados para obtê-lo, ele próprio é praticamente atóxico. Segundo os desenvolvedores, você pode até espalhar no pão e comê-lo.
Depois resultados positivos testes, houve a necessidade de desenvolver uma tecnologia industrial para a produção de biureia. Inicialmente, a síntese do aditivo foi realizada de acordo com a reação (1) utilizando tecnologia química tradicional - em solvente orgânico. O produto alvo foi obtido na forma de solução e isolado na forma cristalina utilizando métodos conhecidos, por exemplo, recristalização múltipla. A tecnologia é complexa e multiestágio, especialmente na fase de purificação da biureia das impurezas. Os químicos geralmente, se possível, se esforçam para se afastar dos solventes orgânicos. E os desenvolvedores os abandonaram, substituindo o solvente orgânico por água comum. A solução é super original. O fato é que o produto inicial (diisocianato) reage ativamente com a água. Foi proposto realizar a reação a uma temperatura muito baixa (negativa). A esta temperatura, a reação (1) ainda está em andamento e a taxa de reação do diisocianato com a água é praticamente reduzida a zero. Ao escolher esta solução, os desenvolvedores tiveram em mente que mesmo em temperatura normal a taxa de reação (1) era várias vezes maior que a taxa de reação do diisocianato com água. O produto alvo foi obtido na forma de solução aquosa e foi nessa forma que foi utilizado na medicina. Consequentemente, não houve necessidade de isolar a biureia da solução. Na teoria, e em alguns casos na prática, tudo funcionou muito bem. Mas por algum motivo solução de água a biureia obtida com esta tecnologia muitas vezes revelou-se tóxica.
O autor juntou-se aos desenvolvedores de tecnologia nesta fase. Embora prestando homenagem à beleza da solução técnica, podemos dizer que ela apresentava algumas deficiências. A desvantagem fundamental da tecnologia era que ela só era eficiente quando os produtos iniciais da reação (1) eram tomados em proporções absolutamente estequiométricas. Teoricamente isso é possível, mas na prática só podemos chegar mais ou menos perto disso. Deixe-me lembrá-lo de que 1 g-mol de uma substância contém 6,02·1023 moléculas (número de Avo-gadro). Tente introduzir substâncias na reação com tal precisão que cada molécula de uma substância corresponda exatamente ao mesmo número de moléculas de outra substância (neste caso, a proporção é 2:1). É improvável que isso tenha sucesso. Portanto, nos casos em que a proporção dos componentes iniciais na reação foi próxima da estequiométrica, obteve-se um produto não tóxico. Noutras situações, e de acordo com a teoria da probabilidade, deveriam ter acontecido com muito mais frequência, a solução revelou-se tóxica devido a resíduos de compostos iniciais tóxicos.
Para resolver este problema aparentemente insolúvel, foi utilizada uma técnica conhecida da teoria da resolução inventiva de problemas (TRIZ) para resolver contradições técnicas (usando uma ação parcialmente redundante ou parcialmente ausente). Uma substância do original (diisocianato) foi retirada um pouco mais do que o necessário para a reação. A reivindicação da invenção, que implementa esta solução, é a seguinte:
Método para produzir 1,1-1,6-hexametileno-3,3,3 1 ,3 1 -tetraquis-(2-oxietil)-biureia pela reação de diisocianato de 1,6-hexametileno com dietanolamina em um solvente, seguido pela manutenção do massa de reação e isolamento do produto alvo, caracterizado pelo fato de que o diisocianato de hexametileno é retirado em uma quantidade de 1,0005-1,1 da estequiométrica, e água é usada como solvente e a mistura de reação é mantida a 25-60°C pelo tempo necessário para produzir diisocianato de 1,6-hexametileno.
Uma quantidade excessiva de diisocianato de 1,6-hesametileno em relação à quantidade estequiométrica garante em todos os casos a ausência do produto alvo dietanolamina na solução aquosa. O diisocianato de 1,6-hexametileno remanescente no meio de reação é convertido em poliureias durante a exposição subsequente como resultado da reação com um solvente (água). As poliureias precipitam e são filtradas. Desta forma, obtém-se uma solução aquosa de biureia, pronta para o uso pretendido. As injeções de tal solução em camundongos, nos quais sua toxicidade foi testada, foram toleradas sem dor. Desta forma original, as “aspirações hídricas” desta tecnologia foram praticamente realizadas.
As “aspirações de água” podem ser rastreadas em quase todas as tecnologias de produção de equipamentos eletrônicos. Em algumas tecnologias (galvanização ou revestimentos químicos, ataque químico, etc.) a sua implementação não requer nenhum esforço. Em princípio, também podem ser utilizados meios não aquosos para obter tais revestimentos. Pesquisas científicas nessa direção estão em andamento. Mas isso é necessário?
Em outras tecnologias, por exemplo, na formação de revestimentos intermediários ou de acabamento de placas de circuito impresso (fotorresistentes, máscaras de solda), esforços consideráveis tiveram que ser feitos para passar das composições de base orgânica para as de base aquosa-álcali.
A tendência de afastamento dos “orgânicos” também domina as tecnologias de limpeza de conjuntos de circuitos impressos de todos os tipos de contaminantes. Solventes orgânicos tóxicos e prejudiciais ao meio ambiente estão sendo substituídos por compostos de limpeza à base de água.
Continua.
Literatura
- Dicionário Politécnico/Conselho Editorial: A. Yu. Ishlinsky e outros M.: Sov. Encic. 1989.
- Enciclopédia Química: Em 5 volumes T. 1 / Conselho Editorial: I. L. Knunyants et al.: Sov. Encic., 1988.
- Salem L. Molécula maravilhosa // Trans. do francês M: Mir, 1982.
- GOST 8420-74. Materiais de pintura e verniz. Métodos para determinar a viscosidade condicional.
- Musakin A.P., Rachinsky F.Yu., Suglobova K.D. Equipamentos para laboratórios químicos. L.: Química, 1982.
- Barshtein R. S., Kirilovich V. P., Nosovsky Yu. materiais poliméricos. M.: Química, 1982.
- Saunders J. X., Frisch K. K. Química de poliuretanos // Transl. do inglês M.: Química, 1972.
- Pat. RF No. Prioridade datada de 10/08/1994.
Os solventes de origem orgânica são amplamente procurados na indústria química, bem como nas áreas de construção, reparação, produção de tintas e vernizes, indústria automotiva, impressão, etc. remoção de contaminantes e depósitos. Este artigo falará sobre diversidade e uso correto solventes orgânicos.
Solventes orgânicos
A peculiaridade das substâncias é sua natureza orgânica e capacidade de dissolver compostos Vários tipos. De acordo com o método de preparação, distinguem-se os seguintes grupos principais:
- hidrocarbonetos;
- cetonas;
- éteres e ésteres;
- álcoois;
- solventes halogenados.
A densidade dos solventes orgânicos depende da temperatura.
Foto de solvente para substâncias orgânicas

Uso de solventes orgânicos
- Os líquidos solventes e seus homólogos são amplamente utilizados em muitos campos industriais. Eles também são procurados para trabalhos de restauração e restauração de valores artísticos. São utilizados no preparo de impregnações, vernizes e limpeza de objetos de qualquer material.
- As fábricas e oficinas automotivas utilizam principalmente gasolina, xileno, hidrocarbonetos clorados, aguarrás e querosene. Eles são usados para lavar, molhar, lavar e desengordurar peças de máquinas.

É impossível imaginar a produção de tintas e vernizes sem solventes orgânicos, que em sua maioria são a base para a fabricação de diversos produtos.
Na vida cotidiana, os solventes são necessários nos seguintes casos:
- para diluir revestimentos altamente concentrados até a consistência e viscosidade exigidas;
- para remover manchas de materiais de tingimento de roupas ou superfícies;
- para a limpeza de ferramentas de trabalho utilizadas em trabalhos de pintura (pincel, pistola, rolo, etc.).
A limpeza eficaz de depósitos ou contaminantes depende da seleção adequada de um solvente adequado. Os exemplos mais comuns para remoção de flacidez de vários tipos estão listados na tabela abaixo.
Solvente ou diluente
- Muitas pessoas usam essas palavras como sinônimos. No entanto composição química os solventes orgânicos possuem características físicas e técnicas completamente diferentes. Adicionar diluente a materiais concentrados não envolve qualquer reação.
- O solvente, por sua vez, ao contrário, afeta a substância, penetrando em sua estrutura e dissolvendo os componentes formadores de filme. Assim, tintas e vernizes esmaltados adquirem fluidez (viscosidade) ideal para pintura.

Os solventes utilizados devem atender a 2 requisitos básicos:
- a capacidade de converter substâncias formadoras de filme em estado líquido;
- durante a evaporação, garantem a estrutura ideal do revestimento, sem perda das propriedades originais e sem formação de defeitos na superfície a ser pintada.
Tipos de solventes orgânicos
Os solventes orgânicos são frequentemente substâncias líquidas com um odor pungente característico. A classificação é realizada de acordo com sua estrutura química, propriedades físicas e outros parâmetros que determinam sua capacidade de interagir com diversas substâncias.
Por composição:
- composições homogêneas são álcool butílico, acetona, solvente, gasolina, isopropanol;
- substâncias multicomponentes (combinadas) - P646, 649, P-4, etc.
Por taxa de evaporação:
- substâncias de baixa volatilidade (terebintina) são utilizadas em esmaltes e vernizes;
- Solventes de média volatilidade (querosene) são utilizados como diluentes para tintas a óleo;
- solventes orgânicos altamente voláteis (gasolina, aguarrás) são adequados para quase todos os tipos de tintas e vernizes.
Deve-se lembrar que quanto maior o grau de volatilidade, maior será sua explosividade e inflamabilidade.
Por ponto de ebulição:
- ebulição baixa - até 100 graus;
- ebulição média - até 150 graus;
- ebulição alta - mais de 150 graus.
Para trabalhar com solventes orgânicos
Dependendo do tipo de solvente, nomeadamente da sua espessura, a aplicação pode ser realizada das seguintes formas:
- método manual;

- mergulho;
- imersão a jato;
- exposição a vapores de substâncias;
- pulverização pneumática, airless ou eletrostática;
- eletrodeposição.
Revisão de solventes orgânicos populares
Os solventes de origem orgânica tornaram-se difundidos no espaço pós-soviético devido à sua alta resistência às condições climáticas adversas.
Grupo de hidrocarbonetos
Gasolina "Galosh", Nefras
- Essas substâncias são obtidas durante a destilação de óleo com baixo teor de enxofre. São um líquido transparente (é permitida uma tonalidade amarelada) com odor adocicado. A principal diferença entre os produtos apresentados são suas pronunciadas propriedades de dissolução de tintas e esmaltes.
- São utilizados para diluir materiais de pintura, preparar e limpar superfícies. Esses solventes fortes são muito procurados em joias, onde são necessários resultados elevados com dosagens mínimas.
Terebintina
- Líquido incolor e inflamável - resultado da destilação da madeira de pinho ou da destilação da resina espécies coníferas(goma de terebintina). Sua temperatura de ignição é de 34 graus.
- Um solvente de cheiro forte é usado para diluir tintas alquídicas e à base de óleo, vernizes e também para limpar ferramentas. É perfeito para desengordurar superfícies antes de pintar ou colar.

Espírito branco
- Uma substância líquida transparente com odor pungente e específico é obtida pela mistura de hidrocarbonetos alifáticos e aromáticos. A substância se caracteriza pela grande eficiência no desengorduramento de superfícies e na remoção de contaminantes de óleo.
- Além disso, é utilizado como diluente para esmaltes alquídicos, vernizes, mastiques à base de betume ou borracha. O compósito dissolverá gorduras, frações de óleo, compostos orgânicos de oxigênio, nitrogênio, etc.
Xileno
- Este hidrocarboneto aromático é um líquido incolor, sem impurezas estranhas. O cheiro agradável não deve enganar; uma alta concentração de vapores certamente fará mal à saúde.
- Ele lida facilmente com tarefas funcionais como: dissolução de tintas à base de resinas epóxi, vernizes poliméricos, mastiques de poliuretano. Baixas taxas de evaporação resultam em uma superfície mais lisa e brilhante.
Grupo cetona
Acetona
- Líquido incolor, volátil, com odor pungente e altamente inflamável. É obtido durante a síntese do fenol. Tem a vantagem de uma boa mistura com água e outros solventes semelhantes.
- É amplamente utilizado para dissolver nitro esmaltes e nitro vernizes, além de alguns sais: iodeto de potássio, cloreto de cálcio. Capaz de quebrar gorduras em superfícies de borracha e remover contaminantes gordurosos e cerosos.

Metil isobutil cetona
- Este solvente é incolor e possui um odor forte e adocicado. É o resultado da condensação da acetona com posterior desidratação e hidrogenação do óxido de mesitil.
- É ativamente utilizado como importante componente na produção de tintas à base de resinas epóxi. Dissolve perfeitamente colofónia, borracha, copolímero de cloreto de vinila e muitas resinas naturais e sintéticas.
Ciclohexanona
- O líquido ligeiramente viscoso e incolor tem um odor muito pungente com tonalidade mentolada. Uma substância altamente inflamável com propriedades semelhantes à acetona. É obtido pela oxidação do ciclohexano na presença de naftenato.
- Indispensável para dissolver nitratos, resinas naturais, óleos, acetatos de celulose, cloretos de polivinila. Juntamente com o acetato de etila, é adequado para diluir a maioria dos tipos de tintas. Ele é parte integral removedores de manchas.
Grupo de éteres e ésteres
Dioxano 1.4
- É um éter obtido sinteticamente. É um líquido incolor e de odor forte. Dissolve-se facilmente em água, álcool e mistura-se com éteres.
- Particularmente procurado na produção de vernizes de nitro e acetato de celulose. Usado como solvente para tintas. Decompõe livremente gorduras, óleos, ceras, etc. Adequado como estabilizador para solventes contendo cloro.
Acetato de etila
- O éster, que é incolor, possui odor agradável (em baixas concentrações). É produzido pelo processamento de ácido acético sintético. O líquido inflamável é caracterizado por alta solubilidade e volatilidade.
- É utilizado para limpeza e desengorduramento de superfícies, além de dissolução de filmes, éteres de celulose, pigmentos, tintas a óleo, vernizes de poliéster, esmaltes e óleos lubrificantes.
Acetato de metila
- O éster etílico incolor do ácido acético é usado para dissolver éteres de celulose, a maioria dos tipos de resinas, gorduras e produtos de tintas e vernizes. Pode ser usado em combinação com outros solventes.
- Suas propriedades solventes são semelhantes às da acetona e podem ser utilizadas como seu substituto. No entanto, o acetato de metila é altamente tóxico, apesar do seu odor agradável.
Grupo de álcool
Etanol
- Um líquido altamente móvel e com odor característico é obtido pela fermentação anaeróbica de hidrocarbonetos de origem vegetal. Altamente inflamável em contato com fogo.
- O álcool industrial é utilizado na produção de tintas e vernizes. São amplamente utilizados para desinfecção e desengorduramento de superfícies antes de pintura ou colagem posterior.

Metanol
- O álcool monohídrico incolor é altamente inflamável e possui odor característico. É obtido sinteticamente. Mistura-se facilmente com água e a maioria dos solventes orgânicos (etanol, acetona, benzeno).
- Tem ampla aplicação na fabricação de tintas e vernizes. Devido à sua alta toxicidade, o uso de metanol em vários produtos de consumo é proibido.
Butanol
- O líquido levemente viscoso é incolor, mas possui um odor característico de fusel. Sua produção é baseada no processo de oxossíntese a partir do acetaldeído. É um importante componente na produção de tintas e vernizes, plastificantes e resinas.
- As propriedades químicas dos solventes orgânicos permitem dissolver óleos secantes, vernizes, tintas, borrachas, resinas naturais e sintéticas. Adequado para remover depósitos e contaminantes de diversas origens.
Regras para trabalhar com solventes orgânicos
A maioria dos solventes orgânicos tem um impacto negativo na saúde humana. A gravidade do impacto é determinada pelo seu tipo. Para prevenir intoxicações ou pelo menos reduzir o efeito tóxico, é necessário seguir normas de segurança ao trabalhar com eles.
- Uso de equipamentos de proteção individual, ou seja, não descuidar dos óculos, luvas e máscaras respiratórias.

- Em caso de contato com a pele, limpe imediatamente a substância com pano limpo e seco e enxágue em água corrente.
- A sala destinada ao trabalho deve estar equipada com sistema de ventilação. Como último recurso, as janelas e portas de entrada são abertas.
- É importante monitorar a temperatura na caixa de trabalho. Alguns solventes são explosivos. Neste sentido, é proibida a sua utilização nas proximidades de objetos quentes (incandescentes).
- Os recipientes com solventes orgânicos são transportados e armazenados em câmaras frigoríficas estritamente na posição vertical (gargalo para cima).
Segurança e saúde
A capacidade de dissolução em gorduras e a volatilidade dos solventes orgânicos determinam seus efeitos tóxicos na saúde humana. Normalmente, os efeitos negativos ocorrem através do trato respiratório e da pele.
- A intoxicação se manifesta pelos seguintes sintomas: irritação da pele, mucosas dos órgãos respiratórios e sistema digestivo. Em caso de toxicidade aguda, podem ocorrer zumbido, náusea, agitação, dormência nas pontas dos dedos, sudorese e batimentos cardíacos arrítmicos.
- Em condições industriais, onde, via de regra, há contato prolongado com substâncias de baixa concentração, os trabalhadores desenvolvem intoxicações crônicas. É acompanhada por falta de apetite, fadiga, sonolência e perda de peso.
O efeito específico dos solventes orgânicos pode se manifestar em quaisquer características, bem como em suas combinações.
- Hidrocarbonetos aromáticos causar irritação do sistema nervoso central, alterando o hemograma. Pode aparecer vermelhidão na pele, acompanhada de coceira.
Para locais de trabalho, a concentração de vapores de benzeno no ar não deve ser superior a 5 mg/m3, para tolueno e xileno - 50 mg/m3.
- Hidrocarbonetos gordurosos. Isso inclui solventes populares como gasolina, éter de petróleo e aguarrás. Nas intoxicações crônicas observa-se instabilidade mental, tremores nas pálpebras e braços estendidos. A presença de cloro em hidrocarbonetos gordurosos (substâncias substituídas por cloro) tem um efeito específico nos órgãos internos, desenvolve anemia e perturba a atividade cardíaca.

Para locais de trabalho, a concentração de vapor no ar para uma mistura de hidrocarbonetos alifáticos e aromáticos não deve ser superior a 100 mg/m3, para tetracloreto de carbono - até 2 mg/m3, dicloroetano - 10 mg/m3. cubo
- Álcoois entrar no corpo através do trato respiratório ou da pele. Os átomos de carbono acumulam-se lentamente no corpo e são eliminados ainda mais lentamente. Os sinais comuns de envenenamento incluem: dores de cabeça, atrofia do nervo óptico e doenças crônicas rins, corações.
Para locais de trabalho, a concentração de metanol no ar não deve exceder 5 mg/m3, para álcool propílico e butílico - 10 mg/m3.
- Ésteres fornecer forte impacto sobre a saúde humana. A inalação prolongada causa dor de cabeça, aumento da frequência cardíaca, diminuição da visão e irritação das membranas mucosas dos olhos.
Para áreas de trabalho, a concentração de vapores de éster no ar não deve ser superior a 100 mg/m3.
- Cetonas. A acetona é um solvente popular neste grupo. Sua alta concentração leva a intoxicações agudas, cujos sintomas são anemia, irritação das mucosas, tonturas, lacrimejamento.

Para locais de trabalho, a concentração de vapores cetônicos no ar não deve ser superior a 200 mg/m3.
- Dissulfeto de carbono esta é uma substância altamente tóxica. Em casos de intoxicação grave, foram observados transtornos mentais, distúrbios gastrointestinais, perda de memória, tremores nas mãos e perda de visão.
Para locais de trabalho, a concentração de vapor de dissulfeto de carbono no ar deve ser de até 1 mg/m3.
- Derivados nitro e amino e seus homólogos representam um grupo extenso de solventes. O quadro crônico de intoxicação se expressa na forma de dor de cabeça, apatia, cor azulada da pele, perturbações do fígado e do sistema nervoso central.
Para locais de trabalho, a concentração de vapores analinos no ar não deve ser superior a 0,1 mg/m3, compostos de benzeno e tolueno - até 1 mg/m3.
Destruição de resíduos
- O problema da reciclagem é relevante nas atividades industriais. Algumas empresas recorrem a empresas especializadas para obter ajuda. A destruição deve ser isenta de resíduos e inofensiva tanto para os seres humanos como para o ambiente.
- Os compostos químicos e suas misturas são tóxicos, ativos e muitos deles são inflamáveis e explosivos. Os vapores produzidos por estas substâncias voláteis causam danos irreparáveis às pessoas e à natureza. Portanto, o processo deve ser abordado obedecendo às normas de segurança, incluindo o uso de equipamentos de proteção individual.
Página 1
Solventes de hidrocarbonetos - pirocondensado, KOH-47-88 e querosene residual não contêm parafina, resinas e outros emulsificantes naturais, portanto não formam emulsões com água ou com ácido clorídrico inibido. Uma emulsão preparada com os solventes listados e uma solução de ácido ou água separa-se poucos minutos após a preparação. Se a solução contiver 0,5% ou mais do emulsificante SKN-26, esta mistura a uma temperatura de 30 C não flui.
Os solventes de hidrocarbonetos são amplamente utilizados na indústria de tintas e vernizes devido ao seu baixo custo e disponibilidade. Este grupo de solventes inclui hidrocarbonetos saturados da série alifática (parafinas ou alcanos) ClH2ya 2, hidrocarbonetos alicíclicos de composição geral CH2 e hidrocarbonetos aromáticos.
Solvente de hidrocarboneto - resíduo de óleo de fundo - KOH - 47 - 88 é um resíduo de produção de plantas da indústria química nacional. A densidade da mistura é 850 - 900 kg / m3, viscosidade cinemática a 20 C 2 1 mPa - s, temperatura de início e fim da ebulição é 88 - 180 C.
O solvente hidrocarboneto praticamente não tem efeito na fluência dos monocristais de estanho, sendo assim um meio inativo.
Os solventes de hidrocarbonetos são amplamente utilizados em uma ampla variedade de indústrias. Seu uso é determinado pela combinação bem-sucedida da alta capacidade de dissolução dos hidrocarbonetos em relação a uma ampla gama de compostos orgânicos com toxicidade relativamente baixa e sem atividade corrosiva.
Os solventes de hidrocarbonetos são caracterizados por um peso molecular médio.
Os solventes de hidrocarbonetos são mais macios do que os considerados; Não removem corantes de materiais têxteis e não removem a gordura natural das fibras de lã, camurça e couro. No entanto, dissolvem gorduras, cera de abelha, óleo de peixe, secreções de potássio, óleos vegetais e lubrificantes, alcatrão, cera, parafina, piche, breu, borracha, betume e outras substâncias. Esses solventes não destroem fibras como acegocloreto, cloreto de polivinila, cloreto de polivinilide, etc. Eles são menos tóxicos e bastante baratos. A desvantagem dos solventes de hidrocarbonetos é a inflamabilidade e a explosividade de suas misturas com o ar.
Solventes de hidrocarbonetos são substâncias tóxicas inflamáveis e explosivas. A maioria deles é caracterizada por alta volatilidade. Os vapores dos solventes são várias vezes mais pesados que o ar; acumulam-se em locais baixos, em ambientes mal ventilados e próximos a equipamentos, o que pode causar explosão ou envenenamento.
// Solventes
Solventes são compostos químicos capazes de dissolver diversas substâncias, ou seja, formar com eles misturas homogêneas de composição variável a partir de dois ou mais componentes.
O solvente é um dos componentes mais necessários na produção de substâncias filmogênicas. O solvente mais comum na natureza é a água comum, mas na indústria de tintas e vernizes esse solvente é utilizado principalmente na produção de tintas, primers e vernizes à base de água. Entre os solventes para tintas, esmaltes e vernizes, os solventes orgânicos são muito mais difundidos. Todos os solventes orgânicos utilizados pela indústria de tintas e vernizes podem ser divididos nos seguintes seis grupos de acordo com sua natureza química:
1) hidrocarbonetos - alifáticos, alicíclicos, aromáticos, além de petróleo e terpenos;
2) cetonas;
3) éteres e ésteres;
4) álcoois;
5) solventes contendo halogênio;
6) outros solventes.
Os solventes de hidrocarbonetos são amplamente utilizados na indústria de tintas e vernizes devido ao seu baixo custo e ampla disponibilidade.
Este grupo de solventes inclui hidrocarbonetos saturados da série alifática (parafinas ou alcanos), hidrocarbonetos alicíclicos e hidrocarbonetos aromáticos.
Os solventes de hidrocarbonetos são obtidos por destilação a seco de madeira e carvão, de gasolina de xisto, de petróleo e gás de petróleo.
Atualmente, a principal fonte natural da maioria dos solventes de hidrocarbonetos é o petróleo.
Contém principalmente hidrocarbonetos parafínicos, naftênicos e aromáticos. Dependendo do tipo de óleo, nele predomina uma ou outra classe de hidrocarbonetos.
Mas as frações de petróleo destiladas em uma ampla faixa de temperatura consistem em uma mistura de hidrocarbonetos de diferentes estruturas químicas.
Hidrocarbonetos alifáticos - principalmente parafinas são utilizados na indústria de tintas e vernizes.
As isoparafinas são amplamente utilizadas no exterior, pois são praticamente inodoras (o odor dos solventes orgânicos se deve à sua alta volatilidade e é um dos fatores nocivos do trabalho com solventes). As isoparafinas são usadas para criar revestimentos pouco tóxicos, na medicina, na produção de materiais de sutura cirúrgica, etc.
Os hidrocarbonetos alicíclicos têm uso limitado na produção e tecnologia de aplicação de tintas e vernizes, embora apresentem maior capacidade de dissolução que os solventes alifáticos e menor toxicidade em relação aos aromáticos. A principal fonte natural desses solventes é o petróleo.
Os solventes alicíclicos são amplamente utilizados na produção de fibras sintéticas, esculturas e tintas de impressão.
O solvente mais utilizado é o ciclohexano, usado para dissolver etilcelulose, óleos e gorduras, ceras e borrachas.
Os hidrocarbonetos aromáticos são o grupo mais extenso de solventes de hidrocarbonetos produzidos pela indústria química.
Actualmente, os hidrocarbonetos aromáticos são produzidos principalmente a partir de fracções de petróleo por reforma catalítica e pirólise e, em muito menor escala, pelo processamento de carvão.
Quase todos os solventes aromáticos são produzidos pela indústria nacional.
Os solventes aromáticos têm maior poder de dissolução em comparação com outros solventes de hidrocarbonetos e estão incluídos como componentes constituintes na maioria dos solventes mistos.
Os solventes aromáticos incluem: benzeno, tolueno e xileno, isopropilbenzeno, solvente, tetralina e decalina.
Para caracterizar os solventes de petróleo, unidos pelo termo “nefras” (solvente de petróleo), são utilizadas características que caracterizam suas composições hidrocarbonadas e fracionárias; estes últimos determinam as propriedades físico-químicas básicas dos solventes.
Outros parâmetros também são indicados, como ponto de fulgor.
Os seguintes tipos de solventes de petróleo são diferenciados de acordo com sua composição de hidrocarbonetos:
Nefras-S são solventes de composição mista, nos quais estão presentes hidrocarbonetos de todos os grupos (mas não mais que 50% da fração mássica dos hidrocarbonetos de cada grupo).
Nefras-A - solventes com predominância de hidrocarbonetos alifáticos e reduzido teor de hidrocarbonetos aromáticos (não superior a 2,5%).
Nefras-I - solventes isoparafínicos.
Nefras-P - parafina contendo mais de 50% da fração mássica de hidrocarbonetos parafínicos.
Nefras-N - com predominância de hidrocarbonetos naftênicos.
As propriedades operacionais mais importantes dos solventes de petróleo são:
Capacidade de dissolver compostos orgânicos;
A capacidade de remover contaminantes orgânicos da superfície dos metais;
Capacidade de evaporar rapidamente;
Capacidade de formar depósitos mínimos de seus componentes;
Corrosividade (determinada pela presença de compostos de enxofre em solventes);
Estabilidade da qualidade dos solventes petrolíferos, caracterizada pela sua vida útil garantida.
Exemplos de solventes de petróleo são: gasolina, aguarrás, solventes hexano e heptano.
Os hidrocarbonetos terpênicos são uma das classes de solventes de origem vegetal há muito conhecidas.
Estes incluem hidrocarbonetos naturais e sintéticos.
Os terpenos são encontrados em óleos essenciais flores, folhas de plantas diversas, em resinas naturais (bálsamos), em agulhas de pinheiro e madeira de coníferas (pinheiro, abeto, abeto, zimbro, lariço).
Solventes de terpeno amplamente utilizados incluem terebintina, dipenteno, óleo de pinho (óleo de pinho) e isopropiltolueno.
As cetonas são solventes para a maioria das substâncias formadoras de filme.
Cetonas alifáticas e cíclicas são utilizadas na indústria de tintas e vernizes.
Entre as cetonas alifáticas saturadas, são amplamente utilizadas: acetona, metiletilcetona, metilisobutilcetona, diisobutilcetona, álcool diacetona.
A principal vantagem das cetonas alifáticas é a sua elevada capacidade de dissolução e toxicidade relativamente baixa.
Entre as cetonas cíclicas, a ciclohexanona e a metilciclohexanona encontraram utilização.
Eles têm maior toxicidade do que as cetonas alifáticas.
Os éteres incluem derivados de álcoois monohídricos e diatômicos (glicóis) e seus compostos cíclicos.
Dos derivados de álcoois alifáticos monohídricos, são utilizados éteres dietílicos e dibutílicos.
De maior interesse são os éteres monoalquílicos de etilenoglicol - celossolves e dietilenoglicol - carbitóis.
Os ésteres são a classe mais comum de solventes orgânicos com enormes aplicações práticas.
Os ésteres são obtidos por esterificação dos álcoois correspondentes com ácidos minerais ou orgânicos.
N Os solventes mais utilizados são ésteres de ácido acético - acetatos (acetato de metila, acetato de etila, acetato de butila).
Outros ésteres (ácidos lácticos - lactatos, ácidos butíricos - butiratos, ácidos fórmicos - formatos) têm uso limitado, inclusive devido ao seu custo bastante elevado.
Devido à sua forte saponificação e alta toxicidade, os formatos quase nunca são utilizados atualmente.
Os álcoois também são amplamente utilizados como solventes.
Os mais comuns são metanol, etilenoglicol, glicerina, pentaeritritol, butanol e isopropanol.
Entre os solventes, os mais utilizados são aulas diferentesálcoois: monohídricos e polihídricos; alifático e cíclico.
Os álcoois são solventes polares e são usados em uma ampla variedade de indústrias.
O álcool mais comum entre os solventes é o etanol – seu consumo global nesta qualidade não chega a 4 milhões de toneladas por ano.
Outros solventes populares são o metanol e o isopropanol, com volumes de consumo nesta qualidade superiores a 1 milhão de toneladas por ano.
O uso de álcoois como solventes inclui as seguintes aplicações: solvente de processo, solvente na produção de tintas e revestimentos, limpador, solvente na produção de produtos de consumo, solvente em aerossol.
Solventes contendo halogênio (clorometanos, cloroetanos, solventes contendo fluorocloro, fluoroalcanos de hidrogênio) têm a maior capacidade de dissolução e a partir deles são obtidos produtos desengordurantes de alta qualidade.
Esses solventes são utilizados, em particular, para desengordurar cilindros de oxigênio ou manômetros.
Esses solventes são caracterizados pela inflamabilidade reduzida, apresentam melhor volatilidade do que a maioria dos solventes e são mais eficazes.
A sua principal desvantagem é a sua toxicidade muito elevada.
A sua utilização dá uma “contribuição” significativa para o efeito estufa e para as chuvas “ácidas”, por isso são classificados como materiais que levam à destruição da camada de ozônio da atmosfera terrestre. Por isso, é compreensível que sejam muito odiados pelos ambientalistas.
Os solventes devem ser quimicamente inertes em relação à substância que está sendo dissolvida, ou seja, não deve entrar em interação química com ele.
Os solventes devem ter baixa higroscopicidade: mesmo com uma pequena quantidade de água, sua capacidade de dissolução é drasticamente reduzida.
Os solventes orgânicos são tóxicos; eles (e seus vapores) têm efeitos nocivos aos seres humanos.
Ao trabalhar com eles, é necessário observar rigorosamente as medidas de segurança, principalmente, garantir uma boa ventilação das instalações e, se necessário, utilizar equipamentos de proteção - luvas e respiradores.
Ao trabalhar com solventes, deve-se levar em consideração o risco de incêndio.
A grande maioria dos solventes orgânicos é inflamável e uma mistura de seus vapores com o ar em uma determinada concentração forma uma mistura explosiva.
Portanto, nas salas onde são armazenados solventes e são realizados trabalhos com eles, as normas de segurança contra incêndio devem ser rigorosamente observadas.
