Zamrażanie roztworów. Roztwory zamarzają w niższej temperaturze niż czysty rozpuszczalnik.
Roztwory wrzą w temperaturze ponad wysoka temperatura Jak czysty rozpuszczalnik;
Wnioski z prawa Raoulta
Idealne są rozwiązania ściśle zgodne z prawem Raoulta. W przypadku rzeczywistych roztworów nieelektrolitów prawo Raoulta jest przestrzegane tym dokładniej, im bardziej rozcieńczony jest ten roztwór. Wraz ze wzrostem stężenia substancji rozpuszczonej większość roztworów wykazuje odchylenia od prawa Raoulta.
Względny spadek prężności pary nasyconej rozpuszczalnika nad roztworem jest równy ułamkowi molowemu substancji rozpuszczonej.
Roztwory elektrolitów (kwasów, zasad, soli) nie podlegają prawu Raoulta. Co więcej, nawet w przypadkach, gdy są rozcieńczone. Przyczynę tego zjawiska omówimy później.
Z prawa Raoulta wynikają dwie ważne konsekwencje:
Przyjrzyjmy się im bardziej szczegółowo.
Gotowanie jest proces fizyczny przejście cieczy w stan gazowy lub parę, podczas którego w całej objętości cieczy tworzą się pęcherzyki gazu.
Ciecz wrze, gdy ciśnienie pary nasyconej zrówna się z ciśnieniem zewnętrznym. Jeśli ciśnienie zewnętrzne (na przykład atmosferyczne) nie zmienia się, a sama ciecz jest substancją indywidualną i chemicznie czystą, wówczas wrze w otwartym, ogrzewanym naczyniu w stałej temperaturze, aż faza ciekła całkowicie zniknie.
Zatem przy ciśnieniu atmosferycznym 101,325 kPa temperatura wrzenia oczyszczonej (destylowanej) wody wynosi 100 o C lub 373,16 K.
Jeśli w H2O rozpuści się jakąś nielotną substancję, wówczas prężność jej pary nasyconej spadnie. Aby powstały roztwór wrzał, konieczne jest podgrzanie go do temperatury wyższej niż 373,16 K, ponieważ tylko w takich warunkach prężność pary nasyconej rozpuszczalnika ponownie stanie się równa ciśnieniu atmosferycznemu.
Zamrażanie lub krystalizacja jest zjawiskiem fizycznym, któremu towarzyszy przemiana cieczy w ciało stałe. Ponadto w całej objętości cieczy tworzą się struktury krystaliczne.
Proces zamrażania rozpoczyna się, gdy ciśnienie pary nasyconej nad cieczą zrówna się z ciśnieniem pary nasyconej nad jej stałymi kryształami.
Jeśli ciśnienie zewnętrzne (atmosferyczne) pozostaje stałe, a ciecz nie zawiera obcych zanieczyszczeń, wówczas podczas procesu krystalizacji temperatura schłodzonej cieczy pozostanie stała, aż faza ciekła całkowicie zamieni się w ciało stałe.
Przy ciśnieniu atmosferycznym 101,325 kPa woda destylowana zamarza w temperaturze 0 o C (273,16 K). Prężność pary nasyconej wody nad lodem i cieczą wynosi w tym przypadku 613,3 Pa.
W przypadku roztworu wodnego prężność pary nasyconej rozpuszczalnika w temperaturze 0 o C będzie mniejsza niż 613,3 Pa, a nad lodem pozostanie niezmieniona. Lód wrzucony do takiego roztworu szybko się stopi na skutek kondensacji nadmiaru pary nad nim.
Dopiero obniżenie temperatury umożliwia ponowne wyrównanie ciśnienia pary nasyconej nad fazą ciekłą i stałą i zainicjowanie procesu krystalizacji.
Ustalono doświadczalnie, że wzrost temperatury wrzenia (Dt bp) i spadek temperatury zamarzania roztworu (Dt sub) w porównaniu z czystym rozpuszczalnikiem jest wprost proporcjonalny do stężenia molowego rozpuszczonej substancji. Matematycznie można to zapisać w następujący sposób:
kip. roztwór – zagotować. p-body = Dt bela. = Em
t zastępca r-tel – t zastępca rozwiązanie = zastępca Dt = km
gdzie m jest stężeniem molowym rozpuszczonej substancji; E i K to odpowiednio stałe ebulioskopowe (łac. ebbulio – odparowanie) i krioskopowe (gr. „krios” – zimno), których wartości zależą jedynie od charakteru rozpuszczalnika (Tabela 7).
Tabela 7. Ebulioskopowe stałe E i krioskopowe K niektórych rozpuszczalników (stopnie/mol)
Ryż. 7.12. Obniżenie prężności pary wody nad roztworem
Linie ciągłe wyrażają granice pól fazowych dla czystej wody. Przypomnijmy, że linia 1 wyświetla równowagę ciecz-para. Po dodaniu nielotnej substancji rozpuszczonej do wody ciśnienie pary nad roztworem (linia przerywana 2 ) maleje w dowolnej temperaturze.
Każda ciecz zamarznie (zestali się), jeśli ciśnienie pary nad nią porówna się z ciśnieniem pary nad fazą stałą (w przypadku wody nad lodem). Dlatego temperatura zamarzania roztworu Zastępca T będzie niższa niż temperatura zamarzania T. o zastępcy czysty rozpuszczalnik - woda.
F.M. Raul (1883) ustalił eksperymentalnie, że spadek temperatury zamarzania (w przeciwnym razie - lodowata depresja)
zastępca DT = T. o zastępcy - Zastępca T ,
spowodowane różnymi substancjami rozpuszczonymi w tych samych ilościach molowych jest takie samo dla danego rozpuszczalnika. Zatem dla 0,1 m roztwory wodne Dla niektórych substancji obserwuje się następujące temperatury krzepnięcia:
Substancja Zastępca T , o C
Nadtlenek wodoru H 2 O 2 - 0,186
Alkohol metylowy CH 3OH - 0,181
Alkohol etylowy C2H5OH - 0,183
Sacharoza C 12H 22 O 11 - 0,186
Dekstroza C6H12O6 - 0,188
Przy różnych stężeniach substancji rozpuszczonych zastępca DT proporcjonalnie do ich stężenia molowego M :
zastępca DT = K cr m (7.1)
Czynnik proporcjonalności K kr w równaniu (7.1), tzw stała krioskopowa, oznacza molowe obniżenie temperatury zamarzania. Wartość ta jest liczbowo równa obniżeniu się temperatury zamarzania roztworu zawierającego 1 mol substancji rozpuszczonej w 1 kilogramie rozpuszczalnika, pod warunkiem, że roztwór ma właściwości idealne. Stała krioskopowa jest cechą rozpuszczalnika, jej wartość nie zależy od charakteru substancji rozpuszczonej.
Stężenie molowe można wyrazić w kategoriach masy substancji rozpuszczonej ( B) i rozpuszczalnik ( A) w gramach (patrz punkt 7.3):
Gdzie M - masa molowa rozpuszczonej substancji (g/mol). Podstawiając to wyrażenie do równania (7.1), otrzymujemy
Z tego równania wynika jedna bardzo ważna okoliczność, a mianowicie: znając dokładny skład rozcieńczonego roztworu i mierząc temperatury zamarzania czystego rozpuszczalnika i roztworu, możesz obliczyć masę molową rozpuszczonej substancji:
Podstawą jest równanie (7.2). krioskopowy(Lub kriometryczny)metoda oznaczanie masy molowej substancji poprzez obniżenie temperatury zamarzania ich roztworów.Metoda kriometryczna jest szeroko stosowana w praktyce laboratoryjnej, w tym w farmacji.
Jego zasada jest następująca. Najpierw mierzy się temperaturę topnienia (lub zamarzania) dokładnej próbki A wybrany rozpuszczalnik. Następnie do rozpuszczalnika dodaje się dokładnie odważoną porcję badanej substancji. B i mierzy się temperaturę topnienia powstałej mieszaniny (lub temperaturę zamarzania, jeśli substancja wybrana jako rozpuszczalnik ma niską temperaturę topnienia). Aby roztwór był rozcieńczony, masa substancji rozpuszczonej musi być znacznie mniejsza niż masa rozpuszczalnika. Otrzymana wartość zastępca DT podstawiamy do równania (7.2) i za jego pomocą obliczamy masę molową badanej substancji. W najprostszym przypadku jako rozpuszczalnik można zastosować wodę destylowaną. Jednak ze względu na małą wartość stałej krioskopowej i niską temperaturę zamarzania, co wymaga stosowania kriostatów lub specjalnych mieszanin chłodzących, wodę wykorzystuje się jedynie do przybliżonego oszacowania masy molowej substancji. Z reguły, zwłaszcza przy badaniu złożonych substancji organicznych o dużej masie molowej, jako rozpuszczalniki wybiera się inne substancje. W tym przypadku szczególne znaczenie ma kamfora ze swoją dużą stałą krioskopową. Głównym warunkiem oznaczania kriometrycznego jest całkowita rozpuszczalność substancji badanej w wybranym rozpuszczalniku. Poniżej znajdują się stałe krioskopowe niektórych substancji (przy normalnym ciśnieniu atmosferycznym):
Substancja T pl o C Krioskopowa
stały K kr
Benzen 5,5 5,12
Kwas octowy 16,8 3,90
Cykloheksan 6,5 20
Kamfora 178,5 39,7
Metodę krioskopową stosuje się także do określania czystości substancji. Polega to na tym, że obecność nawet najmniejszego zanieczyszczenia obniża temperaturę topnienia próbki badanej substancji. Dlatego w chemii (a także w farmacji) jednym z kryteriów czystości substancji jest osiągnięcie maksymalnej temperatury topnienia, która nie wzrasta dalej po dodatkowych operacjach oczyszczania.
Innym ważnym zastosowaniem efektu krioskopowego jest przygotowywanie mieszanin chłodzących. Przy pewnym stosunku wody (lub śniegu) i niektórych soli nieorganicznych można uzyskać niskie temperatury, przechowywany dość długo. Przykładowo mieszanka składająca się ze 100 g śniegu i 143 g CaCl 2 6H 2 O pozwala uzyskać temperaturę -55 o C.
Na obszarach o zimnym klimacie do wody stosowanej w chłodnicach samochodowych dodaje się środki zapobiegające zamarzaniu, takie jak alkohol, gliceryna lub glikol etylenowy, aby zapobiec jej zamarzaniu w zimie. Lód zamarznięty na drogach i chodnikach łatwo się topi po posypaniu sól kuchenna lub popiół, który również opiera się na efekcie krioskopowym. Trzeba tylko pamiętać, że nadmierne wykorzystanie soli do tych celów może spowodować zasolenie pobliskich zbiorników wodnych i gleb na ich brzegach, a w efekcie zaburzenia środowiska.
Zamrażanie to przejście fazowe, podczas którego ciecz zamienia się w ciało stałe. Temperatura zamarzania cieczy to temperatura, w której ciśnienie pary nasyconej nad cieczą jest równe ciśnieniu pary nasyconej nad wypadającymi z niej kryształami fazy stałej.
W tej temperaturze i przy odpowiednim ciśnieniu pary nasyconej szybkość krystalizacji jest równa szybkości topnienia i obie te fazy mogą współistnieć przez długi czas.
Również M.V. Łomonosow zauważył, że rozcieńczony roztwór zamarza w temperaturze niższej niż czysty rozpuszczalnik. Zatem woda morska zamarza nie w temperaturze 273 K, ale w nieco niższej temperaturze. Liczne eksperymenty wykazały, że taką zmianę temperatury zamarzania roztworu można uznać za ogólną zasadę.
Procesy zamrażania i wrzenia zostały szczegółowo zbadane przez Raoulta i przedstawione w formie prawa, które później nazwano drugim prawem Raoulta.
Rozważmy najprostsze wyprowadzenie tego prawa. Rycina 2 przedstawia wykres wyrażający zależność prężności pary nasyconej od temperatury nad czystym rozpuszczalnikiem i nad roztworem.
Krzywa 0A to zależność prężności pary nasyconej czystej wody od temperatury.
Krzywa BC, DE – zależność prężności pary nasyconej wody od roztworów o różnym stężeniu substancji rozpuszczonej
0D – wyraża zależność temperaturową prężności pary nasyconej wody nad lodem.
Z ryc. 2 jasno wynika, że prężność pary nad roztworem w temperaturze 273 K jest niższa niż nad wodą, ale nie jest równa prężności pary nad lodem w tej samej temperaturze. Dopiero w temperaturach poniżej 273 K (T'z) prężność pary nad roztworem spada tak bardzo, że staje się równa prężności pary nad lodem. Odpowiada to punktowi B. Przy wyższych stężeniach roztworów krzywe wyrażające zależność ciśnienia pary wodnej nad roztworem od temperatury znajdują się poniżej krzywej BC, ale do niej równolegle.
Przedstawmy następny zapis:
Р 0 А – prężność pary nad czystym rozpuszczalnikiem w temperaturze 273 K
P A – prężność pary nad roztworem w temperaturze zamarzania T’z
Z prawego trójkąta WOK wyznaczamy
Z rysunku 2 jasno wynika, że , gdzie jest spadek temperatury zamarzania roztworu.
Podstawiając te wartości do powyższego równania, otrzymujemy

 (3)
(3)
Z pierwszego prawa Raoulta dla silnie rozcieńczonych roztworów mamy
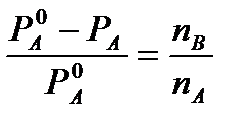
 I
I  (4)
(4)
gdzie n A, n B, m A zachowują przypisane wcześniej oznaczenia (patrz wyżej). Jeśli oznaczymy masę molową rozpuszczalnika przez M 0 A, to

Podstawiając to wyrażenie do równania (4) otrzymujemy

Następnie pomnóż i podziel prawą stronę tego wyrażenia przez 1000
 (5)
(5)
Połączmy wszystkie wielkości stałe w równaniu (5) w jedną stałą K (  ), otrzymujemy następujące wyrażenie
), otrzymujemy następujące wyrażenie
 (6)
(6)
Wyrażenie  reprezentuje molalność roztworu St.
reprezentuje molalność roztworu St.
Podstawiając to wyrażenie do równania (6) otrzymujemy równanie końcowe.
 (7)
(7)
Jest to matematyczny wyraz drugiego prawa Raoulta: spadek temperatury krzepnięcia lub wzrost temperatury wrzenia roztworu jest wprost proporcjonalny do jego stężenia molowego.
Współczynnik K w równaniu (7) nazywany jest stałą krioskopową, pokazuje molowy spadek temperatury zamarzania roztworu i wynosi Cechy indywidulane rozpuszczalnik (K H2O = 1,86°) i ma taki sam wymiar jak E (K° kg mol -1)
Metodę badawczą polegającą na pomiarze spadku temperatury zamarzania roztworów nazywa się krioskopową. Podobnie jak ebulioskopowy, pozwala obliczyć masę molową rozpuszczonej substancji

Rysunek 3 przedstawia urządzenie przeznaczone do pomiaru temperatury zamarzania roztworów.
 |
OSMOZA I CIŚNIENIE OSMOTYCZNE.
Bardzo ważną biologicznie ważną właściwością roztworów jest osmoza.
W naturze roztwory są często oddzielone od rozpuszczalnika membranami, które są przepuszczalne tylko dla cząstek rozpuszczalnika. W takim przypadku substancja rozpuszczona nie może dyfundować do rozpuszczalnika i obserwowane będzie jedynie przejście rozpuszczalnika do roztworu, tj. rozpuszczalnik będzie poruszał się w obu kierunkach, ale nadal trochę więcej go dostanie się do roztworu niż do środka odwrotny kierunek.
Mechanizm osmozy jest łatwy do wyobrażenia na podstawie destylacji izotermicznej. Niech półprzepuszczalna membrana posiadająca mikropory oddzieli rozpuszczalnik i roztwór o stężeniu C w (ryc. 4)

W porach ograniczonych z jednej strony rozpuszczalnikiem, a z drugiej roztworem następuje parowanie. Ze względu na wzrost elastyczności pary nasyconej zgodnie z prawem Raoulta, prężność pary z fazy gazowej zagęszcza się od strony rozpuszczalnika, przechodząc do roztworu.
W wyniku osmozy zwiększa się objętość roztworu i stopniowo maleje jego stężenie; rozpuszczalnik wnikający do roztworu przez membranę zwiększa słup cieczy h, a tym samym zwiększa ciśnienie hydrostatyczne (patrz rys. 5). Jednocześnie zwiększy się liczba cząsteczek rozpuszczalnika przemieszczających się przez membranę w przeciwnym kierunku, tj. od roztworu do rozpuszczalnika. Stopniowo ciśnienie hydrostatyczne i rozcieńczenie roztworu osiągną wartości, przy których liczba cząsteczek rozpuszczalnika poruszających się w obu kierunkach wyrówna się i nastąpi równowaga osmotyczna. Nadciśnienie hydrostatyczne powstałe w wyniku osmozy, mierzone przez kolumnę roztworu o wysokości h, przy której ustala się równowaga osmotyczna, nazywa się ciśnieniem osmotycznym.
![]() Ryż. 5
Ryż. 5
Membrany wykonane z kolodionu, celofanu, miedzi syntlenkowej żelaza itp. są półprzepuszczalne dla wielu roztworów.
PRAWA CIŚNIENIA OSMOTYCZNEGO.
Badanie praw ciśnienia osmotycznego ujawniło ich pełną analogię z prawami gazu. W przypadku rozcieńczonych roztworów nieelektrolitów można je formułować w następujący sposób:
w stałej temperaturze ciśnienie osmotyczne jest wprost proporcjonalne do stężenia molowego substancji rozpuszczonej (analogicznie do prawa Boyle'a-Mariotte'a):

przy stałym stężeniu molowym ciśnienie osmotyczne jest wprost proporcjonalne do temperatury bezwzględnej (analogicznie do prawa Gay-Lussaca):

Z tych dwóch praw wynika, że przy tych samych stężeniach molowych i temperaturze roztwory różnych nieelektrolitów wytwarzają to samo ciśnienie osmotyczne, tj. równomolowe roztwory nieelektrolitów są izotoniczne (analogicznie do prawa Avogadra).
Van't Hoff zaproponował ujednolicone prawo ciśnienia osmotycznego w roztworach (podobne do ujednoliconego prawa gazowego Mendelejewa-Claiperona): Ciśnienie osmotyczne rozcieńczonych roztworów nieelektrolitów jest wprost proporcjonalne do stężenia molowego, współczynnika proporcjonalności i temperatury bezwzględnej:
ponieważ c=n/V, gdzie n jest liczbą moli nieelektrolitu, a V jest objętością roztworu, to  Lub
Lub ![]()
Rozcieńczone roztwory nieelektrolitów.
Właściwości koligatywne roztworów
Ciśnienie pary nasyconej
Równowagę „indywidualnej cieczy i pary” opisuje stała równowagi
K p =p o nas. para /a z (1)
Zatem, ponieważ aktywność pojedynczej cieczy a o x = 1, prężność pary nasyconej jest równa
p o para = K p (2)
i zależy tylko od temperatury.
Ponieważ aktywność rozpuszczalnika jest równa iloczynowi a o x jego frakcji molowej N 1 lub (1 - N 2), gdzie N 2 jest ułamkiem molowym rozpuszczonej substancji, wówczas stała równowagi jest równa:
K p =p 1 o =(p 1 /a o x N 1)=(p 1 /1-N 2) (3)
Stąd dostajemy Prawo Raoulta (1886):
p 1 = p 1 o (1-N 2) = p 1 o N 1 (4)
(p 1 o -p 1)/p 1 o)=N 2 (5)
Prężność pary nasyconej roztworu jest równa jego ciśnieniu nad czystym rozpuszczalnikiem pomnożonemu przez ułamek molowy rozpuszczalnika.
Względny spadek prężności pary nasyconej rozpuszczalnika w stosunku do czystego roztworu jest równy ułamkowi molowemu substancji rozpuszczonej.
Zatem prężność pary zależy już od zawartości substancji rozpuszczonej. Prawo Raoulta można zastosować do określenia masy molowej substancji rozpuszczonej:
Dp/p 1 ° =N 2 =n 2 /n 1 +n 2 ≈m 2 M 1 /m 1 M 2 (6)
Temperatura wrzenia roztworów
Ciecz wrze, gdy ciśnienie pary nasyconej zrówna się z ciśnieniem zewnętrznym. Ponieważ zgodnie z prawem Raoulta prężność pary nad roztworem jest mniejsza niż prężność pary nad czystym rozpuszczalnikiem, temperatura wrzenia roztworu jest wyższa niż temperatura wrzenia czystego rozpuszczalnika.
Doświadczenia wykazały, że dla rozcieńczonych roztworów nieelektrolitów:
gdzie DT to wzrost temperatury wrzenia roztworu w porównaniu do czystego rozpuszczalnika, b to molalność ([E] = K. Kg/mol) E to stała ebulioskopowa (od ebbulio (łac.) - wrzenie), zależna tylko na temat właściwości rozpuszczalnika (jego temperatura wrzenia To i ciepło właściwe parowania L 1):
E=RT o 2 /1000L 1 (8)
Temperatura wrzenia czystego rozpuszczalnika ma określoną wartość przy stałym ciśnieniu zewnętrznym. Temperatura wrzenia roztworu nie jest stała - wzrasta wraz z wrzeniem, ponieważ w wyniku odparowania rozpuszczalnika wzrasta stężenie roztworu. Jednocześnie prężność pary nasyconej stale maleje. Dlatego za temperaturę wrzenia roztworu uważa się temperaturę odpowiadającą pojawieniu się w nim pierwszego pęcherzyka pary.
Temperatura zamarzania roztworów
Nad roztworem prężność pary rozpuszczalnika jest niższa niż prężność pary nad czystym rozpuszczalnikiem. Prężność pary nad fazą stałą i ciekłą również będzie mniejsza. Może się to zdarzyć tylko przy niższej temperaturze zamarzania roztworu w porównaniu z czystym rozpuszczalnikiem. Spadek temperatury zamarzania roztworów nieelektrolitów w stosunku do temperatury zamarzania czystego rozpuszczalnika jest proporcjonalny do molalności roztworu:
gdzie K jest stałą krioskopową (od greckiego „krios” - zimno), zależną tylko od właściwości rozpuszczalnika:
K=RT o 2 /1000L 1, (10)
gdzie To, L * 1 to temperatura zamarzania i ciepło właściwe topnienia czystego rozpuszczalnika.
Ponieważ stężenie rozpuszczonej substancji wzrasta wraz ze krzepnięciem rozpuszczalnika, temperatura zamarzania roztworu nie jest stała i maleje w trakcie procesu. Dlatego temperaturę tworzenia pierwszego kryształu przyjmuje się jako temperaturę zamarzania roztworu.
Tabela 2 pokazuje wartości E i K dla niektórych rozpuszczalników.
Tabela 2.
Kryształy rozpuszczalnika będą w równowadze z roztworem tylko wtedy, gdy ciśnienie pary nasyconej nad kryształami i nad roztworem będzie takie samo. Ponieważ prężność pary rozpuszczalnika nad roztworem jest zawsze niższa niż nad czystym rozpuszczalnikiem, temperatura odpowiadająca tym warunkom będzie zawsze niższa niż temperatura zamarzania czystego rozpuszczalnika. W tym przypadku spadek temperatury zamarzania roztworu ΔT nie zależy od charakteru rozpuszczonej substancji i jest określony jedynie przez stosunek liczby cząstek rozpuszczalnika i rozpuszczonej substancji.
Można wykazać, że spadek temperatury zamarzania roztworu ΔT jest wprost proporcjonalny do stężenia molowego roztworu:
Drugie prawo Raoulta: Wzrost Twrzenia i spadek Tzam roztworu są proporcjonalne do liczby cząstek rozpuszczonej substancji i nie zależą od jej charakteru.
Koniec pracy -
Ten temat należy do działu:
Wykład nr 5. Równowagi fazowe. Roztwory nieelektrolitowe
Stan gazowy substancji charakteryzuje się słabym oddziaływaniem między cząsteczkami i dużymi odległościami między nimi.Dlatego mieszają się gazy... Całkowite ciśnienie mieszaniny gazów jest równe sumie ciśnień cząstkowych wszystkich składników...
Jeśli potrzebujesz dodatkowych materiałów na ten temat lub nie znalazłeś tego czego szukałeś, polecamy skorzystać z wyszukiwarki w naszej bazie dzieł:
Co zrobimy z otrzymanym materiałem:
Jeśli ten materiał był dla Ciebie przydatny, możesz zapisać go na swojej stronie w sieciach społecznościowych:
| Ćwierkać |
Wszystkie tematy w tym dziale:
Wykład nr 5. Równowagi fazowe. Roztwory nieelektrolitowe.
Równowagi fazowe. Na ostatnim wykładzie przyglądaliśmy się równowadze chemicznej, stałej równowagi i jej powiązaniu z tak dalej. wielkości i czynniki wpływające na przesunięcie równowagi.
Systemy dwuskładnikowe.
Rozwiązaniem jest jednorodny układ składający się z dwóch lub więcej składników, którego skład może się stale zmieniać w określonych granicach, bez gwałtownych zmian jego właściwości.
Tworzenie roztworu
Tworzenie roztworu jest złożonym procesem fizycznym i chemicznym. Procesowi rozpuszczania zawsze towarzyszy wzrost entropii układu; Kiedy powstają rozwiązania, często następuje uwolnienie jednego z nich
Rozpuszczalność
Proces rozpuszczania jest związany z dyfuzją, to znaczy ze spontanicznym rozkładem cząstek jednej substancji pomiędzy cząsteczkami drugiej. Proces rozpuszczania następuje po dodaniu substancji rozpuszczonej do rozpuszczalnika
Rozpuszczalność gazów w cieczach
Rozpuszczalność gazów w cieczach zależy od wielu czynników: charakteru gazu i cieczy, ciśnienia, temperatury, stężenia substancji rozpuszczonych w cieczy (w szczególności rozpuszczalności gazów).
Roztwory nieelektrolitowe.
Właściwości roztworów rozważa się na przykładzie roztworów rozcieńczonych, przy tworzeniu których efekty termiczne i objętościowe są równe 0 (roztwory idealne). W takich rozwiązaniach cząstka znajduje się na dużej powierzchni
Względny spadek ciśnienia pary nasyconej nad roztworem jest równy ułamkowi molowemu substancji rozpuszczonej.
Każda ciecz zaczyna wrzeć w temperaturze, w której ciśnienie pary nasyconej osiąga ciśnienie zewnętrzne. T wrzenia - T przy którym ciśnienie pary = 101,3 kPa Woda wrze w temperaturze 100 C,
Ciśnienie osmotyczne
Jeśli dwa roztwory o różnych stężeniach zostaną oddzielone półprzepuszczalną przegrodą, która umożliwia przejście cząsteczek rozpuszczalnika, ale zapobiega przedostawaniu się cząstek substancji rozpuszczonej, zaobserwuję
