Опыт резерфорда по рассеянию альфа частиц. Опыт Резерфорда по рассеянию альфа-частиц (кратко). Причина, по которой отклонялись альфа-частицы
В 1906 г. Резерфорд обнаружил рассеяние α-частиц. Метод Резерфорда заключался в следующем. Проволока, покрытая радием С, помещалась в углубление в куске свинца. Над проволокой помещалась узкая щель; α-частицы, проходя через эту щель попадали на фотографическую пластинку. Все это помещалось в латунный цилиндр, из которого выкачивался воздух. Цилиндр помещался между полюсами электромагнита, силовые линии которого шли параллельно проволоке. Получающиеся на фотопластинке полосы были в пустоте резко ограничены. Если же цилиндр заполнялся воздухом, то полосы получались более широкими, а края их размытыми. Если щель прикрыть тонким слоем какого-либо вещества, то полосы уширяются и интенсивность их постепенно убывает от центра к краям.
В 1909-1910 гг. Г. Гейгер тщательно исследовал рассеяние α-частиц методом сцинтилляции. Прибор Гейгера изображен на рисунке, взятом из статьи Гейгера, 1910 г. В коническую трубку Л, закрытую тонким слоем слюды, вводится радон, который остается в ней на несколько часов. Затем радон засасывается в сосуд В, и вскоре после этого все α-частицы выбрасываются радием: С, осевшим на стенках трубки. Щель D выделяет из потока α-частиц, испускаемых радием С, узкий пучок, который дает яркую картину сцинтилляций на сернистоцинковом экране S. Если затем в Е поместить тонкую пластинку из исследуемого вещества, сцинтилляции на экране уменьшаются вследствие рассеяния α-частиц. Результаты опыта представлены кривыми, где по оси абсцисс отложены углы рассеяния, а по оси ординат - число частиц, рассеиваемых под данным углом. Из опытов Гейгера вытекает, что:
- Наиболее вероятный угол рассеяния (т. е. угол, для которого число рассеянных частиц наибольшее) возрастает для малых толщин приблизительно пропорционально корню квадратному из толщины вещества, пронизываемого α-частицами. Для больших толщин рассеяние возрастает значительно быстрее.
- Наиболее вероятный угол, на который отклоняется частица, проходя через атом, пропорционален атомному весу. Действительное значение этого угла в случае золотого атома составляет около 1 / 200 градуса.
- Наиболее вероятный угол рассеяния быстро увеличивается с уменьшением скорости α-частицы, будучи в первом приближении обратно пропорциональным кубу скорости.
Наиболее поразительным явлением, наблюдавшимся при рассеянии α-частиц, был факт, открытый в 1909 г. Гейгером и Марсденом , что некоторая малая часть частиц рассеивается на очень большие углы, такие, что частицы вылетают обратно в сторону источника. Для α-частиц, испускаемых радием С, приблизительно одна из 8000 частиц рассеивается на угол, больший прямого.

Как объяснить этот факт? Если предположить, что атом имеет структуру, предложенную Д. Д. Томсоном , то единичные отклонения α-частицы при столкновении с таким атомом очень малы, и большие углы рассеяния можно истолковать как кумулятивный эффект, получающийся в результате многих отклонений. Расчеты, проведенные самим Томсоном и Резерфордом, показали, что даже при большем числе столкновений результирующее отклонение α-частицы должно быть очень незначительным. "Я показал,- писал Резерфорд в 1914 г.,- что модель атома, предложенная лордом Кельвином и разработанная с большими деталями сэром Д. Д. Томсоном, не может давать таких больших отклонений, если не принять, что диаметр положительной сферы чрезвычайно мал".
Необходимость интерпретировать результаты опытов Гейгера и Марсдена и привела Резерфорда к ядерной модели атома. Он впервые сообщил о своем открытии в докладе "Рассеяние α- и β-лучей и строение атома", прочитанном в Философском обществе Манчестера 7 марта 1911 г. Мы приведем это сообщение ввиду его огромного исторического значения полностью.
"Хорошо известно, что α- и β-частицы будут отклоняться от своих прямолинейных путей при соударениях с атомами материи. Рассеяние β-частиц вследствие их малого момента (т. е. импульса.- П. К.) и энергии вообще значительно больше, чем отклонение α-частиц. Кажется несомненным, что эти быстро движущиеся частицы действительно проходят через атомную систему и подробное исследование происходящих отклонений должно пролить свет на электрическое строение атома. Обычно предполагается, что наблюдаемое рассеяние является результатом множества малых рассеяний. Сэр Д. Д. Томсон (Proc. Camb. Phil. Soc. 15, p. 5, 1910) недавно продвинул вперед теорию малых рассеяний, и главные выводы теории были экспериментально проверены Гроутером (Proc. Roy. Soc. 84, p. 226, 1910) . По этой теории атом предполагается состоящим из положительно наэлектризованной сферы, содержащей равное количество отрицательного электричества в форме корпускул. При сравнении теории с опытом Гроутер заключил, что число корпускул в атоме примерно в три раза больше его атомного веса, выраженного в весе водорода. Однако имеется ряд экспериментов по рассеянию, которые показывают, что α- и β-частицы иногда испытывают отклонения более 90° в единичном столкновении. Например, Гейгер и Марсден (Proc. Roy. Soc. 82, p. 493, 1909) нашли, что незначительная часть α-частиц, падающих на тонкий золотой листок, испытывает отклонение, больше прямого угла. Такое большое отклонение не может быть объяснено по теории вероятностей, принимая во внимание наблюдаемое экспериментально малое рассеяние. Совершенно определенно кажется, что эти большие отклонения происходят в единичном атомном столкновении.
Чтобы объяснить эти и другие результаты необходимо предположить, что наэлектризованные частицы проходят через интенсивное электрическое поле в атоме. Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины. При таком устройстве атома α- и β-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность большого отклонения мала. По этой теории доля общего числа заряженных частиц, испытывающих отклонение между углами Ф и Ф+dФ дается выражением

где n число атомов в единице объема рассеивающего материала, t - предполагаемая малой толщина материала и ![]() где Ne - заряд в центре атома, Е - заряд наэлектризованной частицы, m - ее масса, и u - ее скорость.
где Ne - заряд в центре атома, Е - заряд наэлектризованной частицы, m - ее масса, и u - ее скорость.
Отсюда следует, что число рассеянных частиц на единицу площади для постоянного расстояния от точки падения пучка лучей меняется как cosec 4 Ф / 2 .Этот закон распределения был проверен экспериментально Гейгером для α-частиц и найден справедливым в пределах экспериментальных ошибок.
Из обсуждения общих результатов рассеяния различными материалами центральный заряд атома был найден очень близко пропорциональным его атомному весу. Точное значение заряда центрального ядра не было определено, но для атома золота оно приблизительно равно 100 единицам заряда".
В такой классически ясной и сжатой форме мир узнал об одном из величайших открытий в истории науки.
Через два года Резерфорд охарактеризовал более подробно свои работы и работы своих сотрудников, приведшие к открытию ядерной модели атома, в книге "Радиоактивные вещества и их излучения".
Здесь были приведены расчеты, позволяющие определить число α-частиц, рассеянных под углом φ к первоначальному направлению пучка:

где n - число атомов в единице объема рассеивающего вещества, t - толщина рассеивающей пластинки, Q - число α-частиц, падающих на единицу площади рассеивающей пластинки, r - расстояние от источника до экрана, b - величина, определяемая равенством

где Ne - заряд рассеивающего ядра, Е - заряд α-частицы, m - ее масса, V - скорость.
Закон Резерфорда позволяет не только проверить справедливость гипотезы ядерного строения атома, но и определить заряд ядра (Ne). Гейгер немедленно в том же, 1911 г. приступил к его проверке. Эксперимент подтвердил справедливость закона cosec 4 φ / 2 и дал указание на то, что величина заряда приблизительно пропорциональна атомному весу. В 1913 г. Гейгер и Марсден предприняли новую экспериментальную проверку формулы Резерфорда, пользуясь методом сцинтилляции. "Это была весьма трудная и кропотливая работа, - писал Резерфорд, - так как нужно было сосчитать много тысяч частиц. Результаты Гейгера и Марсдена весьма близко согласуются с теорией".
Вот некоторые данные Гейгера и Марсдена.
При изменении скорости V и прочих неизменных параметрах формула Резерфорда дает, что yV 4 = const. Данные Гейгера-Марсдена:
>
1 / V 4 (Относительная величина) 1,0 1,21 1,50 1,91 2,84 4,32 9,22
Для зависимости от угла формула Резерфорда дает

По данным Гейгера и Марсдена,

И наконец, для зависимости от заряда (Ne) формула Резерфорда дает постоянство отношений v" / A 2 , где А - атомный вес, v" = v / nt - "приведенное число сцинтилляций". По данным Гейгера и Марсдена,

"Гейгер и Марсден нашли,- указывает Резерфорд,- что рассеяние различными атомами вещества приблизительно пропорционально квадрату атомного веса, откуда следует, что заряд атома приблизительно пропорционален атомному весу. Определив число α-частиц, рассеянных тонкими пленками золота, они заключили, что нуклеарный заряд приблизительно равен половине атомного веса, помноженной на заряд электрона. Вследствие трудностей опыта действительное число можно было определить лишь с точностью, не превосходящей 20%.
"Таким образом,- заключает Резерфорд изложение результатов опытов Гейгера и Марсдена,- экспериментальные результаты Гейгера и Марсдена оказались в полном согласии с предсказаниями теории и указали на то, что сделанная мною гипотеза о строении атома, в ее простейших чертах правильна". Интересно отметить, что еще в 1913 г. Резерфорд принимал заряд ядра равным +Ne, т. е. допускал возможность как положительного, так и отрицательного заряда ядра. Действительно, механика отклонения допускает как положительный, так и отрицательный заряд атома. Но целый ряд фактов, и в частности исследования Д. Д. Томсона с положительными лучами, о которых мы вскоре будем говорить, показали, что носители положительного электричества всегда сопряжены с массой, большей или равной массе атома водорода. Массивное ядро может быть носителем только положительных зарядов. Правда, уже в 1913 г. Бор пришел к выводу, что в составе ядра должны быть и электроны. Эта гипотеза была впервые высказана Марией Склодовской-Кюри. Во всяком случае, к 1913 г. окончательно выяснилась связь между зарядом ядра и порядковым номером элемента в менделеевской таблице (ван ден Брук, Мозли).
Эксперимент по рассеиванию альфа-частиц
Открытие электрона, рентгеновского излучения и явления радиоактивности свидетельствовало о том, что представление об атоме как неделимой частице являлось неверным. К концу \(XIX\) века стало понятно, что атом должен иметь сложное строение. Большой вклад в изучение строения атома внёс физик-экспериментатор Эрнест Резерфорд .
Эрнест Резерфорд
В \(1904\) году Резерфорд начал свои эксперименты по бомбардировке альфа-частицами тонких металлических пластин (золотых и платиновых) для изучения структуры атомов, из которых состоят пластины.
Альфа-частица - ионизированный атом гелия.
Альфа-частица - это массивная (масса альфа-частицы в несколько тысяч раз больше, чем масса электрона) положительно заряженная частица. Заряд альфа-частицы в два раза больше элементарного заряда.
Схематично установка Резерфорда изображена на рисунке ниже.
В толстостенном свинцовом футляре (\(1\)) находится радиоактивное вещество (\(2\)), излучающее поток альфа-частиц. Через небольшое отверстие (\(3\)) поток альфа-частиц направляется на тонкую золотую фольгу (\(4\)) (толщиной порядка \(0,1\) мк). За фольгой располагается экран, покрытый сернистым цинком (\(5\)). При столкновении альфа-частицы на экране наблюдается вспышка.
Согласно модели строения атома по Томпсону, альфа-частицы должны столкнуться с большими плотными атомами и разлететься под разными углами. Однако опыт показал, что большинство альфа-частиц пролетают беспрепятственно через пластинку металла (\(6\)). И только небольшая часть всех альфа-частиц изменяет направление движения, отклоняясь на небольшие углы (\(7\)). А некоторые частицы и вовсе отлетают от фольги в обратном направлении (\(8\)).
Результаты опыта были удивительными. Только в \(1911\) году Резерфорд смог объяснить результаты опытов, предложив новую модель строения атома.
Ядерная модель строения атома
Так как большинство альфа-частиц свободно проходило через фольгу, это означало, что практически всё пространство, через которое проходит поток альфа-частиц - это пустота. Где же тогда «спрятана» вся масса атома? Резерфорд предположил, что практически вся масса атома сосредоточена в очень маленьком объёме - ядре атома. Было очевидно, что ядро должно быть положительно заряжено. Когда альфа-частица пролетает достаточно близко от такого ядра, то из-за Кулоновских сил отталкивания происходит отклонение от первоначального направления движения частицы. А при столкновении с ядром частица отскакивает в обратном направлении. По расчётам Резерфорда, ядро атома должно было иметь размер примерно в \(3000\) раз меньший, чем атом. Остальное пространство атома должны занимать электроны.
Планетарная модель строения атома
Итак, стало понятно, что «пудинговая модель строения атома» неверна. На основе экспериментальных данных была предложена новая модель строения атома, которая получила название «планетарная модель строения атома ».
Обрати внимание!
Согласно модели Резерфорда, атом состоит из очень маленького положительно заряженного ядра, размер которого в тысячи раз меньше самого атома, и электронов, которые вращаются вокруг ядра по круговым орбитам.
Модель очень напоминала модель строения Солнечной системы, где вокруг массивного Солнца по круговым орбитам вращаются планеты.
Таким образом, на основе планетарной модели можно было объяснить результаты опытов по рассеянию альфа - частиц. Однако объяснить стабильность атомов не удавалось. Движение электрона в атоме происходит с ускорением. В соответствии с классической электродинамикой это движение должно было сопровождаться излучением электромагнитных волн, в результате чего энергия электрона в атоме непрерывно уменьшалась бы. Электрон стал бы приближаться к ядру по спирали и должен был бы очень скоро упасть на него. Однако атомы стабильны. Следовательно, планетарная модель противоречила законам классической физики.
Строение атома является сложным. Это подтверждают открытия таких явлений, как электрон, рентгеновские лучи и радиоактивность. В результате теоретических исследований и многочисленных опытов была построена теория строения атома . Особенно важный вклад в создание теории строения атома внёс английский физик Эрнест Резерфорд (1871 – 1937), который проводил опыты по изучению прохождения альфа-частиц через тонкие металлические пластины золота и платины.
Резерфорд в 1906 году предложил провести зондирование атомов тяжёлых элементов альфа-частиц с энергией 4,05 МэВ, которые испускались ядром урана или радия. Таким образом предлагалось изучить рассеяние (изменение направления движения) альфа-частиц в веществе.
Масса альфа-частицы примерно в 8000 раз больше массы электрона. Положительный заряд равен по модулю удвоенному заряду электрона 2е. Скорость альфа-частицы составляет 1/15 скорости света или 2 * 10 7 м/с. Альфа-частица – это полностью ионизированный атом гелия.
Упрощенная схема опытов Резерфорда изображена на рис. 1.1. Альфа-частицы испускались радиоактивным источником 1, помещённым внутри свинцового цилиндра 2 с узким каналом 3. Узкий пучок альфа-частиц из канала падал на фольгу 4 из исследуемого материала, перпендикулярно к поверхности фольги. Из свинцового цилиндра альфа-частицы проходили только через канал, а остальные поглощались свинцом. Прошедшие сквозь фольгу и рассеянные ею альфа-частицы попадали на полупрозрачный экран 5, который был покрыт люминесцирующим веществом (сульфатом цинка). Это вещество было способно светиться при ударе об него альфа-частицы. Столкновение каждой частицы с экраном сопровождалось вспышкой света. Эта вспышка называется сцинтилляция (от латинского scintillation – сверкание, кратковременная вспышка света). За экраном находился микроскоп 6. Чтобы не происходило дополнительного рассеяния альфа-частиц в воздухе, весь прибор размещался в сосуде с достаточным вакуумом.
Рис. 1.1. Упрощённая схема опытов Резерфорда.
В отсутствие фольги на экране возникал светлый кружок, состоящий из сцинтилляций, вызванных тонким пучком альфа-частиц. Но когда на пути движения альфа-частиц помещали тонкую золотую фольгу толщиной примерно 0,1 мк (микрон), то наблюдаемая на экране картинка сильно менялась: отдельные вспышки появлялись не только за пределами прежнего кружка, но их можно было даже наблюдать с противоположной стороны золотой фольги.
Подсчитывая число сцинтилляций в единицу времени в разных местах экрана, можно установить распределение в пространстве рассеянных альфа-частиц. Число альфа-частиц быстро убывает с увеличением угла рассеяния.
Наблюдаемая на экране картина позволила заключить, что большинство альфа-частиц проходит сквозь золотую фольгу без заметного изменения направления их движения. Однако некоторые частицы отклонялись на большие углы от первоначального направления альфа-частиц (порядка 135 о …150 о) и даже отбрасывались назад. Исследования показали, что при прохождении альфа-частиц сквозь фольгу примерно на каждые 10000 падающих частиц только одна отклоняется на угол более 10 о от первоначального направления движения. Лишь в виде редкого исключения одна из огромного числа альфа-частиц отклоняется от своего первоначального направления.
Тот факт, что многие альфа-частицы проходили сквозь фольгу, не отклоняясь от своего направления движения, говорит о том, что атом не является сплошным образованием. Так как масса альфа-частицы почти в 8000 раз превосходит массу электрона, то электроны, входящие в состав атомов фольги, не могут заметно изменить альфа-частиц. Рассеяние альфа-частиц может вызывать положительно заряженная частица атома – атомное ядро.
Атомное ядро – это тело малых размеров, в котором сконцентрированы почти вся масса и почти весь положительный заряд атома.
Чем ближе альфа-частица подходила к ядру, тем больше была сила электрического взаимодействия и тем на больший угол частица отклонялась. На малых расстояниях от ядра положительно-заряженная альфа-частица испытывает значительную силу отталкивания F от ядра, которую определяют по закону Кулона:
| F = |
где r – расстояние от ядра до альфа-частицы; ε 0 – электрическая постоянная в единицах измерения СИ; p – число протонов в ядре; е = 1,6*10-19 Кл – абсолютное значение элементарного электрического заряда (заряда электрона); 2e – заряд альфа-частицы
На рисунке 1.2 показаны траектории альфа-частиц, пролетающих на различных расстояниях от ядра.
Резерфорд смог ввести формулу, связывающую количество рассеянных на определённый угол альфа-частиц с энергией альфа-частиц и протонов р в ядре атома. Опытная проверка формулы подтвердила её справедливость и показала, что количество протонов в ядре равно числу внутриатомных электронов Z и определяется атомным номером химического элемента (то есть порядковым номером элемента в периодической системе Д.И.Менделеева):
p = Z
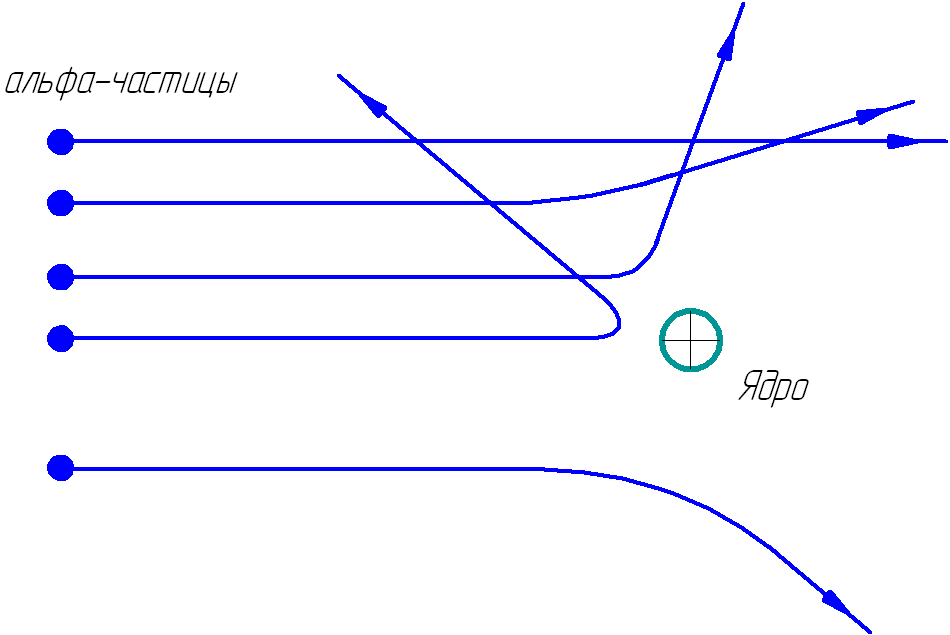
Рис. 1.2. Траектории альфа-частиц.
Подсчитывая количество альфа-частиц, рассеянных на различные углы, Резерфорд смог оценить линейные размеры ядра. Чтобы положительное ядро могло отбросить альфа-частицу назад, потенциальная энергия электростатического (кулоновского) отталкивания у границ ядра атома должна равняться кинетической энергии альфа-частицы:
| = |
Оказалось, что ядро имеет диаметр:
d я = 10 -13 …10 -12 см = 10 -15 …10 -14 м
Линейный диаметр самого атома:
d a = 10 -8 см = 10 -10 м
Планетарная модель атома
После анализа многочисленных опытов, Резерфордом в 1911 году была предложена планетарная модель атома (ядерная модель атома).
Согласно этой модели в центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Вокруг ядра вращаются по орбитам отрицательно заряженные электроны. Электроны движутся вокруг ядра на относительно больших расстояниях, подобно тому, как планеты вращаются вокруг солнца. Из совокупности этих электронов образуется электронная оболочка или электронное облако .
Атом в целом нейтрален, следовательно, абсолютное значение суммарного отрицательного заряда электронов равно положительному заряду ядра: число Z*e протонов в ядре равно числу электронов в электронном облаке и совпадает с порядковым номером (атомным номером) Z атома данного химического элемента в периодической системе Д.И.Менделеева.
Например, атом водорода имеет порядковый номер Z = 1, следовательно, атом водорода состоит из положительного ядра с зарядом, равным абсолютному значению заряда электрона. Вокруг ядра вращается один электрон. Ядро атома водорода названо протоном. Атом лития имеет порядковый номер Z = 3, следовательно, вокруг ядра атома лития вращаются 3 электрона.
Эрнест Резерфорд - это один из основателей фундаментального учения о внутреннем строении атома. Родился ученый в Англии, в семье эмигрантов из Шотландии. Резерфорд был четвертым ребенком в своей семье, при этом оказался самым талантливым. Особый вклад ему удалось внести в теорию строения атома.
Первоначальные представления о строении атома
Нужно отметить, что до того, как был проведен знаменитый опыт Резерфорда по рассеянию альфа-частиц, господствующей на то время идеей о строении атома была модель Томпсона. Этот ученый был уверен, что положительный заряд равномерно заполнял весь объем атома целиком. Отрицательно заряженные электроны, считал Томпсон, были будто бы вкраплениями в него.

Предпосылки к научному перевороту
После окончании школы Резерфорд как самый талантливый ученик получил грант в 50 фунтов для дальнейшего обучения. Благодаря этому он сумел поступить в колледж в Новой Зеландии. Далее молодой ученый сдает экзамены в Кентерберийском университете и начинает серьезно заниматься физикой и химией. В 1891 году Резерфорд сделал свой первый доклад на тему «Эволюция элементов». В нем впервые в истории была обозначена идея о том, что атомы представляют собой сложнейшие структуры.
Тогда в научных кругах господствовала идея Дальтона о том, что атомы неделимы. Всем, кто окружал Резерфорда, его идее показались совершенным безумием. Молодому ученому приходилось постоянно приносить извинения коллегам за свою «чепуху». Но через 12 лет Резерфорд все же сумел доказать свою правоту. У Резерфорда появился шанс продолжить свои исследования в Кавендишской лаборатории в Англии, где он начал изучать процессы ионизации воздуха. Первым открытием Резерфорда были альфа- и бета-лучи.

Опыт Резерфорда
Кратко об открытиии можно рассказать так: в 1912 году Резерфорд вместе со своими помощниками провел свой знаменитый опыт - альфа-частицы испускались из свинцового источника. Все частицы, кроме тех, что оказывались поглощенными свинцом, двигались вдоль установленного канала. Их узкий поток попадал на тонкий слой фольги. Эта линия была перпендикулярна листу. Опыт Резерфорда по рассеянию альфа-частиц доказал: те частицы, которые проходили сквозь лист фольги насквозь, вызывали так называемые сцинтилляции на экране.
Этот экран был покрыт особым веществом, которое начинало светиться при попадании на него альфа-частиц. Пространство между слоем и экраном было заполнено вакуумом для того, чтобы альфа-частицы не рассеивались в воздухе. Такой прибор позволил исследователям наблюдать частицы, рассеивающиеся под углом порядка 150°.
Если же фольгу не использовали в качестве препятствия перед пучком из альфа-частиц, то на экране образовывался светлый кружок из сцинтилляций. Но как только перед их лучом ставили барьер из золотой фольги, то картина сильно менялась. Вспышки появлялись не только вне этого кружка, но и на противоположной стороне фольги. Опыт Резерфорда по рассеянию альфа-частиц показал, что большинство частиц проходит через фольгу без заметных изменений в траектории движения.
При этом некоторые частицы отклонялись под довольно большим углом и даже отбрасывались назад. На каждые 10 000 свободно проходящих через слой золотой фольги частиц лишь одна отклонялась на угол, превышавший 10° - в виде исключения одна из частиц отклонялась на такой угол.

Причина, по которой отклонялись альфа-частицы
То, что детально рассмотрел и доказал опыт Резерфорда - строение атома. Такое положение свидетельствовало о том, что атом не представляет собой сплошное образование. Большинство частиц свободно проходили через фольгу толщиной в один атом. И поскольку масса альфа-частицы практически в 8 000 раз больше массы электрона, то последний не мог бы существенно повлиять на траекторию альфа-частицы. Это могло бы быть сделанным лишь атомным ядром - телом малых размеров, обладающим почти всей массой и всем электрическим зарядом атома. На тот момент это стало значительным прорывом английского физика. Опыт Резерфорда считается одной из важнейших ступеней в становлении науки о внутреннем строении атома.
Другие открытия, полученные в процессе изучения атома
Эти исследования стали прямым доказательством того, что положительный заряд атома находится внутри его ядра. Эта область занимает весьма малое пространство по сравнению с его целостными размерами. В таком малом объеме рассеяние альфа-частиц оказалось очень маловероятным. А те частицы, которые проходили вблизи области атомного ядра, испытывали резкие отклонения от траектории, ведь отталкивающие силы между альфа-частицей и ядром атома были очень мощными. Опыт Резерфорда по рассеянию альфа-частиц доказал вероятность того, что альфа-частица попадет прямо в ядро. Правда, вероятность была очень мала, но все же не равна нулю.
Это был не единственный факт, который доказал опыт Резерфорда. Кратко строение атома изучали и его коллеги, которые сделали ряд других важных открытий. Кроме учения о том, что альфа-частицы представляют собой быстро движущиеся ядра гелия.
Ученый смог описать строение атома, в котором ядро занимает незначительную часть всего объема. Его опыты доказали, что практически весь заряд атома сосредоточен внутри его ядра. При этом происходят как случаи отклонения альфа-частиц, так и случаи их столкновения с ядром.

Опыты Резерфорда: ядерная модель атома
В 1911 году Резерфорд после многочисленных исследований предложил которую назвал планетарной. Согласно данной модели, внутри атома расположено ядро, которое содержит в себе практически всю массу частицы. Электроны движутся вокруг ядра подобно тому, как это делают планеты вокруг Солнца. Из их совокупности образуется так называемое электронное облако. Атом же имеет нейтральный заряд, как показал опыт Резерфорда.
Строение атома в дальнейшем заинтересовало ученого по имени Нильс Бор. Именно он доработал учение Резерфорда, ведь до Бора планетарная модель атома стала сталкиваться с трудностями объяснения. Так как электрон движется вокруг ядра по определенной орбите с ускорением, рано или поздно он должен упасть на ядро атома. Однако Нильс Бор смог доказать, что внутри атома законы классической механики уже не действуют.
Эрнест Резерфорд - это один из основателей фундаментального учения о внутреннем строении атома. Родился ученый в Англии, в семье эмигрантов из Шотландии. Резерфорд был четвертым ребенком в своей семье, при этом оказался самым талантливым. Особый вклад ему удалось внести в теорию строения атома.
Первоначальные представления о строении атома
Нужно отметить, что до того, как был проведен знаменитый опыт Резерфорда по рассеянию альфа-частиц, господствующей на то время идеей о строении атома была модель Томпсона. Этот ученый был уверен, что положительный заряд равномерно заполнял весь объем атома целиком. Отрицательно заряженные электроны, считал Томпсон, были будто бы вкраплениями в него.

Предпосылки к научному перевороту
После окончании школы Резерфорд как самый талантливый ученик получил грант в 50 фунтов для дальнейшего обучения. Благодаря этому он сумел поступить в колледж в Новой Зеландии. Далее молодой ученый сдает экзамены в Кентерберийском университете и начинает серьезно заниматься физикой и химией. В 1891 году Резерфорд сделал свой первый доклад на тему «Эволюция элементов». В нем впервые в истории была обозначена идея о том, что атомы представляют собой сложнейшие структуры.
Тогда в научных кругах господствовала идея Дальтона о том, что атомы неделимы. Всем, кто окружал Резерфорда, его идее показались совершенным безумием. Молодому ученому приходилось постоянно приносить извинения коллегам за свою «чепуху». Но через 12 лет Резерфорд все же сумел доказать свою правоту. У Резерфорда появился шанс продолжить свои исследования в Кавендишской лаборатории в Англии, где он начал изучать процессы ионизации воздуха. Первым открытием Резерфорда были альфа- и бета-лучи.

Опыт Резерфорда
Кратко об открытиии можно рассказать так: в 1912 году Резерфорд вместе со своими помощниками провел свой знаменитый опыт - альфа-частицы испускались из свинцового источника. Все частицы, кроме тех, что оказывались поглощенными свинцом, двигались вдоль установленного канала. Их узкий поток попадал на тонкий слой фольги. Эта линия была перпендикулярна листу. Опыт Резерфорда по рассеянию альфа-частиц доказал: те частицы, которые проходили сквозь лист фольги насквозь, вызывали так называемые сцинтилляции на экране.
Этот экран был покрыт особым веществом, которое начинало светиться при попадании на него альфа-частиц. Пространство между слоем золотой фольги и экраном было заполнено вакуумом для того, чтобы альфа-частицы не рассеивались в воздухе. Такой прибор позволил исследователям наблюдать частицы, рассеивающиеся под углом порядка 150°.
Если же фольгу не использовали в качестве препятствия перед пучком из альфа-частиц, то на экране образовывался светлый кружок из сцинтилляций. Но как только перед их лучом ставили барьер из золотой фольги, то картина сильно менялась. Вспышки появлялись не только вне этого кружка, но и на противоположной стороне фольги. Опыт Резерфорда по рассеянию альфа-частиц показал, что большинство частиц проходит через фольгу без заметных изменений в траектории движения.
При этом некоторые частицы отклонялись под довольно большим углом и даже отбрасывались назад. На каждые 10 000 свободно проходящих через слой золотой фольги частиц лишь одна отклонялась на угол, превышавший 10° - в виде исключения одна из частиц отклонялась на такой угол.

Причина, по которой отклонялись альфа-частицы
То, что детально рассмотрел и доказал опыт Резерфорда - строение атома. Такое положение свидетельствовало о том, что атом не представляет собой сплошное образование. Большинство частиц свободно проходили через фольгу толщиной в один атом. И поскольку масса альфа-частицы практически в 8 000 раз больше массы электрона, то последний не мог бы существенно повлиять на траекторию альфа-частицы. Это могло бы быть сделанным лишь атомным ядром - телом малых размеров, обладающим почти всей массой и всем электрическим зарядом атома. На тот момент это стало значительным прорывом английского физика. Опыт Резерфорда считается одной из важнейших ступеней в становлении науки о внутреннем строении атома.
Другие открытия, полученные в процессе изучения атома
Эти исследования стали прямым доказательством того, что положительный заряд атома находится внутри его ядра. Эта область занимает весьма малое пространство по сравнению с его целостными размерами. В таком малом объеме рассеяние альфа-частиц оказалось очень маловероятным. А те частицы, которые проходили вблизи области атомного ядра, испытывали резкие отклонения от траектории, ведь отталкивающие силы между альфа-частицей и ядром атома были очень мощными. Опыт Резерфорда по рассеянию альфа-частиц доказал вероятность того, что альфа-частица попадет прямо в ядро. Правда, вероятность была очень мала, но все же не равна нулю.
Это был не единственный факт, который доказал опыт Резерфорда. Кратко строение атома изучали и его коллеги, которые сделали ряд других важных открытий. Кроме учения о том, что альфа-частицы представляют собой быстро движущиеся ядра гелия.
Ученый смог описать строение атома, в котором ядро занимает незначительную часть всего объема. Его опыты доказали, что практически весь заряд атома сосредоточен внутри его ядра. При этом происходят как случаи отклонения альфа-частиц, так и случаи их столкновения с ядром.

Опыты Резерфорда: ядерная модель атома
В 1911 году Резерфорд после многочисленных исследований предложил модель строения атома, которую назвал планетарной. Согласно данной модели, внутри атома расположено ядро, которое содержит в себе практически всю массу частицы. Электроны движутся вокруг ядра подобно тому, как это делают планеты вокруг Солнца. Из их совокупности образуется так называемое электронное облако. Атом же имеет нейтральный заряд, как показал опыт Резерфорда.
Строение атома в дальнейшем заинтересовало ученого по имени Нильс Бор. Именно он доработал учение Резерфорда, ведь до Бора планетарная модель атома стала сталкиваться с трудностями объяснения. Так как электрон движется вокруг ядра по определенной орбите с ускорением, рано или поздно он должен упасть на ядро атома. Однако Нильс Бор смог доказать, что внутри атома законы классической механики уже не действуют.
