Apakah phenolphthalein. Bahaya utama dalam penyulingan wap.
(Dokumen)
n2.doc
Agensi Pendidikan Persekutuan
Eksperimen Am 1: Pentitratan
Mengapa anda perlu memastikan mata anda sama rata dengan tanda apabila menambah beberapa titis air terakhir?
- Apakah kepekatan larutan piawai ini?
- Apakah tujuan membilas bikar dan corong dengan air?
- Apakah tujuan membasuh bahagian dalam kelalang isipadu dengan air?
Kaedah penghabluran semula daripada alkohol panas
Daripada jadual, tentukan purata isipadu pentitratan untuk eksperimen ini dan gunakan nilai ini dalam pengiraan anda yang lain. Menggunakan contoh terdahulu yang diberikan, tentukan kepekatan asid asetik dalam sampel cuka. Ingat bahawa anda mempunyai maklumat berikut: isipadu larutan natrium hidroksida anggur, kepekatan larutan natrium hidroksida. Tentukan kepekatan larutan natrium hidroksida dengan kepekatan yang tidak diketahui.
negeri institusi pendidikan pendidikan profesional yang lebih tinggi
Pomeranian universiti negeri dinamakan sempena M.V
Jabatan Kimia
Kerja kursus
Sintesis fenolftalein.
Kajian keterlarutan dalam pelarut dengan pemalar dielektrik yang berbeza
Selesai:
Asid dan bes pekat boleh menyebabkan luka bakar yang serius. Kami mencadangkan menggunakan sarung tangan dan cermin mata keselamatan apabila bekerja dengan asid atau bes. Selepas memastikan buret ditutup, tambahkan larutan asid oksalik piawai ke dalam buret dengan teliti sehingga buret penuh. Letakkan bikar bersih di bawah buret dan letakkan bahagian larutan asid oksalik ke dalamnya dengan berhati-hati. Ini akan memastikan tiada gelembung udara dalam buret. Bahagian atas penyelesaian kini seharusnya berada di antara 0 dan 1 cm 3 markah. Tulis nilai ke tempat perpuluhan kedua. Gunakan pipet untuk menyukat larutan 20 cm 3 \\ dalam kelalang kon. Tambah 3-4 titik penunjuk fenolftalein ke dalam kelalang kon. Lakukan eksperimen pentitratan kasar dengan menambahkan asid oksalik dengan cepat ke dalam kelalang kon dan memusingkan kelalang kon secara berterusan. Berhenti sebaik sahaja warna larutan berubah dan selepas berpusar ia berubah. Jika perubahan warna tidak kekal semasa kelalang dipusing, tambah lebih banyak asid oksalik sehingga tiada warna kekal. Ulang langkah 4-7 dengan kelalang kon kedua. Tambah asid oksalik dengan cepat ke dalam kelalang kon sehingga anda telah menambah 2 cc kurang daripada isipadu pentitratan mentah anda. hidup pada masa ini Seharusnya tiada perubahan warna yang berkekalan. Tambah asid oksalik secara beransur-ansur. Putar di antara setiap titisan dan, jika perlu, bilas bahagian tepi kelalang dengan air. Apabila larutan berubah warna dan kekal warna baharu, beri perhatian kepada kelantangan pada buret. Ingat bahawa isipadu yang dititrasi ialah: -. Untuk ketepatan, ulangi langkah 9-11 sehingga anda mempunyai tiga bacaan dengan perbezaan tidak lebih daripada 0.1 cm3.
- Labelkan salah satu cermin mata \\.
- Gunakan pipet untuk menyukat 100 cm 3 air ke dalam gelas.
- Tambah kira-kira 4 g\\ ke dalam gelas dan kacau.
- Pasang buret pada dirian retort dan letakkan corong kecil di atas.
- Apakah warna larutan natrium hidroksida apabila fenolfthalena ditambah?
- Apakah warna apabila asid yang cukup ditambah?
pelajar tahun 3
Jabatan Kimia
Alferov Vladimir Ivanovich
Disemak:
Profesor Madya, Calon Sains kimia. sains
Levandovskaya T.V.
Profesor Madya, Calon Sains teknologi sains
Chagina N. B.
ARKHANGELSK
1. Kajian literatur……………………………………………..5
Rupa dan sifat fizikal fenolftalein………….5
Penggunaan phenolphthalein……………………………………...6
Sifat kimia…………………………………………………………8
Penyediaan fenolftalein…………………………………………11
1.4.2 Sifat fizikal bahan yang digunakan dalam sintesis….15
Dengan menggunakan contoh terdahulu yang diberikan, tentukan kepekatan larutan natrium hidroksida. Ingat bahawa anda mempunyai maklumat berikut: isipadu larutan natrium hidroksida isipadu larutan asid oksalik kepekatan larutan asid oksalik. Persamaan kimia seimbang untuk tindak balas ini.
Hitung jisim asid oksalik yang mesti dilarutkan oleh pelajar untuk membentuk larutan piawai yang diperlukan. Dia percaya bahawa 40 cm 3 larutan asid oksalik akan meneutralkan sepenuhnya 35 cm 3 larutan natrium hidroksida.
- Kita memerlukan banyak asid oksalik.
- Walau bagaimanapun, kita belum mengetahui jumlah tahi lalat.
1.4.3 Teknik penyulingan wap……………………….16
1.4.4 Kaedah penghabluran semula daripada alkohol panas………….18
1.5 Langkah berjaga-jaga keselamatan……………………………………………………20
1.5.1 Bahaya utama apabila bekerja dengan asid pekat……………………………………………………………………..20
1.5.2 Bahaya utama semasa penyulingan wap……..21
- Tulis persamaan kimia yang seimbang untuk tindak balas.
- Kira kepekatan asid.
Hujan berasid ini mula-mula diperhatikan pada abad kesembilan belas, tetapi hanya pada abad ke-20 barulah keasidan ini tersebar luas pada tahap berbahaya yang kita kaitkan dengan istilah "hujan asid." Penyebab utamanya adalah arang batu yang mengandungi sulfur sebagai najis. Apabila dibakar dalam loji kuasa, sulfur ini bergabung dengan oksigen untuk membentuk sulfur dioksida, yang naik melalui cerobong asap dan meresap melalui atmosfera.
1.5.3 Bahaya utama semasa penghabluran semula daripada alkohol panas………………………………………………………………………………………….21
1.5.4 Ciri-ciri bekerja dengan bahan yang digunakan dalam sintesis ………………………………………………………………………………………22
1.6 Ciri-ciri pelarut………………………………….24
1.6.1 Pengelasan pelarut mengikut sifat fizik...25
Asid sulfurik adalah asid yang sangat kuat, dan apabila air terpeluwap dari udara untuk membentuk titisan hujan, asid larut dalam air. Kemudian hujan turun dan berkumpul di dalam badan air tawar, meningkatkan keasidan mereka. Amerika Syarikat timur laut paling menderita akibat ini kerana Lembah Ohio, termasuk kawasan Ohio dan Pennsylvania, adalah tempat kebanyakan industri arang batu pada setengah abad yang lalu telah berlaku. Disebabkan keadaan cuaca semasa, gas asap ini memasuki atmosfera di Lembah Ohio, tetapi hujan turun ke bahagian utara New York dan New England.
1.6.2 Sistem pengelasan pelarut berdasarkan mereka sifat kimia………………………………………………..30
1.7 Kajian semula kaedah untuk menentukan keterlarutan pepejal………………………………………………………………..35
1.7.1 Kaedah Gravimetrik………………………………………….35
1.7.2 Kaedah elektrokimia…………………………………………37
1.7.3 Kaedah fotoelektrokalorimetrik………………………..41
Meningkatkan keasidan dalam hujan boleh membawa akibat yang dahsyat. Bahan cemar logam dalam tanah, yang biasanya terikat rapat dengan sebatian lain, boleh dibasuh oleh hujan asid ke dalam tasik dan sungai; pada satu ketika banyak kolam di New England tidak dapat menyokong trout sungai kerana ini. Tumbuhan juga sangat sensitif terhadap pH tanah. nutrien yang bermanfaat juga boleh dibasuh keluar dari tanah, menyebabkan tumbuhan tidak dapat bertahan di dalamnya. Di kawasan yang dilanda teruk, berpuluh-puluh pokok mati boleh ditemui, seperti yang ditunjukkan di atas.
2. Bahagian eksperimen……………………………………………………43
2.1 Sintesis fenolftalein………………………………………………………………43
2.2 Penghabluran semula daripada alkohol panas………………………..45
2.3 Penentuan keterlarutan…………………………………….47
Kesimpulan………………………………………………………50
Bibliografi…………………………………………………….51
Bangunan dan patung juga telah rosak akibat hujan asid, yang memakan batu, terutamanya batu kapur. Peningkatan hakisan arca, batu nisan dan juga beberapa bangunan telah menyebabkan kerugian besar - beberapa karya seni telah musnah sepenuhnya.
Sejak itu, pelepasan telah menurun dengan ketara dan begitu juga hujan asid. Walau bagaimanapun, masalah tersebut masih belum dapat dihapuskan dan masih banyak yang perlu dilakukan mengenai masalah alam sekitar yang serius ini. Mari kita lihat asid hidroklorik, yang merupakan komponen utama asid perut, dan natrium hidroksida, yang sering dirujuk sebagai "lye" dan digunakan dalam sabun. Walau bagaimanapun, hampir semua hidronion dan hidroksida bergabung untuk membuat molekul air, meninggalkan hanya penonton klorida dan ion natrium.
pengenalan
Phenolphthalein adalah salah satu penunjuk asid-bes yang paling banyak digunakan dalam kimia. Ia tergolong dalam pewarna triarilmetana yang dipanggil pewarna phthalein.
Tujuan kerja ini adalah untuk mensintesis fenolftalein dan mengkaji keterlarutannya dalam pelarut dengan pemalar dielektrik yang berbeza. Untuk mencapai matlamat ini, perlu menyelesaikan tugas berikut:
Jika jumlah asid hidroklorik adalah betul-betul sama dengan jumlah natrium hidroksida, dalam mol, maka setiap hidronium mesti mempunyai hidroksida untuk bertindak balas meninggalkan larutan yang kini neutral. sekarang ia sepatutnya menjadi segelas air bersih dengan pH 7 dan garam meja biasa dilarutkan di dalamnya. Kami bermula dengan dua bahan yang sangat kaustik dan berakhir dengan produk jinak.
Secara umum, apabila asid dan bes berinteraksi antara satu sama lain, ia meneutralkan satu sama lain dan pH larutan menghampiri ini. Ini dipanggil ".". Hanya apabila jumlah asid kuat dan bes kuat yang sama ditambah bersama barulah pH menjadi tepat. Tetapi dalam banyak kes, asid lemah dan bes lemah bergabung. Walau bagaimanapun, pH akan menghampiri 7, tetapi penyelesaiannya tidak akan neutral. Dalam kes hujan asid, batu dan tanah sering menjadi yang utama, terutamanya batu karbonat yang terdapat di beberapa bahagian negara.
1. Menganalisis literatur mengenai isu ini;
2. Pilih kaedah sintesis dan pilih yang paling sesuai;
3. Menjalankan sintesis, pengasingan dan penulenan produk;
4. Menyiasat keterlarutan dalam pelarut dengan pemalar dielektrik yang berbeza, bandingkan keputusan yang diperoleh dengan data literatur;
Apabila asid lemah dalam hujan asid jatuh ke atas batu, ia dineutralkan oleh bes dalam daun, dalam kotoran dan dalam batu. Walau bagaimanapun, kebanyakan asas ini, seperti yang terdapat dalam batuan, tidak boleh diperbaharui. Selepas satu abad hujan asid, batu-batu meneutralkan semua asas dalam batu, hujan asid hanya memasuki ekosistem dan tiada apa-apa yang meneutralkannya.
Phenolftalein: penunjuk makmal am
Molekul fenolftalein adalah lutsinar dengan kehadiran asid dan merah jambu dengan kehadiran bes. Ini adalah penunjuk yang sangat baik untuk mencari titik kesetaraan dalam pentitratan asid-bes untuk asid ringkas. Dalam Bahagian 5 Bahagian 8 pentitratan diperkenalkan sebagai cara menggabungkan dua larutan bersama untuk mempunyai tindak balas stoikiometri terkawal. Ia memerlukan larutan kepekatan yang diketahui, biasanya dalam buret, yang akan bertindak balas dengan larutan kepekatan yang tidak diketahui dalam bikar di bawahnya. Sebarang tindak balas akan berfungsi untuk pentitratan, tetapi untuk mengetahui apabila tindak balas selesai mesti ada titik akhir yang boleh dilihat.
5.
Buat kesimpulan tentang kerja yang dilakukan.
1. Kajian literatur
1.1 Rupa dan sifat fizikal fenolftalein
Phenolphthalein (Di-n-dioxydiphenylphthalide, 2,2-bis(n-hydroxyphenyl)phthalide) – serbuk hablur putih atau sedikit kekuningan; penghabluran semula daripada etil alkohol cair menghasilkan jarum rombik yang tidak berwarna. Fenolftalein tidak berbau dan tidak stabil di udara. Berat molekul ialah 318.3 g/mol. Fenolftalein cair pada suhu 250 0 C (258 0 C) dan lebih suhu tinggi keagungan .
Phenolphthalein sebagai cara untuk menurunkan berat badan
Untuk tindak balas asid bes, penunjuk boleh memberikan jenis maklumat ini dengan perubahan warna untuk menunjukkan titik akhir. Oleh itu, tindak balas peneutralan asid bes adalah salah satu jenis tindak balas yang paling biasa digunakan dalam ujian pentitratan. Oleh itu, pentitratan boleh digunakan untuk menentukan jumlah asid atau bes dalam larutan yang tidak diketahui.
Semasa pentitratan asid kuat dengan bes yang kuat, titik akhir dicapai apabila pH betul-betul 7, kerana larutan itu sepatutnya hanya larutan akueus tulen dengan elektrolit neutral di dalamnya. Setelah asid hilang, sebarang bes yang kita tambah ke dalam kelalang tidak akan dineutralkan dan pH larutan akan mula meningkat. Walau bagaimanapun, walaupun sebahagian kecil daripada setitik buret asas kuat yang berlebihan akan mengubah pH Satu atau penunjuk sedemikian, fenolftalein, adalah jernih dan tidak berwarna dalam larutan berasid, tetapi bertukar menjadi merah jambu gelap dalam larutan asas jika pH melebihi 2.
Fenolftalein larut dalam etanol, dietil eter, kloroform, aseton, eter petroleum, benzena, toluena dan kurang dalam air.
1.2 Penggunaan fenolftalein
Fenolftalein adalah salah satu penunjuk yang paling banyak digunakan, terutamanya untuk penentuan isipadu asid lemah.
Ia mempunyai beberapa kelebihan: ia tidak sensitif terhadap suhu tinggi, ralat dari kehadiran bahan protein dan koloid adalah tidak penting. Ia boleh digunakan secara meluas walaupun dalam larutan yang mengandungi alkohol, hanya warna larutan beralkali berbeza daripada ciri ton ungu bagi larutan akueus. Dalam larutan alkohol pekat, bentuk utama mempunyai warna biru-ungu. Fenolftalein boleh digunakan dalam pentitratan asid organik dalam larutan alkohol atau untuk menentukan keasidan alkohol dan ester. Hejort dan Ham mencadangkan penggunaan polisodium glikolat untuk membentuk titer asas dengan kehadiran fenolftalein. Keputusan yang memuaskan diperoleh dengan mentitrasi 2•10 -6 - 30•10 -6 g asid organik dalam isipadu 2.7•10 -6 - 40•10 -6 l dengan kehadiran fenolftalein. Menurut penyelidikan Mick, kepekatan penunjuk memainkan peranan yang sangat penting dalam mikroasidimetri. Phenolphthalein adalah komponen daripada banyak penunjuk campuran. Oleh kerana sifatnya, ia sesuai untuk penentuan kalorimetrik pH menggunakan penyelesaian penimbal atau mengikut kaedah Michaelis tanpa penyelesaian penimbal. Bentuk berwarna mematuhi undang-undang Beer dalam pelbagai kepekatan.
Penunjuk asid datang dalam pelbagai jenis
Fakta bahawa Phenolphthalein berubah warna sedikit di atas 0 biasanya menghasilkan ralat yang sangat sedikit dalam eksperimen. Sebagai tambahan kepada phenolphthalein, penunjuk lain termasuk bromothymol blue dan metil oren. Untuk penyelesaian yang hanya berbeza sedikit daripada titik akhirnya, bromothymol blue adalah penunjuk yang baik. Hanya di bawah nilai pH 7, larutan berwarna kuning, yang bertukar menjadi biru tepat di atas pH. Apabila titik akhir pentitratan agak berasid, metil jingga digunakan.
Fenolftalein juga boleh digunakan sebagai reagen dalam analisis kualitatif. Menurut Sachs, beberapa hidroksida logam tidak larut, seperti plumbum, kadmium, zink, magnesium, dan lain-lain, apabila disembur dengan fenolftalein, memberikan warna, yang dijelaskan oleh penjerapan penunjuk. Satu lagi kumpulan tindak balas adalah berdasarkan fakta bahawa dalam persekitaran beralkali fenolftalein dikurangkan oleh zink kepada fenolftalein tidak berwarna. Sebatian leuco ini dioksidakan oleh bahan tertentu, dan kemudian warna merah fenolftalein muncul semula. Kesan yang sama diperhatikan dengan jumlah ion sianida yang sangat kecil (0.01-0.05 mg/l) dengan kehadiran kesan kuprum sulfat. Dengan jumlah kuprum yang sangat kecil (10 -4 - 10 -5%), pengenalan hidrogen peroksida ke dalam sistem membawa kepada peningkatan kadar pengoksidaan sebatian leuco.
Salah satu derivatif fenolftalein, fenolftalein fosfat, digunakan untuk menentukan aktiviti enzim fosfatase. Phenolftalein fosfat sendiri tidak mempunyai sifat penunjuk, tetapi dimusnahkan oleh tindakan enzim; kumpulan fosfat dipisahkan oleh tindakan substrat, dan warna merah fenolftalein muncul.
Dalam perubatan, phenolphthalein digunakan sebagai julap, dan ubat itu dipanggil purgen.
1.3 Sifat kimia
Selang peralihan warna fenolftalein berjulat daripada pH 8.2 (tidak berwarna) hingga pH 9.8 (ungu). Untuk menentukan selang peralihan, satu siri larutan penimbal dengan nilai pH berikut digunakan: 7.8-8.0-8.2-8.4-9.0-9.6-9.8-10.0-10.2. Nilai pH di mana warna merah jambu pertama muncul bergantung pada kepekatan penunjuk. Keamatan warna ungu meningkat secara beransur-ansur sehingga pH 9.8: pH 1/2 9.53.
Proses pembentukan dianion berwarna struktur quinoid (III), yang terbentuk hasil daripada interaksi fenolftalein dengan larutan alkali cair (pH8.5), boleh diwakili seperti berikut:
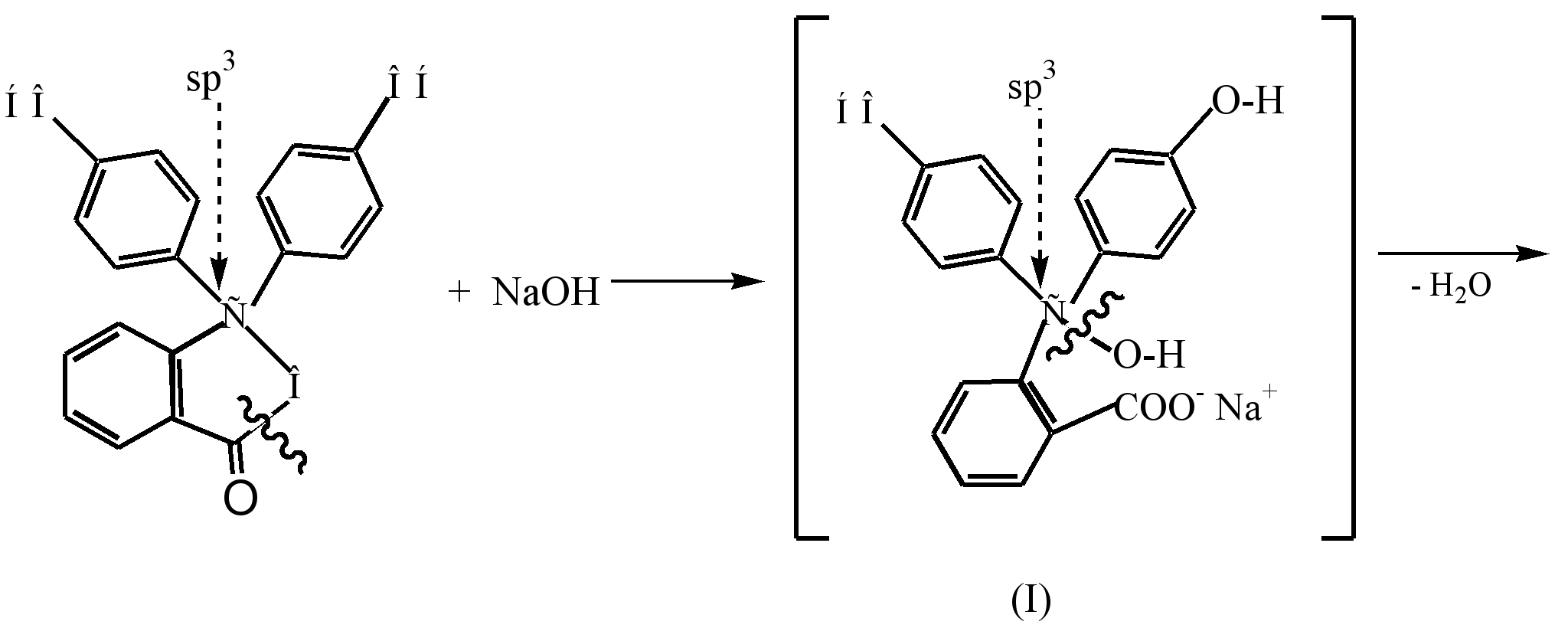

Di bawah pengaruh alkali dalam fenolftalein tidak berwarna, cincin β-lakton terbuka (menghidrolisis), dan alkohol tidak berwarna (I) yang terhasil secara spontan membelah molekul air untuk membentuk garam monosodium (II) kuning. Interaksi selanjutnya dengan alkali membawa kepada pembentukan garam disodium (III) dan kepada pendalaman warna kepada merah, yang disebabkan oleh pemanjangan rantai konjugasi.
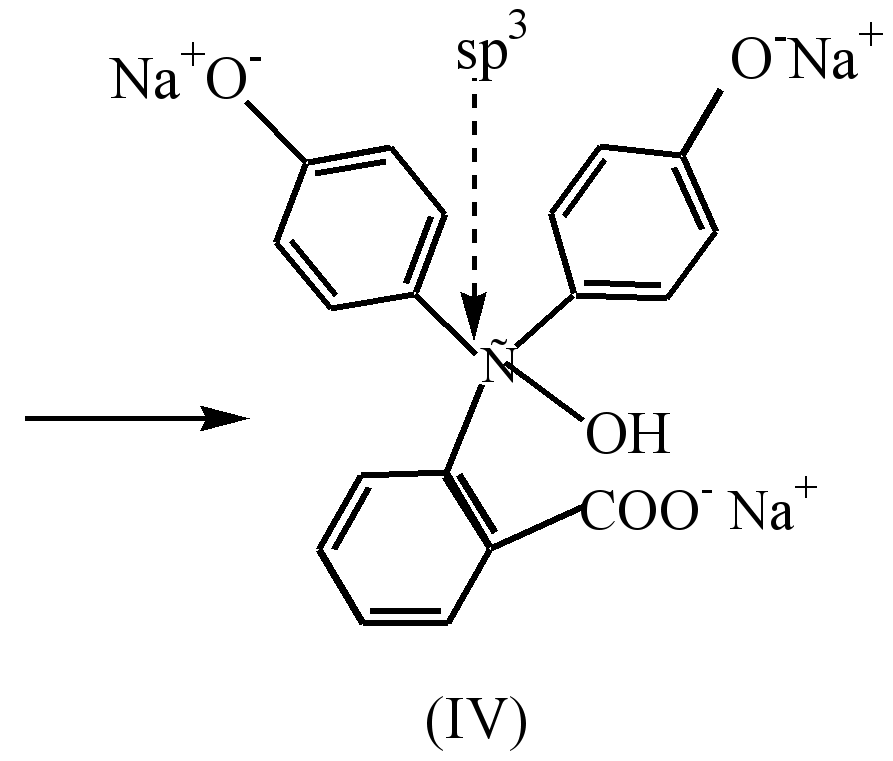
Dalam persekitaran beralkali kuat (pH10), perubahan warna larutan diperhatikan sebagai hasil daripada peralihan garam disodium (III) kepada garam trisodium (IV), di mana gelang tidak berkonjugasi antara satu sama lain.
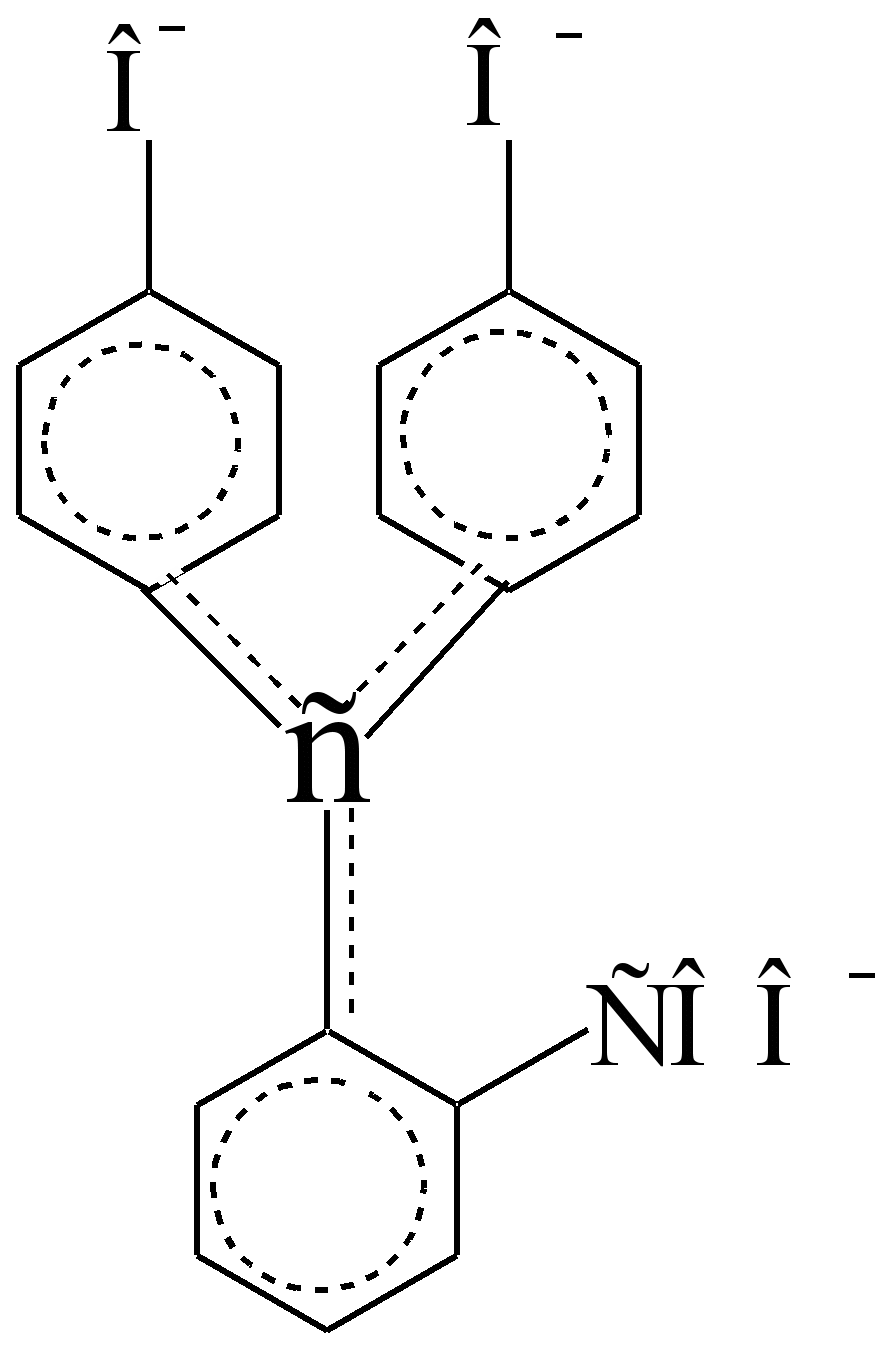
Dalam persekitaran berasid ia tidak berwarna, kerana kromofor benzena lemah diasingkan, autonomi dan dalam?,? – yang berikut tidak berinteraksi (antara muka) antara satu sama lain:
Adakah ia dipisahkan daripada sp 3 - atom karbon yang merupakan penebat dan bukan konduktor? – elektron. Dalam persekitaran beralkali, kitaran lakton dipecahkan, salah satu hidroksil fenolik terion, dan atom C sp 3 memperoleh konfigurasi C sp 2, menjadi konduktor? – elektron antara kromofor benzena, sebagai tambahan kepada auksokrom terkutub – COO - dan –O -. Dalam asid sulfurik pekat penunjuk bertukar oren. Keamatan warna larutan beralkali ungu berkurangan apabila berdiri, sebahagiannya disebabkan oleh pembentukan bes karboksil tidak berwarna (ini adalah penjelmaan boleh balik), sebahagiannya disebabkan oleh pengoksidaan tidak boleh balik melalui udara
Kromofor fenolftalein
(bentuk alkali, 1 = 553 nm, 1 = 9000)
1.4 Penyediaan fenolftalein
Kaedah utama untuk menghasilkan phenolphthalein ialah pemeluwapan fenol dengan phthalic anhydride. Tindak balas ini adalah kes khas asilasi Friedel-Crafts. Tindak balas berlaku apabila dipanaskan dengan mangkin asid (asid sulfurik pekat atau zink klorida):
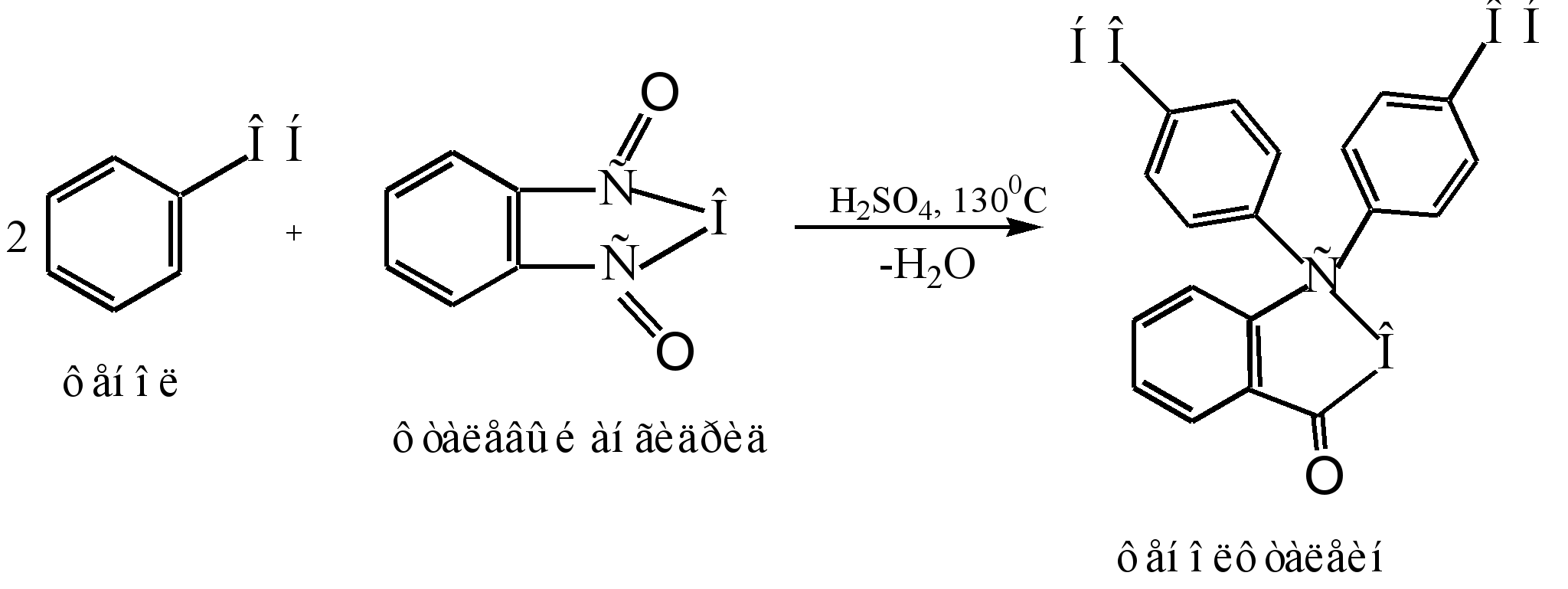
Mekanisme tindak balas boleh diwakili seperti berikut:

Sigma - kompleks
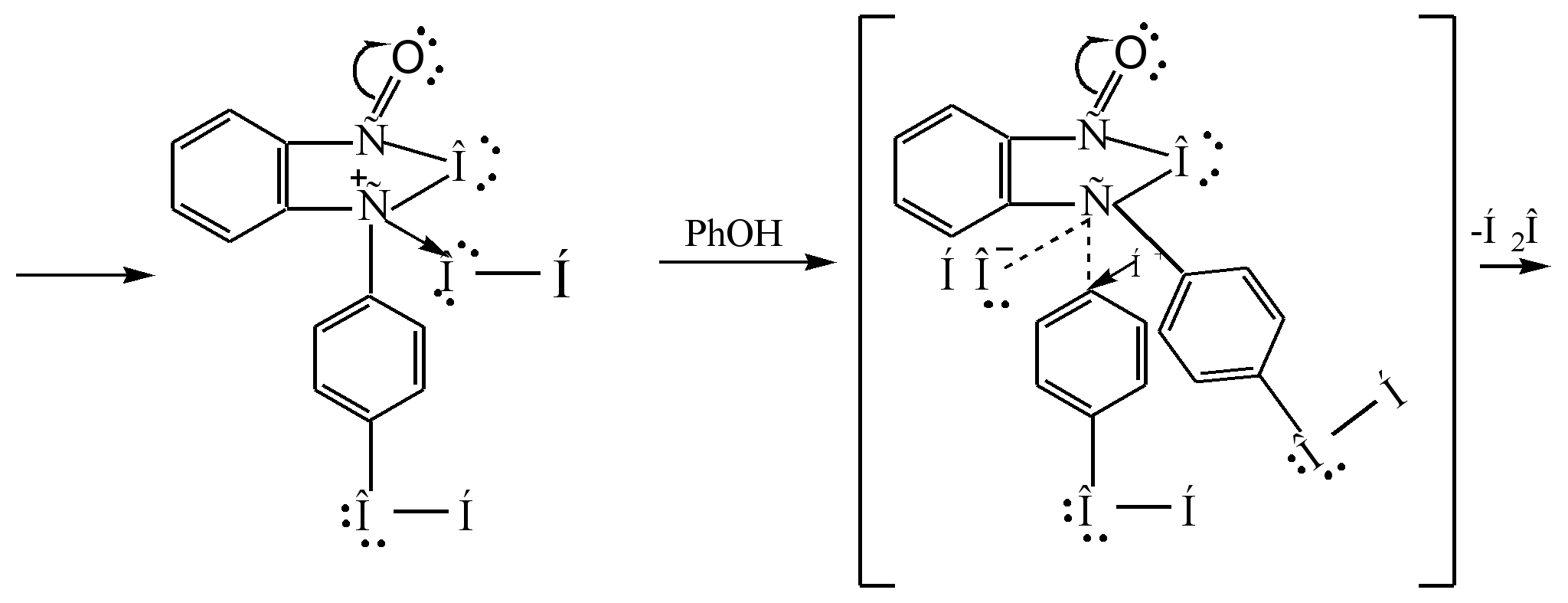
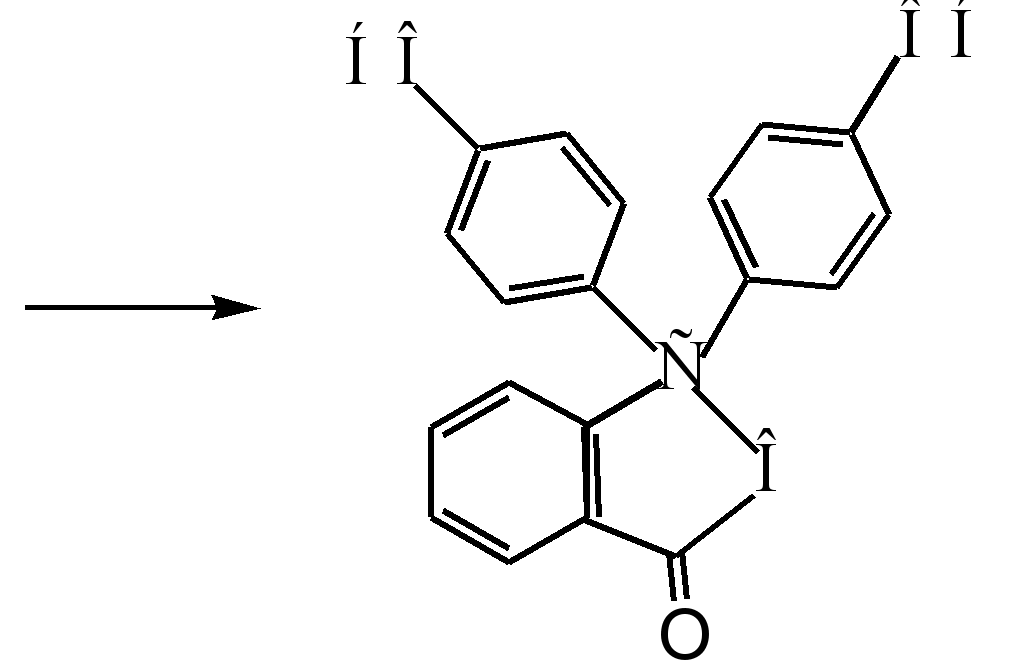
fenolftalein
1.4.1 Kaedah untuk mendapatkan fenolftalein
Setelah menganalisis sumber sastera mengenai isu ini, didapati bahawa kesemuanya manual metodologi Kaedah yang sama untuk mendapatkan fenolftalein diberikan. Ia berdasarkan reaksi yang dikemukakan di atas. Teknik ini sesuai sepenuhnya untuk keadaan makmal kami.
Untuk sintesis anda memerlukan reagen, barangan kaca dan peralatan berikut:
Phthalic anhydride-5g; fenol - 10g; asid sulfurik - 2ml; natrium hidroksida - 4-5%; asid asetik (pekat); asid hidroklorik (pekat); etil alkohol (mutlak).
Kelalang bahagian bawah bulat (50ml) – 1 keping; gelas (100ml) - 1 pc.; cawan porselin - 1 pc.; kelalang kon (250ml) - 2 pcs.; termometer; peranti penyulingan wap; mandi pasir.
Sintesis kemajuan:
Campuran 5 g anhidrida phthalic, 10 g fenol dan 2 ml asid sulfurik diletakkan dalam kelalang dan dipanaskan dalam mandi pasir selama 1.5 jam, dengan ketat mengekalkan suhu 125 - 130 C 0 (termometer dalam cair dan secara berkala mengacau kandungan). Campuran panas dituangkan ke dalam kelalang dengan 100 ml air mendidih, fenol yang tidak bertindak balas disuling dengan wap. Untuk mengelakkan percikan dan kehilangan bahan yang terhasil, cecair mesti dikacau sepanjang masa. Penghujung penyulingan boleh dilihat dengan perubahan kekeruhan sulingan: jika sulingan mengalir agak keruh, maka penyulingan perlu diteruskan, jika sulingan jernih, maka penyulingan boleh dihentikan. Penyelesaian dibiarkan sejuk, selepas itu ia dituangkan ke corong Buchner, cuba, jika boleh, untuk tidak memindahkan mendakan ke penapis. Produk kemudian dibasuh dengan menyiram dalam dua bahagian kecil air sejuk, tambahkan apa yang berakhir pada penapis kepada sebahagian besar bahan pepejal dalam gelas, larutkan kuantiti yang kecil hangat 4-5% natrium hidroksida dan anhidrida phthalic yang tidak bertindak balas dipisahkan dengan penapisan. Asid asetik ditambah kepada turasan merah gelap sehingga fenolftalein dimendakkan sepenuhnya, kemudian 1-2 titik asid hidroklorik ditambah dan dibiarkan selama 1 jam.
Fenolftalein yang dikeluarkan dalam bentuk pasir kekuningan disedut menggunakan corong Buchner. Produk mentah dipindahkan ke gelas dan dilarutkan dengan pemanasan dalam kira-kira 10 ml alkohol. Larutan panas disedut dan mendakan pada penapis dibasuh dengan alkohol panas. Tapis melalui penapis yang dibasahkan dengan alkohol untuk mengeluarkan sebarang titisan minyak yang dilepaskan. Turasan dipindahkan ke cawan porselin dan dipanaskan dalam mandi pasir panas untuk mengeluarkan banyak alkohol. Campuran dalam cawan dibiarkan selama 30 minit. Hablur tidak berwarna atau kuning muda yang dikeluarkan disedut dan dikeringkan di udara antara helaian kertas turas.
1.4.2 Sifat fizikal bahan yang digunakan dalam sintesis
Jadual 1
Sifat fizikal bahan yang digunakan dalam sintesis
| Nama | Formula | penampilan | T pl, 0 C | T mendidih, 0 C | keterlarutan |
|
| Dalam air | dalam yang lain |
|||||
| Fenolftalein | C 20 H 14 O 4 | Jarum tidak berwarna atau berwarna berpasir berbentuk berlian, tidak berbau, tidak stabil di udara | 261 | api- nampaknya | Larut sedikit (0.0002 g dalam 100 g air) | Baik dalam etanol, sederhana dalam dietil eter, juga larut dalam larutan alkali. |
| Fenol | C 6 H 5 OH | Jarum belah ketupat tidak berwarna atau merah jambu | 41-43 | 182 | Dalam keadaan sejuk - sederhana Panas - bagus | Baik dalam etanol, eter, kloroform, gliserin, karbon disulfida |
| Phthalic anhydride | C 8 H 4 O 3 | Jarum berlian putih | 130,8 | Vozg 284.3 | teruk | Dalam etanol, eter, kloroform |
| Asid sulfurik | H2SO4 | Tidak berwarna, cecair likat, dengan bau yang tidak menyenangkan | 10,37 | 330 | | bertindak balas |
| Natrium hidroksida | NaOH | Putih meresap, hablur rombik | 320 | 1378 | Larut dengan pembebasan haba | Dalam alkohol, gliserin, fenol, eter, aseton |
| asid asetik | CH 3 COOH | Cecair tidak berwarna dengan bau yang tidak menyenangkan | 16,6 | 118,1 | | Dalam etanol, eter |
| Asid hidroklorik | HCI | Cecair kekuningan, berasap di udara, dengan bau yang tidak menyenangkan | -15,35 | - | baik | Dalam alkohol |
1.4.3 Teknik penyulingan wap
Oleh kerana semasa sintesis adalah perlu untuk menyaring fenol yang tidak bertindak balas menggunakan penyulingan wap, adalah perlu untuk mempertimbangkan metodologi untuk pelaksanaannya.
Penyulingan dijalankan dalam peranti yang terdiri daripada penjana stim dengan tiub keselamatan, kelalang penyulingan Claisen (250 ml), termometer, pemeluwap Liebig langsung, allonge, dan penerima. Penjana stim dan kelalang penyulingan disambungkan melalui tee ke salah satu cabang yang mana tiub getah dengan pengapit Hoffmann dipasang, dan dipanaskan dalam mandi pasir.
Kemajuan penyulingan (penyulingan): cair panas diletakkan di dalam kelalang penyulingan dengan 100 ml air mendidih. Dengan memanaskan penjana stim dan kelalang penyulingan, sulingan yang mengandungi fenol tidak bertindak balas dikumpulkan. Kehadirannya ditunjukkan oleh kekeruhan sulingan. Penyulingan dihentikan sebaik sahaja penyulingan keruh telah disalirkan, iaitu, sehingga penyulingan jernih muncul. 
Rajah.1 Alat penyulingan wap
1- tiub keselamatan; 2 – tiub bekalan stim; 3 – tee; 4 – pengapit; 5 – penjana stim; 6 – Kelalang Claisen; 7 – termometer; 8 – Peti sejuk Liebig; 9 – allolong; 10 – penerima; 11 - mantel pemanasan; 12 - jubin.
1.4.4 Kaedah penghabluran semula daripada alkohol panas
Secara eksperimen, penghabluran semula dijalankan seperti berikut: Bahan diletakkan di dalam kelalang bahagian bawah bulat dan sedikit pelarut ditambah kepadanya. Campuran dipanaskan di bawah refluks dalam mandi air yang dipanaskan pada plat panas.
Kebanyakan cecair cenderung menjadi terlalu panas dan oleh itu mendidih dengan kuat. Untuk mengelakkan ini, air mendidih ditambah ke dalam kelalang sebelum pemanasan bermula.Melalui pemeluwap refluks, pelarut ditambah secara beransur-ansur dalam bahagian kecil sehingga bahan dibubarkan sepenuhnya.
Selepas bahan telah dibubarkan sepenuhnya, pemanasan dihentikan dan campuran dibiarkan sejuk bersama air di dalam tab mandi. Bahan termendak ditapis.
Dalam kebanyakan kes, penghabluran semula dua langkah adalah dengan cara yang boleh dipercayai penulenan bahan. 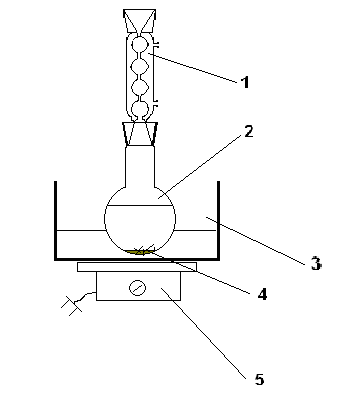
Rajah.2 Peranti penghabluran semula
1- peti sejuk refluks; 2 – kelalang alas bulat; 3 – mandi air; 4 - periuk mendidih; 5 - jubin.
1.5 Langkah berjaga-jaga keselamatan semasa melakukan sintesis
1.5.1 Bahaya utama apabila bekerja dengan asid pekat
1. Asid bukan organik yang kuat menyebabkan luka bakar kimia jika ia bersentuhan dengan kulit.Untuk luka bakar kimia yang disebabkan oleh sentuhan kulit asid pekat, basuh kawasan yang terbakar dengan aliran air yang kuat, dan kemudian dengan larutan 1% natrium bikarbonat (terdapat dalam peti pertolongan cemas). Jika asid masuk ke dalam mata anda, ia hendaklah segera dibasuh dengan larutan 1% natrium bikarbonat dan air suling pada suhu bilik. Dapatkan bantuan daripada doktor.
2. Oleh kerana asid hidroklorik pekat mengukus dengan hidrogen klorida, adalah perlu untuk bekerja dengannya di bawah draf yang berfungsi dengan baik dan tirai draf yang diturunkan. Jika anda diracuni oleh wap hidrogen klorida, anda mesti segera pergi ke udara segar.
3. Asid yang tertumpah mesti ditutup dengan pasir dan dineutralkan dengan pepejal natrium karbonat sehingga evolusi gas berhenti. Selepas peneutralan lengkap, bilas pasir dengan jumlah air paip yang banyak, periksa kesempurnaan pencucian (ambil ujian untuk Cl - menggunakan AgNO 3) dan, selepas mengeringkannya dalam kabinet pengeringan, kembalikan ke kotak dengan pasir.
1.5.2 Bahaya utama semasa penyulingan wap
Bahaya utama semasa penyulingan dikaitkan dengan penggunaan alat pemanas elektrik (dapur elektrik, pemanas mantel).1. Kord (anda tidak boleh menggunakan dapur dengan kord dibalut kain buruk), palam dan badan dapur elektrik mestilah tidak mempunyai kerosakan yang boleh dilihat.
2. Adalah tidak boleh diterima untuk memeriksa suhu permukaan pemancar haba dengan tangan anda.
3. Anda harus menghidupkan dan mematikan dapur elektrik dari rangkaian dengan memasukkan dan menanggalkan palam, memegang soket dengan sebelah tangan dan palam dengan sebelah lagi. Gunakan suis untuk melaraskan pemanasan.
4. Sekiranya berlaku lecur terma, perlu menggunakan rendaman jangka panjang ke kawasan yang terbakar dengan larutan 0.5% kalium permanganat, kemudian tutupnya dengan pembalut steril dan dapatkan nasihat doktor. Untuk luka bakar darjah 3 dan 4, segera gunakan pembalut steril dan dapatkan nasihat doktor.
1.5.3 Bahaya utama semasa penghabluran semula daripada alkohol panas
1. Jumlah isipadu alkohol tambahan hendaklah tidak melebihi 200 ml dan hendaklah tidak melebihi 1/3 daripada isipadu kelalang.2. Saiz tempat mandi air hendaklah saiz yang lebih besar permukaan jubin yang memancarkan haba.
1.5.4 Ciri-ciri bekerja dengan bahan yang digunakan dalam sintesis
Majoriti bahan kimia toksik kepada satu darjah atau yang lain. Langkah berjaga-jaga semasa bekerja dengan mereka adalah bertujuan untuk menghalang penembusan bahan-bahan ini ke dalam badan melalui mulut, paru-paru dan kulit.Semasa sintesis, bahan yang berpotensi berbahaya akan digunakan: fenol, asid sulfurik, asid asetik dan asid hidroklorik.
Fenol adalah bahan kristal tidak berwarna (merah jambu), dengan bau ciri. Kepekatan maksimum yang dibenarkan di udara kawasan kerja ialah 0.3 mg/m 3. Bahaya kelas dua. Semua kerja dengan fenol dijalankan dalam hud wasap. Kesan toksik: racun saraf, mempunyai kerengsaan tempatan yang kuat dan kesan cauterizing, menyebabkan keracunan teruk umum. Kemungkinan kematian. Keadaan ini rumit oleh fakta bahawa bahan itu menyebabkan anestesia tempatan. Pertolongan cemas: jika terkena pada pakaian, tukar dengan segera, jika terkena kulit, basuh. minyak sayuran atau larutan dengan pecahan jisim etanol 10 - 40%.
Asid hidroklorik tergolong dalam kelas bahaya kedua (kepekatan maksimum dalam udara kawasan kerja ialah 5 mg/m 3 dari segi HCl semua kerja dengan asid hidroklorik pekat juga mesti dijalankan dalam hud wasap kerana fakta bahawa ia mengeluarkan wap hidrogen klorida. Jika anda diracuni oleh wap hidrogen klorida, anda mesti keluar ke udara segar, bahaya lain yang disenaraikan di atas.
Asid sulfurik ( = 1.84 g/cm 3) – MPC рз = 1 mg/m 3. Bahaya kelas dua. Selepas kira-kira 5 s, dehidrasi kuat tisu di mana titisan masuk bermula. Pertolongan cemas: mencuci kulit air mengalir diikuti dengan peneutralan.
Asid asetik – MPC рз = 5 mg/m3. Kelas bahaya tiga7. Wap merengsakan saluran pernafasan atas dengan pecahan jisim bahan melebihi 30% bertindak pada kulit, dan lebih 2% pada mata. Pertolongan cemas: (lihat asid sulfurik dan asid hidroklorik).
1.6 Ciri-ciri pelarut
Pemalar dielektrik menduduki tempat yang istimewa dalam ciri-ciri pelarut. Kelebihan yang terakhir berbanding kriteria lain adalah disebabkan oleh kesederhanaan model elektrostatik pelarutan, dan oleh itu pemalar dielektrik telah menjadi ukuran berguna bagi kekutuban pelarut. Dalam hal ini, adalah penting untuk mengetahui dengan jelas apa sebenarnya kebolehtelapan makroskopik pelarut, juga dipanggil pemalar dielektrik relatif, mencerminkan:
r = 0 /
0 – pemalar dielektrik vakum.
Pemalar dielektrik ditentukan dengan meletakkan pelarut di antara dua plat bercas kapasitor. Dengan kehadiran pelarut, ketegangan medan elektrik antara plat E berkurangan berbanding dengan tegangan E 0 yang diukur dalam vakum, dan nisbah E 0 / mewakili pemalar dielektrik pelarut. Jika molekul pelarut tidak mempunyai momen dipol kekalnya sendiri, maka di bawah pengaruh medan luar, cas intramolekul dipisahkan, mendorong dipol.
DALAM medan elektrik molekul dengan dipol kekal atau teraruh berorientasikan dengan cara tertentu; fenomena ini dipanggil polarisasi. Semakin tinggi tahap polarisasi, semakin besar penurunan kekuatan medan elektrik. Oleh itu, pemalar dielektrik secara langsung berkaitan dengan keupayaan pelarut untuk memisahkan cas dan mengorientasikan dipolnya sendiri.
1.6.1 Pengelasan pelarut mengikut sifat fizik.
Pemalar dielektrik (DP) penyelesaian adalah salah satu faktor yang paling penting di antara mereka yang mempunyai paling banyak pengaruh yang kuat mengenai ciri-ciri proses yang berlaku dalam larutan.
Nilai DP pelarut individu berbeza-beza dalam had yang sangat ketara - dari -1.8 (alkana) hingga 170-180 (N-alkylamides asid karboksilik alifatik). Terminologi yang mendasari penggredan pelarut mengikut DP tidak sepenuhnya jelas dan konsisten. Pelarut dengan DP tinggi dipanggil polar malah tinggi polar, walaupun, secara tegasnya, istilah "polar" merujuk kepada momen dipol µ molekul pelarut, iaitu ia tidak mencirikan makro tetapi sifat mikro pelarut.
Walau bagaimanapun, seperti berikut dari teori yang menghubungkan dengan µ, dalam kes umum terdapat perubahan simpatik dalam kuantiti ini. Di samping itu, untuk mencirikan pelarut dengan kehadiran atau ketiadaan momen dipol dalam molekulnya, istilah "dipol" (µ0) telah diperkenalkan. dan pelarut “apolar” (µ = 0).
Kekutuban rendah termasuk pelarut yang DPnya berada dalam julat = l.8h12, pelarut kutub sederhana termasuk pelarut dengan = 12h50, dan pelarut kekutuban tinggi dengan > 50. Kerelatifan pembahagian ini bukan sahaja terletak malah bukan begitu. banyak dalam selang yang dipilih secara sewenang-wenangnya, tetapi juga dalam keadaan yang lebih penting.
Walaupun terdapat kaitan antara DP dan momen dipol bagi cecair individu, yang agak jelas ditubuhkan oleh teori, seseorang harus berhati-hati terhadap keselarian yang tidak jelas antara kuantiti dan µ . Hakikatnya ialah perkaitan antiselari (tetapi bukan rantai) bagi dipol membawa kepada penurunan momen dipol bagi bahan bersekutu berbanding dengan momen dipol bagi satu molekul dan, akibatnya, kepada penurunan dalam DP cecair. Inilah sebabnya mengapa DP cecair yang dibentuk oleh molekul dengan momen dipol yang agak besar boleh menjadi agak rendah.
Kekutuban pelarut dipengaruhi dengan ketara oleh ciri-ciri strukturnya. Pelarut berstruktur, sebagai peraturan, mempunyai DP yang tinggi.
Pemalar dielektrik bersama dengan pembentukan homomolekul ikatan kimia- salah satu faktor terpenting yang menentukan sifat cecair individu, yang bergantung kepada tenaga interaksi antara molekul. Yang terakhir ditentukan oleh interaksi reaktif, tenaga yang bergantung pada DP statik (), DP diekstrapolasi kepada panjang gelombang yang tidak terhingga ( ) dan diambil sama dengan? 1.1 n D, serta momen dipol µ dan isipadu molar?:
E R = 
Nilai tenaga interaksi reaktif molekul dipol beberapa pelarut diberikan dalam Jadual 1.
Seperti yang ditekankan oleh M.I. Shakhparonov, medan reaktif molekul polar tidak membawa kepada pembentukan struktur kimia (sekutu homomolekul), yang kewujudannya ditentukan oleh interaksi kimia. Kestabilan yang terakhir berkurangan dengan peningkatan tenaga medan reaktif.
Tenaga medan reaktif menerangkan beberapa sifat fizikal pelarut, dan oleh itu mungkin berguna untuk mengelaskan pelarut mengikut nilainya. - Er .
Jelas sekali, semua pelarut yang molekulnya tidak mempunyai momen dipol akan membentuk kelas tidak reaktif. cecair. Pelarut dengan tenaga medan reaktif dalam julat - Er = 0h5 kJ·mol -1 membentuk kelas yang reaktif rendah, dalam julat - Er =5h15 kJ mol -1 - sederhana-reaktif dan, akhirnya, pelarut dengan – E R 25 kJ mol -1 membentuk kelas pelarut yang sangat reaktif.
Sebagai peraturan, cecair yang sangat reaktif melarutkan kedua-dua nonelektrolit dan elektrolit dengan baik, dan yang kedua lebih baik dipisahkan di dalamnya berbanding dengan kelas lain (mengikut sistem pengelasan ini) pelarut. Ini dijelaskan oleh fakta bahawa pelarut yang sangat reaktif menggabungkan nilai DP dan momen dipol yang tinggi.
Jadual 2
Tenaga medan reaktif beberapa pelarut pada 298.15 K.
| Pelarut | -E R , kJ mol -1 | pelarut | -E R , kJ mol -1 |
| Aniline | 2,9 | Metil etil keton | 3,4 |
| Aseton | 9,1 | Asid formik | 5,2 |
| Asetonitril | 20,9 | Nitrobenzena | 17,1 |
| Butil alkohol | 2,9 | Nitrometana | 17,5 |
| air | 18,6 | Piridin | 5,7 |
| Hexen-1 | 0,15 | Propilena karbonat | 43,8 |
| N,N-dimethylacetamide | 15,8 | Propil alkohol | 3,6 |
| Dimetil sulfoksida | 6,4 | Toluene | 0,05 |
| Dimetilformamida | 19,5 | Asid asetik | 3,7 |
| Dioksana | 0,07 | Tetrahydrofuran | 2,9 |
| 1,2 – dikloroetana | 4,2 | Klorobenzena | 1,8 |
| o – Xylena | 0,12 | Etil asetat | 2,45 |
| n – Xylena | 0,05 | Etilena glikol | 8,9 |
| N-methylacetamide | 24,1 | Etanol | 4,7 |
| Metil format | 4,0 |
Mengikut kelikatan (lebih tepat, dengan pekali kelikatan ) cecair dibahagikan kepada kelikatan rendah dengan 10 -2 Pa s.
Berdasarkan kekonduksian elektrik tertentu cecair dibahagikan kepada cecair “mengalirkan” dengan kira-kira 10 2 - 10 -1 cm·m -1 dan lebih tinggi; “konduksi sederhana” – dengan kira-kira 10 -1 – 10 -4 dan dengan 10 -4 cm·m -1 dikelaskan sebagai “tidak konduktor”.
Klasifikasi pelarut mengikut takat didih juga disebut, di mana pelarut dibahagikan kepada yang didih rendah (150 0 C).
Untuk mengelaskan pelarut mengikut keupayaannya untuk menyejat, skala relatif berdasarkan haba penyejatan telah dicadangkan. Oleh itu, pelarut yang sangat meruap (kemeruapan relatif 35) dibezakan. Jika kita menumpukan secara langsung pada haba penyejatan, maka pelarut yang sangat meruap haruslah yang dicirikan oleh haba penyejatan H penyejatan Jadual 3
Pengelasan pelarut mengikut pemalar dielektrik
| SANGAT POLAR |
|||
| PELARUT |  r r | PELARUT | r |
| air | 78,30 | DMF | 36,71 |
| Etilena glikol | 37,7 | benzonitril | 26,20 |
| Metanol | 32,66 | Nitrobenzena | 34,78 |
| DMSO | 46,45 | Gliserol | 51,7 |
| POLAR LEMAH |
|||
| THF | 7,58 | Anhidrida asetik | 20,7 |
| Dietil eter | 4,20 | Butanon - 2 | 18,51 |
| Aseton | 20,70 | Pentanon - 2 | 15,38 |
| Etanol | 24,55 | Piridin | 12,91 |
| Asid asetik | 6,17 | Metil asetat | 6,68 |
| Propanol - 1 | 20,45 | Cyclohexanone | 16,10 |
| Butanol - 1 | 17,51 | Quinalin | 8,95 |
| Isoamil alkohol | 15,19 | Kloroform | 4,81 |
| Aniline | 6,71 | Amil alkohol | 13,9 |
| BUKAN POLAR |
|||
| 1,4 - dioksana | 2,21 | Sikloheksana | 2,02 |
| Trichlorethylene | 3,42 | N – pentana | 1,84 |
| Benzena | 2,27 | Karbon disulfida | 2,64 |
| Toluene | 2,38 | Dietilamin | 3,78 |
| Karbon tetraklorida | 2,23 | dietil karbonat | 2,82 |
| Trietilamin | 2,42 | ||
| n – heptana | 1,92 | ||
| n – heksana | 1,88 | ||
1.6.2 Sistem pengelasan pelarut berdasarkan sifat kimianya
Kebanyakan sistem untuk mengelaskan pelarut mengikut ciri kimia, sama ada secara jelas atau tersirat, mengambil kira sifat asid-besnya. Oleh itu yang paling sistem umum pengelasan pelarut memperuntukkan pembahagiannya kepada dua kelas yang luas - penderma
(asas) dan penerima (berasid), definisinya, jelas sekali, menentukan awal pengenalpastian kelas pelarut acuh tak acuh yang lain. Adalah lazim untuk mengklasifikasikan setiap pelarut khusus sebagai salah satu daripada kelas ini, jika hanya kerana keupayaan molekul pelarut untuk menderma atau menerima pasangan elektron daripada pasangan bergantung pada sifat kedua-dua pelarut dan sebatian terlarut. Itulah sebabnya klasifikasi ini memperuntukkan tingkah laku ciri pelarut dalam tindak balas atau proses pelarutan.
Ciri umum pelarut penderma ialah pelarutan keutamaan kation sebagai zarah yang dicirikan oleh kekurangan elektron. Begitu juga, pelarut akseptor lebih suka melarutkan anion sebagai spesies dengan elektron berlebihan.
Kepelbagaian pelarut penderma ditentukan oleh bilangan unsur yang agak besar yang atomnya boleh bertindak sebagai penderma pasangan elektron, dan kepelbagaian sebatian kimia unsur-unsur ini. Oleh itu, wakil kelas pelarut ini dibahagikan kepada N-bes (amin atau amida pelbagai jenis), 0-bes (eter dan ester, alkohol, keton, kurang kerap aldehid), bes-S (tioeter, tioalkohol, sulfoksida), bes-P (trialkil-, triaril- atau alkylarylphosphines), dsb.
Pelarut penerima dibahagikan kepada protik dan aprotik.
Pelarut yang mampu mengambil bahagian dalam keseimbangan protolitik, bergantung pada fungsi yang dipamerkan, sering dipanggil protofilik (asas) dan protogenik. (berasid). Pelarut yang mempamerkan kedua-dua fungsi dengan mudah (alkohol, keton) dipanggil amfiprotik.
Banyak molekul pelarut mengambil bahagian dalam pelarutan melalui pembentukan ikatan hidrogen (H-). Selaras dengan ini, klasifikasi pelarut mengikut keupayaan mereka untuk membentuk ikatan-H telah dicadangkan.
Kelas pertama dalam sistem pengelasan ini terdiri daripada cecair yang di dalamnya terdapat rangkaian tiga dimensi ikatan-H. Pelarut kelas ini (air, asid formik, asid sulfurik, glikol) dicirikan oleh DP yang sangat tinggi dan kelikatan dan tenaga pengaktifan aliran likat yang agak tinggi. Sebagai peraturan, pelarut kelas ini larut dengan baik antara satu sama lain, membentuk sekutu heteromolekul melalui ikatan H.
Kelas kedua ialah cecair dengan rangkaian dua dimensi ikatan-H. Sebagai peraturan, molekul pelarut kelas ini mengandungi satu kumpulan hidroksil (alkohol monohidrik, asid karboksilik monobes, fonol, dll.). Kecenderungan untuk membentuk sekutu heteromolekul dalam kumpulan pelarut ini secara amnya kurang ketara berbanding wakil kelas pertama.
Kelas ketiga menyatukan cecair yang molekulnya mengandungi atom nitrogen, oksigen, sulfur, fluorin, dan lain-lain, yang mampu membentuk ikatan-H dengan penderma proton. Kelas ini termasuk ester, amina, keton, aldehid, dsb.
Kelas keempat termasuk cecair yang molekulnya boleh menjadi penderma proton. Ini termasuk kloroform, dichloroethane, dsb.
Kelas kelima menyatukan cecair yang molekulnya tidak mampu keadaan biasa mengambil bahagian dalam pembentukan ikatan-H. Kumpulan ini termasuk alkana, karbon tetraklorida, perhaloalkana, dsb.
Parker mencadangkan untuk mengelaskan pelarut mengikut keupayaannya untuk melarutkan ion. Dalam klasifikasi ini, pelarut dibahagikan kepada kumpulan.
Apolar aprotik - cecair dengan DP rendah (
Aprotik dipolar - cecair dengan nilai DP ( > 15) dan momen dipol yang agak tinggi (µ > 2D) ,
tidak mengandungi hidrogen yang mampu membentuk ikatan-H. Wakil kumpulan pelarut ini ialah sulfur dioksida, nitrobenzena, nitrometana, asetonitril, propilena karbonat, DMSO, dll.
Protik - cecair yang molekulnya mengandungi kumpulan di mana atom hidrogen disambungkan kepada atom elektronegatif. Sebatian yang termasuk dalam kumpulan ini (asid karboksilik, alkohol, fenol, dll.) Dibezakan dengan keupayaan yang dinyatakan dengan jelas untuk membentuk ikatan-H.
Keupayaan pelarut pelarut secara amnya meningkat daripada kumpulan pertama kepada kumpulan ketiga.
Brønsted mencadangkan untuk mengklasifikasikan pelarut berdasarkan gabungan pemalar dielektrik dan protogenisiti. Selaras dengan ciri-ciri ini, dia membahagikan pelarut kepada lapan kumpulan.
Contoh pelarut pelbagai kumpulan dalam rangka klasifikasi Brensted termasuk: I - air II - asid sulfurik, asid formik III - hidrazin, nitrobenzene, asetonitril, nitromethane; cecair bromo- dan hidrogen iodida VII - trietilamin, piridin VIII - heksana, klorobenzena;
Pengelasan Brønsted membolehkan seseorang meramalkan sifat asid-bes bagi sebatian terlarut dalam pelarut setiap kumpulan. Oleh itu, dalam pelarut kumpulan II, kekuatan bes adalah jauh lebih tinggi daripada pelarut kumpulan III; Kekuatan asid dalam pelarut kumpulan III biasanya lebih tinggi daripada pelarut kumpulan VII, dsb.
Jadual 4
Pengelasan pelarut mengikut Brønsted.
| Harta benda | Jenis pelarut |
|||||||
| saya | II | III | IV | V | VI | VII | VIII |
|
| DP | + | + | + | + | - | - | - | - |
| Protogenisiti | + | + | - | - | + | + | - | - |
| Protofilaliti | + | - | + | - | + | - | + | - |
* Tanda + dan – dalam baris pertama sepadan dengan DP tinggi dan rendah, dalam baris yang tinggal - dengan kehadiran atau ketiadaan harta ini.
Pengelasan pelarut juga dicadangkan, berdasarkan lapan ciri fizikal: fungsi Kirkwood, pembiasan molar, parameter keterlarutan Hildebrand, indeks biasan, takat didih, momen dipol, serta tenaga bagi orbital molekul tidak terisi tertinggi dan terendah. Berdasarkan gabungan sifat-sifat ini, adalah dicadangkan untuk membahagikan pelarut kepada sembilan kumpulan:
1) dipolar aprotik (contohnya, asetonitril, nitrometana, aseton, 1,2-dikloroetana);
2) aprotik sangat dipolar (DMSO, DMF, DMAA, propilena karbonat, nitrobenzena);
3) aprotik, sangat dipolar dan sangat polarisasi (sulfolana, HMFTA);
4) aromatik non-polar (benzena, toluena);
aromatik agak kutub (chlorobenzene, o-dichlorobenzene, acetophenone);
penderma elektron (trietilamin, eter, dioksana);
pelarut dengan ikatan H (alkohol, asid karboksilik);
pelarut yang sangat berkaitan dengan ikatan H (formamida,
dietilena glikol, air);
pelarut dengan fungsi yang tidak ditentukan (karbon disulfida, kloroform).
1.7 Kajian semula kaedah untuk menentukan keterlarutan pepejal
1.7.1 Penentuan gravimetrik keterlarutan
Kaedah ini terdiri daripada menentukan jisim bahan yang terlarut dalam jisim pelarut tertentu (keterlarutan spesifik P ` ) dan mengira keterlarutan sebagai jisim bahan yang mampu larut dalam 100 gram pelarut tertentu. Kaedahnya adalah penilaian.Satu sampel bahan ujian ditimbang pada neraca teknokimia (g 1 ` ). Timbang satu sampel pelarut (g p). Tentukan jisim penapis kering (g 2). Tuangkan sampel bahan ke dalam pelarut; jika bahan itu telah larut sepenuhnya, maka perlu menambahnya sehingga pelarutan berhenti, perhatikan sampel lengkap bahan yang dituangkan ke dalam pelarut (g 1). Tapis bahan tidak larut melalui penapis dan tentukan jisim penapis basah dengan bahan yang tinggal (g 3). Keringkan penapis dengan bahan yang tinggal kepada berat tetap (g 4). Kira keterlarutan spesifik menggunakan formula:
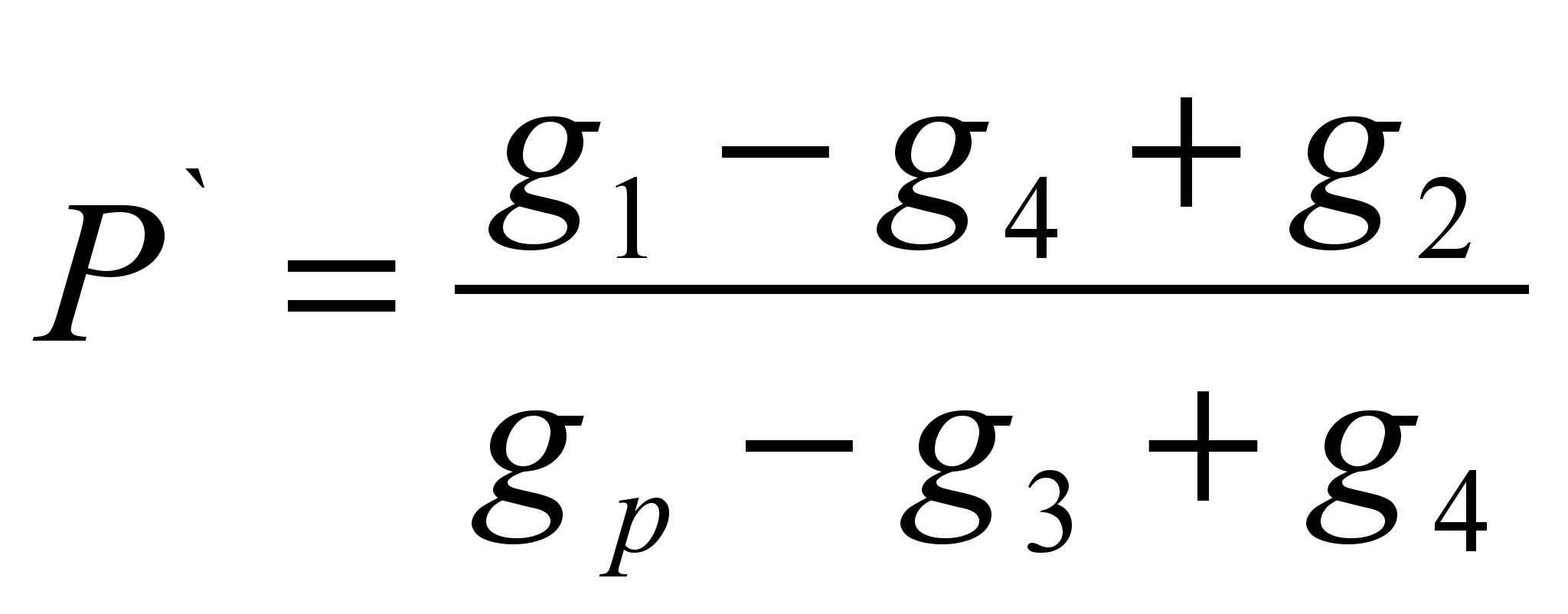
P = P` 100 (g/100 g)
Jadual 5
Keterlarutan fenolftalein dalam beberapa pelarut
| pelarut | keterlarutan | r |
| Sangat polar |
||
| air | 0,0002 | 78,30 |
| Metil alkohol | 19,42 | 52,66 |
| Kutub lemah |
||
| Etanol | 17,29 | 24,55 |
| Aseton | 16,98 | 20,70 |
| kloroform | 2,97 | 4,81 |
| Bukan polar |
||
| xilena | 0,19 | 2,43 |
| toluena | 0,17 | 2,38 |
| benzena | 0,16 | 2,27 |
1.7.2 Kaedah elektrokimia.
1. Pasang pemasangan untuk menentukan rintangan isipadu larutan elektrolit mengikut rajah (lihat Rajah 3).
2. Larutan akueus kalium klorida dengan kepekatan tertentu dituangkan ke dalam bekas pengukur hingga tanda dan bekas dengan elektrod disimpan dalam termostat pada suhu tertentu. Selepas 15-20 minit, sambungkan kapal di titik B dan D ke pemasangan.
3. Menggunakan majalah perintang dan sesentuh bergerak C, jambatan itu seimbang, mencapai sama ada bunyi paling sedikit dalam telefon atau amplitud minimum gelombang sinus pada skrin ascillograph. Titik pampasan didekati sama ada dari satu hujung rheochord atau dari yang lain. Pengukuran dan pengiraan seterusnya bagi R x:
R x = R 1 
Ulang 3-4 kali pada rintangan yang berbeza R 1 . Dalam kes ini, sentuhan bergerak tidak boleh mendekati hujung rheochord. Jika sisihan dalam ukuran kurang daripada 0.5%, maka hasilnya dianggap memuaskan dan teruskan untuk mengira pemalar vesel menggunakan formula:
K=  /
w =
Rx
/
w =
Rx
Di mana R x ialah rintangan penyelesaian; -
kekonduksian elektrik tertentu.
4. Sebilangan kecil garam dituangkan ke dalam 100 ml air dan, tutup rapat kelalang dengan penyumbat, goncangkannya secara berterusan selama 20 minit. Suspensi yang terhasil disedut melalui penapis kaca, dan mendakan digunakan untuk menyediakan larutan tepu. Larutan yang terhasil dituangkan ke dalam bekas untuk mengukur kekonduksian elektrik dan, selepas termostat, rintangan larutan diukur.
=
k /
Rx  = /
C
= /
C
Di mana C ialah kenormalan larutan, kg eq / m 3.
Oleh kerana kepekatan garam dalam larutan tepu adalah rendah, maka = . Berdasarkan persamaan:
C = ( r - V ) /
di mana r– kekonduksian elektrik khusus larutan garam.
Produk keterlarutan untuk elektrolit monovalen:
![]() = ( C ) 2
= ( C ) 2
6. Masukkan keputusan ke dalam jadual:
| garam | t, C 0 | , cm/m | Rintangan, Ohm | K | | | C | L |
|||
| R 1 | R2(AC) | R 3(CB) | R X |
||||||||
Jadual 6
Kekonduksian elektrik khusus larutan KCI
| t, C 0 | 1 N KCI | 0.1 N | 0.02 N | 0.01 N |
| 10 4 , Ohm -1 cm -1 |
||||
| 0 | 654,1 | 71,5 | 15,21 | 7,76 |
| 10 | 831,9 | 93,3 | 19,94 | 10,20 |
| 14 | 906,3 | 102,5 | 21,93 | 11,21 |
| 16 | 944,1 | 107,2 | 22,94 | 11,73 |
| 18 | 982,2 | 111,9 | 23,97 | 12,25 |
| 20 | 1020,7 | 116,7 | 25,01 | 12,78 |
| 22 | 1055,4 | 121,5 | 26,06 | 13,32 |
| 24 | 1098,4 | 126,4 | 27,12 | 13,86 |
| 25 | 1118,0 | 128,8 | 27,65 | 14,13 |
| 26 | 1137,7 | 131,8 | 28,19 | 14,41 |
| 28 | 136,2 | 29,27 | 14,96 |
|
| 30 | 141,2 | 30,36 | 15,52 |
|
| 32 | 146,2 | 31,46 | 16,09 |
|
| 34 | 151,3 | 32,56 | 16,67 |
|
| 36 | 156,4 | 33,68 | ||
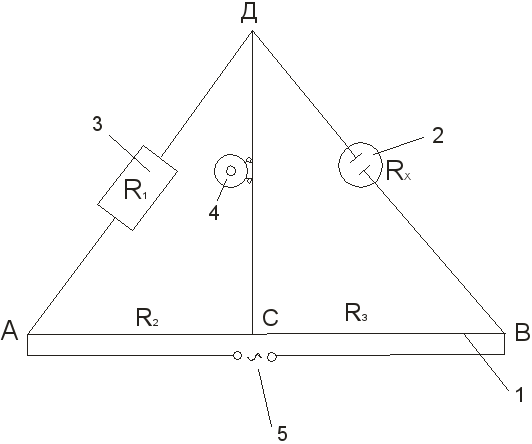
Rajah.3 Gambar rajah pemasangan untuk menentukan kekonduksian elektrik:
1 – wayar diregangkan di atas pembaris; 2 – kapal pengukur dengan elektrod; 3 – reostat; 4 – telefon berimpedans rendah; 5 – sumber semasa.
1.7.3
Kaedah fotoelektrokalometrik.
Kaedah ini adalah berdasarkan hukum aditiviti ketumpatan optik sambil memerhatikan undang-undang asas penyerapan cahaya.
Kemajuan kerja
1.Pemilihan penapis cahaya yang optimum.
1.1. Masukkan ke dalam kelalang volumetrik 25 ml:
Campurkan larutan dan ukur ketumpatan optik berbanding pelarut yang dipilih menggunakan penapis cahaya yang berbeza dalam kuvet yang paling sesuai. Nyatakan saiz kuvet. Lihat helaian data peranti untuk prosedur pengendalian untuk FEC.
1.2. Masukkan data yang diperoleh ke dalam jadual:
1.3. Lukiskan lengkung penyerapan cahaya A = f(, nm) pada kertas graf dan tentukan penapis panjang gelombang yang paling sesuai digunakan semasa operasi.
2. Pembinaan graf.
2.1. Sediakan satu siri penyelesaian standard. Ukur ketumpatan optik setiap siri penyelesaian standard yang disediakan menggunakan penapis cahaya yang dipilih sebelum ini.
2.2. Masukkan data eksperimen ke dalam jadual (lihat di bawah) untuk setiap siri penyelesaian secara berasingan, dan jalankan pemprosesan statistik keputusan yang diperolehi.
2.3. Menggunakan data jadual pada kertas graf, bina graf A = f(C bahan) dan hitung keterlarutan fenolftalein dalam pelarut.
Setelah mengkaji literatur mengenai isu keterlarutan fenolftalein, kaedah yang dinyatakan di atas telah dipilih. Dan setelah membandingkannya mengikut kemungkinan menggunakannya dalam keadaan makmal kami, dari segi tempoh, dan dari segi kemudahan pelaksanaan, kaedah gravimetrik untuk menentukan keterlarutan telah dipilih.
2. Bahagian eksperimen
2.1 Sintesis fenolftalein
Sintesis telah dijalankan mengikut kaedah yang dinyatakan dalam kajian literatur (klausa 1.4.1).
| Tindakan | pemerhatian |
| 1. Ditimbang: 5 g –phthalic anhydride (gred reagen) | Serbuk kristal putih Kristal merah jambu, meresap |
| 2. Letakkan reagen dalam kelalang kon berdasar rata (100 ml), dikacau dengan termometer di dalamnya. | Jisim seperti bubur telah terbentuk, dan campuran dipanaskan sedikit (t ≈ 37 0 C). |
| 3. Letakkan kelalang dan panaskan dalam mandi pasir (suhu dalam 125 - 130 0 C). Panaskan selama 1.5 jam. | Pada suhu 45 0 C, fenol cair, phthalic anhydride (serpihan putih) terapung dalam cair keperangan. Selepas dipanaskan selama 30 minit (t ≤ 130 0 C), cair coklat-lembayung homogen terbentuk. Selepas 1 jam pemanasan - cair homogen warna merah darah. Selepas 1.5 jam pemanasan berhenti. |
| 4. Dia menuang cair panas ke dalam kelalang dengan air mendidih dan menyuling fenol yang tidak bertindak balas dengan wap air (lihat gambar pemasangan dalam bahagian kajian literatur yang sepadan). | Dalam kelalang dengan air mendidih, selepas menuang cair panas, kepingan fenolftalein kuning muda yang tidak berbentuk mula terapung, kekeruhan sedikit air berlaku, t ? 99 0 C. Sulingan keruh dibebaskan (V = 50 ml). Selepas 15 minit penyulingan, sulingan jernih mula menitis. |
| 5. Dekantasi larutan dengan fenolftalein pada corong Buchner tanpa memindahkan mendakan ke penapis. Saya membasuh sedimen dengan tiga bahagian air sejuk, 100 ml setiap satu. | Suhu larutan ialah 26 0 C, dalam larutan (V? 170 ml) terdapat kepingan fenolftalein berbentuk bijian, berwarna sedikit kekuningan. |
| 6. Fenolftalein yang ditapis dilarutkan dalam 15 ml larutan natrium hidroksida hangat (? = 5%). | T NaOH ?42 0 C, larutan bertukar menjadi merah gelap. |
| 7. Saya menapis larutan merah gelap. | Suhu penyelesaian? 35 0 C. Selepas tamat penapisan, lapisan bahan nipis, merah jambu-putih, berhablur halus telah mendap pada penapis (kemungkinan besar ini adalah anhidrida phthalic yang tidak bertindak balas). |
| 8. Kepada turasan (V? 50 ml) ditambah 5 ml asid asetik (c.), dalam 1 ml bahagian, kacau. | Terdapat perubahan dalam warna larutan daripada merah gelap kepada larutan kelabu-putih, keruh (berkeping). Penyelesaiannya tidak memanaskan badan. Suhu penyelesaian? 31 0 C. |
| 9. Ditambah 2 titik asid hidroklorik (k.) | Perubahan visual tidak berlaku |
| 10. Biarkan ia berdiri selama 1 jam. | Serpihan itu menetap di bahagian bawah kaca; di atas sedimen terdapat larutan telus, kepingan itu berwarna putih kelabu. |
| 11. Menapis mendakan yang terhasil. | Terdapat buburan putih-kelabu pada penapis. ow? 5.07 |
Sebanyak 5.07 g penyediaan basah diperolehi.
2.2 Penghabluran semula daripada alkohol panas
Penghabluran semula telah dijalankan mengikut kaedah yang dinyatakan dalam kajian literatur (bahagian 1.4.4). Satu replika telah dilakukan. Lukisan peranti ditunjukkan dalam perenggan 1.4.4 ulasan literatur.
| Tindakan | Pemerhatian |
| Satu sampel fenolftalein (5.07 g) dimasukkan ke dalam kelalang dan 50 ml etanol 96% ditambah. | Sebahagian kecil pheolphthalein terlarut. Alkohol telah menjadi sedikit keruh. |
| Panaskan kelalang hingga mendidih. Ditambah alkohol sehingga phenolphthalein larut sepenuhnya (0.5 ml setiap satu). V ETOH = 7 ml. | fenolftalein telah dibubarkan sepenuhnya. Alkoholnya keruh. t campuran = 85 o C. |
| Campuran perlahan-lahan disejukkan ke suhu bilik. | campuran t = 19 o C. Banyak hablur putih terjatuh daripada larutan dalam bentuk hablur kecil. Penyelesaiannya adalah telus. |
| Hablur yang jatuh disedut keluar, dibasuh pada penapis dengan air batu, dan dikeringkan di antara helaian kertas turas. | fenolftalein yang diperolehi dalam bentuk hablur udara warna putih-kelabu, berbutir halus. m(phenolphthalein) = 4.08 g. Hasil penghabluran semula ialah 83.5%. |
Pengiraan penghabluran semula:
Keluaran penghabluran semula:
W,% = (m(phenolphthalein) silang kering 100%) / m(phenolphthalein) kering
W,% =  % = 83,5 %
% = 83,5 %
Pengiraan hasil sintesis:
Untuk mendapatkan 0.0388 mol fenolftalein (teori) atau m = 0.0338 mol 318 g/mol = 10.7 g.
Output daripada teori:
W=  100 % = 40, 5 %
100 % = 40, 5 %
Oleh itu, ia diperoleh secara prinsip kuantiti yang mencukupi phenolphthalein (kira-kira 4.08 g) untuk penyelidikan lanjut. Sintesis telah dijalankan dengan hasil produk yang boleh diterima.
2.3 Penentuan keterlarutan
Penentuan keterlarutan fenolftalein telah dijalankan melalui gravimetri (lihat perenggan 1.7.1).
Kloroform, benzena dan xilena dipilih sebagai pelarut. kerana menurut data literatur (lihat Jadual 5) fenolftalein di dalamnya mempunyai keterlarutan yang boleh diterima untuk jisim fenolftalein yang tersedia. Saya tidak menggunakan air, kerana phenolphthalein mempunyai keterlarutan yang sangat rendah (kira-kira 10 -4 g setiap 100 g). Saya juga tidak menggunakan etanol, kerana phenolphthalein mempunyai keterlarutan yang sangat baik dalam alkohol dan penggunaan bahan yang besar akan diperlukan. Penentuan dilakukan pada 21 ± 1 o C (suhu fasa cecair). Infusi berlangsung selama 30 ± 1 min, dengan kacau kuat.
Formula pengiraan:
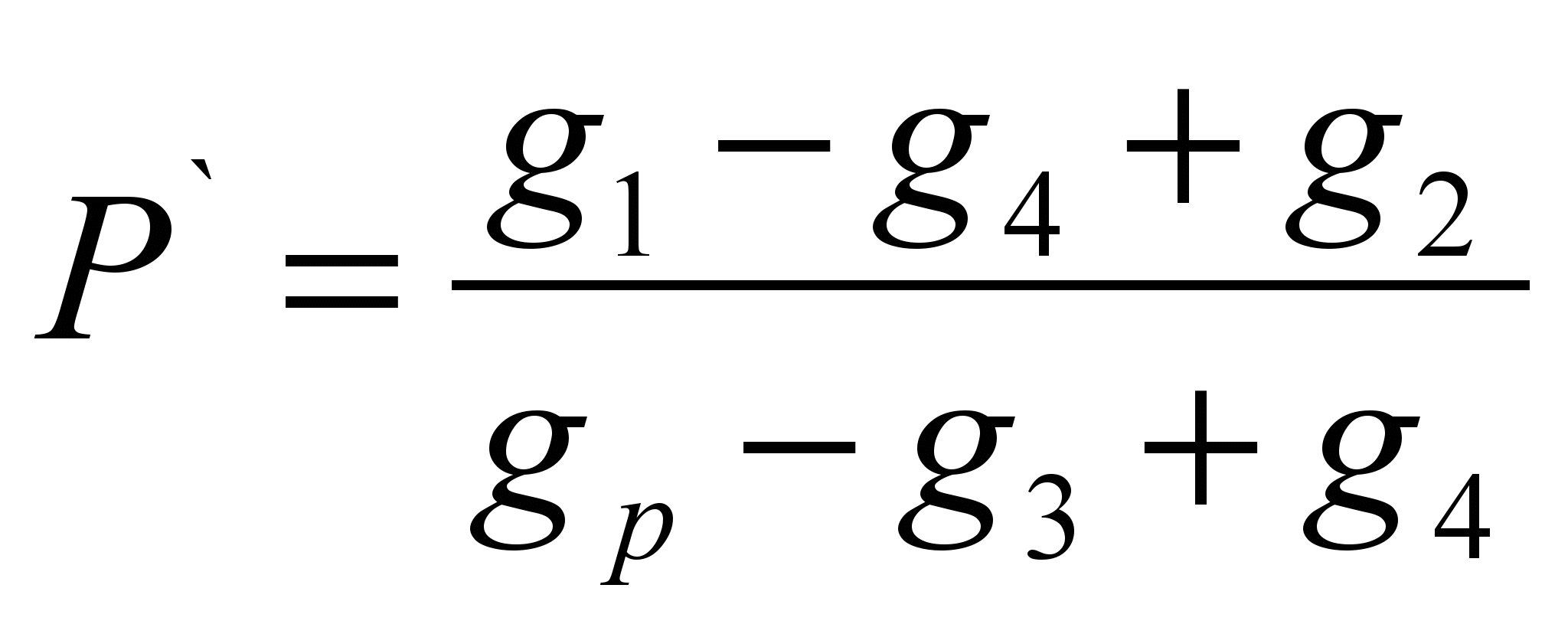 ; P = P` 100 (g/100 g)
; P = P` 100 (g/100 g)
Di mana, g 1 – sampel fenolftalein, g;
G 2 – jisim penapis kering, g;
G 3 – jisim penapis basah dengan sisa fenolftalein, g;
G 4 – jisim penapis kering dengan sisa fenolftalein, g;
G p—berat pelarut, g;
P – keterlarutan, larutan g/100 g;
Р` - keterlarutan khusus, g/1 g larutan.
Keputusan penentuan:
P (phenolphthalein / kloroform) = (3.0 ± 0.03) g / 100 g kloroform; ? = 1%.
P (phenolphthalein / xylene) = (0.22 ± 0.01) g / 100 g xylene; ? = 6%.
P (phenolphthalein / benzena) = (0.19 0.01) g / 100 g benzena; = 6%.
Berdasarkan data eksperimen, jadual ringkasan dan graf telah dibina.
Jadual 7
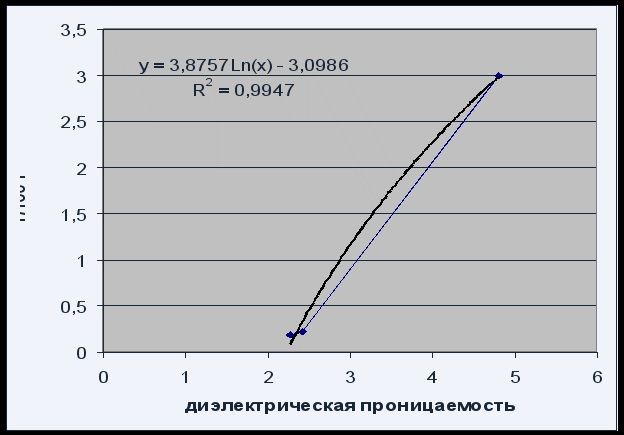
Rajah.4 Kebergantungan keterlarutan pada pemalar dielektrik pelarut
Kebergantungan keterlarutan pada pemalar dielektrik pelarut boleh digambarkan oleh persamaan logaritma P = 3.8757 Ln(x) – 3.0986 dengan kualiti yang memuaskan R 2 = 0.995.
Disebabkan fakta bahawa keterlarutan fenolftalein meningkat dengan peningkatan pemalar dielektrik pelarut (meningkatkan kekutubannya), kita boleh mengatakan bahawa fenolftalein ialah sebatian polar.
Kesimpulan
Semasa kerja, 26 sumber sastera telah dianalisis. Diterangkan kedudukan umum diperoleh melalui tindak balas fenol dan anhidrida phthalic. Kajian semula kaedah sintesis telah dijalankan (satu kaedah ditemui, dalam sumber literatur berbeza kaedah berbeza dalam berat beban reagen) fenolftalein. Menjalankan sintesis menggunakan kaedah ini tidak rumit dengan proses sampingan. Bahaya utama semasa sintesis dan pengendalian bahan yang digunakan dikenal pasti. Kaedah untuk menentukan keterlarutan telah dipilih. Kloroform, xilena dan benzena dipilih sebagai pelarut untuk menentukan keterlarutan.
Fenolftalein telah disintesis dengan hasil sebanyak 40.5%. Syarat untuk sintesis, penulenan dan pengasingan diperhatikan mengikut ketat dengan data kaedah.
Keterlarutan fenolftalein (mengikut penentuan gravimetrik) ialah: 3.00 ± 0.03 g/100 g kloroform, 0.22 ± 0.01 g/100 g xilena, 0.19 ± 0.01 g/100 g benzena.
Peningkatan dalam keterlarutan fenolftalein dengan peningkatan pemalar dielektrik pelarut mengesahkan bahawa fenolftalein ialah sebatian ipolar.
Senarai sastera terpakai
1.Agronomov A.E. kerja makmal dalam kimia organik. – M.: Pendidikan, 1977. 230 hlm.2. Astakhova L.I., Krivenko A.P. Bengkel kimia organik. – M.: Mir, 1990. 180 hlm.
3.Bichot E. Penunjuk. – M.: Mir, 1976. 356 hlm.
4. Buhler K., Pearson D. Sintesis organik. M.: Lebih tinggi. Shk., 1973. 340 hlm.
5. Gerasimov Ya.I. Termodinamik penyelesaian. – M.: Rumah penerbitan – Universiti Negeri Moscow, 1980. 170 p.
6. Bengkel Gitis S.S. tentang kimia organik /S. S. Gitis, A. I. Glaz, A. I. Ivanov. – M.: VSh, 1991.
7.Golodnikov G.V. Bengkel kimia organik. – M.: Kimia, 1978. 160 hlm.
8. Grandberg I. I. Kerja amali dan seminar dalam kimia organik: Manual untuk pelajar. universiti – ed. ke-4, disemak. dan tambahan – M.: Bustard, 2001.
9. Ivanov V. G. Bengkel mengenai kimia organik: Buku Teks. Manual untuk pelajar. lebih tinggi ped. buku teks pertubuhan / V. G. Ivanov, O. N. Geva, Yu. – M.: Pusat Penerbitan “Akademi”, 2000.
10. Karapetyants M.Kh. Pengenalan kepada teori proses kimia. – M.: Lebih tinggi. Shk., 1975. 280 hlm.
11.Kirilin V.A. Termodinamik penyelesaian. – M.: Tenaga, 1980. 80 hlm.
12.Kogan V.B. Buku Panduan Keterlarutan. – M.: Leningrad penerbitan Akademi Sains, 1961. 300 p.
13. Levina R. Ya. – M.: Kimia, 1980.
14. Organikum: Kerja amali tentang kimia organik. – M.: Mir, 1979 – T.2.
15. Petrov A. A. Kimia organik: Buku teks untuk universiti / A. A. Petrov, H. V. Balyan, A. T. Troshchenko. – ed. ke-5, disemak. dan tambahan – St. Petersburg: Ivan Fedorov, 2002.
16. Reichard K. Pelarut dan kesan alam sekitar dalam kimia organik. – M.: Mir, 1991. 182 hlm.
17. Panduan kelas makmal dalam kimia organik: Manual untuk universiti / N. N. Artemyeva, V. L. Beloborodova, S. E. Zurabyan dan lain-lain; Ed. N. A. Tyukavkina. – ed. ke-2, disemak. dan tambahan – M.: Bustard, 2002.
18.Hartanah sebatian organik: buku rujukan /Ed. A. A. Potekhina. – L.: Kimia, 1984.
19. Smolina T. A. Kerja amali dalam kimia organik: bengkel kecil /T. A. Smolina, N. V. Vasilyeva, N. B. Kupletskaya. – ed. ke-2, disemak. – M.: Pendidikan, 1986.
20. Buku Panduan Kimia / Ed. B. N. Nikolsky dan lain-lain - L.: Kimia, 1964.
21. Stromberg A. G. Kimia fizikal: Buku teks. untuk kimia. pakar. universiti /A. G. Stromberg, D. P. Semchenko; Ed. A. G. Stromberg. – ed. ke-5, rev. – M.: VSh, 2003.
22. Traven V. F. Kimia organik: Buku teks untuk universiti. – M.: ICC “Akademkniga”, 2004. – T.1.
23.Kimia fizikal. Dalam 2 buah buku. Buku 1. Struktur jirim. Termodinamik: Buku teks. untuk universiti / K. S. Krasnov, N.K. Vorobyov, I.I. Ed. K. S. Krasnova - ed. ke-3, disemak. – M.: VSh, 2001.
24. Fialkov Yu.A. Pelarut sebagai agen kawalan proses kimia. - L.: Kimia, 1990. 240 hlm.
25.Kimia kamus ensiklopedia/Ed. I. L. Knunyants dan lain-lain - M.: Ensiklopedia Soviet, 1983.
26. Khramkina M.N. Bengkel tentang sintesis organik. – M.: Moscow State University Publishing House, 1985. 473 p.
Formula empirik Phenolphthalein: C20H14O4 .
Apakah itu Phenolftalein?
Menurut Wikipedia, 4,4'-dioxyphthalophenone atau 3,3-bis-(4-hydroxyphenyl)phthalide mewakili penunjuk asid-bes .
Bahan seperti litmus, fenolftalein, metil jingga digunakan secara meluas dalam kimia untuk menentukan keasidan larutan.
Dalam bentuknya yang tidak berubah, produk adalah kristal lutsinar yang tidak larut dalam air, tetapi sangat larut dalam alkohol dan dietil eter . Bahan itu boleh disintesis daripada fenol Dan anhidrida phthalic oleh tindak balas pemeluwapan, menggunakan zink klorida Bagaimana pemangkin (anda juga boleh menggunakan pekat asid sulfurik ).
Bahan ini dalam persekitaran berasid ( pH dari 0 hingga 3) memperoleh warna oren yang jelas. Dalam persekitaran yang sedikit berasid dan neutral ( pH dari 4 hingga 7) larutan tidak akan berubah warnanya. Dengan bantuan Phenolphthalein anda boleh mengenali persekitaran yang beralkali. Oleh kerana produk mengambil warna merah dalam larutan, pH iaitu dari 8 hingga 10 ( larutan alkali). Jika nilai-nilai nilai pH dari 11 hingga 14, maka penunjuk tidak akan menjejaskan warna ubat dalam apa jua cara. Fenolftalein digunakan untuk pentitratan pelbagai larutan akueus V kimia analitik , bahan yang dilarutkan dalam alkohol biasanya digunakan.
Phenolphthalein juga digunakan secara meluas dalam perubatan. apa dah jadi Purgen ? Ia adalah sinonim untuk Phenolphthalein. Pada abad yang lalu, bahan itu digunakan secara aktif sebagai julap. Ubat ini secara aktif merangsang motilitas usus. Kini julap Purgen jarang digunakan kerana keupayaannya untuk terkumpul di dalam badan dan menjejaskan fungsi buah pinggang.
Tindakan farmakologi
Laksatif.
Farmakodinamik dan farmakokinetik
Phenolftalein, apakah itu?
Purgen adalah julap yang kuat. Mekanisme tindakannya adalah berdasarkan peningkatan peristalsis usus. Ini berlaku kerana keupayaan bahan untuk menekan natrium-kalium ATPase , merangsang adenil siklase dan semakin meningkat biosintesis . Bahan tersebut merangsang sinaps dan ujung saraf dinding usus, mengganggu keseimbangan air-elektrolit V Saluran gastrousus , cecair terkumpul.
Selepas dos pertama, kesan produk berlaku dalam masa 24 jam. Bahan tersebut cenderung terkumpul di dalam badan, mempunyai kesan merengsa pada buah pinggang, dan mempunyai prokarsinogenik harta benda.
Petunjuk untuk digunakan
Persediaan yang mengandungi bahan ini digunakan sebagai julap untuk kronik.
Kontraindikasi
Laxative Purgen adalah kontraindikasi:
- untuk penyakit buah pinggang;
- pesakit dengan halangan usus ;
- apabila menggunakan Phenolftalein;
- apabila kompleks gejala dikesan pada pesakit " perut akut ”.
Ubat tidak boleh digunakan untuk masa yang lama. Penjagaan khusus mesti diambil semasa merawat orang tua.
Kesan sampingan
Tablet Purgen boleh menyebabkan:
- degupan jantung yang cepat kerana tidak normal keseimbangan air-elektrolit ;
- albuminuria ;
- runtuh ;
- penurunan paras kalium dalam darah;
- perubahan warna air kencing daripada kuning kepada merah jambu atau coklat;
- ruam kulit dll.
Arahan untuk Purgen (Kaedah dan dos)
Julap boleh didapati dalam bentuk tablet, pelbagai dos atau serbuk untuk pentadbiran lisan.
Arahan untuk penggunaan Phenolphthalein
Secara purata, dos harian untuk orang dewasa ialah 100 mg.
Kanak-kanak ditetapkan 50-200 mg ubat setiap hari, bergantung pada umur dan berat badan mereka.
Jumlah maksimum bahan yang boleh diambil dalam masa 24 jam ialah 300 mg.
Kursus rawatan ditetapkan oleh pakar. Ubat yang mengandungi komponen ini tidak boleh diambil untuk masa yang lama.
Terlebih dos
Ubat itu boleh menyebabkan pendarahan buasir , penurunan yang ketara, sehingga runtuh , kemunculan protein dalam air kencing. Sekiranya berlebihan, disyorkan untuk berunding dengan doktor.
Interaksi
Fenolftalein boleh menyebabkan pengekalan kalium dalam badan jika terapi dijalankan serentak diuretik penjimat kalium .
Syarat jualan
Tiada preskripsi diperlukan.
Keadaan penyimpanan
Simpan persediaan berasaskan Phenolphthalein di tempat yang kering, gelap, terlindung daripada kanak-kanak, pada suhu bilik.
Terbaik sebelum tarikh
Serbuk mempunyai jangka hayat yang tidak terhad, tablet boleh disimpan selama 10 tahun (kecuali dinyatakan sebaliknya oleh pengilang pada pembungkusan).
Arahan khas
Pada masa kini, ubat yang mengandungi phenolphthalein jarang digunakan dalam perubatan. Selalunya, keutamaan diberikan kepada julap moden dan selamat yang lain.
Untuk kanak-kanak
Bahan itu ditetapkan dengan berhati-hati. Pelarasan dos adalah perlu bergantung pada umur dan berat kanak-kanak.
Warga emas
Secara peribadi usia tua Kesan pengambilan ubat ini berlaku dalam masa 24-72 jam.
Untuk penurunan berat badan
Pada awal abad yang lalu, bahan itu digunakan untuk menurunkan berat badan. Kini terdapat ubat lain yang mempunyai kesan yang sama. Ramai kanak-kanak perempuan dalam mencari angka yang ideal menyalahgunakan julap, yang tidak boleh dilakukan. Ini mungkin berbahaya kepada kesihatan anda.
Ubat yang mengandungi (Analog)
Padanan kod ATX Tahap 4:
Ex Lax, Purgen, Purgofen, Purgil, Phenaloin, Laxatol, Laxoil.
Harga Purgen, mana nak beli
Harga julap dalam bentuk serbuk Phenolphthalein secara borong adalah kira-kira 1,700 rubel setiap 1 kg.
Hampir mustahil untuk membeli produk di Moscow, kerana ubat berdasarkannya tidak dibekalkan ke farmasi untuk masa yang lama.
Harga Phenolphthalein mungkin berbeza bergantung pada pengeluar.
