Pembekuan penyelesaian. Larutan membeku pada suhu yang lebih rendah daripada pelarut tulen.
Penyelesaian mendidih pada lebih daripada suhu tinggi bagaimana pelarut tulen;
Akibat daripada undang-undang Raoult
Penyelesaian yang mematuhi undang-undang Raoult adalah ideal. Untuk penyelesaian sebenar bukan elektrolit, hukum Raoult diperhatikan dengan lebih tepat, lebih cair larutan ini. Apabila kepekatan zat terlarut meningkat, kebanyakan larutan mempamerkan penyelewengan daripada hukum Raoult.
Penurunan relatif dalam tekanan wap tepu pelarut di atas larutan adalah sama dengan pecahan mol zat terlarut.
Larutan elektrolit (asid, bes, garam) tidak mematuhi hukum Raoult. Lebih-lebih lagi, walaupun dalam kes di mana ia dicairkan. Punca fenomena ini akan dibincangkan kemudian.
Dua akibat penting berikut dari undang-undang Raoult:
Mari kita lihat mereka dengan lebih terperinci.
Mendidih adalah proses fizikal peralihan cecair kepada keadaan gas atau wap, di mana gelembung gas terbentuk di seluruh isipadu cecair.
Cecair mendidih apabila tekanan wap tepunya menjadi sama dengan tekanan luar. Jika tekanan luaran (contohnya, atmosfera) tidak berubah, dan cecair itu sendiri adalah bahan tulen individu dan kimia, maka ia mendidih dalam bekas terbuka yang dipanaskan pada suhu malar sehingga fasa cecair hilang sepenuhnya.
Jadi, pada tekanan atmosfera 101.325 kPa, takat didih air tulen (suling) ialah 100 o C atau 373.16 K.
Jika beberapa bahan tidak meruap dilarutkan dalam H 2 O, maka tekanan wap tepunya akan berkurangan. Agar larutan yang terhasil mendidih, perlu memanaskannya pada suhu yang lebih tinggi daripada 373.16 K, kerana hanya dalam keadaan sedemikian tekanan wap tepu pelarut akan kembali menjadi sama dengan tekanan atmosfera.
Pembekuan atau penghabluran ialah fenomena fizikal yang disertai dengan perubahan cecair kepada pepejal. Selain itu, struktur kristal terbentuk sepanjang keseluruhan isipadu cecair.
Proses pembekuan bermula apabila tekanan wap tepu di atas cecair menjadi sama dengan tekanan wap tepu di atas kristal pepejalnya.
Jika tekanan luaran (atmosfera) kekal malar dan cecair tidak mengandungi bendasing asing, maka semasa proses penghabluran suhu cecair yang disejukkan akan kekal malar sehingga fasa cecair sepenuhnya bertukar menjadi pepejal.
Pada tekanan atmosfera bersamaan dengan 101.325 kPa, air suling membeku pada 0 o C (273.16 K). Tekanan wap tepu air di atas ais dan cecair dalam kes ini ialah 613.3 Pa.
Untuk larutan akueus, tekanan wap tepu pelarut pada 0 o C akan kurang daripada 613.3 Pa, dan di atas ais ia kekal tidak berubah. Ais yang dijatuhkan ke dalam larutan sedemikian akan cepat cair disebabkan oleh pemeluwapan wap berlebihan di atasnya.
Hanya dengan menurunkan suhu tekanan wap tepu di atas fasa cecair dan pepejal boleh disamakan semula dan proses penghabluran dimulakan.
Secara eksperimen telah ditubuhkan bahawa peningkatan takat didih (Dt bp) dan penurunan takat beku larutan (Dt sub) berbanding dengan pelarut tulen adalah berkadar terus dengan kepekatan molal bahan terlarut. Secara matematik, ini boleh ditulis seperti berikut:
t kip. penyelesaian - t mendidih. p-badan = Dt bale. = Em
t timbalan r-tel – t timbalan penyelesaian = Dt timbalan = Km
di mana m ialah kepekatan molal bahan terlarut; E dan K adalah, masing-masing, pemalar ebullioscopic (Latin ebbulio - mendidih) dan cryoscopic (Greek "krios" - sejuk), yang nilainya hanya bergantung pada sifat pelarut (Jadual 7).
Jadual 7. Pemalar Ebullioscopic E dan cryoscopic K beberapa pelarut (deg/mol)
nasi. 7.12. Mengurangkan tekanan wap air di atas larutan
Garis pepejal menyatakan sempadan medan fasa untuk air tulen. Ingat bahawa talian 1 memaparkan keseimbangan cecair-wap. Selepas menambahkan bahan larut tidak meruap ke dalam air, tekanan wap di atas larutan (garis putus-putus 2 ) menurun pada sebarang suhu.
Mana-mana cecair akan membeku (memejal) apabila tekanan wap di atasnya dibandingkan dengan tekanan wap di atas fasa pepejal (dalam kes air, di atas ais). Oleh itu, suhu beku larutan T timbalan akan kurang daripada suhu beku T tentang timbalan pelarut tulen - air.
F.M. Raul (1883) secara eksperimen menetapkan bahawa penurunan suhu beku (jika tidak - kemurungan beku)
timbalan DT = T tentang timbalan - T timbalan ,
disebabkan oleh zat terlarut yang berbeza yang diambil dalam kuantiti molar yang sama adalah sama untuk pelarut tertentu. Jadi, untuk 0.1m larutan akueus Bagi sesetengah bahan, suhu pemejalan berikut diperhatikan:
Bahan T timbalan , o C
Hidrogen peroksida H 2 O 2 - 0.186
Metil alkohol CH 3 OH - 0.181
Etil alkohol C 2 H 5 OH - 0.183
Sukrosa C 12 H 22 O 11 - 0.186
Dekstrosa C6H12O6 - 0.188
Pada kepekatan zat terlarut yang berbeza timbalan DT berkadar dengan kepekatan molal mereka m :
timbalan DT = K cr m (7.1)
Faktor perkadaran K cr dalam persamaan (7.1), dipanggil pemalar krioskop, mewakili penurunan molar dalam takat beku. Nilai ini secara berangka sama dengan penurunan takat beku larutan yang mengandungi 1 mol bahan terlarut dalam 1 kilogram pelarut, dengan syarat larutan itu mempunyai sifat yang ideal. Pemalar krioskop adalah ciri pelarut; nilainya tidak bergantung pada sifat zat terlarut.
Kepekatan molal boleh dinyatakan dalam sebutan jisim zat terlarut ( b) dan pelarut ( A) dalam gram (lihat klausa 7.3):
di mana M - jisim molar bahan terlarut (g/mol). Menggantikan ungkapan ini ke dalam persamaan (7.1), kita perolehi
Satu keadaan yang sangat penting berikutan daripada persamaan ini, iaitu: mengetahui komposisi tepat larutan cair dan mengukur suhu beku pelarut dan larutan tulen, anda boleh mengira jisim molar bahan terlarut:
Persamaan (7.2) adalah asas cryoscopic(atau kriometrik)kaedah menentukan jisim molar bahan dengan menurunkan takat beku larutannya Kaedah kriometri digunakan secara meluas dalam amalan makmal, termasuk di farmasi.
Prinsipnya adalah seperti berikut. Pertama, suhu lebur (atau pembekuan) sampel yang tepat diukur A pelarut terpilih. Kemudian bahagian bahan ujian yang ditimbang dengan tepat ditambah kepada pelarut. b dan takat lebur campuran yang terhasil diukur (atau takat beku jika bahan yang dipilih sebagai pelarut mempunyai takat lebur yang rendah). Berat zat terlarut mestilah lebih rendah daripada berat pelarut agar larutan menjadi cair. Nilai yang diterima timbalan DT digantikan ke dalam persamaan (7.2) dan dengan bantuannya jisim molar bahan yang dikaji dikira. Dalam kes yang paling mudah, air suling boleh digunakan sebagai pelarut. Walau bagaimanapun, disebabkan oleh nilai kecil pemalar krioskop dan takat beku yang rendah, yang memerlukan penggunaan kriostat atau campuran penyejukan khas, air hanya digunakan untuk anggaran anggaran jisim molar bahan. Sebagai peraturan, terutamanya apabila mengkaji bahan organik kompleks dengan jisim molar yang besar, bahan lain dipilih sebagai pelarut. Dalam kes ini, kapur barus dengan pemalar krioskop yang besar adalah amat penting. Syarat utama untuk penentuan kriometrik ialah keterlarutan lengkap bahan ujian dalam pelarut terpilih. Di bawah ialah pemalar krioskop bagi beberapa bahan (pada tekanan atmosfera biasa):
Bahan T pl o C Krioskopik
tetap K cr
Benzena 5.5 5.12
Asid asetik 16.8 3.90
Sikloheksana 6.5 20
Kapur barus 178.5 39.7
Kaedah cryoscopic juga digunakan untuk menentukan ketulenan bahan. Ini adalah berdasarkan fakta bahawa kehadiran walaupun bendasing yang kecil mengurangkan takat lebur sampel bahan yang dikaji. Oleh itu, dalam kimia (dan juga dalam farmasi), salah satu kriteria untuk ketulenan bahan ialah pencapaian suhu lebur maksimum yang tidak meningkat lagi selepas operasi penulenan tambahan.
Satu lagi aplikasi penting kesan cryoscopic ialah penyediaan campuran penyejukan. Dengan nisbah air (atau salji) tertentu dan beberapa garam tak organik, anda boleh dapatkan suhu rendah, disimpan untuk masa yang agak lama. Sebagai contoh, campuran yang terdiri daripada 100 g salji dan 143 g CaCl 2 6H 2 O membolehkan anda memperoleh suhu -55 o C.
Di kawasan beriklim sejuk, bahan antibeku seperti alkohol, gliserin atau etilena glikol ditambah ke dalam air yang digunakan dalam radiator kereta untuk mengelakkannya daripada membeku pada musim sejuk. Ais beku di jalan raya dan kaki lima mudah cair apabila ditaburkan garam meja atau abu, yang juga berdasarkan kesan cryoscopic. Anda hanya perlu ingat bahawa penggunaan garam yang berlebihan untuk tujuan ini boleh menyebabkan salinisasi takungan dan tanah berdekatan di tebingnya dan, akibatnya, gangguan alam sekitar.
Pembekuan ialah peralihan fasa di mana cecair bertukar menjadi pepejal. Takat beku cecair ialah suhu di mana tekanan wap tepu di atas cecair adalah sama dengan tekanan wap tepu di atas hablur fasa pepejal yang jatuh daripadanya.
Pada suhu ini dan tekanan wap tepu yang sepadan, kadar penghabluran adalah sama dengan kadar lebur dan kedua-dua fasa ini boleh wujud bersama untuk masa yang lama.
Juga M.V. Lomonosov menyedari bahawa larutan cair membeku pada suhu yang lebih rendah daripada pelarut tulen. Oleh itu, air laut membeku bukan pada 273 K, tetapi pada suhu yang lebih rendah sedikit. Banyak eksperimen telah menunjukkan bahawa perubahan dalam suhu beku larutan boleh dianggap sebagai peraturan am.
Proses pembekuan dan pendidihan dikaji secara terperinci oleh Raoult dan dibentangkan dalam bentuk undang-undang, yang kemudiannya dipanggil undang-undang kedua Raoult.
Mari kita pertimbangkan terbitan paling mudah bagi undang-undang ini. Rajah 2 menunjukkan rajah yang menyatakan pergantungan tekanan wap tepu pada suhu di atas pelarut tulen dan di atas larutan.
Lengkung 0A ialah pergantungan tekanan wap tepu air tulen pada suhu.
Lengkung BC, DE – pergantungan tekanan wap tepu air ke atas larutan dengan kepekatan berbeza bahan terlarut
0D – menyatakan pergantungan suhu tekanan wap tepu air ke atas ais.
Daripada Rajah 2 adalah jelas bahawa tekanan wap di atas larutan pada 273 K adalah lebih rendah daripada di atas air, tetapi ia tidak sama dengan tekanan wap di atas ais pada suhu yang sama. Hanya pada suhu di bawah 273 K (T'z) tekanan wap di atas larutan berkurangan sehingga ia menjadi sama dengan tekanan wap di atas ais. Ini sepadan dengan titik B. Pada kepekatan larutan yang lebih tinggi, lengkung yang menyatakan pergantungan tekanan wap air di atas larutan pada suhu terletak di bawah lengkung BC, tetapi selari dengannya.
Mari kita perkenalkan tatatanda seterusnya:
Р 0 А – tekanan wap di atas pelarut tulen pada 273 K
P A – tekanan wap di atas larutan pada suhu beku T’z
daripada segi tiga tepat Kami menentukan FOC
Daripada Rajah 2 adalah jelas bahawa , di manakah penurunan suhu beku larutan.
Menggantikan nilai-nilai ini ke dalam persamaan di atas, kita dapat

 (3)
(3)
Daripada undang-undang pertama Raoult untuk penyelesaian yang sangat cair yang kami ada
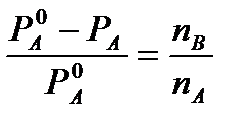
 Dan
Dan  (4)
(4)
di mana n A, n B, m A mengekalkan sebutan yang ditetapkan sebelum ini (lihat di atas). Jika kita menyatakan jisim molar pelarut dengan M 0 A, maka

Menggantikan ungkapan ini ke dalam persamaan (4) kita perolehi

Darab dan bahagi sebelah kanan ungkapan ini dengan 1000, kemudian
 (5)
(5)
Mari kita gabungkan semua kuantiti tetap dalam persamaan (5) menjadi satu pemalar K (  ), kita mendapat ungkapan berikut
), kita mendapat ungkapan berikut
 (6)
(6)
Ungkapan  mewakili molaliti larutan St.
mewakili molaliti larutan St.
Menggantikan ungkapan ini ke dalam persamaan (6), kita memperoleh persamaan akhir.
 (7)
(7)
Ini adalah ungkapan matematik hukum kedua Raoult: penurunan takat beku atau peningkatan takat didih larutan adalah berkadar terus dengan kepekatan molalnya.
Pekali K dalam persamaan (7) dipanggil pemalar krioskop, menunjukkan penurunan molar dalam suhu beku larutan, adalah ciri individu pelarut (K H2O = 1.86º) dan mempunyai dimensi yang sama dengan E (Kº kg mol -1)
Kaedah penyelidikan berdasarkan mengukur penurunan takat beku larutan dipanggil cryoscopic. Ia, seperti yang ebullioscopic, membolehkan anda mengira jisim molar bahan terlarut

Rajah 3 menunjukkan peranti yang direka untuk mengukur takat beku larutan.
 |
OSMOSIS DAN TEKANAN OSMOTIK.
Sifat biologi yang penting bagi larutan ialah osmosis.
Secara semula jadi, larutan sering dipisahkan daripada pelarut oleh membran yang telap hanya kepada zarah pelarut. Dalam kes ini, zat terlarut tidak boleh meresap ke dalam pelarut, dan hanya peralihan pelarut ke dalam larutan akan diperhatikan, i.e. pelarut akan bergerak dalam kedua-dua arah, tetapi masih lebih sedikit daripadanya akan masuk ke dalam larutan daripada masuk arah terbalik.
Mekanisme osmosis mudah dibayangkan berdasarkan penyulingan isoterma. Biarkan membran separa telap yang mempunyai mikropori memisahkan pelarut dan larutan dengan kepekatan C dalam (Rajah 4)

Dalam liang yang dihadkan pada satu sisi oleh pelarut dan di sisi lain oleh larutan, penyejatan berlaku. Disebabkan oleh peningkatan keanjalan wap tepu mengikut hukum Raoult, tekanan wap dari fasa wap tertumpu dari bahagian pelarut, melalui larutan.
Akibat osmosis, isipadu larutan meningkat dan kepekatannya berkurangan secara beransur-ansur; pelarut yang menembusi ke dalam larutan melalui membran meningkatkan lajur cecair h dan, oleh itu, meningkatkan tekanan hidrostatik (lihat Rajah 5). Pada masa yang sama, bilangan molekul pelarut yang bergerak melalui membran dalam arah yang bertentangan akan meningkat, i.e. daripada larutan kepada pelarut. Secara beransur-ansur, tekanan hidrostatik dan pencairan larutan akan mencapai nilai di mana bilangan molekul pelarut yang bergerak dalam kedua-dua arah akan menyamai dan keseimbangan osmotik akan berlaku. Tekanan hidrostatik berlebihan yang terbentuk akibat osmosis, diukur dengan lajur larutan ketinggian h, di mana keseimbangan osmotik ditubuhkan, dipanggil tekanan osmotik.
![]() nasi. 5
nasi. 5
Membran yang diperbuat daripada collodion, selofan, kuprum besi-sinoksida, dll. adalah separa telap kepada banyak larutan.
UNDANG-UNDANG TEKANAN OSMOTIK.
Kajian undang-undang tekanan osmotik mendedahkan analogi lengkap mereka dengan undang-undang gas. Untuk larutan cair nonelektrolit, ia boleh dirumuskan seperti berikut:
pada suhu malar, tekanan osmosis adalah berkadar terus dengan kepekatan molar zat terlarut (analogi dengan hukum Boyle-Mariotte):

pada kepekatan molar malar, tekanan osmotik adalah berkadar terus dengan suhu mutlak (analogi dengan hukum Gay-Lussac):

Daripada dua undang-undang ini ia mengikuti bahawa pada kepekatan dan suhu molar yang sama, larutan nonelektrolit yang berbeza menghasilkan tekanan osmotik yang sama, i.e. larutan equimolar bagi nonelektrolit adalah isotonik (analogi dengan hukum Avogadro).
Van't Hoff mencadangkan undang-undang bersatu untuk tekanan osmotik dalam larutan (serupa dengan undang-undang gas bersatu Mendeleev-Claiperon): Tekanan osmotik larutan cair bukan elektrolit adalah berkadar terus dengan kepekatan molar, pekali perkadaran dan suhu mutlak:
kerana c=n/V, dengan n ialah bilangan mol bukan elektrolit, dan V ialah isipadu larutan, maka  atau
atau ![]()
Larutan cair bukan elektrolit.
Sifat koligatif larutan
Tekanan wap tepu
Keseimbangan "wap cecair individu" diterangkan oleh pemalar keseimbangan
K p =p tentang kita. pasangan /a o f (1)
Oleh itu, oleh kerana aktiviti cecair individu a o x = 1, tekanan wap tepu adalah sama dengan
pasangan p o = K p (2)
dan hanya bergantung pada suhu.
Oleh kerana aktiviti pelarut adalah sama dengan hasil darab a o x pecahan molarnya N 1 atau (1 - N 2), di mana N 2 ialah pecahan molar bahan terlarut, pemalar keseimbangan adalah sama dengan:
K p =p 1 o =(p 1 /a o x N 1)=(p 1 /1-N 2) (3)
Dari sini kita dapat undang-undang Raoult (1886):
p 1 = p 1 o (1-N 2) = p 1 o N 1 (4)
(p 1 o -p 1)/p 1 o)=N 2 (5)
Tekanan wap tepu larutan adalah sama dengan tekanannya di atas pelarut tulen didarab dengan pecahan mol pelarut.
Penurunan relatif dalam tekanan wap tepu pelarut ke atas larutan tulen adalah sama dengan pecahan mol zat terlarut.
Oleh itu, tekanan wap sudah bergantung kepada kandungan zat terlarut. Hukum Raoult boleh digunakan untuk menentukan jisim molar suatu zat terlarut:
Dp/p 1 ° =N 2 =n 2 /n 1 +n 2 ≈m 2 M 1 /m 1 M 2 (6)
Takat didih larutan
Cecair mendidih apabila tekanan wap tepu menjadi sama dengan tekanan luar. Oleh kerana, mengikut undang-undang Raoult, tekanan wap di atas larutan adalah kurang daripada tekanan wap di atas pelarut tulen, takat didih larutan adalah lebih tinggi daripada takat didih pelarut tulen.
Eksperimen telah menunjukkan bahawa untuk larutan cair bukan elektrolit:
di mana DT ialah pertambahan takat didih larutan berbanding dengan pelarut tulen, b ialah molaliti ([E] = K. Kg/mol) E ialah pemalar ebulioskopik (dari ebbulio (lat.) - mendidih), bergantung sahaja pada sifat pelarut (suhu didih T o dan haba tentu penyejatan L 1):
E=RT o 2 /1000L 1 (8)
Takat didih pelarut tulen mempunyai nilai tertentu pada tekanan luar tetap. Takat didih larutan tidak tetap - ia meningkat apabila ia mendidih, kerana disebabkan oleh penyejatan pelarut, kepekatan larutan meningkat. Pada masa yang sama, tekanan wap tepu berkurangan sepanjang masa. Oleh itu, takat didih larutan dianggap sebagai suhu yang sepadan dengan penampilan gelembung wap pertama di dalamnya.
Takat beku larutan
Di atas larutan, tekanan wap pelarut adalah lebih rendah daripada tekanan wap di atas pelarut tulen. Tekanan wap di atas fasa pepejal dan cecair juga akan menjadi kurang. Ini hanya boleh berlaku pada takat beku larutan yang lebih rendah berbanding dengan pelarut tulen. Penurunan takat beku larutan bukan elektrolit berbanding dengan takat beku pelarut tulen adalah berkadar dengan kemolaran larutan:
di mana K ialah pemalar krioskop (dari bahasa Yunani "krios" - sejuk), bergantung hanya pada sifat pelarut:
K=RT o 2 /1000L 1, (10)
di mana T o, L * 1 ialah takat beku dan haba tentu pelakuran pelarut tulen.
Oleh kerana kepekatan bahan terlarut meningkat dengan pemejalan pelarut, takat beku larutan tidak tetap dan berkurangan semasa proses. Oleh itu, suhu pembentukan kristal pertama diambil sebagai suhu beku larutan.
Jadual 2 menunjukkan nilai E dan K bagi sesetengah pelarut.
Jadual 2.
Hablur pelarut akan berada dalam keseimbangan dengan larutan hanya apabila tekanan wap tepu di atas kristal dan di atas larutan adalah sama. Oleh kerana tekanan wap pelarut di atas larutan sentiasa lebih rendah daripada tekanan di atas pelarut tulen, suhu yang sepadan dengan keadaan ini akan sentiasa lebih rendah daripada takat beku pelarut tulen. Dalam kes ini, penurunan suhu beku larutan ΔT tidak bergantung pada sifat bahan terlarut dan hanya ditentukan oleh nisbah bilangan zarah pelarut dan bahan terlarut.
Ia boleh ditunjukkan bahawa penurunan suhu beku larutan ΔT adalah berkadar terus dengan kepekatan molal larutan:
Undang-undang kedua Raoult: Peningkatan takat didih dan penurunan dalam larutan Tzam adalah berkadar dengan bilangan zarah bahan terlarut dan tidak bergantung kepada sifatnya.
Tamat kerja -
Topik ini tergolong dalam bahagian:
Kuliah Bil 5. Keseimbangan fasa. Larutan bukan elektrolit
Keadaan gas suatu bahan dicirikan oleh interaksi yang lemah antara zarah dan jarak yang besar di antara mereka Oleh itu, gas bercampur... Jumlah tekanan campuran gas adalah sama dengan jumlah tekanan separa semua komponen...
Jika anda perlukan bahan tambahan mengenai topik ini, atau anda tidak menemui apa yang anda cari, kami mengesyorkan menggunakan carian dalam pangkalan data kerja kami:
Apa yang akan kami lakukan dengan bahan yang diterima:
Jika bahan ini berguna kepada anda, anda boleh menyimpannya ke halaman anda di rangkaian sosial:
| Tweet |
Semua topik dalam bahagian ini:
Kuliah Bil 5. Keseimbangan fasa. Larutan bukan elektrolit.
Keseimbangan fasa.
Dalam kuliah terakhir kita melihat keseimbangan kimia, pemalar keseimbangan, hubungannya dengan sebagainya. kuantiti dan faktor yang mempengaruhi anjakan keseimbangan.
Sistem dua komponen.
Penyelesaian ialah sistem homogen yang terdiri daripada dua atau lebih komponen, komposisi yang boleh terus berubah dalam had tertentu tanpa perubahan mendadak dalam sifatnya.
Pembentukan larutan adalah proses fizikal dan kimia yang kompleks. Proses pembubaran sentiasa disertai dengan peningkatan dalam entropi sistem; Apabila penyelesaian terbentuk, selalunya terdapat pelepasan sama ada
Keterlarutan
Proses pelarutan dikaitkan dengan resapan, iaitu, dengan pengagihan spontan zarah satu bahan antara zarah yang lain. Apabila zat terlarut ditambah kepada pelarut, proses pembubaran
Keterlarutan gas dalam cecair
Keterlarutan gas dalam cecair bergantung kepada beberapa faktor: sifat gas dan cecair, tekanan, suhu, kepekatan bahan terlarut dalam cecair (terutama keterlarutan gas).
Larutan bukan elektrolit.
Sifat penyelesaian dipertimbangkan menggunakan contoh larutan cair, dalam pembentukan kesan haba dan isipadu adalah sama dengan 0 (penyelesaian ideal). Dalam penyelesaian sedemikian, zarah terletak pada besar
Penurunan relatif dalam tekanan wap tepu di atas larutan adalah sama dengan pecahan mol zat terlarut.
Mana-mana cecair mula mendidih pada suhu di mana tekanan wap tepunya mencapai tekanan luar. T mendidih - T di mana tekanan wap = 101.3 kPa Air mendidih pada 100 C,
Tekanan osmotik
Jika dua larutan dengan kepekatan yang berbeza dipisahkan oleh partition separa telap yang membenarkan molekul pelarut melalui tetapi menghalang laluan zarah terlarut, saya akan memerhatikan
