Уусмалын хөлдөх цэг. Уусмал нь цэвэр уусгагчаас бага температурт хөлддөг.
Электролит бус шингэрүүлсэн уусмал.
Уусмалын коллигатив шинж чанар
Уурын ханасан даралт
"Бие даасан шингэн-уур" тэнцвэрийг тэнцвэрийн тогтмолоор тодорхойлно
K p =p бидний тухай. хос /a o f (1)
Тиймээс бие даасан шингэний идэвхжил a o x = 1 тул ханасан уурын даралт нь тэнцүү байна
p o хос = K p (2)
ба зөвхөн температураас хамаарна.
Уусгагчийн идэвхжил нь a o x түүний молийн фракц N 1 эсвэл (1 - N 2) бүтээгдэхүүнтэй тэнцүү тул N 2 нь ууссан бодисын молийн фракц юм, тэнцвэрийн тогтмол нь:
K p =p 1 o =(p 1 /a o x N 1)=(p 1 /1-N 2) (3)
Эндээс бид авдаг Раулийн хууль (1886):
p 1 = p 1 o (1-N 2) = p 1 o N 1 (4)
(p 1 o -p 1)/p 1 o)=N 2 (5)
Уусмалын ханасан уурын даралт нь түүний цэвэр уусгагч дээрх даралттай тэнцүү байна.
Цэвэр уусмал дээрх уусгагчийн ханасан уурын даралтын харьцангуй бууралт нь ууссан бодисын моль фракцтай тэнцүү байна.
Тиймээс уурын даралт нь ууссан бодисын агууламжаас аль хэдийн хамаардаг. Ууссан бодисын молийн массыг тодорхойлохын тулд Раульын хуулийг ашиглаж болно.
Dp/p 1 ° =N 2 =n 2 /n 1 +n 2 ≈m 2 M 1 /m 1 M 2 (6)
Уусмалын буцалгах цэг
Ханасан уурын даралт нь гадаад даралттай тэнцэх үед шингэн буцалгана. Раулийн хуулийн дагуу уусмал дээрх уурын даралт нь цэвэр уусгагч дээрх уурын даралтаас бага байдаг тул уусмалын буцалгах цэг нь цэвэр уусгагчийн буцлах температураас өндөр байна.
Туршилтаар электролит бус шингэрүүлсэн уусмалын хувьд:
Энд DT нь цэвэр уусгагчтай харьцуулахад уусмалын буцалгах температурын өсөлт, b нь моль чанар ([E] = К. Кг/моль) E нь эбуллиоскопийн тогтмол (ebbulio (лат.) - буцалгах), зөвхөн хамаарна. уусгагчийн шинж чанар (түүний буцлах температур T o ба ууршилтын хувийн дулаан L 1):
E=RT o 2 /1000L 1 (8)
Цэвэр уусгагчийн буцлах цэг нь тогтмол гадаад даралттай үед тодорхой утгатай байдаг. Уусмалын буцалгах цэг тогтмол биш - буцалгах тусам нэмэгддэг, учир нь уусгагчийн ууршилтаас болж уусмалын концентраци нэмэгддэг. Үүний зэрэгцээ ханасан уурын даралт байнга буурдаг. Тиймээс уусмалын буцалгах цэг нь түүний доторх анхны уурын бөмбөлгийн харагдах байдалд тохирсон температур гэж тооцогддог.
Уусмалын хөлдөх цэг
Уусмалын дээр уусгагчийн уурын даралт нь цэвэр уусгагч дээрх уурын даралтаас бага байна. Хатуу ба шингэн фазын дээрх уурын даралт нь мөн бага байх болно. Энэ нь цэвэр уусгагчтай харьцуулахад уусмалын бага хөлдөх цэгт л тохиолдож болно. Цэвэр уусгагчийн хөлдөх температуртай харьцуулахад электролит бус уусмалын хөлдөх цэгийн бууралт нь уусмалын мольтай пропорциональ байна.
Энд K нь зөвхөн уусгагчийн шинж чанараас хамааран криоскопийн тогтмол (Грек "криос" - хүйтэн) юм.
K=RT o 2 /1000L 1, (10)
Энд T o, L * 1 нь цэвэр уусгагчийн хөлдөх цэг ба хайлуулах тусгай дулаан юм.
Уусгагч хатуурах тусам ууссан бодисын концентраци нэмэгддэг тул уусмалын хөлдөх температур тогтмол биш бөгөөд процессын явцад буурдаг. Тиймээс анхны талст үүсэх температурыг уусмалын хөлдөх температур гэж авна.
Хүснэгт 2-т зарим уусгагчийн хувьд E ба K-ийн утгыг харуулав.
Хүснэгт 2.
Уусмалын хөлдөх цэг.
| Параметрийн нэр | Утга |
| Нийтлэлийн сэдэв: | Уусмалын хөлдөх цэг. |
| Рубрик (сэдэвчилсэн ангилал) | Боловсрол |
Уусмалын буцалгах цэг.
Уусмал дээрх ханасан уурын даралтын харьцангуй бууралт нь ууссан бодисын моль фракцтай тэнцүү байна.
Электролитийн бус уусмалууд.
Уусмалын шинж чанарыг шингэрүүлсэн уусмалын жишээн дээр авч үзсэн бөгөөд үүсэх үед дулааны болон эзэлхүүний нөлөө нь 0 (хамгийн тохиромжтой шийдэл) байна. Ийм шийдэлд бөөмс нь бие биенээсээ хол зайд байрладаг бөгөөд харилцан нөлөөллийн хүчийг үл тоомсорлож болно.
Уурын даралтын бууралт нь уусгагчийн гадаргуугаас ялгаатай нь уусмалын гадаргуу нь дэгдэмхий бус уусмалын хэсгүүдээр хэсэгчлэн эзэлдэгтэй холбоотой юм. Энэ нь нэгж хугацаанд уурших уусгагч молекулуудын тоо буурахад хүргэдэг; хийнээс уусмал руу шилжих уусгагчийн молекулуудын тоо өөрчлөгдөөгүй хэвээр байна. Энэ тохиолдолд шийдлийн харилцан үйлчлэлийн хүч гол үүрэг гүйцэтгэдэг. Οʜᴎ нь уусгагчийн молекулуудын наалдацын хүчнээс хамаагүй хүчтэй бөгөөд энэ нь шилжилтийг тайлбарладаг. бага тооуусгагч молекулуудыг хийн фаз руу .
Хоёр бүрэлдэхүүн хэсэгтэй хамгийн тохиромжтой шийдлийг авч үзье.
ref.rf дээр нийтлэгдсэн
Уусгагч ба ууссан бодисын ханасан уурын даралтыг тус тус: P 0 1 ба P 0 2 гэж үзье. Молийн бутархай: X1 ба X2. Хэрэв уусдаг бодис дэгдэмхий биш бол P 0 2 = 0 байна. Дараа нь уурын нийт даралт нь уусгагчийн хэсэгчилсэн уурын даралттай тэнцүү байна: P = P1 = P 0 1 * X1. Уусмалын ханасан уурын нийт даралтыг зөвхөн дэгдэмхий бүрэлдэхүүн хэсгийн уурын хэсэгчилсэн даралтаар тодорхойлно.
өөрөөр хэлбэл уусмал дээрх уусгагчийн ханасан уурын даралт нь түүний цэвэр уусгагч дээрх даралт ба уусгагчийн моль фракцийн үржвэртэй тэнцүү байна (Раултын нэгдүгээр хууль, 1887).
(2.55) тэгшитгэлийг арай өөр хэлбэрээр өгч болно. x I = 1 – x 2 (энд x 2 нь ууссан бодисын моль фракц) тул
p 1 = p 0 1 (1-x 2)= p 0 1 – p 0 1 x 2 эсвэл p 0 1 – p 1 = p 0 1 x 2
р 0 1 –р 1 / р 0 1 = x 2
Аливаа шингэн нь ханасан уурын даралт нь гадаад даралтад хүрэх температурт буцалж эхэлдэг. T буцалгана - Т уурын даралт = 101.3 кПа Ус 100 С-т буцалгана, учир нь фазын диаграммын энэ цэг дэх даралт 1 атм байна. Раулийн хуулийн дагуу хэрэв та уусмалд дэгдэмхий бус бүрэлдэхүүн хэсгийг оруулбал уурын даралт буурна. Одоо та даралтыг 1 атм болгохын тулд уусмалыг 100 секундээс дээш халаах хэрэгтэй.
Tzam – T, усны уурын даралт = мөсний уурын даралт = 613 Па.
DT=Tr-r-Tr-l=Ec m, c m нь ууссан бодисын моль чанар, E нь ууссан бодисын эбуллиоскопийн тогтмол байдал.
Диаграмм өг.
Уусгагчийн талстууд нь талстууд ба уусмал дээрх ханасан уурын даралт ижил байх үед л уусмалтай тэнцвэртэй байх болно. Уусмал дээрх уусгагчийн уурын даралт нь цэвэр уусгагчийнхаас үргэлж бага байдаг тул энэ нөхцөлд тохирох температур нь цэвэр уусгагчийн хөлдөх цэгээс үргэлж бага байх болно. Энэ тохиолдолд уусмалын хөлдөх температурын бууралт ΔT нь ууссан бодисын шинж чанараас хамаарахгүй бөгөөд зөвхөн уусгагч ба ууссан бодисын тоосонцорын харьцаагаар тодорхойлогддог.
ΔT уусмалын хөлдөх температурын бууралт нь уусмалын молийн концентрацтай шууд пропорциональ байгааг харуулж болно.
Раулийн хоёр дахь хууль: Tboil-ийн өсөлт ба Tzam уусмалын бууралт нь ууссан бодисын бөөмийн тоотой пропорциональ бөгөөд түүний шинж чанараас хамаардаггүй.
Уусмалын хөлдөх цэг. - үзэл баримтлал ба төрөл. "Уусмалын хөлдөх цэг" ангиллын ангилал ба онцлог. 2014, 2015 он.
Хөлдөлт нь шингэн нь хатуу болж хувирдаг үе шат юм. Шингэний хөлдөх цэг нь шингэн дээрх ханасан уурын даралт нь түүнээс унасан хатуу фазын талстуудын дээрх ханасан уурын даралттай тэнцүү байх температур юм.
Энэ температур болон түүнд тохирсон ханасан уурын даралтад талсжих хурд нь хайлах хурдтай тэнцүү бөгөөд эдгээр хоёр үе шат нь удаан хугацаанд зэрэгцэн орших боломжтой.
Мөн M.V. Ломоносов шингэрүүлсэн уусмал нь түүнээс бага температурт хөлддөг болохыг анзаарсан цэвэр уусгагч. Тиймээс далайн ус 273 К-т биш, харин бага зэрэг бага температурт хөлддөг. Уусмалын хөлдөх температурын ийм өөрчлөлтийг ерөнхий дүрэм гэж үзэж болохыг олон тооны туршилтууд харуулсан.
Хөлдөх, буцалгах үйл явцыг Раульт нарийвчлан судалж, хууль хэлбэрээр танилцуулсан бөгөөд үүнийг хожим Раультын хоёр дахь хууль гэж нэрлэсэн.
Энэ хуулийн хамгийн энгийн гарал үүслийг авч үзье. 2-р зурагт ханасан уурын даралт нь цэвэр уусгагч ба уусмалаас дээш температураас хамаарах хамаарлыг харуулсан диаграммыг үзүүлэв.
0А муруй нь цэвэр усны ханасан уурын даралтын температураас хамаарах хамаарал юм.
Муруй BC, DE – ууссан бодисын өөр өөр концентрацитай уусмалаас усны ханасан уурын даралтын хамаарал.
0D - мөсөн дээрх усны ханасан уурын даралтын температурын хамаарлыг илэрхийлдэг.
2-р зурагнаас харахад 273 К-ийн уусмал дээрх уурын даралт нь уснаас бага байх боловч ижил температурт мөсөн дээрх уурын даралттай тэнцүү биш байна. Зөвхөн 273 К (T'z) -ээс доош температурт уусмал дээрх уурын даралт маш их буурч, мөсөн дээрх уурын даралттай тэнцүү болно. Энэ нь В цэгтэй тохирч байна. Уусмалын өндөр концентрацитай үед уусмал дээрх усны уурын даралтын температураас хамаарах хамаарлыг илэрхийлсэн муруйнууд нь ВС муруйны доор байрлах боловч түүнтэй параллель байна.
Ингээд танилцуулъя дараагийн тэмдэглэгээ:
Р 0 А – 273 К-ийн цэвэр уусгагчаас дээш уурын даралт
P A – T’z хөлдөх температурт уусмал дээрх уурын даралт
WOK гурвалжин гурвалжингаас бид тодорхойлно
2-р зурагт уусмалын хөлдөх температурын бууралт хаана байгаа нь тодорхой байна.
Эдгээр утгыг дээрх тэгшитгэлд орлуулснаар бид олж авна

 (3)
(3)
Өндөр шингэрүүлсэн уусмалын тухай Раультын анхны хуулиас бид
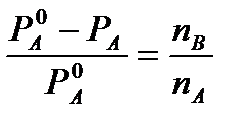
 Тэгээд
Тэгээд  (4)
(4)
Энд n A, n B, m A нь өмнө нь өгсөн тэмдэглэгээг хадгална (дээрхийг харна уу). Хэрэв уусгагчийн молийн массыг М 0 А гэж тэмдэглэвэл

Энэ илэрхийлэлийг (4) тэгшитгэлд орлуулснаар бид олж авна

Энэ илэрхийллийн баруун талыг 1000-аар үржүүлж хуваа
 (5)
(5)
(5) тэгшитгэлийн бүх тогтмол хэмжигдэхүүнүүдийг нэг тогтмол K () болгон нэгтгэцгээе.  ), бид дараах илэрхийллийг авна
), бид дараах илэрхийллийг авна
 (6)
(6)
Илэрхийлэл  уусмалын молярийг илэрхийлдэг St.
уусмалын молярийг илэрхийлдэг St.
Энэ илэрхийлэлийг (6) тэгшитгэлд орлуулснаар бид эцсийн тэгшитгэлийг олж авна.
 (7)
(7)
Энэ бол Раультын хоёр дахь хуулийн математик илэрхийлэл юм: уусмалын хөлдөх температур буурах эсвэл буцлах температур нэмэгдэх нь түүний молийн концентрацтай шууд пропорциональ байна.
(7) тэгшитгэлийн K коэффициентийг криоскопийн тогтмол гэж нэрлэдэг бөгөөд энэ нь уусмалын хөлдөх температурын молийн бууралтыг харуулдаг. хувь хүний онцлогуусгагч (K H2O = 1.86º) ба E (Kº кг моль -1) хэмжээтэй ижил хэмжээтэй байна.
Уусмалын хөлдөх температурын бууралтыг хэмжихэд үндэслэсэн судалгааны аргыг криоскоп гэж нэрлэдэг. Энэ нь эбуллиоскопийн нэгэн адил ууссан бодисын молийн массыг тооцоолох боломжийг танд олгоно

Уусмалын хөлдөх цэгийг хэмжих зориулалттай төхөөрөмжийг 3-р зурагт үзүүлэв.
 |
ОСМОС БА ОСМОТ ДАРАЛТ.
Уусмалын биологийн чухал шинж чанар бол осмос юм.
Байгалийн хувьд уусмалыг уусгагчаас зөвхөн уусгагч хэсгүүдийг нэвчих чадвартай мембранаар тусгаарладаг. Энэ тохиолдолд уусгагч нь уусгагч руу тархах боломжгүй бөгөөд зөвхөн уусгагч уусмал руу шилжих нь ажиглагдах болно, жишээлбэл. уусгагч нь хоёр чиглэлд шилжих боловч уусгагчаас бага зэрэг илүү нь уусмал руу орох болно урвуу чиглэл.
Осмосын механизмыг изотермийн нэрэлт дээр үндэслэн төсөөлөхөд хялбар байдаг. Микро нүх сүвтэй хагас нэвчилттэй мембранаар уусгагч болон С концентрацитай уусмалыг тусгаарлана (Зураг 4).

Нэг талдаа уусгагчаар, нөгөө талаас уусмалаар хязгаарлагдсан нүхэнд ууршилт үүсдэг. Раультын хуулийн дагуу ханасан уурын уян хатан чанар нэмэгдсэнтэй холбоотойгоор уурын фазын уурын даралт нь уусгагч талаас төвлөрч, уусмал руу шилждэг.
Осмосын үр дүнд уусмалын хэмжээ нэмэгдэж, түүний концентраци аажмаар буурдаг; мембранаар дамжин уусмал руу нэвчиж байгаа уусгагч нь шингэний баганыг нэмэгдүүлж, улмаар гидростатик даралтыг нэмэгдүүлдэг (5-р зургийг үз). Үүний зэрэгцээ эсрэг чиглэлд мембранаар дамжих уусгагч молекулуудын тоо нэмэгдэх болно, өөрөөр хэлбэл. уусмалаас уусгагч хүртэл. Аажмаар уусмалын гидростатик даралт ба шингэрүүлэлт нь хоёр чиглэлд хөдөлж буй уусгагч молекулуудын тоо тэнцүү болж, осмосын тэнцвэрт байдалд хүрэх болно. Осмосын үр дүнд үүссэн илүүдэл гидростатик даралтыг h өндөртэй уусмалын баганагаар хэмжиж, осмосын тэнцвэрт байдал тогтсоныг осмосын даралт гэнэ.
![]() будаа. 5
будаа. 5
Коллодион, гилгэр хальсан, төмрийн синоксид зэс гэх мэтээр хийсэн мембран нь олон уусмалд хагас нэвчдэг.
ОСМОТ ДАРАЛТЫН ХУУЛЬ.
Осмосын даралтын хуулиудыг судлах нь тэдгээрийн хийн хуулиудтай бүрэн аналогийг илчилсэн. Электролит бус шингэрүүлсэн уусмалуудын хувьд тэдгээрийг дараах байдлаар томъёолж болно.
Тогтмол температурт осмосын даралт нь ууссан бодисын молийн концентрацитай шууд пропорциональ байна (Бойл-Мариотт хуультай ижил төстэй):

Тогтмол молийн концентрацитай үед осмосын даралт нь үнэмлэхүй температуртай шууд пропорциональ байна (Гэй-Люссакийн хуультай адил):

Эдгээр хоёр хуулиас харахад ижил молийн концентраци ба температурт өөр өөр электролитийн уусмалууд ижил осмосын даралтыг үүсгэдэг, өөрөөр хэлбэл. Электролитгүй бодисын эквимоляр уусмал нь изотоник шинж чанартай байдаг (Авогадрогийн хуультай ижил төстэй).
Вант Хофф уусмал дахь осмосын даралтын нэгдсэн хуулийг санал болгосон (Менделеев-Клайпероны хийн нэгдсэн хуультай адил): Электролит бус шингэрүүлсэн уусмалын осмосын даралт нь молийн концентраци, пропорциональ коэффициент ба үнэмлэхүй температуртай шууд пропорциональ байна:
c=n/V учир, энд n нь электролит бус молийн тоо, V нь уусмалын эзэлхүүн юм.  эсвэл
эсвэл ![]()
Хуудас 1
Шингэрүүлсэн уусмалын хөлдөх цэгийн бууралт нь ууссан бодисын концентрацтай пропорциональ байна. Уусмалын буцалгах цэгийн өсөлтийн концентрациас хамаарах хамаарлыг гаргахад гүйцэтгэсэн бүх үндэслэл, математик үйлдлүүдийг давтах замаар энэхүү дүгнэлтийг гаргаж болно.
Тиймээс шингэрүүлсэн уусмалын хөлдөх температур буурах, буцлах температур нэмэгдэх нь ууссан бодисын концентрацтай пропорциональ байна. Энэ мэдэгдлийг мөн анх Раульт хэлсэн бөгөөд үүнийг Раультын хоёр дахь хууль гэж нэрлэдэг.
Шингэрүүлсэн уусмалын хөлдөх температур буурах нь ууссан бодисын концентрацтай пропорциональ байгааг туршилтаар тогтоосон. 1883 онд Францын химич F. M. Raoult маш сонирхолтой нээлт хийсэн: ижил молийн хэмжээгээр авсан өөр өөр ууссан бодисын хөлдөх температурын бууралт нь тухайн уусгагчийн хувьд ижил байна.
Шингэрүүлсэн уусмалын хөлдөх температур буурах нь ууссан бодисын концентрацтай пропорциональ байгааг туршилтаар тогтоосон. 1883 онд Францын химич F. M. Raoult маш сонирхолтой нээлт хийсэн: ижил молийн хэмжээгээр авсан өөр өөр ууссан бодисуудын хөлдөх температурын бууралт нь тухайн уусгагчийн хувьд адилхан болж хувирав.
Криоскопийн хэмжилт нь цэвэр уусгагчтай харьцуулахад шингэрүүлсэн уусмалын (AG3) хөлдөх цэгийн бууралтыг тодорхойлоход суурилдаг.
Хүчтэй электролитийн үйл ажиллагааны дундаж коэффициентийг шингэрүүлсэн электролитийн уусмалын хөлдөх цэгийн бууралтаар тооцоолно.
K3-ийн утга нь зөвхөн уусгагчийн шинж чанараас хамаардаг тул шингэрүүлсэн уусмалын хөлдөх цэгийн бууралтыг ууссан бодисын шинж чанараар бус зөвхөн концентрацаар тодорхойлно.
Тамман [4, Каррара, Орндорф, Уайт 16], Мендель нар устөрөгчийн хэт ислийн (5-аас бага жин агуулсан) шингэрүүлсэн уусмалын хөлдөх цэгийг бууруулахын тулд хэд хэдэн хэмжилт хийжээ.
K3-ийн утга нь зөвхөн уусгагчийн шинж чанараас хамаарна. Тиймээс тухайн уусгагч дахь шингэрүүлсэн уусмалын хөлдөх температурын бууралтыг зөвхөн ууссан бодисын концентрацаар тодорхойлно.
/(3-ын утга нь зөвхөн уусгагчийн шинж чанараас хамаарна. Иймээс тухайн уусгагч дахь шингэрүүлсэн уусмалын хөлдөх температур буурах нь зөвхөн ууссан бодисын концентрациар тодорхойлогддог.
Уусмал нь бага температурт хөлдөж, өндөр температурт буцалгадаг нь туршлагаас мэдэгдэж байна. өндөр температурцэвэр уусгагчийн хөлдөх болон буцлах цэгээс илүү. Шингэрүүлсэн уусмалын хөлдөх температур буурах, буцлах температур нэмэгдэх нь зөвхөн уусмалын концентрацаас хамаардаг боловч ууссан бодисын шинж чанараас хамаардаггүй болохыг хэмжилтүүд харуулсан.
Практикт тоо-дундаж молекулын жинг дээжийн жинг доторх молекулын тоонд хуваах замаар тооцдог. Тоо-дундаж молекул жинг осмосын даралтыг тодорхойлох, шингэрүүлсэн полимер уусмалын буцалгах цэгийг нэмэгдүүлэх, хөлдөх температурыг бууруулах, түүнчлэн эцсийн бүлгийн тоог тодорхойлох замаар олно.
Уусмал нь бага температурт хөлдөж, цэвэр уусгагчаас өндөр температурт буцалгана. Эдгээр хуулиуд нь зөвхөн дэгдэмхий бус бодисын уусмалд хамаарна. Шингэрүүлсэн уусмалын хөлдөх температур буурах, түүнчлэн буцалгах температур нэмэгдэх нь зөвхөн уусмалын концентрацаас хамаардаг боловч ууссан бодисын шинж чанараас хамаардаггүй нь тогтоогдсон.
Хөлдөлтийн тогтмол (криоскопийн тогтмол) Кзан буюу хөлдөх цэгийн молийн бууралт нь тухайн уусгагчийн утгын шинж чанар бөгөөд ууссан бодисын шинж чанараас үл хамаарна. Физик утгаДээрх тэгшитгэлээс тодорхой байна: Хам нь 1000 г уусгагч дахь 1 моль бодис агуулсан уусмалын хөлдөх температурын бууралт бөгөөд энэ концентрацийн уусмал нь хамгийн тохиромжтой шинж чанартай, ууссан бодис нь тохирох шинж чанартай байх тохиолдолд. салахгүй, холбоогүй. Туршилтаар тодорхойлохын тулд / (шингэрүүлсэн уусмалын хөлдөх температурын бууралтыг хэмжиж, дараа нь эдгээр өгөгдлийг 1 моль хүртэл дахин тооцоолох хэрэгтэй.
Уусгагчийн талстууд нь талстууд ба уусмал дээрх ханасан уурын даралт ижил байх үед л уусмалтай тэнцвэртэй байх болно. Уусмалын дээрх уусгагчийн уурын даралт нь цэвэр уусгагчийнхаас үргэлж бага байдаг тул энэ нөхцөлд тохирох температур нь цэвэр уусгагчийн хөлдөх цэгээс үргэлж бага байх болно. Энэ тохиолдолд уусмалын хөлдөх температурын бууралт ΔT нь ууссан бодисын шинж чанараас хамаарахгүй бөгөөд зөвхөн уусгагч ба ууссан бодисын тоосонцорын харьцаагаар тодорхойлогддог.
ΔT уусмалын хөлдөх температурын бууралт нь уусмалын молийн концентрацтай шууд пропорциональ байгааг харуулж болно.
Раулийн хоёр дахь хууль: Tboil-ийн өсөлт ба Tzam уусмалын бууралт нь ууссан бодисын бөөмийн тоотой пропорциональ бөгөөд түүний шинж чанараас хамаардаггүй.
Ажлын төгсгөл -
Энэ сэдэв нь дараах хэсэгт хамаарна.
Лекц No 5. Фазын тэнцвэрт байдал. Электролитийн бус уусмалууд
Бодисын хийн төлөв нь бөөмс хоорондын харилцан үйлчлэл сул, тэдгээрийн хоорондын зай их байдаг тул хий холилдох... Хийн хольцын нийт даралт нь бүх бүрэлдэхүүн хэсгүүдийн хэсэгчилсэн даралтын нийлбэртэй тэнцүү байна...
Хэрэв танд энэ сэдвээр нэмэлт материал хэрэгтэй бол эсвэл хайж байсан зүйлээ олоогүй бол манай ажлын мэдээллийн санд байгаа хайлтыг ашиглахыг зөвлөж байна.
Хүлээн авсан материалыг бид юу хийх вэ:
Хэрэв энэ материал танд хэрэгтэй байсан бол та үүнийг нийгмийн сүлжээн дэх хуудсандаа хадгалах боломжтой.
| Жиргээ |
Энэ хэсгийн бүх сэдвүүд:
Лекц No 5. Фазын тэнцвэрт байдал. Электролитийн бус уусмалууд.
Фазын тэнцвэрт байдал. Сүүлийн лекцээр бид химийн тэнцвэрт байдал, тэнцвэрийн тогтмол байдал, тэдгээрийн хоорондын хамаарлыг авч үзсэн. хэмжигдэхүүн ба тэнцвэрт байдалд шилжихэд нөлөөлөх хүчин зүйлс.
Хоёр бүрэлдэхүүн хэсэгтэй системүүд.
Шийдэл гэдэг нь хоёр ба түүнээс дээш бүрэлдэхүүн хэсгээс бүрдэх нэгэн төрлийн систем бөгөөд түүний шинж чанарт огцом өөрчлөлт оруулахгүйгээр найрлага нь тодорхой хязгаарт тасралтгүй өөрчлөгдөж байдаг.
Уусмалыг бүрдүүлэх
Уусмал үүсэх нь физик, химийн нарийн төвөгтэй процесс юм. Татан буулгах үйл явц нь системийн энтропи нэмэгдэхэд үргэлж дагалддаг; Шийдэл үүсэх үед ихэвчлэн аль нэг нь ялгардаг
Уусах чадвар
Уусах үйл явц нь тархалттай холбоотой, өөрөөр хэлбэл нэг бодисын бөөмсийг нөгөөгийн хэсгүүдийн хооронд аяндаа хуваарилахтай холбоотой байдаг. Уусгагч руу ууссан бодис нэмэхэд уусгах үйл явц
Шингэн дэх хийн уусах чадвар
Шингэн дэх хийн уусах чадвар нь хэд хэдэн хүчин зүйлээс хамаардаг: хий ба шингэний шинж чанар, даралт, температур, шингэнд ууссан бодисын концентраци (ялангуяа хийн уусах чадвар).
Электролитийн бус уусмалууд.
Уусмалын шинж чанарыг шингэрүүлсэн уусмалын жишээн дээр авч үзсэн бөгөөд үүсэх үед дулааны болон эзэлхүүний нөлөө нь 0 (хамгийн тохиромжтой шийдэл) байна. Ийм шийдэлд бөөмс нь том хэмжээтэй байдаг
Уусмал дээрх ханасан уурын даралтын харьцангуй бууралт нь ууссан бодисын моль фракцтай тэнцүү байна.
Аливаа шингэн нь ханасан уурын даралт нь гадаад даралтад хүрэх температурт буцалж эхэлдэг. T буцалгана - Т уурын даралт = 101.3 кПа Ус 100 С-т буцалгана,
Осмосын даралт
Хэрэв өөр өөр концентрацитай хоёр уусмалыг уусгагч молекулыг нэвтрүүлэх боломжийг олгодог боловч ууссан бодисын хэсгүүдийг нэвтрүүлэхээс сэргийлдэг хагас нэвчүүлэх хуваалтаар тусгаарлавал би ажиглах болно.
