რა სისტემებს უწოდებენ გადაწყვეტილებებს. თემა: მოძღვრება გადაწყვეტილებების შესახებ. ხსნარების კლასიფიკაცია
გადაწყვეტილებები- თხევადი დოზის ფორმა, რომელიც მიიღება თხევადი, მყარი ან აირისებრი ნივთიერებების შესაბამის გამხსნელში გახსნით. დისპერსოლოგიური კლასიფიკაციის მიხედვით, ხსნარები არის თავისუფლად დისპერსიული სისტემები თხევადი დისპერსიული საშუალებით.
ფარმაცევტულ პრაქტიკაში ხსნარები შეადგენს საშუალოდ 30%-მდე მთლიანი სააფთიაქო ფორმულირებით. დიდი სპეციფიკური სიმძიმეხსნარები, ისევე როგორც ყველა თხევადი დოზის ფორმა, აიხსნება მათი რიგი უპირატესობებით სხვა დოზირების ფორმებთან შედარებით.
ხსნარების უპირატესობები მყარ დოზირების ფორმებთან შედარებით:
მაღალი ბიოშეღწევადობა;
შემცირებული გამაღიზიანებელი თვისებები;
თერაპიული ეფექტის სწრაფი დაწყება;
გემოს კორექციის შესაძლებლობა;
სიმარტივე და გამოყენების სიმარტივე.
ხსნარების ნაკლოვანებები მყარ დოზირების ფორმებთან შედარებით:
მოკლე შენახვის ვადა;
დამხმარე ნივთიერებების შემადგენლობის შემუშავების აუცილებლობა. გადაწყვეტილებების თანდაყოლილი უარყოფითი მხარეები გავლენას არ ახდენს მათ ფართო გამოყენებაზე.
ხსნარების კლასიფიკაცია წარმოდგენილი დიაგრამაში.
ხსნარის თვისებები მოცემულია ცხრილში. 12.1.
ცხრილი 12.1.ხსნარების თვისებები
გადაწყვეტილებების დასახელება | დისპერსიული ფაზა | ნაწილაკების ზომა | SDF-ის მაგალითები | თვისებები |
დაბალი მოლეკულური წონის ნივთიერებების ნამდვილი ხსნარები | იონების მოლეკულები | 1 ნმ | გლუკოზის, ნატრიუმის ქლორიდის ხსნარები | ისინი გადიან ფილტრში, დიალიზის მემბრანაში და არ ცვლიან თავის თვისებებს ცენტრიფუგირების ან გაცხელებისას. შესაძლებელია ნალექი (დამარილება) ალკოჰოლით, აცეტონით, გაჯერებული ელექტროლიტებით |
მართალია გადაწყვეტილებები საზღვაო ძალები | მოლეკულები | 1-100 ნმ | გამოსავალი პეპსინი, ჟელატინი | ისინი გადიან ფილტრში, არ გადიან დიალიზის მემბრანაში და იცვლებიან თვისებებს ცენტრიფუგირების ან გაცხელებისას. შესაძლებელია დამარილება (კოაცერვაცია) ალკოჰოლით, აცეტონით, გაჯერებული ელექტროლიტებით |
კოლოიდური ხსნარები | მიცელი | 1-100 ნმ | Collargol გადაწყვეტილებები |
12.1. გამხსნელები
ხსნარის დასამზადებლად საჭიროა სამკურნალო ნივთიერებები და გამხსნელები.
გამხსნელები- ცალკეული ქიმიური ნაერთები ან მათი ნარევები, რომლებსაც შეუძლიათ დაშლა სხვადასხვა ნივთიერებები, ე.ი. ფორმა მათთან ერთად ერთგვაროვანი სისტემები- გადაწყვეტილებები.
გამხსნელები იყოფა 2 კლასად:
წყალი (გაწმენდილი ან საინექციო);
ორგანული გამხსნელები (ეთილის სპირტი, გლიცერინი, ქლოროფორმი, ეთერი და ა.შ.).
ძირითადი მოთხოვნები გამხსნელებისთვის:
გამხსნელი ძალა;
ქიმიური გულგრილობა და ბიოლოგიური უვნებლობა;
არ არის უსიამოვნო გემო ან სუნი;
მიკრობიოლოგიური სისუფთავე;
დაბალი ფასი და ხელმისაწვდომობა.
12.1.1. წყალი
აფთიაქში, დოზის ფორმების წარმოების ძირითადი გამხსნელებია გაწმენდილი წყალი და საინექციო წყალი.
12.1.2. გაწმენდილი წყალი
ადრე გამოიყენებოდა ტერმინი „გამოხდილი წყალი“, ე.ი. დისტილაციით მიღებული წყალი. ამჟამად შემუშავებულია ახალი ტექნოლოგიები, რომლებიც შესაძლებელს ხდის საჭირო ხარისხის წყლის მიღებას მემბრანის მეშვეობით იონების გაფილტვრით. ამიტომ GF X! ტერმინი "გამოხდილი წყალი" შეიცვალა უფრო ზოგადი ტერმინით "გაწმენდილი წყალი". ეს ტერმინი გამორიცხავს განმარტებას
წყლის მიღების მეთოდი და ადგენს ზოგადი მოთხოვნებიმის ხარისხზე.
გაწმენდილი წყლის მიღების 2 გზა არსებობს:
დისტილაცია;
უკუ ოსმოზი. მოწყობილობა წყლის წარმოებისთვის
განწმენდილი
წყლის დისტილერები DE წყლის დისტილერები (ნახ. 12.1) შექმნილია გაწმენდილი წყლის წარმოებისთვის. სხეული და ძირითადი ნაწილები დამზადებულია უჟანგავი ფოლადი. ტექნიკური მახასიათებლები მოცემულია ცხრილში. 12.2.
დისტილერი შედგება შემდეგი ძირითადი ბლოკებისგან (ნახ. 12.2): გამაგრილებელი (კონდენსატორი), ექვალაიზერი, აორთქლების კამერა (აორთქლება), ელექტრო გამათბობლები, დონის სენსორი, საკონტროლო ბლოკი.
რეკომენდებულია მცირე მოცულობის გაწმენდილი წყლის წარმოებისთვის

ბრინჯი. 12.1.DE წყლის დისტილერების გარეგნობა
ცხრილი 12.2.ძირითადი ტექნიკური მახასიათებლები DE დისტილერები

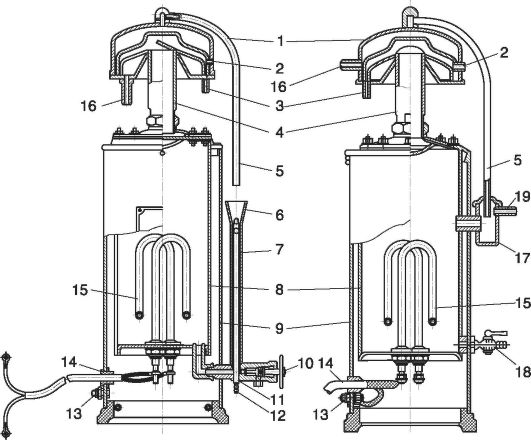
ბრინჯი. 12.2.დისტილერი:
1 - კონდენსატორი; 2 - ხვრელი; 3 - nipple; 4 - მილი; 5 - გადინების მილი; 6 - funnel; 7 - გამათანაბრებელი; 8 - აორთქლება; 9 - გარსაცმები; 10 - ჩამოსასხმელი; 11 - ჯვარი; 12 - ხვრელი ძუძუს; 13 - დამიწების ჭანჭიკი; 14 - მავთული; 15 - გათბობის ელემენტი; 16 - nipple; 17 - გამათანაბრებელი ავზი; 18 - გადინების სარქველი; 19 - წყლის გადინების მოწყობილობა

ბრინჯი. 12.3.მაგიდის წყლის დისტილატორი
იყენებთ კონტრატოპის დისტილერებს, როგორიცაა MELAdest? 65 MELAG-დან (სურ. 12.3). დისტილერი საშუალებას გაძლევთ მიიღოთ გაწმენდილი წყალი, რომელიც აკმაყოფილებს ფარმაკოპეის მოთხოვნებს. პროდუქტიულობა - 0,7 ლ/სთ. ზომები - 23. 38 სმ სიმძლავრე - 500 W. მთავარი უპირატესობებია ენერგიის დაბალი მოხმარება და პროდუქტიულობა, რაც საშუალებას აძლევს დისტილერის გამოყენებას მხოლოდ რამდენიმე რეცეპტის დასამზადებლად.
დისტილაციით გაწმენდილი წყლის მიღების წესები
1. გაწმენდილი წყლის მიღება და შენახვა უნდა განხორციელდეს სპეციალურ
სპეციალურად ამ მიზნით აღჭურვილი ოთახში წყლის გამოხდის ან ამ მიზნით ნებადართული სხვა დანადგარების გამოყენებით.
2. წყლის დისტილატორის გამოყენებით წყლის მიღებისას, სამუშაოს დაწყებამდე ყოველდღე:
დისტილატორი და მილსადენები ორთქლდება 10-15 წუთის განმავლობაში დახურული სარქველებიწყლის მიწოდება კონდენსატორში;
15-20 წუთში წყლის პირველი პორციები იყრება.
3. მიღებული წყალი, გაწმენდილი და საინექციო, გროვდება სუფთა, სტერილიზებულ ან ორთქლით დამუშავებულ სამრეწველო კოლექტორებში, რომლებიც დამზადებულია მასალებისგან, რომლებიც არ ცვლის წყლის თვისებებს და იცავს მას უცხო ნაწილაკებისა და მიკრობიოლოგიური დამაბინძურებლებისგან (გამონაკლისის სახით - მინაში. ცილინდრები). კოლექციებს უნდა ჰქონდეს მკაფიო წარწერა: "გაწმენდილი წყალი", "საინექციო წყალი". წყლის შეგროვებას ერთვის ტეგი, რომელშიც მითითებულია მისი მიღების თარიღი, ანალიზის ნომერი და შემმოწმებელი პირის ხელმოწერა. თუ რამდენიმე კოლექცია ერთდროულად გამოიყენება, ისინი დანომრილია. საინექციო წყლის შეგროვებისა და შესანახი კონტეინერების ეტიკეტზე უნდა იყოს მითითებული, რომ მათი შიგთავსი არ არის სტერილიზებული.
4. შუშის კოლექციები მჭიდროდ იკეტება საცობებით 2 ნახვრეტით: ერთი მილისთვის, რომლითაც წყალი მიედინება, მეორე მინის მილისთვის, რომელშიც ჩასმულია სტერილური ბამბის ტამპონი (იცვლება ყოველდღიურად).
5. გაწმენდილი წყალი გამოიყენება ახლად მომზადებული ან ინახება დახურულ ჭურჭელში არა უმეტეს 3 დღისა.
სახელმწიფო ფონდის მოთხოვნები გაწმენდილი წყლის ხარისხისთვის
თითოეული ცილინდრიდან გაწმენდილი წყალი ყოველდღიურად ანალიზდება ქლორიდების, სულფატების და კალციუმის მარილების არარსებობისთვის. კვარტალურად გაწმენდილი წყალი იგზავნება ტერიტორიულ საკონტროლო და ანალიტიკურ ლაბორატორიაში სრული ქიმიური ანალიზისთვის.
გაწმენდილი წყალი უნდა იყოს უფერო, გამჭვირვალე, უსუნო და უგემოვნო. pH მნიშვნელობა შეიძლება მერყეობდეს 5.0-6.8 შორის. მშრალი ნარჩენი არ უნდა აღემატებოდეს 0,001%-ს (ანუ 1 მგ 100 მლ წყალში). წყალი არ უნდა შეიცავდეს შემამცირებელ ნივთიერებებს (100 მლ წყალს 10 წუთის განმავლობაში ადუღებთ 2 მლ განზავებულ გოგირდმჟავასთან და 1 მლ 0,01 მ კალიუმის პერმანგანატის ხსნართან ერთად, წყალი უნდა დარჩეს შეღებილი. ვარდისფერი), ნიტრატები, ნიტრიტები, ქლორიდები, სულფატები, კალციუმი, მძიმე ლითონები, ნახშირორჟანგი. დასაშვებია მხოლოდ ამიაკის კვალი (არაუმეტეს 0,00002%).
გაწმენდილი წყლის მიკრობიოლოგიური სისუფთავე უნდა აკმაყოფილებდეს სასმელ წყალს. ნებადართულია შეიცავდეს არაუმეტეს 100 მიკროორგანიზმს მლ-ზე ოჯახის ბაქტერიების არარსებობის შემთხვევაში. Enterobacteriaceae, P. aeruginosa, S. aureus.
12.1.3. საინექციო წყალი
საინექციო ხსნარების დასამზადებლად გამოიყენება საინექციო წყალი, რომელმაც უნდა გაიაროს გაწმენდილი წყლის ტესტი და ასევე უნდა იყოს სტერილური და პიროგენისგან თავისუფალი.
საინექციო წყალი ასეპტიურ პირობებში მიიღება თუ არა ჯანდაცვის სამინისტროს ბრძანებით? 309. საინექციო წყლის მომზადება წარმოებს ასეპტიკური დანადგარის გამოხდის ოთახში, სადაც კატეგორიულად აკრძალულია ნებისმიერი სამუშაოს შესრულება, რომელიც არ არის დაკავშირებული წყლის დისტილაციასთან.
საინექციო წყალი მიიღება წყლის დისტილერების ან საპირისპირო ოსმოსის დანადგარების გამოყენებით მათზე თანდართული ინსტრუქციის შესაბამისად.
ცნობილია, რომ პიროგენული ნივთიერებები არამდგრადია და მათი გამოხდა წყლის ორთქლით შეუძლებელია. დისტილატის დაბინძურება პიროგენული ნივთიერებებით ხდება წყლის პაწაწინა წვეთების გადატანით ან ორთქლის ნაკადით მათი ამოღებით კონდენსატორში. აქედან გამომდინარე, საინექციო წყლის მიღებისას მთავარი ამოცანაა წყლის წვეთების გამოყოფა ორთქლის ფაზიდან. ამ მიზნით AA-1 წყლის დისტილერებს (ნახ. 12.4) აქვთ გამყოფები (8), სადაც ორთქლი გადის გრძელ გრაგნილ გზას და თანდათან კარგავს წვეთოვან-თხევად ფაზას კონდენსატორისკენ მიმავალ გზაზე.
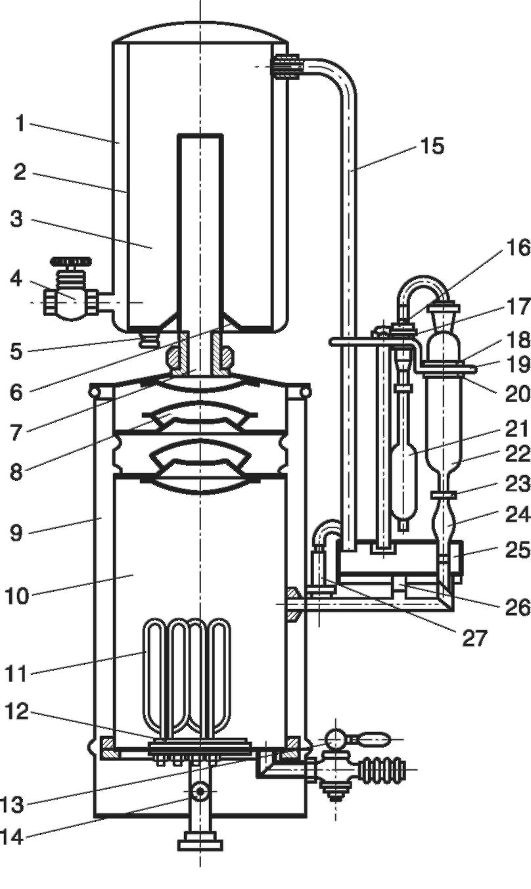
ბრინჯი. 12.4.წყლის დისტილატორი AA-1
AA-1 წყლის გამოხდის ძირითადი ნაწილებია აორთქლების კამერა (10 ) გამყოფით (8), კონდენსატორით (1-6 ), ექვალაიზერის კოლექტორი (25) და ელექტრო პანელი. აორთქლების კამერა (10) გარედან დაცულია ფოლადის გარსაცმით (9), რომელიც შექმნილია სითბოს დანაკარგების შესამცირებლად და მოქმედი პერსონალის დამწვრობისგან დასაცავად. ბოლოში (12 ) კამერა აღჭურვილია ოთხი ელექტრო გამათბობლით (11) და გადატვირთული კიდეებით (B). აორთქლების კამერაში (10) წყალი (დამატებული ქიმიკატებით) (14 ), თბება ელექტრო გამათბობლებით (11), იქცევა ორთქლად, რომელიც გამყოფების მეშვეობით (8) და ორთქლის მილი (7) შედის კონდენსაციის კამერაში (3), გაცივებული

ბრინჯი. 12.5.შუშის ნამცხვრები
სროლა ცივი წყალი (15), და კონდენსაციის დროს გადაიქცევა უპიროგენულ წყალში.
დემინერალიზაციის უმაღლესი ხარისხის პიროგენისგან თავისუფალი წყლის მისაღებად გამოიყენება Sanyo მინის დისტილერები (სურ. 12.5). დისტილატორს აქვს დაპატენტებული ორთქლის ხაფანგი, რომელიც უზრუნველყოფს უმაღლესი სისუფთავის დისტილატს პიროგენისგან; pH 5,6-6,0. პროდუქტიულობა - 8 ლ/სთ.
გაწმენდილი საინექციო წყალი (დემინერალიზებული)
დემინერალიზებული წყალი (აკვა დემინერალისტა)სამედიცინო პრაქტიკაში გამოიყენება საინექციო წყალთან ერთად საინექციო ხსნარების დასამზადებლად.
დემინერალიზებული წყალი საინექციო ხსნარებისთვის მიიღება წყაროს წყლის უკუ ოსმოსის ერთეულისა და სასტერილიზაციო ფილტრის გავლით. სცენაზე საპირისპირო ოსმოზიწყალი გაწმენდილია ორგანული ნაერთებიდა მარილები. მინარევების მოცილება ხდება წყლის გავლის გზით ნახევრად გამტარ მემბრანაში ოსმოსურ წნევაზე მეტი წნევით. პროცესის ეფექტურობის გასაზრდელად გამოიყენება მემბრანის ზედაპირზე წყლის ტანგენციალური მიწოდება რეცირკულაციის დროს. მოწყობილობა შედგება სერიით დაკავშირებული სვეტებისგან (ნახ. 12.6), რომელიც შედგება მემბრანული ფილტრების სისტემისგან, რომელიც შემოვიდა გარკვეული გზით. მემბრანებს აქვთ ფორების ზომები 0,0005-0,001 მმ. უკუ ოსმოსის სისტემების მონიტორინგი ხდება სისტემიდან გამოსული წყლის სპეციფიური ელექტრული გამტარობის გაზომვით.
საინექციო წყლის შენახვა
მიღებული საინექციო წყალი გროვდება სუფთა, სტერილიზებულ ან ორთქლით დამუშავებულ მინის კონტეინერებში ან სპეციალურ ჭურჭელში (ნახ. 12.7). კონტეინერებს მკაფიოდ უნდა ჰქონდეს წარწერა „საინექციო წყალი“. საინექციო წყლის შესანახი კონტეინერი აღჭურვილი უნდა იყოს:
შემრევი;
ორთქლისა და გაგრილების წყლის მიწოდების ქურთუკი;
შხაპის სისტემა ჭურჭლის მთელი შიდა ზედაპირის უწყვეტი დასველების უზრუნველსაყოფად;
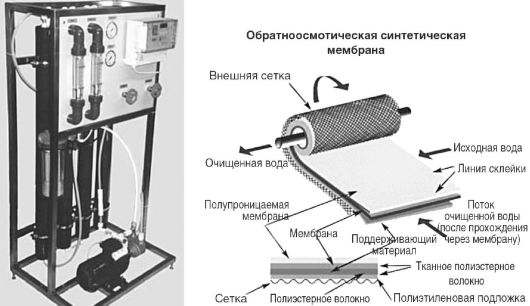
ბრინჯი. 12.6.უკუ ოსმოსის დანადგარები "აპიროგენ-20" და უკუ ოსმოსის მემბრანა

ბრინჯი. 12.7.უწყვეტი ცირკულაციის წყლის საინექციო შესანახი ავზი სამრეწველო წარმოებისთვის
თერმოსტატის სისტემა;
ჰიდროფობიური ჰაერის ფილტრი;
ფეთქებადი მემბრანა;
წნევის საზომი;
დონის კონტროლის სისტემა. გამოიყენება საინექციო წყალი
ახლად მომზადებული ან შენახული 5-დან 10 C ტემპერატურაზე თუ 80-დან 95 C-მდე დახურულ ჭურჭელში, რომელიც არ ცვლის წყლის თვისებებს, იცავს მას მექანიკური მინარევებისაგან და მიკრობიოლოგიური დამაბინძურებლებისგან, არა უმეტეს 24 საათის განმავლობაში? საჭიროების შემთხვევაში საინექციო წყლის გრძელვადიანი შენახვისთვის აუცილებელია მისი მიმოქცევის ორგანიზება 85-90 C დიაპაზონში.
მოთხოვნები საინექციო წყლის ხარისხზე A. პიროგენული ნივთიერებების არარსებობა
პიროგენული ნივთიერებები (ბერძ. პირ- ცეცხლი, ლათ. თაობა- დაბადება) ეწოდება მიკროორგანიზმების, მკვდარი მიკრობული უჯრედების სასიცოცხლო აქტივობისა და დაშლის პროდუქტებს. ქიმიური შემადგენლობის თვალსაზრისით, პიროგენული ნივთიერებები წარმოადგენს ლიპოპოლისაქარიდის ბუნების მაღალმოლეკულურ ნაერთებს ნაწილაკების ზომით 50 ნმ-დან 1 მიკრონიმდე. დადგენილია, რომ პიროგენულ ნივთიერებებს ძირითადად გრამუარყოფითი ბაქტერიები ქმნიან.
პიროგენული ნივთიერებების შემცველი ხსნარის შეყვანა იწვევს პიროგენურ ეფექტს (სხეულის ტემპერატურის მატება, ცხელება). ყველაზე მძიმე პიროგენული რეაქციები შეინიშნება ინტრავასკულარული, ზურგის და ქალასშიდა ინექციების დროს.
პიროგენული ნივთიერებები არის თერმოსტაბილური ნივთიერებები; ისინი ნადგურდებიან მხოლოდ მშრალი ჰაერის სტერილიზატორებში 30 წუთის განმავლობაში. შესაძლო პიროგენული ეფექტის საშიშროების გამო, 10 მლ ან მეტი მოცულობით (GF) ინტრავენურად შეყვანილი ხსნარები შემოწმებულია პიროგენულობაზე. უნდა შემოწმდეს 5% გლუკოზის ხსნარი, იზოტონური ნატრიუმის ქლორიდი და ჟელატინის ხსნარი. კვარტალში ერთხელ ტესტირება ხსნარების პიროგენურობისა და საინექციო წყლის იზოტონური ხსნარის სახით ტარდება ბიოლოგიური მეთოდის (MF) გამოყენებით.
ბიოლოგიური მეთოდი. საცდელი ხსნარი შეჰყავთ 1,5-2,5 კგ წონით 3 ჯანმრთელ კურდღელს ყურის ვენაში 10 მლ კურდღლის სხეულის წონის 1 კგ-ზე. სამკურნალო ნივთიერების ან წყლის ხსნარი განიხილება პიროგენისგან თავისუფალი, თუ შეყვანის შემდეგ, 3 ექსპერიმენტული კურდღლიდან არცერთ 3 გაზომვაში არ ყოფილა სხეულის ტემპერატურის ზრდა 0,6 °C-ზე მეტით, სხეულის საწყის ტემპერატურასთან შედარებით, და საერთო ჯამში ტემპერატურის მატებამ 3 კურდღელი 1.4?C-ს არ გადააჭარბა.
ლიმულუსის ტესტი.პიროგენურობის ტესტირების ოფიციალური ბიოლოგიური მეთოდის გარდა, ფართოდ გამოიყენება ლიმულუსის ტესტი (LALtest), რომელიც ეფუძნება გელის წარმოქმნას ბაქტერიული პიროგენების ამებოციტულ ლიზატთან ურთიერთქმედების დროს. Limulus polyphemus. LAL ტესტი ეფუძნება ამებოციტების ლიზატის (რელიქტური ცხოველების ჰემოლიმფური უჯრედები - ცხენის ნაჭუჭის კიბორჩხალების) უნარს სპეციალურად რეაგირებდეს გრამუარყოფითი ბაქტერიების ენდოტოქსინებთან. ამჟამად
LAL ტესტი ლეგალიზებულია მრავალი ქვეყნის ფარმაკოპეის მიერ და 2009 წლიდან იგი შემოთავაზებულია რუსეთის ფედერაციის ფარმაკოპეაში შესატანად, როგორც პიროგენული ნივთიერებების იდენტიფიცირების ალტერნატიული მეთოდი. დეპიროგენაციის მეთოდები:
ქიმიური;
ფიზიკურ-ქიმიური;
ფერმენტული.
დეპიროგენაციის ქიმიური მეთოდები:
პიროგენული ნივთიერებების პიროლიზური დაშლა თერმოსტაბილურ ნივთიერებებში (ნატრიუმის ქლორიდის დეპიროგენაცია
180-200 C);
გათბობა 6% წყალბადის ზეჟანგის ხსნარში 100? C 1 საათის განმავლობაში;
ინახება გოგირდის მჟავით დამჟავებულ კალიუმის პერმანგანატის 0,5-1%-იან ხსნარში 25-30 წუთის განმავლობაში. ხსნარის მოსამზადებლად კალიუმის პერმანგანატის 1%-იან ხსნარს 10 წილ 1,5%-იან გოგირდმჟავას ხსნარს უმატებენ. დამუშავების შემდეგ ჭურჭელი და მილები კარგად ირეცხება ახლად მომზადებული საინექციო წყლით.
ფიზიკურ-ქიმიური მეთოდები:
ხსნარების გადატანა სვეტებში გააქტიურებული ნახშირბადით და ცელულოზით;
მემბრანული ულტრაფილტრების გამოყენება უარყოფითი ზეტა პოტენციალით. ეს მეთოდიმოსახერხებელია საინექციო ხსნარების სამრეწველო წარმოებისთვის.
B. საინექციო წყლის ხარისხის კონტროლი
რუსეთის ფედერაციის ჯანდაცვის სამინისტროს ბრძანების საფუძველზე? 309 და MU-78-113 „გაწმენდილი წყლისა და საინექციო წყლის მომზადება, შენახვა და განაწილება“, დათარიღებული 1998 წლის 22 მაისით, საინექციო წყლის ყოველდღიური მონიტორინგი ხორციელდება სახელმწიფო ფონდის „გაწმენდილი წყალი“ და „წყალი“ მუხლების შესაბამისად. ინექცია“ ფარმაკოპეის მონოგრაფიის მიხედვით (ცხრილი 12.3).
თუ აფთიაქს აქვს წყლის განაწილების სისტემა მილსადენებით, მაშინ საინექციო წყალი ექვემდებარება დამატებით კონტროლს მილსადენებში. გაწმენდილი წყლის განაწილების სისტემაში დინების სიჩქარე (მარყუჟის სისტემებისთვის), ტემპერატურა (ცხელი სისტემებისთვის) და წყლის ელექტროგამტარობა ექვემდებარება უწყვეტ მონიტორინგს. გარდა ამისა, სასურველია ორგანული ნახშირბადის შემცველობის კონტროლი.
ცხრილი 12.3. გაწმენდილი წყლისა და საინექციო წყლის ხარისხის ინდიკატორები FS-2619 და FS-2620 მიხედვით
ინდიკატორები | საზომი ერთეულები | გაწმენდილი წყალი | საინექციო წყალი |
გარეგნობა | უფერო გამჭვირვალე სითხე, უსუნო და უგემოვნო |
||
pH | 5,0-7,0 | 5,0-7,0 |
|
მშრალი ნარჩენი | <0,001 | <0,001 |
|
შემცირების აგენტები | FS მეთოდის მიხედვით | FS მეთოდის მიხედვით |
|
ნახშირორჟანგი | FS მეთოდის მიხედვით | FS მეთოდის მიხედვით |
|
ნიტრატები და ნიტრიტები | მგ/მლ | <0,0002 | <0,0002 |
ამიაკი | მგ/მლ | <0,0002 | <0,0002 |
ქლორიდები | მგ/მლ | <0,0001 | <0,0001 |
სულფატები | მგ/მლ | <0,003 | <0,003 |
კალციუმი | მგ/მლ | <0,0035 | <0,0035 |
მძიმე ლითონები | მგ/მლ | <0,0005 | <0,0005 |
მიკროორგანიზმები | ერთეული/მლ | <100 при отсутствии бактерий семейства Enterobacteriacea, Staphylococcus aureus, Pseudomonas aeruginosa. | არცერთი |
პიროგენურობა | არაპიროგენული |
12.2. ნივთიერებების ხსნადობა გფ
ხსნარების დამზადების ტექნოლოგია დამოკიდებულია არა მხოლოდ გამხსნელის თვისებებზე, არამედ წამლის ნივთიერების ხსნადობაზე.
ხსნადობა- ნივთიერების მაქსიმალური კონცენტრაცია, რომელიც შეიძლება მთლიანად გაიხსნას მოცემულ გამხსნელში მოცემულ ტემპერატურასა და წნევაზე. სამკურნალო ნივთიერება განიხილება დაშლილად, თუ მისი ნაწილაკები არ არის აღმოჩენილი ხსნარში, როდესაც შეინიშნება გადამცემ სინათლეში.
გლობალური ფონდის მონაცემებით, დადგენილია 7 ტერმინი, რომელიც ახასიათებს წამლების ხსნადობას (ცხრილი 12.4).
ცხრილი 12.4.ხსნადობის მახასიათებლები გფ-ის მიხედვით
12.2.1. ხსნადობაზე მოქმედი ფაქტორები
ა ტემპერატურა
ნებისმიერი ნივთიერების ხსნადობა დამოკიდებულია ტემპერატურაზე. ნივთიერებების უმეტესობა ენდოთერმულია, შთანთქავს სითბოს დაშლისას. ამ ნივთიერებებისთვის ხსნარის გაცხელება ზრდის ხსნადობას. ზოგიერთი ნივთიერება (ჰიდროქსიდი ან კალციუმის გლიცეროფოსფატი და ნატრიუმის კარბენიცილინი) წარმოქმნის სითბოს დაშლის პროცესში. ასეთი ნივთიერებების ხსნადობა მცირდება ტემპერატურის მატებასთან ერთად.
B. სხვა იონების არსებობა
ხსნადობა თითქმის ყოველთვის მცირდება ხსნარში დამატებითი ნივთიერებების ან იონების შეყვანისას (დამარილება). თუმცა, არსებობს საპირისპირო კავშირი ხსნადობის ზრდას შორის, როდესაც იონები შედის ხსნარში:
- გლობულინის ცილების ხსნადობის გაზრდა, რომლებიც უკეთესად იხსნება ნატრიუმის ქლორიდის ხსნარში, ვიდრე წყალში;
- იოდის დაშლა კალიუმის იოდიდის გაჯერებულ ხსნარში KJ 3 კომპლექსის წარმოქმნით;
- ვერცხლისწყლის ქლორიდის დაშლა ნატრიუმის ქლორიდის ხსნარში რთული ნაერთის Na 2 HgCl 4 წარმოქმნით.


აქედან გამომდინარეობს, რომ ნატრიუმის ფენობარბიტალი დაშლილ მდგომარეობაშია 8,3-ზე მეტი pH-ით. pH-ის დაქვეითება გამოიწვევს ფენობარბიტალის ნალექს.
დ. გამხსნელის პოლარობა
მოცემულ გამხსნელში წამლის ხსნადობა დიდწილად დამოკიდებულია გამხსნელის პოლარობაზე. დიელექტრიკული მუდმივიდან გამომდინარე, გამხსნელები კლასიფიცირდება როგორც პოლარული (e > 50), ნახევრადპოლარული (e = 20-50) ან არაპოლარული (e = 1-20) (ცხრილი 12.5).
ცხრილი 12.5.გამხსნელების დიელექტრიკული მუდმივი
გამხსნელი | დიელექტრიკული მუდმივი, e, 20 ?C |
N-მეთილფორმამიდი | |
წყალი | |
სორბიტოლის ხსნარი (70%) | |
სიროფი (64%) | |
გლიცერინი | |
პროპილენ გლიკოლი | 32,1 |
ეთანოლი | |
პოლიეთილენ გლიკოლი 400 | 12,4 |
ქლოროფორმი | |
აბუსალათინის ზეთი | |
ეთერი | |
ზეითუნის ზეთი |
პოლარული გამხსნელები ხსნიან მარილებს ან ძლიერ პოლარულ (დიპოლურ) მოლეკულებს. არაპოლარული გამხსნელები ხსნიან არაპოლარულ მოლეკულებს. ნახევრად პოლარული გამხსნელები (ალკოჰოლი და კეტონები) შეიძლება დაიშალოს ორივე მათი თვისებებიდან გამომდინარე. ამრიგად, აფთიაქში არსებობს გამხსნელის არჩევის უნივერსალური წესი: „მსგავსი იშლება მსგავსებად“.
ნახევრად პოლარულ გამხსნელებში ნივთიერებების ხსნადობის გაზრდის 2 გზა არსებობს:
1. pH-ის შეცვლით ნივთიერების (მარილის ან ფუძის) პოლარობის შესაცვლელად. მარილის კონცენტრაციის ზრდა იწვევს ზრდას
მარილების ხსნადობა პოლარულ გამხსნელებში, ფუძეები არაპოლარულში.
2. სხვადასხვა პოლარობის გამხსნელების შერევა გამხსნელის პოლარობის შესაცვლელად.

მაგალითი 2
შეცვალეთ ალკოჰოლი გლიცერინით ფურაცილინის ხსნარში 1:1500. გამხსნელის დიელექტრიკული მუდმივის დასადგენად მზადდება ეთანოლისა და წყლის ნარევები. შემდეგ ამ ნარევებში ამზადებენ ხსნარებს, ტოვებენ ღამით, ნალექის დაკვირვებით (ცხრილი 12.6).
მაგალითად, ფურაცილინის ნალექი არ დაფიქსირებულა 60/40 ან მეტი ნარევში; ექსპერიმენტების შედეგები წარმოდგენილია ქვემოთ: + (დიახ), - (არა).
ცხრილი 12.6.ალკოჰოლის მოქმედება ფურაცილინის ნალექზე
% v/v ალკოჰოლი | |||||||||||
ნალექები |


უსაფრთხოების კითხვები
1. განსაზღვრეთ ამონახსნები დისპერსოლოგიური კლასიფიკაციის თვალსაზრისით.
2. რა მეთოდები არსებობს გაწმენდილი წყლის მისაღებად?
3. რა მოთხოვნები აქვს გაწმენდილი წყლის ხარისხს?
4. რა მოთხოვნები აქვს საინექციო წყლის ხარისხს?
5. რა მეთოდები არსებობს საინექციო წყლის მისაღებად?
6. როგორ ინახება გაწმენდილი წყალი და საინექციო წყალი?
ტესტები
1. ხსნარები - თხევადი დოზის ფორმა, რომელიც მიიღება გახსნით:
1. თხევადი.
2. მყარი.
3. აირისებრი ნივთიერებები შესაბამის გამხსნელში
2. დაბალი მოლეკულური წონის ნივთიერებების ნამდვილი ხსნარები:
1. გაიარეთ ფილტრი.
2. გაიარეთ დიალიზური მემბრანა.
3. არ შეცვალოთ თვისებები ცენტრიფუგაციის დროს.
4. თბებიან.
3. გაწმენდილი წყლის მიღების მეთოდები:
1. დისტილაცია.
2. უკუ ოსმოზი.
3. იონის გაცვლა.
4. დისტილატორი შედგება შემდეგი ძირითადი ბლოკებისაგან:
1. ქულერი (კონდენსატორი).
2. ექვალაიზერი.
3. შემავსებელი.
4. აორთქლების კამერა (აორთქლება).
5. ელექტრო გამათბობლები.
6. დონის სენსორი.
7. მართვის ბლოკი.
5. ყოველდღე, სამუშაოს დაწყებამდე, დისტილატორი და მილსადენები ორთქლდება წყალმომარაგების სარქველებით დახურულ კონდენსატორში:
1,5 წთ.
2. 10 წთ.
3. 15 წთ.
4. 20 წთ.
5. შემდეგ წყლის პირველ პორციებს ყრიან 15-20 წუთის განმავლობაში.
6. წყლის დისტილერებს პიროგენისგან თავისუფალი წყლის AA-1 წარმოებისთვის აქვთ გამყოფები:
1. მექანიკური ჩანართების განყოფილება.
2. ორთქლიდან წვეთოვანი სითხის ფაზის ამოსაღებად.
3. მიკროორგანიზმების მოსაშორებლად.
7. რა არის სწორი:
1. გამოიყენეთ ახლად მომზადებული წყალი საინექციო;
2. ინახება 5-დან 10 C ტემპერატურაზე.
3. ინახება 80-დან 95 C ტემპერატურაზე.
8. შემდეგ პროდუქტებს ეწოდება პიროგენული ნივთიერებები:
1. მიკროორგანიზმების სასიცოცხლო აქტივობა.
2. მიკროორგანიზმების დაშლა.
3. მკვდარი მიკრობული უჯრედები.
4. სიცოცხლისუნარიანი მიკროორგანიზმები.
9. პიროგენული ნივთიერებები განადგურებულია:
1. ადუღეთ 6 საათი.
2. სტერილიზაცია 132°C ტემპერატურაზე 30 წუთის განმავლობაში.
3. გათბობა მშრალი ჰაერის სტერილიზატორებში 250 C ტემპერატურაზე 30 წუთის განმავლობაში.
10. საინექციო წყალი უნდა იყოს:
1 სტერილური. 2. არაპიროგენული.
9. გადაწყვეტილებები. ხსნარების კლასიფიკაცია
მათი აგრეგაციის მდგომარეობის მიხედვით, ხსნარები შეიძლება იყოს აირისებრი, თხევადი და მყარი.
ნებისმიერი ხსნარი შედგება გახსნილი ნივთიერებებისა და გამხსნელისაგან, თუმცა ეს ცნებები გარკვეულწილად თვითნებურია. მაგალითად, ალკოჰოლისა და წყლის თანაფარდობიდან გამომდინარე, ეს სისტემა შეიძლება იყოს ალკოჰოლის ხსნარი წყალში ან წყალი ალკოჰოლში.
როგორც წესი, გამხსნელად ითვლება ის კომპონენტი, რომელიც ხსნარში არის იმავე აგრეგაციის მდგომარეობაში, როგორც დაშლამდე.
ხსნარების შესწავლა განსაკუთრებით საინტერესოა ექიმებისთვის, რადგან ყველაზე მნიშვნელოვანი ბიოლოგიური სითხეები - სისხლი, ლიმფა, შარდი, ნერწყვი, ოფლი - არის მარილების, ცილების, ნახშირწყლების, ლიპიდების ხსნარები წყალში.
ბიოლოგიური სითხეები მონაწილეობენ საკვები ნივთიერებების (ცხიმები, ამინომჟავები, ჟანგბადი), წამლების გადატანაში ორგანოებსა და ქსოვილებში, აგრეთვე მეტაბოლიტების (შარდოვანა, ბილირუბინი, ნახშირორჟანგი და ა.შ.) ორგანიზმიდან გამოდევნაში. სისხლის პლაზმა არის უჯრედების - ლიმფოციტების, ერითროციტების, თრომბოციტების საშუალება.
სხეულის თხევად მედიაში შენარჩუნებულია მუდმივი მჟავიანობა, მარილების და ორგანული ნივთიერებების კონცენტრაცია. ამ მუდმივობას კონცენტრაციის ჰომეოსტაზს უწოდებენ.
ხსნარების კლასიფიკაცია
ნივთიერებების ხსნარებს, რომელთა მოლური მასა 5000 გ/მოლზე ნაკლებია, ეწოდება დაბალი მოლეკულური წონის ნაერთების ხსნარებს (LMC), ხოლო ნივთიერებების ხსნარებს, რომელთა მოლური მასა 5000 გ/მოლზე მეტია, ეწოდება მაღალი მოლეკულური წონის ნაერთების ხსნარებს. HMC).
ელექტროლიტური დისოციაციის არსებობის ან არარსებობის მიხედვით, NMS ხსნარები იყოფა ორ კლასად - ელექტროლიტების და არაელექტროლიტების ხსნარებად.
ელექტროლიტური ხსნარები არის მარილების, მჟავების, ფუძეების და ამფოლიტების ხსნარები, რომლებიც იშლება იონებად. მაგალითად, KNO 3, HCl, KOH, Al(OH) 3, გლიცინის ხსნარები.
ელექტროლიტური ხსნარების ელექტრული გამტარობა უფრო მაღალია, ვიდრე გამხსნელის.
არაელექტროლიტების ხსნარები არის ნივთიერებების ხსნარები, რომლებიც პრაქტიკულად არ იშლება წყალში. მაგალითად, საქაროზის, გლუკოზის, შარდოვანას ხსნარები. არაელექტროლიტური ხსნარების ელექტრული გამტარობა ოდნავ განსხვავდება გამხსნელისგან.
NMS-ის ხსნარებს (ელექტროლიტები და არაელექტროლიტები) კოლოიდური ხსნარებისგან განსხვავებით უწოდებენ ჭეშმარიტს. ჭეშმარიტ ხსნარებს ახასიათებთ შემადგენლობის ერთგვაროვნება და გამხსნელსა და გამხსნელს შორის ინტერფეისის არარსებობა. გახსნილი ნაწილაკების (იონების და მოლეკულების) ზომა 10-9 მ-ზე ნაკლებია.
BMC-ების უმეტესობა არის პოლიმერები, რომელთა მოლეკულები (მაკრომოლეკულები) შედგება დიდი რაოდენობით განმეორებადი ჯგუფებისგან ან მონომერული ერთეულებისგან, რომლებიც ერთმანეთთან არის დაკავშირებული ქიმიური ბმებით. IUD ხსნარებს პოლიელექტროლიტური ხსნარები ეწოდება.
პოლიელექტროლიტებს მიეკუთვნება პოლიმჟავები (ჰეპარინი, პოლიადენილის მჟავა, პოლიასპარტინის მჟავა და სხვ.), პოლიბაზები (პოლილიზინი), პოლიამფოლიტები (ცილები, ნუკლეინის მჟავები).
IUD ხსნარების თვისებები მნიშვნელოვნად განსხვავდება NMS ხსნარების თვისებებისგან. ამიტომ, ისინი განიხილება ცალკეულ განყოფილებაში. ეს თავი ეძღვნება დაბალი მოლეკულური წონის ელექტროლიტების, ამფოლიტების და არაელექტროლიტების ხსნარებს.
10. წყალი, როგორც გამხსნელი
ჩვენს პლანეტაზე ყველაზე გავრცელებული გამხსნელი წყალია. საშუალოდ 70 კგ წონის ადამიანის სხეული შეიცავს დაახლოებით 40 კგ წყალს. ამ შემთხვევაში, დაახლოებით 25 კგ წყალი არის უჯრედების შიგნით არსებული სითხე, ხოლო 15 კგ არის უჯრედგარე სითხე, რომელიც მოიცავს სისხლის პლაზმას, უჯრედშორის სითხეს, ცერებროსპინალურ სითხეს, თვალშიდა სითხეს და კუჭ-ნაწლავის ტრაქტის თხევად შიგთავსს. ცხოველურ და მცენარეულ ორგანიზმებში წყალი ჩვეულებრივ შეადგენს 50%-ზე მეტს, ზოგიერთ შემთხვევაში კი წყლის შემცველობა 90-95%-ს აღწევს.
მისი ანომალიური თვისებების გამო წყალი უნიკალური გამხსნელია, რომელიც შესანიშნავად არის ადაპტირებული სიცოცხლისთვის.
პირველ რიგში, წყალი კარგად ხსნის იონურ და ბევრ პოლარულ ნაერთს. წყლის ეს თვისება დიდწილად განპირობებულია მისი მაღალი დიელექტრიკული მუდმივით (78,5).
წყალში ადვილად ხსნადი ნივთიერებების კიდევ ერთი დიდი კლასი მოიცავს პოლარულ ორგანულ ნაერთებს, როგორიცაა შაქარი, ალდეჰიდები, კეტონები და ალკოჰოლები. წყალში მათი ხსნადობა აიხსნება წყლის მოლეკულების ტენდენციით, შექმნან პოლარული ბმები ამ ნივთიერებების პოლარულ ფუნქციურ ჯგუფებთან, მაგალითად, ალკოჰოლისა და შაქრის ჰიდროქსილის ჯგუფებთან ან ალდეჰიდების და კეტონების კარბონილის ჯგუფის ჟანგბადის ატომთან. ქვემოთ მოცემულია წყალბადის ბმების მაგალითები, რომლებიც მნიშვნელოვანია ბიოლოგიურ სისტემებში ნივთიერებების ხსნადობისთვის. მაღალი პოლარობის გამო წყალი იწვევს ნივთიერებების ჰიდროლიზს.
ვინაიდან წყალი წარმოადგენს ორგანიზმის შიდა გარემოს ძირითად ნაწილს, ის უზრუნველყოფს ორგანიზმში საკვები ნივთიერებებისა და მეტაბოლური პროდუქტების შეწოვის პროცესებს, მოძრაობას.
უნდა აღინიშნოს, რომ წყალი არის ნივთიერებების, კერძოდ, გლუკოზის ბიოლოგიური დაჟანგვის საბოლოო პროდუქტი. ამ პროცესების შედეგად წყლის წარმოქმნას თან ახლავს დიდი რაოდენობით ენერგიის გამოყოფა - დაახლოებით 29 კჯ/მოლი.
ასევე მნიშვნელოვანია წყლის სხვა ანომალიური თვისებები: მაღალი ზედაპირული დაძაბულობა, დაბალი სიბლანტე, მაღალი დნობის და დუღილის წერტილები და უფრო მაღალი სიმკვრივე თხევად, ვიდრე მყარ მდგომარეობაში.
წყალს ახასიათებს ასოციაციების არსებობა - წყალბადის ბმებით დაკავშირებული მოლეკულების ჯგუფები.
წყლისადმი მიდრეკილების მიხედვით, ხსნადი ნაწილაკების ფუნქციური ჯგუფები იყოფა ჰიდროფილებად (წყლის მომზიდველად), ადვილად ხსნად წყალში, ჰიდროფობებად (მოგერიებული წყალი) და დიფილური.
ჰიდროფილურ ჯგუფებს მიეკუთვნება პოლარული ფუნქციური ჯგუფები: ჰიდროქსილ -OH, ამინო -NH 2, თიოლ -SH, კარბოქსილ -COOH. ჰიდროფობიურ ჯგუფებში შედის არაპოლარული ჯგუფები, მაგალითად ნახშირწყალბადის რადიკალები: CH3-(CH2) p -, C6H5-. Hyphilic მოიცავს ნივთიერებებს (ამინომჟავები, ცილები), რომელთა მოლეკულები შეიცავს როგორც ჰიდროფილურ ჯგუფს (-OH, -NH 2, -SH, -COOH) და ჰიდროფობიურ ჯგუფებს: (CH 3 - (CH 2) p, - C 6 H 5 -).
როდესაც დიფილური ნივთიერებები იშლება, წყლის სტრუქტურა იცვლება ჰიდროფობიურ ჯგუფებთან ურთიერთქმედების შედეგად. ჰიდროფობიურ ჯგუფებთან ახლოს მდებარე წყლის მოლეკულების მოწესრიგების ხარისხი იზრდება და წყლის მოლეკულების კონტაქტი ჰიდროფობიურ ჯგუფებთან მცირდება მინიმუმამდე. ჰიდროფობიური ჯგუფები, როდესაც დაკავშირებულია, უბიძგებს წყლის მოლეკულებს მათი მდებარეობიდან.
11. ხსნარის კონცენტრაცია და მისი გამოხატვის მეთოდები
გამოსავალიცვლადი შემადგენლობის ერთგვაროვან სისტემას, რომელიც შედგება ორი ან მეტი ნივთიერებისგან, რომელიც წონასწორობის მდგომარეობაშია, ეწოდება. ნივთიერებებს, რომლებიც ქმნიან ხსნარს, ეწოდება ხსნარის კომპონენტები.
ხსნარის მნიშვნელოვანი მახასიათებელია მისი კონცენტრაცია. ეს მნიშვნელობა განსაზღვრავს ხსნარის ბევრ თვისებას.
ნივთიერების კონცენტრაცია(ხსნარის კომპონენტი) არის რაოდენობა, რომელიც იზომება გახსნილი ნივთიერების რაოდენობით, რომელიც შეიცავს ხსნარის ან გამხსნელის გარკვეულ მასას ან მოცულობას.
კონცენტრაციის გამოხატვის ყველაზე ხშირად გამოყენებული გზებია: მასის წილი, მოლური კონცენტრაცია, მოლური ეკვივალენტური კონცენტრაცია, მოლური ფრაქცია, მოცულობითი ფრაქცია, ტიტრი.
მასური წილი ვ(X) გამოიხატება ერთეულის ნაწილებში, პროცენტში (%), ppm (პროცენტის მეათასედი) და ნაწილებში მილიონზე (ppm). მასის წილი გამოითვლება ფორმულების გამოყენებით:
W (X) = m (X) / მ (ზომა),
W (X) = m (X) / მ (ზომა) × 100%,
სადაც m (X) არის მოცემული X კომპონენტის (გახსნილი ნივთიერების) მასა, კგ (გ);
მ (ხსნარი) – ხსნარის მასა, კგ (გ).
მოლური კონცენტრაცია გამოიხატება მოლ/მ3, მოლ/დმ3, მოლ/სმ3, მოლ/ლ, მოლ/მლ. მედიცინაში სასურველია მოლ/ლ ერთეულების გამოყენება. მოლური კონცენტრაცია გამოითვლება ფორმულით:
C(X) = n (X) /ვ(p-p) = m (X) /მ(X)× ვ(rr) ,
სადაც n (X) არის სისტემაში გახსნილი ნივთიერების რაოდენობა, მოლი;
მ(X) – გახსნილი ნივთიერების მოლური მასა, კგ/მოლი ან გ/მოლი;
m (X) – გახსნილი ნივთიერების მასა, კგ ან გ, შესაბამისად;
ვ(ხსნარი) – ხსნარის მოცულობა, ლ. მოლარული კონცენტრაცია
b (X) გამოიხატება მოლ/კგ ერთეულებში.
ჩაწერის ფორმა, მაგალითად: b(HCl) = 0,1 მოლ/კგ. გამოთვალეთ მოლური კონცენტრაცია ფორმულის გამოყენებით:
b (X) = n (X) / m (r-l) = m (X) /მ(X) × m (განზომილება)
სადაც m (ხსნარი) არის გამხსნელის მასა, კგ.
ქიმიაში ფართოდ გამოიყენება ეკვივალენტური და ეკვივალენტური ფაქტორის ცნება.
ექვივალენტიეწოდება X ნივთიერების რეალურ ან პირობით ნაწილაკს, რომელიც მოცემულ მჟავა-ტუტოვანი რეაქციაში უდრის წყალბადის ერთ იონს ან მოცემულ რედოქს რეაქციაში - ერთ ელექტრონს, ან მარილებს შორის მოცემულ გაცვლის რეაქციაში - მუხტის ერთეულს.
მოცულობითი წილადი f ( X) გამოიხატება ერთეულის წილადებში ან პროცენტულად, გამოითვლება ფორმულის გამოყენებით:
F (X) = ვ(X) /ვ(rr)
სად ვ(X) არის ხსნარის მოცემული X კომპონენტის მოცულობა;
ვ(р-р) – გამხსნელის მთლიანი მოცულობა.
ხსნარის ტიტრი აღინიშნება T-ით (X), საზომი ერთეულია კგ/სმ3, გ/სმ3, გ/მლ. ხსნარის ტიტრი შეიძლება გამოითვალოს ფორმულის გამოყენებით:
T (X) = m (X) /ვ(rr)
სადაც m (X) არის ნივთიერების მასა, ჩვეულებრივ g;
ვ(ხსნარი) – ხსნარის მოცულობა, მლ.
12. დაშლის პროცესი
დაშლის პროცესის ბუნება რთულია. ბუნებრივია, ჩნდება კითხვა, რატომ არის ზოგიერთი ნივთიერება ადვილად ხსნადი ზოგიერთ გამხსნელში და ცუდად ხსნადი ან პრაქტიკულად უხსნადი ზოგში.
ხსნარების ფორმირება ყოველთვის დაკავშირებულია გარკვეულ ფიზიკურ პროცესებთან. ერთ-ერთი ასეთი პროცესია ხსნარისა და გამხსნელის დიფუზია. დიფუზიის წყალობით, ნაწილაკები (მოლეკულები, იონები) ამოღებულია გამხსნელი ნივთიერების ზედაპირიდან და თანაბრად ნაწილდება გამხსნელის მთელ მოცულობაში. სწორედ ამიტომ, მორევის არარსებობის შემთხვევაში, დაშლის სიჩქარე დამოკიდებულია დიფუზიის სიჩქარეზე. თუმცა, მხოლოდ ფიზიკური პროცესები ვერ ხსნის ნივთიერებების არათანაბარი ხსნადობას სხვადასხვა გამხსნელებში.
დიდი რუსი ქიმიკოსი D.I. მენდელეევი (1834-1907) თვლიდა, რომ ქიმიური პროცესები მნიშვნელოვან როლს თამაშობენ დაშლაში. მან დაამტკიცა გოგირდმჟავას ჰიდრატების არსებობა
H 2 SO 4 H 2 O, H 2 SO 4 2H 2 O, H 2 SO 4 4H 2 O და ზოგიერთი სხვა ნივთიერება, მაგალითად, C 2 H 5 OH3H 2 O. ამ შემთხვევებში დაშლას თან ახლავს წარმოქმნა. ქიმიური ბმები გახსნილი ნივთიერებისა და გამხსნელის ნაწილაკებს შორის. ამ პროცესს სოლვაცია ეწოდება იმ კონკრეტულ შემთხვევაში, როდესაც გამხსნელი წყალია, მას ჰიდრატაცია ეწოდება.
როგორც დადგენილია, გახსნილი ნივთიერების ბუნებიდან გამომდინარე, ფიზიკური ურთიერთქმედების შედეგად შეიძლება წარმოიქმნას სოლვატები (ჰიდრატები): იონ-დიპოლური ურთიერთქმედება (მაგალითად, იონური სტრუქტურის მქონე ნივთიერებების დაშლისას (NaCI და ა.შ. დიპოლ-დიპოლური ურთიერთქმედება – მოლეკულური სტრუქტურის მქონე ნივთიერებების (ორგანული ნივთიერებების) დაშლისას.
ქიმიური ურთიერთქმედება ხორციელდება დონორ-აქცეპტორული ობლიგაციების მეშვეობით. აქ გახსნილი ნივთიერების იონები არიან ელექტრონების მიმღებები, ხოლო გამხსნელები (H 2 O, NH 3) არიან ელექტრონების დონორები (მაგალითად, აკვა კომპლექსების წარმოქმნა), ასევე წყალბადის ბმების წარმოქმნის შედეგად (მაგ. მაგალითად, ალკოჰოლის წყალში დაშლა).
გახსნილი ნივთიერების გამხსნელთან ქიმიური ურთიერთქმედების მტკიცებულება არის თერმული ეფექტები და ფერის ცვლილებები, რომლებიც თან ახლავს დაშლას.
მაგალითად, როდესაც კალიუმის ჰიდროქსიდი იხსნება წყალში, სითბო გამოიყოფა:
KOH + xH 2 O = KOH (H 2 O) x; ΔН° sol = –55 კჯ/მოლ.
და როდესაც ნატრიუმის ქლორიდი იხსნება, სითბო შეიწოვება:
NaCI + xH 2 O = NaCI (H 2 O) x; ΔН° sol = +3,8 კჯ/მოლ.
სითბოს, რომელიც გამოიყოფა ან შეიწოვება, როდესაც ნივთიერების 1 მოლი იხსნება ხსნარის სითბო Q ხსნარი
თერმოდინამიკის პირველი კანონის მიხედვით
Q ამოხსნა = ΔН ხსნარი ,
სადაც ΔН დაშლა არის ენთალპიის ცვლილება ნივთიერების მოცემული რაოდენობის დაშლისას.
წყალში თეთრი უწყლო სპილენძის სულფატის დაშლა იწვევს ინტენსიური ლურჯი ფერის გამოჩენას. სოლვატების წარმოქმნა, ფერის ცვლილებები, თერმული ეფექტები, ისევე როგორც რიგი სხვა ფაქტორები, მიუთითებს ხსნარის კომპონენტების ქიმიური ბუნების ცვლილებაზე მისი წარმოქმნის დროს.
ამრიგად, თანამედროვე კონცეფციების შესაბამისად, დაშლა არის ფიზიკურ-ქიმიური პროცესი, რომელშიც როლს ასრულებს როგორც ფიზიკური, ასევე ქიმიური ტიპის ურთიერთქმედება.
13. დაშლის პროცესის თერმოდინამიკა
თერმოდინამიკის მეორე კანონის მიხედვით, p, T = const-ზე, ნივთიერებები შეიძლება სპონტანურად დაითხოვონ ნებისმიერ გამხსნელში, თუ ამ პროცესის შედეგად სისტემის გიბსის ენერგია მცირდება, ე.ი.
ΔG = (ΔН – TΔS)< 0.
ΔH სიდიდეს ეწოდება ენთალპიის ფაქტორი, ხოლო TΔS მნიშვნელობა ეწოდება დაშლის ენტროპიის კოეფიციენტს.
როდესაც თხევადი და მყარი ნივთიერებები იხსნება, სისტემის ენტროპია ჩვეულებრივ იზრდება (ΔS > 0), რადგან გახსნილი ნივთიერებები გადადიან უფრო მოწესრიგებული მდგომარეობიდან ნაკლებად მოწესრიგებულში. ენტროპიის ფაქტორის წვლილი, რომელიც ხელს უწყობს ხსნადობის ზრდას, განსაკუთრებით შესამჩნევია მომატებულ ტემპერატურაზე, რადგან ამ შემთხვევაში T ფაქტორი დიდია და TΔS პროდუქტის აბსოლუტური მნიშვნელობა ასევე დიდია და გიბსის ენერგიის შემცირება. შესაბამისად იზრდება.
როდესაც აირები იხსნება სითხეში, სისტემის ენტროპია ჩვეულებრივ მცირდება (ΔS< 0), так как растворяемое вещество из менее упорядоченного состояния (боль–шого объема) переходит в более упорядоченное (ма–лый объем). Снижение температуры благоприятствует растворению газов, потому что в этом случае множи–тель Т мал и абсолютное значение произведения TΔS будет тем меньше, а убыль энергии Гиббса тем больше, чем ниже значение Т.
ხსნარის წარმოქმნის დროს, სისტემის ენთალპია ასევე შეიძლება გაიზარდოს (NaCI) ან შემცირდეს (KOH). დაშლის პროცესის ენთალპიის ცვლილება უნდა ჩაითვალოს ჰესის კანონის შესაბამისად, როგორც დაშლის პროცესის თანმხლები ყველა პროცესის ენდოთერმული და ეგზოთერმული წვლილის ალგებრული ჯამი. ეს არის ნივთიერებების კრისტალური ბადის განადგურების ენდოთერმული ეფექტები, მოლეკულების ობლიგაციების გაწყვეტა, გამხსნელის საწყისი სტრუქტურის განადგურება და სხვადასხვა ურთიერთქმედების პროდუქტების წარმოქმნის ეგზოთერმული ეფექტები, მათ შორის სოლვატები.
წარმოდგენის სიმარტივისთვის, ხსნარის ΔH დაშლის ენთალპიის ზრდა შეიძლება წარმოდგენილი იყოს, როგორც სხვაობა Ecr ენერგიას, რომელიც დახარჯულია ხსნარის ბროლის გისოსების განადგურებაზე და E sol ენერგიას შორის, რომელიც გამოიყოფა ნაწილაკების ხსნარის დროს. გამხსნელის მოლეკულების მიერ გამხსნელი. სხვა სიტყვებით რომ ვთქვათ, ენთალპიის ცვლილება არის ენთალპიის ცვლილების ალგებრული ჯამი ΔН cr კრისტალური ბადის განადგურების შედეგად და ენთალპიის ΔН sol-ის ცვლილების შედეგად გამხსნელის ნაწილაკებით ხსნარებით:
ΔН sol = ΔН cr + ΔН sol,
სადაც ΔН დისტანცია არის ენთალპიის ცვლილება დაშლის დროს.
თუმცა, ორგანულ გამხსნელებში კეთილშობილი აირების დაშლას ხშირად თან ახლავს სითბოს შეწოვა, მაგალითად, ჰელიუმი და ნეონი აცეტონში, ბენზოლში, ეთანოლში და ციკლოჰექსანში.
მოლეკულური კრისტალური სტრუქტურისა და სითხეების მყარი ნივთიერებების დაშლისას, მოლეკულური ბმები არ არის ძალიან ძლიერი და, შესაბამისად, ჩვეულებრივ ΔH sol > ΔH cr ეს იწვევს იმ ფაქტს, რომ, მაგალითად, სპირტებისა და შაქრების დაშლა ეგზოთერმული პროცესია (ΔH sol< 0).
იონური გისოსებით მყარი ნივთიერებების დაშლისას ენერგიის თანაფარდობა E cr და E sol შეიძლება განსხვავებული იყოს. თუმცა, უმეტეს შემთხვევაში, იონების ხსნარის დროს გამოთავისუფლებული ენერგია არ ანაზღაურებს კრისტალური ბადის განადგურებაზე დახარჯულ ენერგიას, შესაბამისად, დაშლის პროცესი ენდოთერმულია.
ამრიგად, თერმოდინამიკური მონაცემები შესაძლებელს ხდის სხვადასხვა ნივთიერების სპონტანური დაშლის პროგნოზირებას თერმოდინამიკის პირველი და მეორე კანონების საფუძველზე.
14. ხსნადობა
თუ ხსნადი ნივთიერება შედის კონტაქტში გამხსნელთან, ხსნარის წარმოქმნის პროცესი ხშირ შემთხვევაში ხდება სპონტანურად, სანამ არ მიიღწევა გარკვეული შემზღუდველი კონცენტრაცია (გაჯერება ხდება). ეს ხდება წონასწორობის მიღწევისას, როდესაც ენთალპიისა და ენტროპიის ფაქტორები თანაბარი ხდება, ანუ ΔН = TΔS.
მაგალითად, როდესაც კრისტალები შეჰყავთ სითხეში, მოლეკულები ან იონები ბროლის ზედაპირიდან გადადიან ხსნარში. დიფუზიის გამო, ნაწილაკები თანაბრად ნაწილდება გამხსნელის მთელ მოცულობაში. დაშლა გრძელდება გაჯერებამდე.
ზეგაჯერებული ხსნარი არის ხსნარი, რომლის კონცენტრაცია უფრო მაღალია, ვიდრე გაჯერებულში.
გაჯერებულზე დაბალი კონცენტრაციის მქონე ხსნარს უჯერი ეწოდება.
ნივთიერების უნარს, დაითხოვოს კონკრეტულ გამხსნელში, ეწოდება ხსნადობა. რიცხობრივად, ნივთიერების ხსნადობა უდრის მისი გაჯერებული ხსნარის კონცენტრაციას.
ხსნადობა შეიძლება გამოიხატოს იმავე ერთეულებში, როგორც კონცენტრაცია, მაგალითად, ხსნარის ოდენობით, რომელიც შეიცავს 1 ლიტრ გაჯერებულ ხსნარში, მოლ/ლ, ან ხსნარის მასის მიხედვით 100 გ გაჯერებულ ხსნარში. ხსნადობის ერთეულია გრამი 100 გ გამხსნელზე. შესაბამის მნიშვნელობას ეწოდება ხსნადობის კოეფიციენტი.
ხსნადობა დამოკიდებულია გამხსნელისა და გამხსნელის ბუნებაზე, ტემპერატურაზე, წნევაზე და ხსნარში სხვა ნივთიერებების არსებობაზე.
14b გავლენა კომპონენტების ბუნების ხსნადობაზე
ნივთიერებების დაშლის უნარი განისაზღვრება ხსნარის X1 და X2 კომპონენტების მოლეკულებს შორის ურთიერთქმედების ძალების ბუნებით: გამხსნელი - გამხსნელი (X 1 - X 1), გამხსნელი - გამხსნელი (X 2 - X 2), გამხსნელი - გამხსნელი ( X 1 – X 2) (წერტილები მიუთითებენ მოლეკულურ ბმებზე).
ნივთიერებების ხსნადობა მერყეობს ფართო საზღვრებში. მაგალითები აჩვენებს სხვადასხვა მარილების ხსნადობას ერთსა და იმავე გამხსნელში (წყალში) და ერთი და იმავე ნივთიერების (AgNO 3) ხსნადობას სხვადასხვა გამხსნელებში.
იონური ტიპის ბმის მქონე ნივთიერებები და პოლარული მოლეკულებისგან შემდგარი ნივთიერებები უკეთ იხსნება პოლარულ გამხსნელებში, როგორიცაა წყალი და ალკოჰოლი. ამ გამხსნელებს ახასიათებთ მაღალი დიელექტრიკული მუდმივი.
ნივთიერებების მაღალი ხსნადობა საკმაოდ ხშირად განპირობებულია მოლეკულური, კერძოდ წყალბადის ბმების წარმოქმნით. ამრიგად, წყლისა და ალკოჰოლის შეუზღუდავი ურთიერთხსნადობა აიხსნება წყალბადის ბმების წარმოქმნით წყალსა და ალკოჰოლის მოლეკულებს შორის, ხოლო AgcI კრისტალების დაშლა ამიაკის წყალხსნარში აიხსნება ქიმიური დონორ-მიმღები ბმის წარმოქმნით. ვერცხლის იონი ამიაკის მოლეკულებით (AgCI წყალში პრაქტიკულად უხსნადი). ამავე მიზეზით, პირიდინი, გამხსნელი დაბალი დიელექტრიკული მუდმივით, ავლენს ძალიან მაღალ ხსნადობას.
ვინაიდან ხსნადობა ახასიათებს ნამდვილ წონასწორობას, გარე პირობების გავლენა ამ მდგომარეობაზე (წნევა, ტემპერატურა) ხარისხობრივად შეიძლება შეფასდეს ლე შატელიეს პრინციპის გამოყენებით. ასეთი შეფასებები აუცილებელია ღრმა ზღვის დაივინგის პრაქტიკაში, ცხელ მაღაზიებში მუშაობისას და ა.შ.
15. აირების ხსნადობა სითხეებში. ჰენრი-დალტონისა და სეჩენოვის კანონები
სითხეებში აირების დაშლა თითქმის ყოველთვის თან ახლავს სითბოს გამოყოფას. მაშასადამე, აირების ხსნადობა მცირდება ტემპერატურის მატებასთან ერთად ლე შატელიეს პრინციპის მიხედვით. ეს ნიმუში ხშირად გამოიყენება წყლიდან გახსნილი გაზების მოსაშორებლად (მაგალითად, C0 2 ) ხარშვით. ზოგჯერ გაზის დაშლას თან ახლავს სითბოს შეწოვა (მაგალითად, კეთილშობილი აირების დაშლა ზოგიერთ ორგანულ გამხსნელებში). ამ შემთხვევაში ტემპერატურის მატება ზრდის გაზის ხსნადობას.
გაზი განუსაზღვრელი ვადით არ იხსნება სითხეში. გაზის გარკვეულ კონცენტრაციაზე X, წონასწორობა დამყარებულია:
როდესაც გაზი იხსნება სითხეში, ხდება სისტემის მოცულობის მნიშვნელოვანი შემცირება. ამიტომ, წნევის მატებამ, ლე შატელიეს პრინციპის მიხედვით, უნდა გამოიწვიოს წონასწორობის მარჯვნივ გადანაცვლება, ანუ აირის ხსნადობის ზრდა. თუ გაზი ოდნავ ხსნადია მოცემულ სითხეში და წნევა დაბალია, მაშინ გაზის ხსნადობა მისი წნევის პროპორციულია. ეს დამოკიდებულება გამოიხატება ჰენრის კანონით (1803): გაზის რაოდენობა, რომელიც გახსნილია მოცემულ ტემპერატურაზე სითხის გარკვეულ მოცულობაში, წონასწორობაში, პირდაპირპროპორციულია გაზის წნევისა.
ჰენრის კანონი შეიძლება დაიწეროს შემდეგი ფორმით:
თან(X) = კ r(X) × P(X)
სად არის გაზის კონცენტრაცია გაჯერებულ ხსნარში, მოლ/ლ;
P (X) – გაზის წნევა X ხსნარის ზემოთ, Pa;
კ r(X) - ჰენრის მუდმივი გაზისთვის X, mol×l-1 × Pa -1.
ჰენრის მუდმივი დამოკიდებულია გაზის ბუნებაზე, გამხსნელზე და ტემპერატურაზე.
ჰენრის კანონი მოქმედებს მხოლოდ შედარებით განზავებული ხსნარებისთვის, დაბალი წნევის დროს და ქიმიური ურთიერთქმედების არარსებობის შემთხვევაში გახსნილი აირის მოლეკულებსა და გამხსნელს შორის.
ჰენრის კანონი დალტონის ზოგადი კანონის განსაკუთრებული შემთხვევაა. თუ ვსაუბრობთ არა ერთი აირისებრი ნივთიერების, არამედ აირების ნარევის დაშლაზე, მაშინ თითოეული კომპონენტის ხსნადობა ემორჩილება დალტონის კანონს: აირის ნარევის თითოეული კომპონენტის ხსნადობა მუდმივ ტემპერატურაზე პროპორციულია ნაწილობრივი წნევისა. კომპონენტი სითხის ზემოთ და არ არის დამოკიდებული ნარევის მთლიან წნევაზე და სხვა კომპონენტების ინდივიდუალურობაზე.
სხვა სიტყვებით რომ ვთქვათ, აირების ნარევის სითხეში გახსნის შემთხვევაში, ნაწილობრივი წნევა p ჩანაცვლებულია ჰენრის კანონის მათემატიკური გამოხატულებით! ამ კომპონენტის.
კომპონენტის ნაწილობრივი წნევა გაგებულია, როგორც კომპონენტის წნევის წილი გაზის ნარევის მთლიანი წნევისგან:
R i / R სულ
კომპონენტის ნაწილობრივი წნევა გამოითვლება ფორმულის გამოყენებით
რუსმა ექიმ-ფიზიოლოგმა ი.მ.სეჩენოვმა (1829-1905) სითხეებში აირების ხსნადობის შესწავლისას ელექტროლიტების თანდასწრებით დაადგინა შემდეგი ნიმუში (სეჩენოვის კანონი): სითხეებში აირების ხსნადობა ელექტროლიტების თანდასწრებით მცირდება; გაზები გამოიყოფა.
Р i = Р სულ ×(X i)
სადაც p i არის X i კომპონენტის ნაწილობრივი წნევა;
პტოტი – აირის ნარევის მთლიანი წნევა;
x(X i) – i-ე კომპონენტის მოლური წილი.
ელექტროლიტების თანდასწრებით სითხეებში აირების ხსნადობის შესწავლისას რუსმა ექიმმა და ფიზიოლოგმა ი.მ. სეჩენოვმა (1829-1905) დაადგინა შემდეგი ნიმუში (სეჩენოვის კანონი): სითხეებში აირების ხსნადობა ელექტროლიტების თანდასწრებით მცირდება; გაზები გამოიყოფა.
მათი აგრეგაციის მდგომარეობის მიხედვით, ხსნარები შეიძლება იყოს აირისებრი, თხევადი და მყარი.
ნებისმიერი ხსნარი შედგება გახსნილი ნივთიერებებისა და გამხსნელისაგან, თუმცა ეს ცნებები გარკვეულწილად თვითნებურია. მაგალითად, ალკოჰოლისა და წყლის თანაფარდობიდან გამომდინარე, ეს სისტემა შეიძლება იყოს ალკოჰოლის ხსნარი წყალში ან წყალი ალკოჰოლში.
როგორც წესი, გამხსნელად ითვლება ის კომპონენტი, რომელიც ხსნარში არის იმავე აგრეგაციის მდგომარეობაში, როგორც დაშლამდე.
ხსნარების შესწავლა განსაკუთრებით საინტერესოა ექიმებისთვის, რადგან ყველაზე მნიშვნელოვანი ბიოლოგიური სითხეები - სისხლი, ლიმფა, შარდი, ნერწყვი, ოფლი - არის მარილების, ცილების, ნახშირწყლების, ლიპიდების ხსნარები წყალში.
ბიოლოგიური სითხეები მონაწილეობენ საკვები ნივთიერებების (ცხიმები, ამინომჟავები, ჟანგბადი), წამლების გადატანაში ორგანოებსა და ქსოვილებში, აგრეთვე მეტაბოლიტების (შარდოვანა, ბილირუბინი, ნახშირორჟანგი და ა.შ.) ორგანიზმიდან გამოდევნაში. სისხლის პლაზმა არის უჯრედების - ლიმფოციტების, ერითროციტების, თრომბოციტების საშუალება.
სხეულის თხევად მედიაში შენარჩუნებულია მუდმივი მჟავიანობა, მარილების და ორგანული ნივთიერებების კონცენტრაცია. ამ მუდმივობას კონცენტრაციის ჰომეოსტაზს უწოდებენ.
ხსნარების კლასიფიკაცია
ნივთიერებების ხსნარებს, რომელთა მოლური მასა 5000 გ/მოლზე ნაკლებია, ეწოდება დაბალი მოლეკულური წონის ნაერთების ხსნარებს (LMC), ხოლო ნივთიერებების ხსნარებს, რომელთა მოლური მასა 5000 გ/მოლზე მეტია, ეწოდება მაღალი მოლეკულური წონის ნაერთების ხსნარებს. HMC).
ელექტროლიტური დისოციაციის არსებობის ან არარსებობის მიხედვით, NMS ხსნარები იყოფა ორ კლასად - ელექტროლიტების და არაელექტროლიტების ხსნარებად.
ელექტროლიტური ხსნარები არის მარილების, მჟავების, ფუძეების და ამფოლიტების ხსნარები, რომლებიც იშლება იონებად. მაგალითად, KNO 3, HCl, KOH, Al(OH) 3, გლიცინის ხსნარები.
ელექტროლიტური ხსნარების ელექტრული გამტარობა უფრო მაღალია, ვიდრე გამხსნელის.
არაელექტროლიტების ხსნარები არის ნივთიერებების ხსნარები, რომლებიც პრაქტიკულად არ იშლება წყალში. მაგალითად, საქაროზის, გლუკოზის, შარდოვანას ხსნარები. არაელექტროლიტური ხსნარების ელექტრული გამტარობა ოდნავ განსხვავდება გამხსნელისგან.
NMS-ის ხსნარებს (ელექტროლიტები და არაელექტროლიტები) კოლოიდური ხსნარებისგან განსხვავებით უწოდებენ ჭეშმარიტს. ჭეშმარიტ ხსნარებს ახასიათებთ შემადგენლობის ერთგვაროვნება და გამხსნელსა და გამხსნელს შორის ინტერფეისის არარსებობა. გახსნილი ნაწილაკების (იონების და მოლეკულების) ზომა 10-9 მ-ზე ნაკლებია.
BMC-ების უმეტესობა არის პოლიმერები, რომელთა მოლეკულები (მაკრომოლეკულები) შედგება დიდი რაოდენობით განმეორებადი ჯგუფებისგან ან მონომერული ერთეულებისგან, რომლებიც ერთმანეთთან არის დაკავშირებული ქიმიური ბმებით. IUD ხსნარებს პოლიელექტროლიტური ხსნარები ეწოდება.
პოლიელექტროლიტებს მიეკუთვნება პოლიმჟავები (ჰეპარინი, პოლიადენილის მჟავა, პოლიასპარტინის მჟავა და სხვ.), პოლიბაზები (პოლილიზინი), პოლიამფოლიტები (ცილები, ნუკლეინის მჟავები).
IUD ხსნარების თვისებები მნიშვნელოვნად განსხვავდება NMS ხსნარების თვისებებისგან. ამიტომ, ისინი განიხილება ცალკეულ განყოფილებაში. ეს თავი ეძღვნება დაბალი მოლეკულური წონის ელექტროლიტების, ამფოლიტების და არაელექტროლიტების ხსნარებს.
გადაწყვეტილებები შეიძლება იყოს თხევადი, მყარი და აირი .
გამხსნელიშეიძლება იყოს მყარი, თხევადი და აირი.
თითქმის ყველა აირი იხსნება ერთმანეთში. სითხეები, აირები და მყარი ნივთიერებები იხსნება სითხეებში. მყარ ნაწილებში იხსნება მხოლოდ მყარი. მყარ ხსნარებში იქმნება მყარი კომპონენტების ერთგვაროვანი სისტემა.
გაზის ხსნარებიარის გაზების, თხევადი და მყარი ხსნარები გაზებში. ნულოვანი წნევის ზღვარში ნებისმიერი რეალური გაზი წარმოადგენს ერთმანეთისგან დამოუკიდებელ ნაწილაკების სისტემას, ე.ი. აქვს იდეალური სისტემის მახასიათებლები. ამ აირების ნარევი, ე.წ იდეალური გაზი, ემორჩილება დალტონის კანონი:(სად რ- მთლიანი წნევა; რ მე- ნაწილობრივი წნევა მეე კომპონენტი). წნევის მატებასთან ერთად ჩნდება ურთიერთქმედება ნაწილაკებს შორის, შემდეგ კი რეალური აირების, თხევადი ორთქლისა და მყარი ნივთიერებების ნარევი განიხილება როგორც აირის ხსნარი.
ყველაზე გავრცელებული თხევადიკერძოდ, წყალხსნარები. „თხევადი აირის“ და „თხევად-მყარი“ ხსნარების შემთხვევაში, გამხსნელად, როგორც წესი, ითვლება სითხე. თხევად-თხევადი ხსნარებში, გამხსნელი არის კომპონენტი, რომელიც ჭარბობს სხვა კომპონენტებთან შედარებით, რომელსაც ეწოდება ხსნადი.
ხსნადი ნივთიერების თვისებებიდან გამომდინარე, განასხვავებენ მათ თხევადი ხსნარებიარა ელექტროლიტები, ელექტროლიტები და მაღალი მოლეკულური წონის ნაერთები(საზღვაო ფლოტი). ეს უკანასკნელი განხილვის საგანია კოლოიდების ქიმიაში.
გამხსნელის მოცემულ მოცულობაში გახსნილი ნივთიერების რაოდენობას ეწოდება კონცენტრაცია.
კონცენტრაციის გამოხატვის გზები:
1)მოლარული კონცენტრაცია M(ან მოლარობა) – ნივთიერების მოლების რაოდენობა გახსნილი 1 მ3 (ან ლიტრ) ხსნარში:
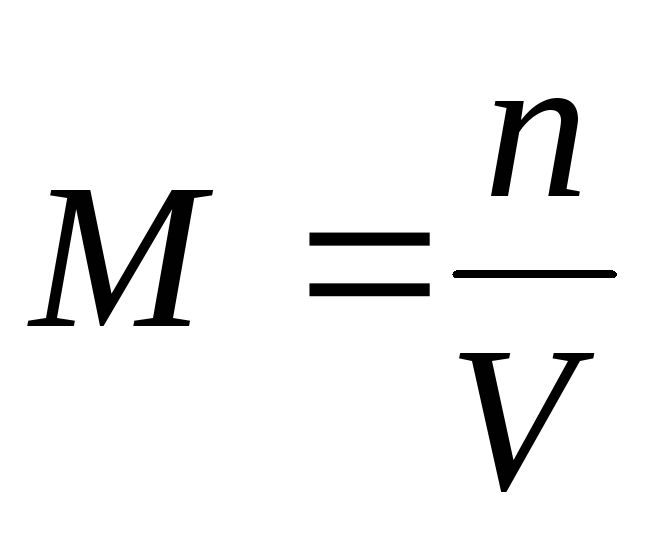
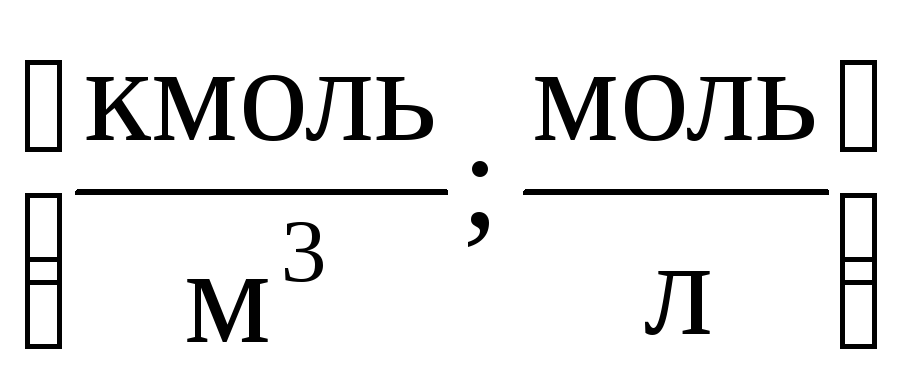
2)მოლარული კონცენტრაციათ (ან მოლალობა) – გახსნილი ნივთიერების მოლების რაოდენობა 1 კგ ან 1000 გ გამხსნელში:
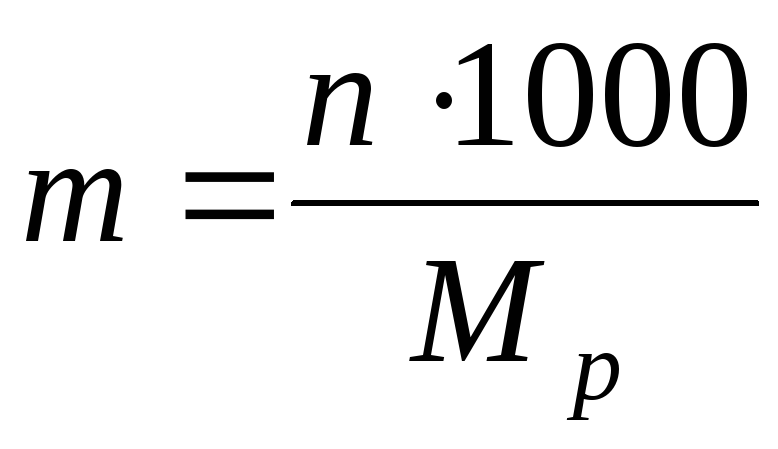

სად მ გვ - გამხსნელის მასა.
3) პროცენტული კონცენტრაცია ω განისაზღვრება ნივთიერების გრამების რაოდენობით 100 გ (წონით) ან 100 მლ (მოცულობით) ხსნარში:
 ან
ან 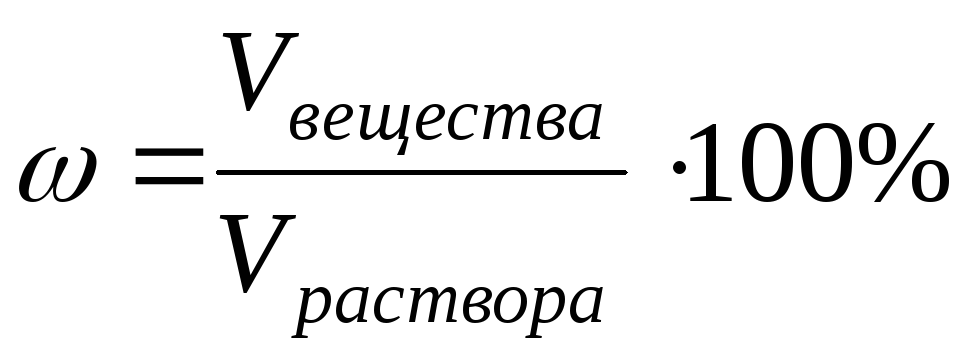
4)მოლური ფრაქციან- ერთი კომპონენტის n მოლის რაოდენობის თანაფარდობა ხსნარის ყველა კომპონენტის n მოლის საერთო რაოდენობასთან:
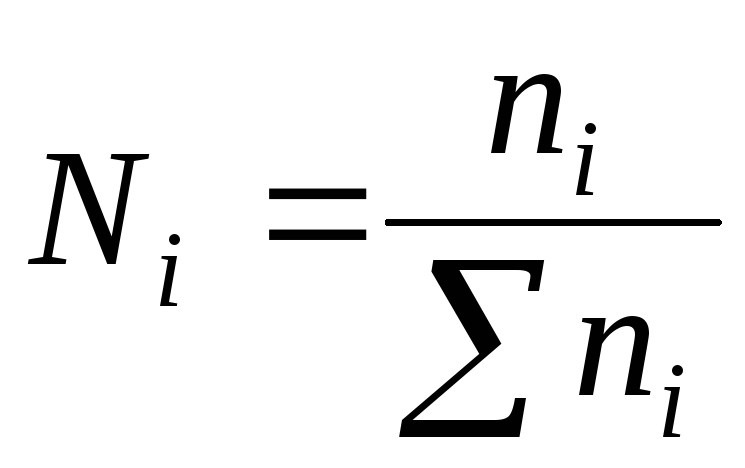
ხსნარის ყველა კომპონენტის მოლური წილადების ჯამი უდრის ერთიანობას:
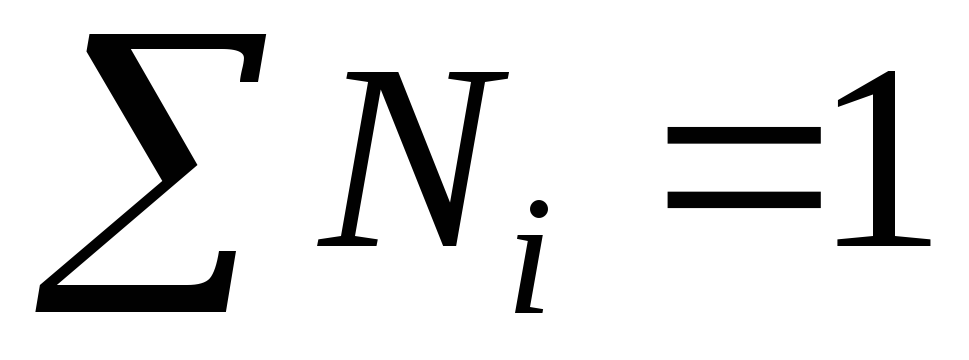
მაგალითი.გამოვთვალოთ M, m და N გოგირდმჟავას ცნობილი მასობრივი კონცენტრაციის საფუძველზე ω = 98%, ხსნარის სიმკვრივეა 1,84 გ/ლ; ხსნარის კომპონენტების მოლური მასები ტოლია 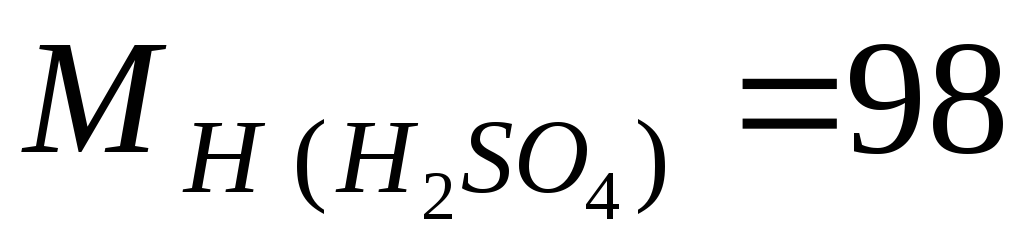 გ/მოლი;
გ/მოლი; 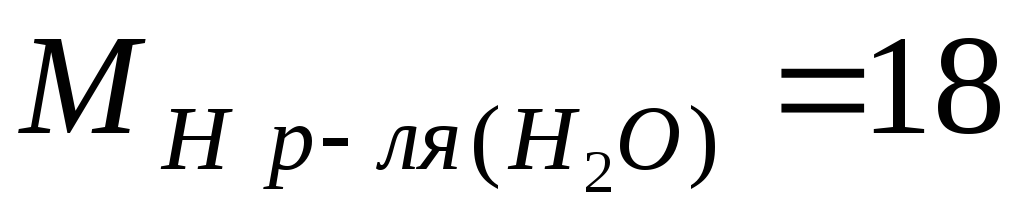 გ/მოლ.
გ/მოლ.
ხსნარის მოლარობაა:
ხსნარის მოლილობა არის:
გოგირდმჟავას მოლური ფრაქციაა:
II ხსნარები ასევე იყოფა გამხსნელსა და ხსნარს შორის ურთიერთქმედების ხარისხის მიხედვით.
იდეალური გადაწყვეტილებები ეს არის გადაწყვეტილებები, რომლებშიც მსგავს და განსხვავებულ მოლეკულებს შორის ურთიერთქმედების ძალა ერთნაირია.
A - გახსნილი ნივთიერება, ვ ა - ა
B - გამხსნელი, ვ B-B
AB ხსნარი ვ ა - ა = ვ B-B = ვ ა -ში
იდეალურ ხსნარებში სხვადასხვა კომპონენტის მოლეკულებს შორის ურთიერთქმედების ენერგია ერთნაირია; ხსნარის ყველა მოლეკულას (ხსნარსა და გამხსნელს) აქვს ერთი და იგივე ძალის ველი და ყველა კომპონენტის მოლეკულების მოცულობა ტოლია. იდეალურ თხევად ხსნარში, იდეალური აირისგან განსხვავებით, არსებობს ურთიერთქმედება მოლეკულებს შორის. ხსნარში ყველა მოლეკულის ურთიერთქმედების იგივე ენერგია იწვევს მათ ერთგვაროვან განაწილებას მოცულობაში. ამიტომ იდეალური ხსნარის კომპონენტების შერევის ენტროპია არის ΔSიდეალური აირის შერევის ენტროპიის ტოლია ΔS ი.გ. .
ყველა მოლეკულის თანაბარი მოცულობა უზრუნველყოფს სისტემის მოცულობის მუდმივ შენარჩუნებას იდეალური ხსნარის ფორმირებისას. იდეალური ხსნარის ამ ფორმირებისას თერმული ეფექტი ნულის ტოლია. ამასთან დაკავშირებით შეგვიძლია მივცეთ იდეალური თხევადი ხსნარების კიდევ ერთი განმარტება. იდეალური იქნება ისეთი გადაწყვეტილებები, რომელთა ფორმირებას აგრეგაციის იმავე მდგომარეობაში და ნებისმიერი თანაფარდობით მიღებული კომპონენტებისგან არ ახლავს მოცულობის და თერმული ეფექტის ცვლილება, ხოლო ენტროპიის ცვლილება უდრის ენტროპიის ცვლილებას იდეალის შერევისას. გაზები, ე.ი.
Δ ვ=0; ΔH=0; ΔS= ΔS ი.გ.
იდეალური ხსნარების მოცულობა და ენთალპია არის დანამატი და დამოკიდებულია ხსნარის შემადგენლობაზე.
გასათვალისწინებელია, რომ გადაწყვეტილებები შეიძლება ჩაითვალოს იდეალურად, როდესაც ყველა ზემოთ ჩამოთვლილი პირობა დაკმაყოფილებულია და, გარდა ამისა, კომპონენტების ნაწილობრივი წნევა უნდა იყოს თანაბარი, მათ უნდა ჰქონდეთ იგივე ტემპერატურა და აგრეგაციის იგივე მდგომარეობა.
იდეალურ გადაწყვეტილებებს იდეალურს უწოდებენ, რადგან ისინი სინამდვილეში არ არსებობს. თუმცა, არსებობს გადაწყვეტილებების მნიშვნელოვანი რაოდენობა, რომელთა თვისებები ახლოსაა იდეალურ გადაწყვეტილებებთან. ეს მოიცავს განზავებულ ხსნარებს.
გიბსის ენერგია მეე იდეალური ხსნარის კომპონენტი რიცხობრივად უდრის ქიმიურ პოტენციალს და შეიძლება წარმოდგენილი იყოს შემდეგნაირად:
როდესაც ∆ ჰ მე =0, ქიმიური პოტენციალი მეე კომპონენტი იდეალურ ხსნარში უდრის:
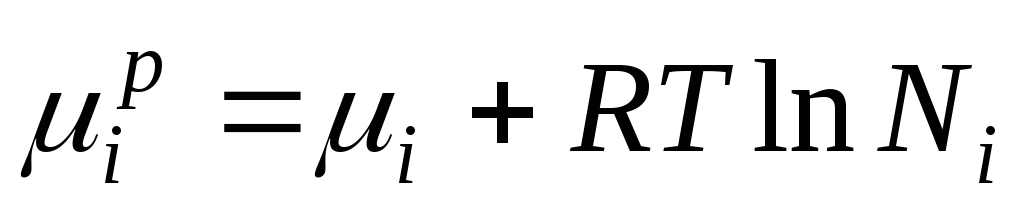 , სად
, სად
µ მე , µ მე გვ- ქიმიური პოტენციალი მეინდივიდუალური კომპონენტი ხსნარში; ნ მე -მოლური ფრაქცია მეე კომპონენტი.
განვასხვავოთ ეს განტოლება და მივიღოთ:
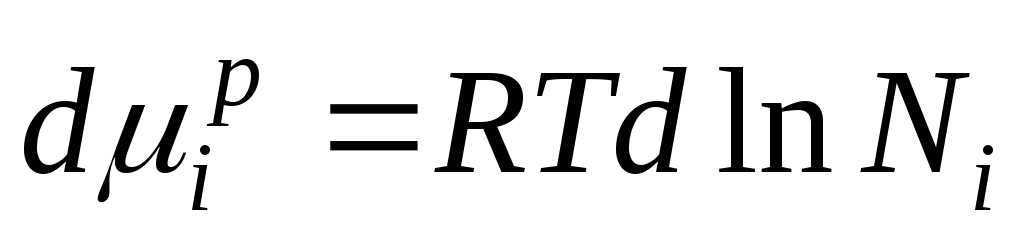
იმის გამო, რომ 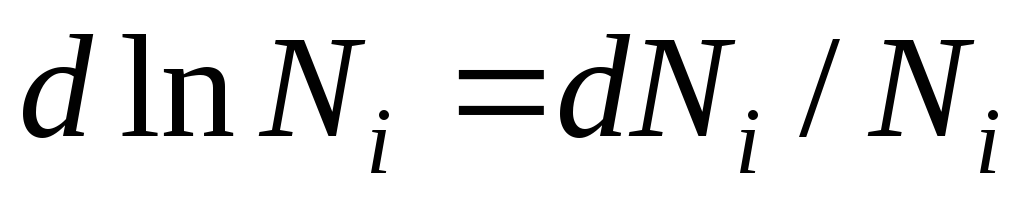 ჩვენ ვიღებთ:
ჩვენ ვიღებთ:
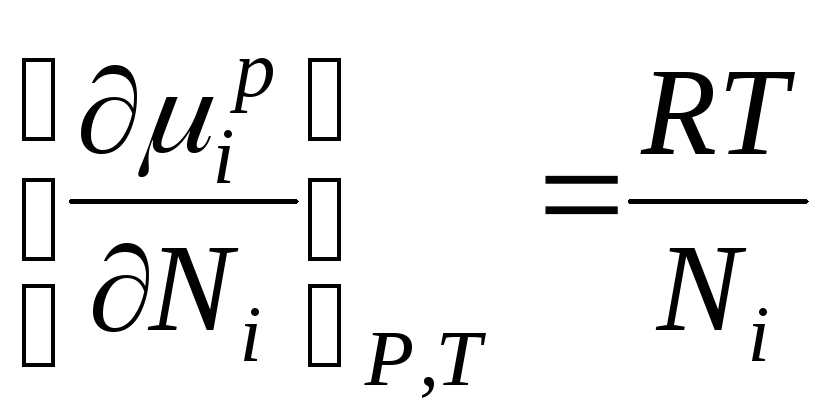
ეს განტოლება გვიჩვენებს ურთიერთობას იდეალური ხსნარის კომპონენტების ქიმიურ პოტენციალსა და მის შემადგენლობას შორის, რომელიც განისაზღვრება ხსნარის კომპონენტების მოლური ფრაქციის მიხედვით.
განვიხილოთ უკიდურესად განზავებული ხსნარები, რომლებსაც ხშირად უწოდებენ უბრალოდ განზავებულს. უკიდურესად განზავებული ხსნარები ეს არის ხსნარები, რომლებშიც გამხსნელი ემორჩილება იდეალური ხსნარების კანონს, ხოლო ხსნადი ნივთიერება ემორჩილება რეალური ხსნარების კანონებს.
განზავებულ ხსნარში გახსნილი ნივთიერების კონცენტრაცია უსასრულოდ მცირეა, ამიტომ მის მოლეკულებს შორის ურთიერთქმედება შეიძლება უგულებელყო. შემდეგ უკიდურესად განზავებული ხსნარები შეიძლება აღწერილი იყოს კანონებითა და განტოლებით, რომლებიც მოქმედებს იდეალური ამონახსნებისთვის.
არაიდეალური (რეალური) გადაწყვეტილებები ეს არის გადაწყვეტილებები, რომლებშიც მსგავს და განსხვავებულ მოლეკულებს შორის ურთიერთქმედების ძალები განსხვავებულია.
AB ხსნარი ვ ა - ა ≠ ვ B-B ≠ ვ ა -ში
რეალური გადაწყვეტილებები არ ემორჩილება იდეალური და უკიდურესად განზავებული ხსნარების კანონებს. თუმცა, დამხმარე სიდიდეების შემოღებით, არაიდეალური ამონახსნების თვისებები ასევე შეიძლება გამოიხატოს იდეალური ამონახსნების კანონებით.
ხსნადობა. ხსნარების კონცენტრაციის გამოხატვის მეთოდები. დაშლა, როგორც ფიზიკური და ქიმიური პროცესი.
მიზნები:
საგანმანათლებლო:
− ცნებების ჩამოყალიბება: „ხსნარი“, „დაშლა“, „ხსნადობა“, „კონცენტრაცია“.
− განვიხილოთ ხსნარების ფიზიკური, ქიმიური და თანამედროვე თეორია.
− აჩვენე გადაწყვეტილებების მნიშვნელობა ადამიანის ცხოვრებაში.
საგანმანათლებლო:
− მოსწავლეთა ცოდნის, უნარებისა და შესაძლებლობების კონსოლიდაცია გადაჭრის თემაზე პრობლემების გადაჭრაში.
განმანათლებლები:
− მოსწავლეებში დაკვირვების უნარის, ლოგიკური აზროვნების, დასკვნების და დასკვნების გამოტანის უნარის განვითარება.
ლექციის მიმდინარეობა
I. საორგანიზაციო მომენტი. ქიმიური რეაქციის სიჩქარის შესახებ ცოდნის ტესტირება.
II. ახალი მასალის ახსნა.
მასწავლებელი:გადაწყვეტილებები მნიშვნელოვან როლს თამაშობენ ბუნებაში, ტექნოლოგიასა და მეცნიერებაში.
სად გამოიყენება გადაწყვეტილებები? (მოსწავლეთა პასუხები)
მასწავლებელი:გადაწყვეტილებების როლი დედამიწაზე სიცოცხლის გაჩენასა და განვითარებაში დიდია. ორგანიზმების წარმოშობის ერთ-ერთი თეორია არის სიცოცხლის წარმოშობის თეორია პირველად ოკეანეში, რომელიც იყო წყალი მასში გახსნილი ნივთიერებებით. ამ ხსნარიდან ორგანიზმებმა მიიღეს ზრდისა და განვითარებისათვის საჭირო იონები და მოლეკულები.
ადამიანის სხეული შეიცავს ფიზიოლოგიურად მნიშვნელოვან ხსნარებს. რომელი? (სისხლი, კუჭის წვენი და ა.შ.)
გამოსავალიარის ერთგვაროვანი სისტემა, რომელიც შედგება ორი ან მეტი კომპონენტისგან, რომლის შინაარსი შეიძლება შეიცვალოს გარკვეულ ფარგლებში ჰომოგენურობის დარღვევის გარეშე.
ხსნარი არის ერთგვაროვანი (ერთგვაროვანი) სისტემა, რომელიც შედგება გახსნილი ნივთიერების, გამხსნელის და მათი ურთიერთქმედების პროდუქტების ნაწილაკებისგან.
ხსნარების კლასიფიკაცია
აგრეგაციის მდგომარეობის მიხედვით:გაზი (ჰაერი), თხევადი (ზღვის წყალი), მყარი (შენადნობები)
გამხსნელის შემადგენლობით(წყალი, ამიაკი, ბენზოლი და ა.შ.)
ნაწილაკების ზომის ან დაფქვის ხარისხის მიხედვით (დისპერსიულობა):
შეაჩერე(უხეში სისტემები) - ნაწილაკების ზომა 10-3 -10-5 სმ სუსპენზიები არის ძალიან მყიფე, ჰეტეროგენული სისტემები. ჩვეულებრივ, უხეშად დაშლილი სისტემებია
სუსპენზიების, ემულსიების, აეროზოლების სახით.
მიეცით ბუნებრივი უხეში სისტემების მაგალითები?
კოლოიდური ხსნარები- ნაწილაკების ზომა
10-5 - 10-7 სმ კოლოიდური DS-ის მაგალითებია წებოს და ჟელატინის ხსნარები.
კოლოიდური ხსნარები გამოირჩევიან იმით, რომ მათი ნაწილაკები ძლიერად ფანტავს მათში გამავალ სინათლეს და შესამჩნევს ხდის გადაცემული სინათლის სხივის გზას (ტინდალის ეფექტი).
ნამდვილი გადაწყვეტილებები -ნაწილაკების ზომაა 10-7 - 10-8 სმ, ეს არის ერთგვაროვანი, სტაბილური DS.
გაჯერებული ხსნარის კონცენტრაციას ე.წ ხსნადობა მიუთითებს ტემპერატურაზე, რომელზედაც იგი განისაზღვრება.
ნ ხსნადობა - გახსნილი ნივთიერების მოლების რაოდენობა ერთ ლიტრ ხსნარში (გაჯერების მდგომარეობაში)
ხსნადობა- ნივთიერების უნარი შექმნას ერთგვაროვანი სისტემები სხვა ნივთიერებებთან - ხსნარები, რომლებშიც ნივთიერება არის ცალკეული ატომების, იონების, მოლეკულების ან ნაწილაკების სახით. ხსნადობა გამოიხატება როგორც გამხსნელი ნივთიერების კონცენტრაცია მის გაჯერებულ ხსნარში, პროცენტულად ან წონით ან მოცულობის ერთეულებით. აირების ხსნადობა სითხეში დამოკიდებულია ტემპერატურასა და წნევაზე. თხევადი და მყარი ნივთიერებების ხსნადობა თითქმის მთლიანად დამოკიდებულია ტემპერატურაზე.
ნ კოეფი. ხსნადობა- ხსნარის კომპონენტის მასა 100 გ ხსნარში
ჭეშმარიტი გადაწყვეტილებები არის თერმოდინამიკურად სტაბილური სისტემები, რომლებიც დროში განუსაზღვრელი სტაბილურია.
ხსნარების ფორმირების მამოძრავებელი ძალებია ენტროპია და ენთალპიის ფაქტორები. როდესაც აირები იხსნება სითხეში, ენტროპია ყოველთვის მცირდება ΔS< 0, а при растворении кристаллов возрастает (ΔS >0). რაც უფრო ძლიერია ურთიერთქმედება ხსნარსა და გამხსნელს შორის, მით უფრო დიდია ენთალპიის ფაქტორის როლი ხსნარების წარმოქმნაში. დაშლის ენთალპიის ცვლილების ნიშანი განისაზღვრება დაშლის თანმხლები პროცესების ყველა თერმული ეფექტის ჯამის ნიშნით, რაშიც მთავარი წვლილი მიუძღვის ბროლის ბადის თავისუფალ იონებად განადგურებას (ΔH > 0). და მიღებული იონების ურთიერთქმედება გამხსნელის მოლეკულებთან (სოლტივაცია, ΔH< 0). При этом независимо от знака энтальпии при растворении (абсолютно нерастворимых веществ нет) всегда ΔG = ΔH – T·ΔS < 0, т. к. переход вещества в раствор сопровождается значительным возрастанием энтропии вследствие стремления системы к разупорядочиванию. Для жидких растворов (расплавов) процесс растворения идет самопроизвольно (ΔG < 0) до установления динамического равновесия между раствором и твердой фазой.
