რა არის ფენოლფთალეინი. ორთქლის გამოხდის ძირითადი საფრთხეები.
(დოკუმენტი)
n2.doc
განათლების ფედერალური სააგენტო
ზოგადი ექსპერიმენტი 1: ტიტრები
ბოლო რამდენიმე წვეთი წყლის დამატებისას რატომ უნდა დარწმუნდეთ, რომ თვალები თანაბარი იყოს?
- რა არის ამ სტანდარტული ხსნარის კონცენტრაცია?
- რა დანიშნულება აქვს ჭიქის და ძაბრის წყლით ჩამორეცხვას?
- რა დანიშნულება აქვს მოცულობითი კოლბის შიგნიდან წყლით გამორეცხვას?
ცხელი სპირტიდან რეკრისტალიზაციის მეთოდი
ცხრილიდან განსაზღვრეთ ამ ექსპერიმენტის საშუალო ტიტრირების მოცულობა და გამოიყენეთ ეს მნიშვნელობა დანარჩენ გამოთვლებში. წინა მოცემული მაგალითების გამოყენებით განსაზღვრეთ ძმარმჟავას კონცენტრაცია ძმრის ნიმუშში. გახსოვდეთ, რომ თქვენ გაქვთ შემდეგი ინფორმაცია: ნატრიუმის ჰიდროქსიდის ხსნარის ვაზის მოცულობის მოცულობა, ნატრიუმის ჰიდროქსიდის ხსნარის კონცენტრაცია. განსაზღვრეთ უცნობი კონცენტრაციის ნატრიუმის ჰიდროქსიდის ხსნარის კონცენტრაცია.
სახელმწიფო საგანმანათლებლო დაწესებულებისუმაღლესი პროფესიული განათლება
პომერანული Სახელმწიფო უნივერსიტეტიმ.ვ.ლომონოსოვის სახელობის
ქიმიის დეპარტამენტი
კურსის მუშაობა
ფენოლფთალეინის სინთეზი.
სხვადასხვა დიელექტრიკული ნებართვის მქონე გამხსნელებში ხსნადობის შესწავლა
დასრულებული:
კონცენტრირებულმა მჟავებმა და ფუძეებმა შეიძლება გამოიწვიოს მძიმე დამწვრობა. ჩვენ გირჩევთ გამოიყენოთ ხელთათმანები და სათვალეები მჟავასთან ან ფუძესთან მუშაობისას. დარწმუნდებით, რომ ბურეტი დახურულია, ფრთხილად დაამატეთ ოქსილის მჟავას სტანდარტული ხსნარი ბიურეტში, სანამ არ გაივსება. მოათავსეთ სუფთა ჭიქა ბურეტის ქვეშ და ფრთხილად მოათავსეთ მასში ოქსილის მჟავას ხსნარის ნაწილი. ეს უზრუნველყოფს, რომ არ იყოს ჰაერის ბუშტები ბიურეტში. ხსნარის ზედა ნაწილი ახლა უნდა იყოს 0 და 1 სმ3 ნიშნებს შორის. ჩაწერეთ მნიშვნელობა მეორე ათობითი ადგილზე. გამოიყენეთ პიპეტი, რათა გაზომოთ 20 სმ3 ხსნარი კონუსურ კოლბაში. კონუსურ კოლბას დაამატეთ ფენოლფთალეინის ინდიკატორის 3-4 წვეთი. ჩაატარეთ უხეში ტიტრაციის ექსპერიმენტი კონუსურ კოლბაში ოქსილის მჟავას სწრაფად დამატების და კონუსური კოლბის გამუდმებით მორევით. გააჩერეთ როგორც კი ხსნარის ფერი შეიცვლება და მორევის შემდეგ შეიცვლება. თუ კოლბის ტრიალის დროს ფერის ცვლილება არ შენარჩუნდება, დაამატეთ მეტი ოქსილის მჟავა, სანამ ფერი აღარ დარჩება. გაიმეორეთ ნაბიჯები 4-7 მეორე კონუსური კოლბით. სწრაფად დაამატეთ ოქსილის მჟავა კონუსურ კოლბაში, სანამ არ დაამატებთ 2 სმ3-ით ნაკლებს, ვიდრე მთლიანი ტიტრების მოცულობა. ჩართულია ამ მომენტშიარ უნდა იყოს ხანგრძლივი ფერის ცვლილება. თანდათანობით დაამატეთ ოქსილის მჟავა. მორევა თითოეულ წვეთს შორის და, საჭიროების შემთხვევაში, ჩამოიბანეთ კოლბის გვერდები წყლით. როდესაც ხსნარი იცვლის ფერს და რჩება ახალ ფერად, აღნიშნეთ მოცულობა ბურეტზე. გახსოვდეთ, რომ ტიტრირებული მოცულობა: -. სიზუსტისთვის, გაიმეორეთ 9-11 ნაბიჯები, სანამ არ გაქვთ სამი წაკითხვა, რომელთა სხვაობა არ აღემატება 0,1 სმ3.
- მონიშნეთ ერთი სათვალე \\.
- გამოიყენეთ პიპეტი, რათა გაზომოთ 100 სმ3 წყალი ჭიქაში.
- ჭიქაში დაამატეთ დაახლოებით 4 გ და აურიეთ.
- დაამაგრეთ ბურეტი რეტორტის სადგამზე და ზემოდან მოათავსეთ პატარა ძაბრი.
- რა ფერის იყო ნატრიუმის ჰიდროქსიდის ხსნარი ფენოლფთალეინის დამატებისას?
- რა ფერი იყო, როდესაც საკმარისი მჟავა დაემატა?
მე-3 კურსის სტუდენტი
ქიმიის განყოფილებები
ალფეროვი ვლადიმერ ივანოვიჩი
შემოწმებულია:
ასოცირებული პროფესორი, კანდ. ქიმ. მეცნიერებები
ლევანდოვსკაია T.V.
ასოცირებული პროფესორი, კანდ. ტექ. მეცნიერებები
ჩაგინა ნ.ბ.
არხანგელსკი
1. ლიტერატურის მიმოხილვა………………………………………………..5
ფენოლფთალეინის გარეგნობა და ფიზიკური თვისებები………….5
ფენოლფთალეინის გამოყენება……………………………………………...6
ქიმიური თვისებები …………………………………………………8
ფენოლფთალეინის მიღება……………………………………………… 11
1.4.2 ფიზიკური თვისებებისინთეზში გამოყენებული ნივთიერებები ... .15
წინა მოცემული მაგალითების გამოყენებით განსაზღვრეთ ნატრიუმის ჰიდროქსიდის ხსნარის კონცენტრაცია. გახსოვდეთ, რომ თქვენ გაქვთ შემდეგი ინფორმაცია: ნატრიუმის ჰიდროქსიდის ხსნარის მოცულობა ოქსილის მჟავას ხსნარის მოცულობაში ოქსილის მჟავას ხსნარის კონცენტრაცია. დაბალანსებული ქიმიური განტოლება ამ რეაქციისთვის.
გამოთვალეთ ოქსილის მჟავის მასა, რომელიც მოსწავლემ უნდა დაითხოვოს საჭირო სტანდარტული ხსნარის შესაქმნელად. მას მიაჩნია, რომ ოქსილის მჟავას ხსნარის 40 სმ 3 მთლიანად ანეიტრალებს ნატრიუმის ჰიდროქსიდის ხსნარის 35 სმ 3-ს.
- ჩვენ გვჭირდება ოქსილის მჟავას მასა.
- თუმცა ჯერ არ ვიცით ხალების რაოდენობა.
1.4.3 ორთქლით გამოხდის პროცედურა……………………….16
1.4.4 ცხელი სპირტიდან რეკრისტალიზაციის მეთოდი………….18
1.5 უსაფრთხოების ზომები…………………………………………………………………………………
1.5.1 ძირითადი საშიშროება კონცენტრირებულ მჟავებთან მუშაობისას…………………………………………………………………………..20
1.5.2 ძირითადი საშიშროება ორთქლის გამოხდისას……..21
- დაწერეთ რეაქციის გაწონასწორებული ქიმიური განტოლება.
- გამოთვალეთ მჟავის კონცენტრაცია.
ეს ხშირად მჟავე წვიმა პირველად აღინიშნა მეცხრამეტე საუკუნეში, მაგრამ მხოლოდ მეოცე საუკუნემდე გავრცელდა ეს მჟავიანობა იმ საშიშ დონეზე, რომელსაც ჩვენ ვუკავშირებთ ტერმინს "მჟავა წვიმა". მთავარი დამნაშავე იყო ნახშირი, რომელიც შეიცავს გოგირდს, როგორც მინარევს. ელექტროსადგურში წვისას ეს გოგირდი აერთიანებს ჟანგბადს და წარმოქმნის გოგირდის დიოქსიდს, რომელიც ამოდის ბუხარში და იშლება ატმოსფეროში.
1.5.3 ძირითადი საშიშროება ცხელი სპირტიდან რეკრისტალიზაციის დროს…………………………………………………………………………….21
22
1.6 გამხსნელების დახასიათება……………………………………….24
1.6.1 გამხსნელების კლასიფიკაცია ფიზიკური თვისებების მიხედვით…25
გოგირდის მჟავა ძალიან ძლიერი მჟავაა და როდესაც წყალი ჰაერიდან კონდენსირდება წვიმის წვეთებით, მჟავა იხსნება წყალში. მერე წვიმა მოდის და სხეულებში გროვდება სუფთა წყალიმათი მჟავიანობის გაზრდა. ამით ყველაზე მეტად ჩრდილო-აღმოსავლეთი შეერთებული შტატები დაზარალდა, რადგან ოჰაიოს ველი, ოჰაიოს და პენსილვანიის ტერიტორიების ჩათვლით, არის ადგილები, სადაც ყველაზე მეტი ქვანახშირის მოპოვება მოხდა გასული საუკუნის ნახევარი. გაბატონებული ამინდის პირობების გამო, ეს გრიპის აირები შედიან ატმოსფეროში ოჰაიოს ველზე, მაგრამ წვიმა მოდის ნიუ-იორკსა და ახალ ინგლისში.
1.6.2 გამხსნელების კლასიფიკაციის სისტემები მათი მიხედვით ქიმიური თვისებები………………………………………………..30
1.7 მყარი ნივთიერებების ხსნადობის განსაზღვრის მეთოდების მიმოხილვა………………………………………………………………………..35
1.7.1 გრავიმეტრული მეთოდი…………………………………….35
1.7.2 ელექტროქიმიური მეთოდი……………………………………… 37
1.7.3 ფოტოელექტროკალორიმეტრიული მეთოდი……………………..41
გაზრდილი წვიმის მჟავიანობა შეიძლება დამღუპველი იყოს. ნიადაგში არსებული ლითონის მინარევები, რომლებიც, როგორც წესი, მჭიდროდ არის შეკრული სხვა ნაერთებთან, შეიძლება გაირეცხოს ტბებსა და ნაკადულებში მჟავა წვიმით; ერთ დროს, ახალი ინგლისის ბევრ ტბას ამის გამო არ შეეძლო კალმახის შენარჩუნება. მცენარეები ასევე ძალიან მგრძნობიარეა ნიადაგის pH-ის მიმართ. სასარგებლო საკვები ნივთიერებები ასევე შეიძლება გაირეცხოს ნიადაგიდან, რის გამოც მცენარეები ვერ იარსებებს მასში. განსაკუთრებით მძიმედ დაზიანებულ რაიონებში ათობით მკვდარი ხე გვხვდება, როგორც ეს ზემოთ არის ნაჩვენები.
2. ექსპერიმენტული ნაწილი………………………………………………43
2.1 ფენოლფთალეინის სინთეზი………………………………………………...43
2.2 რეკრისტალიზაცია ცხელი სპირტიდან………………………..45
2.3 ხსნადობის განსაზღვრა…………………………………………….47
დასკვნა …………………………………………………………… 50
ბიბლიოგრაფიული სია…………………………………………….51
შენობები და ქანდაკებები ასევე დაზიანდა მჟავე წვიმის შედეგად, რომელიც ჭამს კლდეებს, განსაკუთრებით კირქვას. სკულპტურების, საფლავის ქვების და ზოგიერთი შენობის გაზრდილმა ეროზიამ გამოიწვია უზარმაზარი ზარალი - ხელოვნების ზოგიერთი ნიმუში მთლიანად განადგურდა.
მას შემდეგ გამონაბოლქვი საგრძნობლად შემცირდა და მჟავე წვიმაც მოვიდა. თუმცა, პრობლემა ჯერ არ არის აღმოფხვრილი და კიდევ ბევრია გასაკეთებელი ამ სერიოზულ ეკოლოგიურ პრობლემაზე. მოდით შევხედოთ მარილმჟავას, რომელიც კუჭის მჟავას ძირითადი კომპონენტია და ნატრიუმის ჰიდროქსიდს, რომელსაც ხშირად „ლას“ უწოდებენ და გამოიყენება საპონში. თუმცა, თითქმის ყველა ჰიდრონიონი და ჰიდროქსიდი აერთიანებს წყლის მოლეკულებს, ტოვებს მხოლოდ ქლორიდ-მაყურებელს და ნატრიუმის იონებს.
შესავალი
ფენოლფთალეინი არის ერთ-ერთი ყველაზე ფართოდ გამოყენებული მჟავა-ტუტოვანი მაჩვენებელი ქიმიაში. ის მიეკუთვნება ტრიარილმეთანის საღებავებს, რომელსაც ეწოდება ფთალეინი.
ამ სამუშაოს მიზანია ფენოლფთალეინის სინთეზი და მისი ხსნადობის შესწავლა გამხსნელებში სხვადასხვა დიელექტრიკულ მუდმივებთან. ამ მიზნის მისაღწევად აუცილებელია შემდეგი ამოცანების გადაჭრა:
თუ მარილმჟავას ოდენობა ზუსტად იგივეა, რაც ნატრიუმის ჰიდროქსიდის რაოდენობა მოლებში, მაშინ თითოეულ ჰიდრონიუმს უნდა ჰქონდეს ჰიდროქსიდი, რათა რეაგირება მოახდინოს და დატოვოს ხსნარი, რომელიც ამჟამად ნეიტრალურია. ახლა ეს უნდა იყოს ჭიქა სუფთა წყალი 7 pH-ით და მასში გახსნილი ჩვეულებრივი სუფრის მარილი. ჩვენ ვიწყებთ ორი უკიდურესად კაუსტიკური ნივთიერებით და ვამთავრებთ კეთილთვისებიანი პროდუქტებით.
ზოგადად, როდესაც მჟავები და ფუძეები ურთიერთქმედებენ ერთმანეთთან, ისინი ანეიტრალებენ ერთმანეთს და ხსნარის pH უახლოვდება ამას. მას ჰქვია ".". მხოლოდ მაშინ, როდესაც თანაბარი რაოდენობით ძლიერი მჟავა და ძლიერი ბაზა დაემატება ერთმანეთს, pH ზუსტი იქნება. მაგრამ ხშირ შემთხვევაში სუსტი მჟავები და სუსტი ფუძეები ერწყმის ერთმანეთს. თუმცა, pH მიუახლოვდება 7-ს, მაგრამ ხსნარი არ იქნება ნეიტრალური. მჟავა წვიმის შემთხვევაში, ქანები და ნიადაგი ხშირად მთავარია, განსაკუთრებით კარბონატული ქანები, რომლებიც გვხვდება ქვეყნის ზოგიერთ ნაწილში.
1. ამ საკითხზე ლიტერატურის ანალიზი;
2. შეარჩიეთ სინთეზის მეთოდები და შეარჩიეთ მათგან ყველაზე შესაფერისი;
3. განახორციელოს პროდუქტის სინთეზი, იზოლაცია და გაწმენდა;
4. სხვადასხვა დიელექტრიკული მუდმივების მქონე გამხსნელებში ხსნადობის გამოკვლევა, მიღებული შედეგების შედარება ლიტერატურულ მონაცემებთან;
როდესაც მჟავა წვიმაში სუსტი მჟავები კლდეზე ცვივა, ისინი ნეიტრალიზდება ფოთლებზე, ტალახში და კლდეებში არსებული ფუძეებით. თუმცა, ამ ფუნდამენტებიდან ბევრი, მაგალითად, ქანებში, არ არის განახლებადი. საუკუნის მჟავა წვიმის შემდეგ ქანები ანეიტრალებს კლდეებში არსებულ ყველა ფუძეს, მჟავა წვიმა მხოლოდ ეკოსისტემაში შედის და არაფერი ანეიტრალებს მას.
ფენოლფთალეინი: ზოგადი ლაბორატორიული მაჩვენებელი
ფენოლფთალეინის მოლეკულა გამჭვირვალეა მჟავის თანდასწრებით და ვარდისფერი ფუძის არსებობისას. ეს შესანიშნავი მაჩვენებელია მარტივი მჟავებისთვის მჟავა-ტუტოვანი ტიტრირების ეკვივალენტობის წერტილის დასადგენად. მე-8 ნაწილის მე-5 განყოფილებაში, ტიტრები დაინერგა, როგორც ორი ხსნარის ერთმანეთთან შერწყმის გზა, რათა ჰქონდეს კონტროლირებადი სტექიომეტრიული რეაქცია. ის მოითხოვს ცნობილი კონცენტრაციის ხსნარს, ჩვეულებრივ, ბურეტში, რომელიც რეაგირებს უცნობი კონცენტრაციის ხსნართან ქვემო ქვაბში. ნებისმიერი რეაქცია იმუშავებს ტიტრირებისთვის, მაგრამ იმისათვის, რომ გავიგოთ, როდის არის რეაქცია, უნდა არსებობდეს ხილული საბოლოო წერტილი.
5.
გააკეთეთ დასკვნა შესრულებული სამუშაოს შესახებ.
1. ლიტერატურის მიმოხილვა
1.1 ფენოლფთალეინის გარეგნობა და ფიზიკური თვისებები
ფენოლფთალეინი (დი-ნ-დიოქსიდიფენილფტალიდი, 2,2-ბის(n-ჰიდროქსიფენილ)ფტალიდი) არის თეთრი ან ოდნავ მოყვითალო კრისტალური ფხვნილი; განზავებული ეთანოლისგან ხელახლა კრისტალიზებისას წარმოიქმნება უფერო, რომბისებრი ნემსები. ფენოლფთალეინი უსუნოა და ჰაერში არასტაბილურია. მოლეკულური წონაა 318,3 გ/მოლი. ფენოლფთალეინი დნება 250 0 C (258 0 C) და მეტ ტემპერატურაზე მაღალი ტემპერატურაამაღლებს.
ფენოლფთალეინი წონის დაკლებისთვის
მჟავა ბაზის რეაქციებისთვის, ინდიკატორებს შეუძლიათ მოგვაწოდონ მხოლოდ ამ ტიპის ინფორმაცია ფერის ცვლილებით, რათა მიუთითონ საბოლოო წერტილი. მაშასადამე, მჟავა ბაზის ნეიტრალიზაციის რეაქციები არის რეაქციის ერთ-ერთი ყველაზე გავრცელებული ტიპი, რომელიც გამოიყენება ტიტრირების ანალიზებში. ამრიგად, ტიტრირება შეიძლება გამოყენებულ იქნას უცნობი ხსნარში მჟავის ან ფუძის რაოდენობის დასადგენად.
ძლიერი მჟავების ძლიერი ბაზებით ტიტრირებისას, საბოლოო წერტილი მიიღწევა, როდესაც pH არის ზუსტად 7, რადგან ხსნარი უნდა იყოს მხოლოდ სუფთა წყალხსნარი მასში ნეიტრალური ელექტროლიტებით. მას შემდეგ, რაც მჟავა გაქრება, ნებისმიერი ბაზა, რომელსაც ჩვენ დავამატებთ კოლბას, არ განეიტრალება და ხსნარის pH დაიწყებს მატებას. თუმცა, ჭარბი ძლიერი ფუძის ბიურეტიდან მცირეოდენი წვეთიც კი შეცვლის pH-ს. ერთი ან ასეთი მაჩვენებელი, ფენოლფთალეინი, გამჭვირვალე და უფეროა მჟავა ხსნარებში, მაგრამ ხდება მუქი ვარდისფერი ძირითადი ხსნარებში, თუ pH 2-ზე მეტია.
ფენოლფთალეინი ხსნადია ეთანოლში, დიეთილის ეთერში, ქლოროფორმში, აცეტონში, ნავთობის ეთერში, ბენზოლში, ტოლუოლში და ცუდად წყალში.
1.2 ფენოლფთალეინის გამოყენება
ფენოლფთალეინი ერთ-ერთი ყველაზე ფართოდ გამოყენებული მაჩვენებელია, განსაკუთრებით სუსტი მჟავების მოცულობითი განსაზღვრისას.
მას აქვს მთელი რიგი უპირატესობები: არ არის მგრძნობიარე მომატებული ტემპერატურის მიმართ, ცილოვანი ნივთიერებებისა და კოლოიდების არსებობის შეცდომა უმნიშვნელოა. მისი ფართო გამოყენება შესაძლებელია ალკოჰოლის შემცველ ხსნარებშიც კი, მხოლოდ ტუტე ხსნარის ფერი განსხვავდება წყალხსნარისთვის დამახასიათებელი იისფერი ტონისგან. კონცენტრირებულ ალკოჰოლურ ხსნარებში ძირითად ფორმას აქვს ლურჯი-იისფერი ფერი. ფენოლფთალეინი შეიძლება გამოყენებულ იქნას ორგანული მჟავების ტიტრირებისას ალკოჰოლურ ხსნარებში ან სპირტებისა და ეთერების მჟავიანობის დასადგენად. ჰეიორტი და ჰემი გვთავაზობენ პოლინატრიუმის გლიკოლატის გამოყენებას საბაზისო ტიტრის დასადგენად ფენოლფთალეინის თანდასწრებით. დამაკმაყოფილებელი შედეგები მიიღება 210 -6 - 3010 -6 გ ორგანული მჟავების ტიტრირებით 2,710 -6 - 4010 -6 ლ ფენოლფთალეინის თანდასწრებით. მიკის კვლევის მიხედვით, ინდიკატორის კონცენტრაცია ძალიან მნიშვნელოვან როლს ასრულებს მიკროაციდიმეტრიაში. ფენოლფთალეინი მრავალი შერეული ინდიკატორის შემადგენელი ნაწილია. თავისი თვისებებიდან გამომდინარე, იგი ვარგისია pH-ის კალორიმეტრიული განსაზღვრისათვის ბუფერული ხსნარების ან მიქაელისის მეთოდით ბუფერული ხსნარების გარეშე. ფერადი ფორმა ემორჩილება ლუდის კანონს კონცენტრაციების ფართო დიაპაზონში.
მჟავა ინდიკატორები მრავალი ტიპისაა
ის ფაქტი, რომ ფენოლფთალეინი იცვლის ფერს 0-ზე ოდნავ ზემოთ, ჩვეულებრივ, ექსპერიმენტში ძალიან მცირე შეცდომას იწვევს. ფენოლფთალეინის გარდა, სხვა ინდიკატორებში შედის ბრომოთიმოლ ლურჯი და მეთილის ფორთოხალი. ხსნარებისთვის, რომლებიც მხოლოდ ზღვრულად განსხვავდებიან საბოლოო წერტილისგან, ბრომოთიმოლის ლურჯი კარგი მაჩვენებელია. pH 7-ის ქვემოთ, ხსნარს აქვს ყვითელი ფერი, რომელიც ცისფერი ხდება pH-ის ზემოთ. როდესაც ტიტრირების ბოლო წერტილი საკმაოდ მჟავეა, გამოიყენება მეთილის ფორთოხალი.
ფენოლფთალეინი ასევე შეიძლება გამოყენებულ იქნას როგორც რეაგენტი თვისებრივი ანალიზის დროს. საქსის აზრით, ლითონების ზოგიერთი უხსნადი ჰიდროქსიდი, როგორიცაა ტყვია, კადმიუმი, თუთია, მაგნიუმი და ა.შ. ფენოლფთალეინით შესხურებისას იძლევა ფერს, რაც აიხსნება ინდიკატორის ადსორბციით. რეაქციების სხვა ჯგუფი ემყარება იმ ფაქტს, რომ ტუტე გარემოში ფენოლფთალეინი თუთიით მცირდება უფერო ფენოლფთალეინამდე. ეს ლეიკო ნაერთი იჟანგება გარკვეული ნივთიერებებით და შემდეგ კვლავ ჩნდება ფენოლფთალეინის წითელი ფერი. მსგავსი ეფექტი შეინიშნება ციანიდის იონების ძალიან მცირე რაოდენობით (0,01-0,05 მგ/ლ) სპილენძის სულფატის კვალის არსებობისას. სპილენძის ძალიან მცირე რაოდენობით (10 -4 - 10 -5%) წყალბადის ზეჟანგის სისტემაში შეყვანა იწვევს ლეიკო ნაერთების დაჟანგვის პროცესის სიჩქარის ზრდას.
ფენოლფთალეინის ერთ-ერთი წარმოებული - ფენოლფთალეინ ფოსფატი - გამოიყენება ფოსფატაზას ფერმენტის აქტივობის დასადგენად. თავად ფენოლფთალეინ ფოსფატს არ გააჩნია ინდიკატორის თვისებები, მაგრამ ნადგურდება ფერმენტის მოქმედებით; ფოსფატის ჯგუფები იშლება სუბსტრატის მოქმედებით და ჩნდება ფენოლფთალეინის წითელი ფერი.
მედიცინაში ფენოლფთალეინს იყენებენ საფაღარათო საშუალებად და პრეპარატს პურგენს უწოდებენ.
1.3 ქიმიური თვისებები
ფენოლფთალეინის ფერთა გადასვლის ინტერვალი მერყეობს pH 8,2-დან (უფერო) pH 9,8-მდე (ფუჩქნიანი). გარდამავალი ინტერვალის დასადგენად გამოიყენება ბუფერული ხსნარების სერია შემდეგი pH მნიშვნელობებით: 7,8-8,0-8,2-8,4-9,0-9,6-9,8-10,0-10,2. pH მნიშვნელობა, რომლის დროსაც პირველი ვარდისფერი ფერი ჩნდება, დამოკიდებულია ინდიკატორის კონცენტრაციაზე. მეწამული ფერის ინტენსივობა თანდათან იზრდება pH 9,8-მდე: pH 1/2 9,53.
კვინოიდური სტრუქტურის (III) ფერადი დიანიონის ფორმირების პროცესი, რომელიც წარმოიქმნება ფენოლფთალეინის განზავებულ ტუტე ხსნართან (pH8,5) ურთიერთქმედების შედეგად, შეიძლება წარმოდგენილი იყოს შემდეგნაირად:
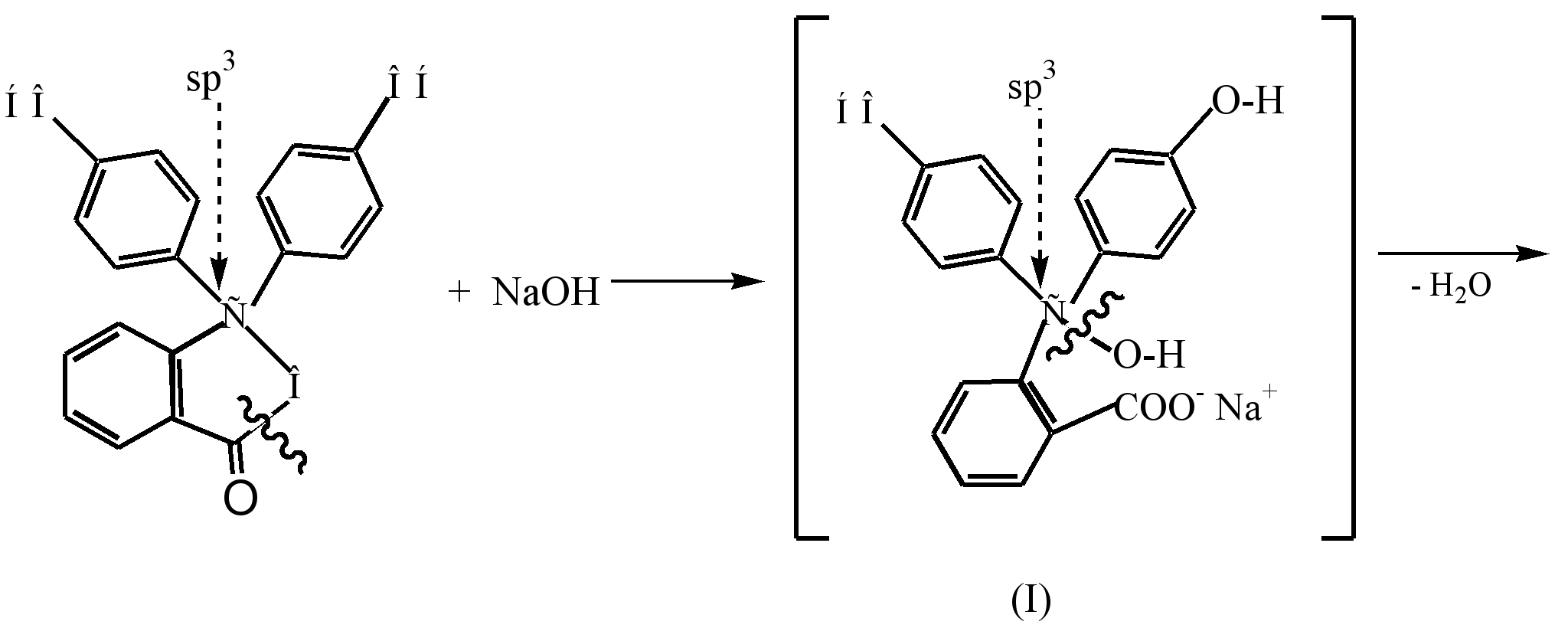

უფერო ფენოლფთალეინში ტუტეს მოქმედებით, β-ლაქტონის რგოლი იხსნება (ჰიდროლიზი) და შედეგად მიღებული უფერო ალკოჰოლი (I) სპონტანურად იშლება წყლის მოლეკულას მონონატრიუმის მარილის წარმოქმნით (II). ყვითელი ფერი. ტუტესთან შემდგომი ურთიერთქმედება იწვევს დინატრიუმის მარილის (III) წარმოქმნას და ჟოლოს ფერის გაღრმავებას, რაც გამოწვეულია კონიუგაციის ჯაჭვის გახანგრძლივებით.
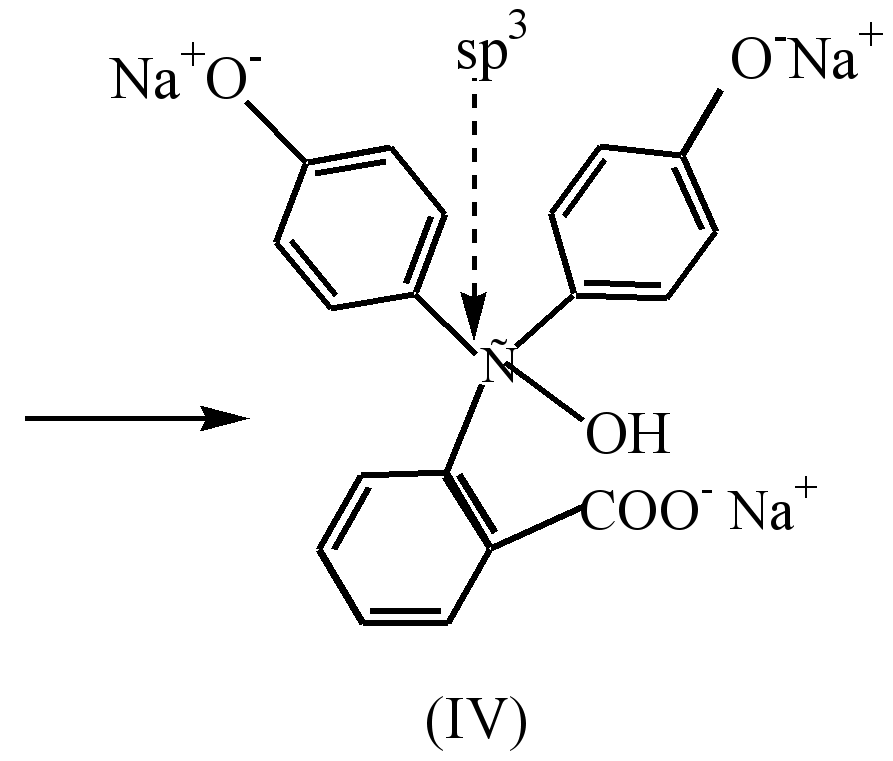
ძლიერ ტუტე გარემოში (рН10) შეიმჩნევა ხსნარის გაუფერულება დინატრიუმის მარილის (III) ტრინატრიუმის მარილზე (IV) გადასვლის შედეგად, რომელშიც რგოლები არ არის კონიუგირებული.
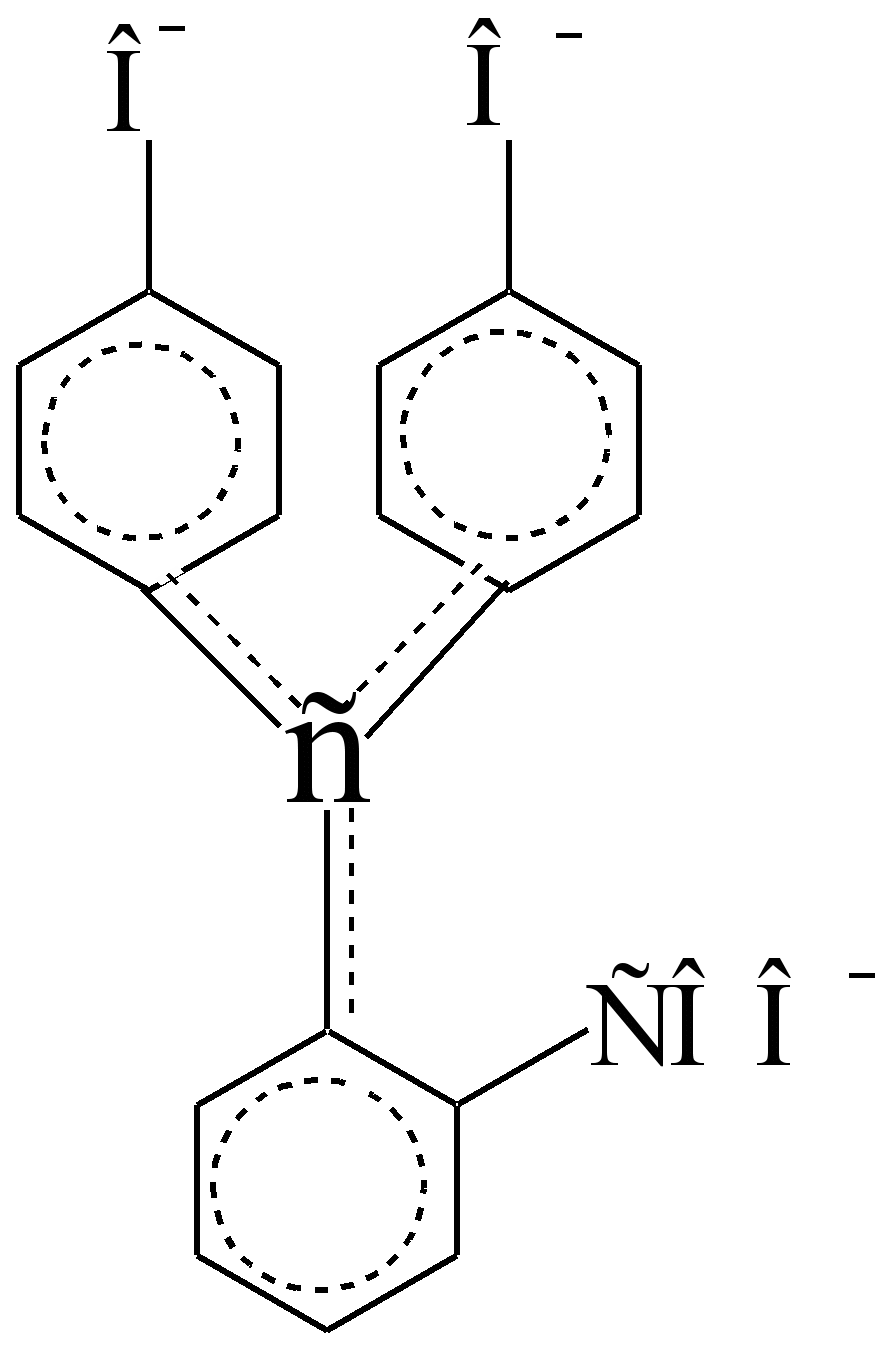
მჟავე გარემოში ის უფეროა, ვინაიდან სუსტი ბენზოლის ქრომოფორები იზოლირებულია, ავტონომიური და ?,? - ერთმანეთთან ურთიერთქმედება (დაწყვილება) არ შედის:
ისინი გამოყოფილია C sp 3 - ნახშირბადის ატომით, რომელიც არის იზოლატორი და არა გამტარი? - ელექტრონები. ტუტე გარემოში ლაქტონის ციკლი იშლება, ერთ-ერთი ფენოლური ჰიდროქსილი იონირდება და C sp 3 - ატომი იძენს C sp 2 - კონფიგურაციას და ხდება გამტარი? - ელექტრონები ბენზოლის ქრომოფორებს შორის, უფრო მეტიც, ჯერ კიდევ პოლარიზებული აუქსოქრომები - COO - და -O -. კონცენტრირებულ გოგირდმჟავაში ინდიკატორი ბრუნავს ნარინჯისფერი. იასამნისფერი ტუტე ხსნარების ფერის ინტენსივობა მცირდება დგომისას, ნაწილობრივ უფერო კარბოქსილის ფუძის წარმოქმნის გამო (ეს არის შექცევადი ტრანსფორმაცია), ნაწილობრივ ჰაერით შეუქცევადი დაჟანგვის გამო.
ფენოლფთალეინის ქრომოფორი
(ტუტე ფორმა, 1 = 553 ნმ, 1 = 9000)
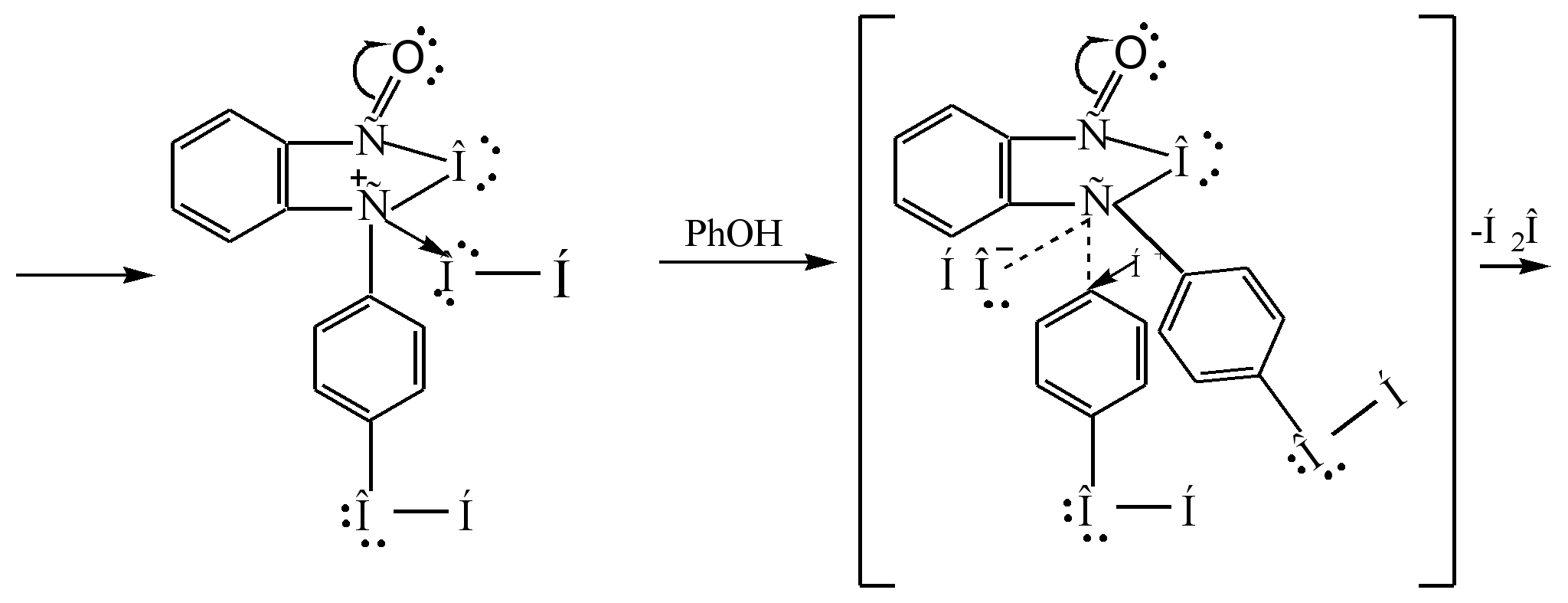
1.4 ფენოლფთალეინის მიღება
ფენოლფთალეინის მიღების ძირითადი მეთოდია ფენოლის კონდენსაცია ფტალის ანჰიდრიდთან. ეს რეაქცია Friedel-Crafts-ის აცილირების განსაკუთრებული შემთხვევაა. რეაქცია მიმდინარეობს მჟავა კატალიზატორით (კონცენტრირებული გოგირდმჟავა ან თუთიის ქლორიდი) გაცხელებისას:
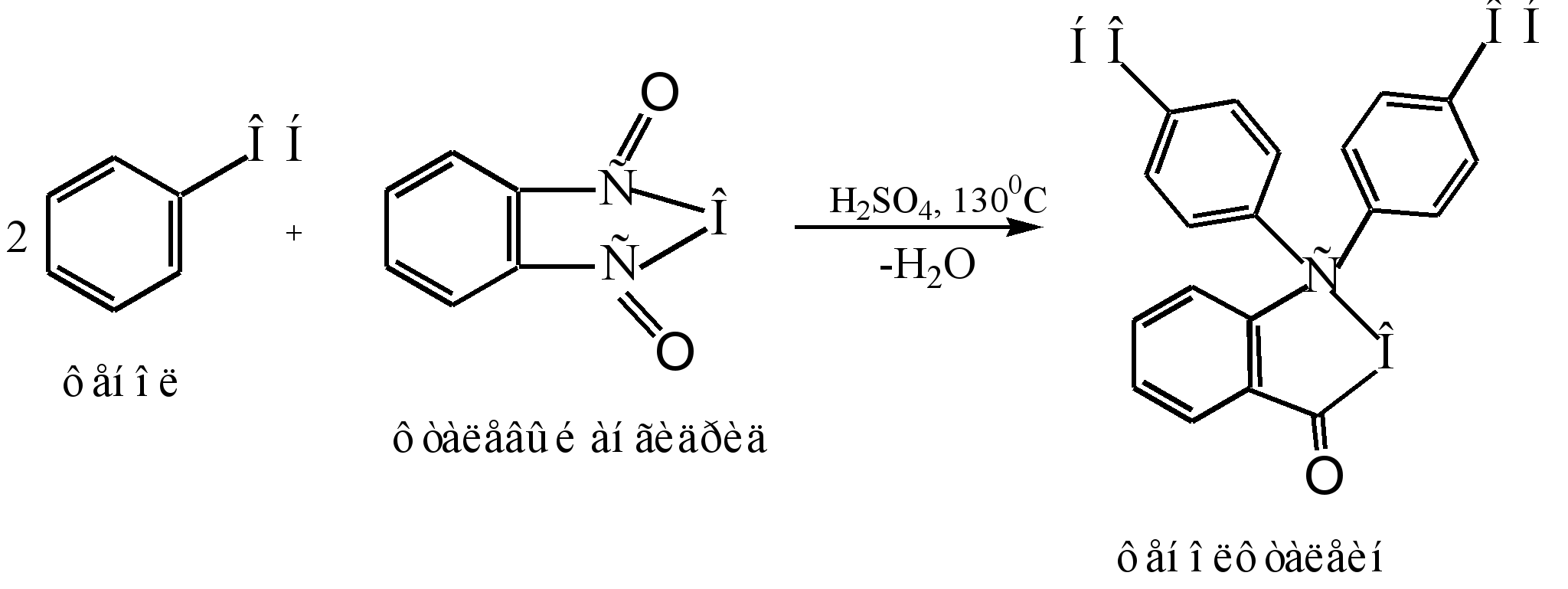
რეაქციის მექანიზმი შეიძლება წარმოდგენილი იყოს შემდეგნაირად:

სიგმა - კომპლექსი
ფენოლფთალეინი
1.4.1 ფენოლფთალეინის მიღების მეთოდები
ამ საკითხზე ლიტერატურის გაანალიზების შემდეგ აღმოჩნდა, რომ ყველა მეთოდოლოგიურ სახელმძღვანელოში მოცემულია ფენოლფთალეინის მიღების ერთი და იგივე მეთოდი. იგი ეფუძნება ზემოთ მოყვანილ რეაქციას. ტექნიკა სრულად არის ადაპტირებული ჩვენს ლაბორატორიულ პირობებთან.
სინთეზისთვის დაგჭირდებათ შემდეგი რეაგენტები, ჭურჭელი და აღჭურვილობა:
ფტალის ანჰიდრიდი - 5 გ; ფენოლი - 10 გ; გოგირდის მჟავა - 2 მლ; ნატრიუმის ჰიდროქსიდი - 4-5%; ძმარმჟავა (კონცენტრირებული); მარილმჟავა (კონცენტრირებული); ეთილის სპირტი (აბსოლუტური).
მრგვალძირიანი კოლბა (50 მლ) - 1 ც.; მინა (100 მლ) - 1 ც.; ფაიფურის ჭიქა - 1 ც.; კონუსური კოლბები (250 მლ) - 2 ც.; თერმომეტრი; ორთქლის დისტილაციის აპარატი; ქვიშის აბაზანა.
პროგრესის სინთეზი:
5 გ ფტალის ანჰიდრიდის, 10 გ ფენოლისა და 2 მლ გოგირდმჟავას ნარევი მოთავსებულია კოლბაში და თბება ქვიშის აბაზანაზე 1,5 საათის განმავლობაში, მკაცრად დაიცვან ტემპერატურა 125 - 130 C 0 (თერმომეტრი დნობისა და პერიოდულად აურიეთ შიგთავსი). ცხელ ნარევს ასხამენ კოლბაში 100 მლ მდუღარე წყალში, ურეაგირებულ ფენოლს გამოხდიან ორთქლთან ერთად. გადაყრისა და ნივთიერების დაკარგვის თავიდან ასაცილებლად, სითხე ყოველთვის უნდა აურიოთ. დისტილაციის დასასრული ჩანს დისტილატის სიმღვრივის ცვლილებით: თუ დისტილატი მოღრუბლულია, მაშინ დისტილაცია უნდა გაგრძელდეს, თუ დისტილაცია გამჭვირვალეა, მაშინ დისტილაცია შეიძლება შეწყდეს. ხსნარი ნებადართულია გაცივდეს, რის შემდეგაც მას აყრიან ბუხნერის ძაბრზე, შეძლებისდაგვარად ცდილობენ არ გადაიტანონ ნალექი ფილტრში. შემდეგ პროდუქტი გარეცხილია დეკანტაციით ორ მცირე ნაწილად. ცივი წყალი, დაამატეთ ის, რაც ჯერ კიდევ ფილტრზეა, ჭიქაში არსებული მყარი ნივთიერების დიდ ნაწილს, გახსენით მცირე რაოდენობითთბილი 4-5% ნატრიუმის ჰიდროქსიდი და არარეაგირებული ფთალიუმის ანჰიდრიდი გამოიყოფა ფილტრაციით. მუქ წითელ ფილტრატს უმატებენ ძმარმჟავას ფენოლფთალეინის სრულ დალექვამდე, შემდეგ უმატებენ 1-2 წვეთ მარილმჟავას და ტოვებენ 1 საათის განმავლობაში.
გამოთავისუფლებული ფენოლფთალეინი მოყვითალო ქვიშის სახით იწოვება ბუხნერის ძაბრზე. ნედლი პროდუქტი გადააქვთ ჭიქაში და იხსნება დაახლოებით 10 მლ სპირტში გაცხელებით. ცხელი ხსნარი იწოვება და ფილტრის ნამცხვარი ირეცხება ცხელი სპირტით. იფილტრება სპირტით დასველებული ფილტრის მეშვეობით ზეთის გამოყოფილი წვეთებიდან. ფილტრატი გადადის ფაიფურის ჭურჭელში და ცხელ ქვიშის აბაზანაში ალკოჰოლის დიდი ნაწილის მოსაშორებლად. ნარევი ჭიქაში გააჩერეთ 30 წუთის განმავლობაში. გამოყოფილი უფერო ან ღია ყვითელი კრისტალები იწოვება და აშრობს ჰაერში ფილტრის ქაღალდის ფურცლებს შორის.
1.4.2 სინთეზში გამოყენებული ნივთიერებების ფიზიკური თვისებები
ცხრილი 1
სინთეზში გამოყენებული ნივთიერებების ფიზიკური თვისებები
| სახელი | ფორმულა | გარეგნობა | T pl, 0 С | T bale, 0 C | ხსნადობა |
|
| Წყალში | განსხვავებულში |
|||||
| ფენოლფთალეინი | C 20 H 14 O 4 | უფერო ან ქვიშიანი რომბისებრი ნემსები, უსუნო, არასტაბილური ჰაერით | 261 | საჰაერო- nyatsya | იშვიათად ხსნადი (0,0002 გ 100 გ წყალში) | კარგია ეთანოლში, ნაკლებად დიეთილის ეთერში, ასევე ხსნადი ტუტე ხსნარებში. |
| ფენოლი | C 6 H 5 OH | უფერო ან მოვარდისფრო რომბისებური ნემსები | 41-43 | 182 | სიცივეში - ზომიერად ცხელი - კარგი | კარგია ეთანოლში, ეთერში, ქლოროფორმში, გლიცერინში, ნახშირბადის დისულფიდში |
| ფტალის ანჰიდრიდი | C 8 H 4 O 3 | თეთრი რომბისებრი ნემსები | 130,8 | ვოზგ 284.3 | ცუდი | ეთანოლში, ეთერში, ქლოროფორმში |
| Გოგირდის მჟავა | H2SO4 | უფერო, ბლანტი სითხე უსიამოვნო სუნით | 10,37 | 330 | | რეაგირებს |
| ნატრიუმის ჰიდროქსიდი | NaOH | თეთრი დელიკატური, რომბისებრი კრისტალები | 320 | 1378 | ხსნადი სითბოთი | ალკოჰოლში, გლიცერინში, ფენოლში, ეთერში, აცეტონში |
| ძმარმჟავა | CH 3 COOH | უფერო სითხე მძაფრი სუნით | 16,6 | 118,1 | | ეთანოლში, ეთერში |
| Მარილმჟავა | HCI | მოყვითალო სითხე, ორთქლი ჰაერში, უსიამოვნო სუნით | -15,35 | - | კარგი | ალკოჰოლში |
1.4.3 ორთქლით გამოხდის პროცედურა
ვინაიდან სინთეზის დროს საჭირო იქნება არარეაგირებული ფენოლის დისტილაციის ჩატარება ორთქლის დისტილაციის გამოყენებით, აუცილებელია განიხილოს მისი განხორციელების მეთოდი.
დისტილაცია ტარდება მოწყობილობაში, რომელიც შედგება ორთქლის გენერატორისგან უსაფრთხოების მილით, კლაიზენის დისტილაციის კოლბაში (250 მლ), თერმომეტრი, პირდაპირი Liebig კონდენსატორი, ალონჟი და მიმღები. ორთქლის გენერატორი და დისტილაციის კოლბა, რომლებიც დაკავშირებულია ჩაის საშუალებით, რომლის ერთ-ერთ ტოტთან არის ჩასმული რეზინის მილი ჰოფმანის სამაგრით, თბება ქვიშის აბაზანაში.
დისტილაციის (დისტილაციის) მიმდინარეობა: ცხელ დნობას ათავსებენ დისტილაციურ კოლბაში 100 მლ მდუღარე წყალში. ორთქლის გენერატორისა და დისტილაციის კოლბის გახურებით გროვდება დისტილატი, რომელიც შეიცავს არარეაგირებულ ფენოლს. მის არსებობას ადასტურებს დისტილატის სიმღვრივე. დისტილაცია ჩერდება მოღრუბლული დისტილატის ჩამონადენის ბოლოს, ანუ მანამ, სანამ არ გამოჩნდება გამჭვირვალე დისტილატი. 
ნახ.1ორთქლის დისტილაციის აპარატი
1- უსაფრთხოების მილი; 2 - ორთქლის მიწოდების მილი; 3 - ჩაი; 4 - clamp; 5 - ორთქლის გენერატორი; 6 - Claisen კოლბა; 7 - თერმომეტრი; 8 – Liebig მაცივარი; 9 - ალონგე; 10 - მიმღები; 11 - გამაცხელებელი მანტია; 12 - ფილები.
1.4.4 ცხელი სპირტიდან რეკრისტალიზაციის მეთოდი
ექსპერიმენტულად რეკრისტალიზაცია ხორციელდება შემდეგნაირად: ნივთიერებას ათავსებენ მრგვალძირიან კოლბაში და მას უმატებენ ცოტაოდენ გამხსნელს. ნარევი თბება რეფლუქსის ქვეშ ცხელი წყლის აბაზანაში.
სითხეების უმეტესობას აქვს მიდრეკილება გადახურებისკენ და, შესაბამისად, ისინი დუღს ძლიერი დარტყმებით. ამის თავიდან ასაცილებლად კოლბაში შეჰყავთ მდუღარე წყალი გათბობის დაწყებამდე.რეფლუქს კონდენსატორის მეშვეობით გამხსნელს თანდათან ემატება მცირე ნაწილებში, სანამ ნივთიერება მთლიანად არ დაიშლება.
ნივთიერების სრული დაშლის შემდეგ გათბობა ჩერდება და ნარევი წყალთან ერთად გაცივდება აბაზანაში. დალექილი ნივთიერება იფილტრება.
უმეტეს შემთხვევაში, ორეტაპიანი რეკრისტალიზაცია ხდება საიმედო გზითნივთიერების გაწმენდა. 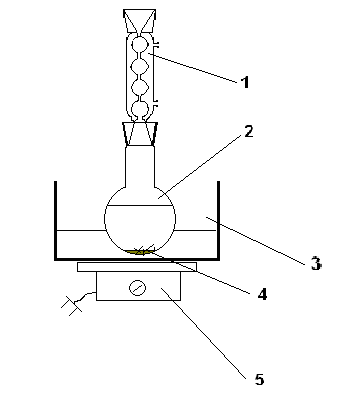
ნახ.2რეკრისტალიზატორი
1- საპირისპირო მაცივარი; 2 - მრგვალი ფსკერის კოლბა; 3- წყლის აბაზანა; 4 - მდუღარე წყალი; 5 - ფილები.
1.5 სინთეზის უსაფრთხოება
1.5.1 ძირითადი საფრთხეები კონცენტრირებულ მჟავებთან მუშაობისას
1.ძლიერი არაორგანული მჟავები იწვევს ქიმიურ დამწვრობას კანთან შეხების შემთხვევაში.კანთან კონტაქტით გამოწვეული ქიმიური დამწვრობისთვის კონცენტრირებული მჟავები, დამწვარი ადგილი ჩამოიბანეთ წყლის ძლიერი ნაკადით, შემდეგ კი ნატრიუმის ბიკარბონატის 1%-იანი ხსნარით (შეიძლება პირველადი დახმარების ნაკრებში). თუ მჟავა მოხვდება თვალებში, ისინი დაუყოვნებლივ უნდა ჩამოიბანოთ 1% ნატრიუმის ბიკარბონატის ხსნარით და გამოხდილი წყლით ოთახის ტემპერატურაზე. ეძიეთ დახმარება ექიმს.
2. გამომდინარე იქიდან, რომ კონცენტრირებული მარილმჟავა ორთქლდება წყალბადის ქლორიდით, აუცილებელია მასთან მუშაობა კარგად მოქმედი ნაკაწრის ქვეშ და ჩამოშვებული საქაჩო ფარდის ქვეშ. წყალბადის ქლორიდის ორთქლით მოწამვლის შემთხვევაში დაუყოვნებლივ გადით სუფთა ჰაერზე.
3. დაღვრილი მჟავა უნდა დაიფაროს ქვიშით და განეიტრალდეს მყარი ნატრიუმის კარბონატით გაზის ევოლუციის შეწყვეტამდე. ჩამოიბანეთ ქვიშა სრული ნეიტრალიზაციის შემდეგ დიდი მოცულობის ონკანის წყლით, შეამოწმეთ რეცხვის სისრულე (გააკეთეთ ტესტი Cl-ზე - AgNO 3-ის გამოყენებით) და ღუმელში გაშრობის შემდეგ დააბრუნეთ ყუთში ქვიშით.
1.5.2 ძირითადი საფრთხე ორთქლის გამოხდისას
დისტილაციის დროს ძირითადი საფრთხე დაკავშირებულია ელექტრო გამათბობელი მოწყობილობების გამოყენებასთან (ელექტრო ღუმელები, მანტიის გამათბობლები).1. კაბელი (არ გამოიყენოთ ფილები კაბით ნაჭრის გრაგნილში), ელექტრო ღუმელის შტეფსელი და კორპუსი არ უნდა ჰქონდეს თვალსაჩინო დაზიანება.
2. დაუშვებელია სითბოს გამოსხივების ზედაპირის ტემპერატურის ხელებით შემოწმება.
3. ჩართეთ და გამორთეთ ელექტრო ღუმელი ქსელიდან შტეფსელის ჩასმით და ამოღებით, ერთი ხელით დაიჭირეთ სოკეტი, მეორეთი კი შტეფსელი. გამოიყენეთ გადამრთველი სითბოს დასარეგულირებლად.
4. თერმული დამწვრობის დროს აუცილებელია დამწვარი ადგილის ხანგრძლივი ლოსიონების დამზადება კალიუმის პერმანგანატის 0,5%-იანი ხსნარით, შემდეგ სტერილური ბინტით დაფარვა და ექიმთან კონსულტაცია. 3 და 4 გრადუსიანი დამწვრობის დროს დაუყოვნებლივ წაისვით სტერილური სახვევი და მიმართეთ ექიმს.
1.5.3 ძირითადი საშიშროება ცხელი სპირტიდან რეკრისტალიზაციის დროს
1. დამატებული სპირტის საერთო მოცულობა არ უნდა აღემატებოდეს 200 მლ-ს და უნდა დაიკავოს კოლბის მოცულობის არაუმეტეს 1/3.2. წყლის აბაზანის ზომა უნდა იყოს ზომაზე მეტისითბოს გამოსხივება კრამიტის ზედაპირი.
1.5.4 სინთეზში გამოყენებულ ნივთიერებებთან მუშაობის თავისებურებები
უმრავლესობა ქიმიური ნივთიერებებიგარკვეულწილად ტოქსიკური. მათთან მუშაობისას სიფრთხილის ზომები მიზნად ისახავს ორგანიზმში ამ ნივთიერებების შეღწევის შემთხვევების თავიდან აცილებას პირის ღრუს, ფილტვებისა და კანის მეშვეობით.სინთეზის დროს გამოყენებული იქნება პოტენციურად საშიში ნივთიერებები: ფენოლი, გოგირდის მჟავა, ძმარმჟავა და მარილმჟავა.
ფენოლი არის უფერო (ვარდისფერი), კრისტალური ნივთიერება დამახასიათებელი სუნით. MPC სამუშაო ადგილის ჰაერში არის 0.3 მგ/მ 3. საშიშროების II კლასი. ფენოლთან ყველა სამუშაო ხორციელდება კვამლის გამწოვში. ტოქსიკური ეფექტი: ნერვის შხამი, აქვს ძლიერი ადგილობრივი გამაღიზიანებელი და გამომწვევი ეფექტი, იწვევს ზოგად მძიმე მოწამვლას. შესაძლო ფატალური შედეგი. სიტუაციას ართულებს ის ფაქტი, რომ ნივთიერება იწვევს ადგილობრივ ანესთეზიას. პირველადი დახმარება: ტანსაცმელთან მოხვედრის შემთხვევაში დაუყოვნებლივ გამოიცვალეთ იგი, კანთან შეხების შემთხვევაში ჩამოიბანეთ მცენარეული ზეთიან ეთანოლის მასური ფრაქციის მქონე ხსნარი 10 - 40%.
მარილმჟავა მიეკუთვნება მეორე საშიშროების კლასს (სამუშაო უბნის ჰაერში მაქსიმალური კონცენტრაციის ზღვარი არის 5 მგ/მ 3 HCl-ით), კონცენტრირებულ მარილმჟავასთან ყველა სამუშაო ასევე უნდა ჩატარდეს გამწოვში. რომ წყალბადის ქლორიდის ორთქლს გამოყოფს. წყალბადის ქლორიდის ორთქლებით მოწამვლისას აუცილებელია სუფთა ჰაერზე გადაადგილება, ზემოთ მითითებულია სხვა საფრთხეები.
გოგირდის მჟავა ( \u003d 1,84 გ / სმ 3) - MAC pz \u003d 1 მგ / მ 3. საშიშროების II კლასი. დაახლოებით 5 წამის შემდეგ იწყება ქსოვილების ძლიერი დეჰიდრატაცია, სადაც წვეთი დაეცა. პირველი დახმარება: კანის დაბანა გაშვებული წყალიმოჰყვა ნეიტრალიზაცია.
ძმარმჟავა - MPC pz = 5 მგ / მ 3. საშიშროების კლასი 37. ორთქლები აღიზიანებს ზედა სასუნთქ გზებს, 30%-ზე მეტი ნივთიერების მასობრივი ფრაქციის მქონე ხსნარები მოქმედებს კანზე, 2%-ზე მეტი თვალებზე. პირველადი დახმარება: (იხ. გოგირდმჟავა და მარილმჟავა).
1.6 გამხსნელების დახასიათება
გამხსნელების მახასიათებლებში განსაკუთრებული ადგილი უკავია დიელექტრიკულ გამტარიანობას. ამ უკანასკნელის უპირატესობა სხვა კრიტერიუმებთან შედარებით განპირობებულია ელექტროსტატიკური ხსნარის მოდელების სიმარტივით და, შესაბამისად, გამხსნელი პოლარობის სასარგებლო საზომად იქცა. ამასთან დაკავშირებით, მნიშვნელოვანია ნათლად ვიცოდეთ, რა ზუსტად ასახავს გამხსნელის მაკროსკოპულ ნებადართულობას, რომელსაც ასევე უწოდებენ ფარდობით ნებადართულობას:
რ = 0 /
0 – ვაკუუმის გამტარობა.
ნებადართულობა განისაზღვრება გამხსნელის მოთავსებით ორ დამუხტულ კონდენსატორის ფირფიტას შორის. გამხსნელის თანდასწრებით, დაძაბულობა ელექტრული ველიფირფიტებს შორის E მცირდება ვაკუუმში გაზომილ E 0 დაძაბულობასთან შედარებით, ხოლო E 0 / თანაფარდობა არის გამხსნელის გამტარიანობა. თუ გამხსნელის მოლეკულებს არ აქვთ საკუთარი მუდმივი დიპოლური მომენტი, მაშინ გარე ველის გავლენის ქვეშ ხდება ინტრამოლეკულური მუხტების გამოყოფა, რაც იწვევს დიპოლს.
AT ელექტრული ველიმუდმივი ან ინდუცირებული დიპოლის მქონე მოლეკულები გარკვეულწილად არის ორიენტირებული; ამ ფენომენს პოლარიზაცია ეწოდება. რაც უფრო მაღალია პოლარიზაციის ხარისხი, მით უფრო ძლიერია ელექტრული ველის სიძლიერის ვარდნა. მაშასადამე, ნებართვა პირდაპირ კავშირშია გამხსნელის უნართან, განასხვავოს მუხტები და ორიენტირება მოახდინოს საკუთარ დიპოლებზე.
1.6.1 გამხსნელების კლასიფიკაცია ფიზიკური თვისებების მიხედვით.
e ხსნარის დიელექტრიკული მუდმივა (DP) ერთ-ერთი ყველაზე მნიშვნელოვანი ფაქტორია მათ შორის, რომლებსაც აქვთ ყველაზე მეტი ძლიერი გავლენახსნარში მიმდინარე პროცესის მახასიათებლებზე.
ცალკეული გამხსნელების DP მნიშვნელობები მერყეობს ძალიან ფართო დიაპაზონში - ~1,8 (ალკანები) 170-180-მდე (ალიფატური კარბოქსილის მჟავების N-ალკილამიდები). ტერმინოლოგია, რომელიც საფუძვლად უდევს გამხსნელების გრადაციას DP-ს მიხედვით, არ არის სრულად განსაზღვრული და თანმიმდევრული. მაღალი DP გამხსნელებს ეწოდება პოლარული და კიდევ მაღალი პოლარული, თუმცა, მკაცრად რომ ვთქვათ, ტერმინი "პოლარული" ეხება გამხსნელის მოლეკულის დიპოლურ მომენტს μ, ანუ ახასიათებს გამხსნელის არა მაკრო, არამედ მიკრო თვისებებს.
თუმცა, როგორც და μ-თან დაკავშირებული თეორიიდან გამომდინარეობს, ზოგად შემთხვევაში, ამ რაოდენობებში სიმბოლური ცვლილებაა. გარდა ამისა, გამხსნელების დასახასიათებლად მათ მოლეკულებში დიპოლური მომენტის არსებობით ან არარსებობით, გამოიყენება ტერმინოლოგია "დიპოლი" (μ0) და "აპოლარული" (μ = 0) გამხსნელები.
დაბალპოლარული გამხსნელები მოიცავს გამხსნელებს, რომელთა DP არის = l.8h12 დიაპაზონში, საშუალო პოლარული გამხსნელები = 12h50, მაღალი პოლარობის გამხსნელები > 50. ამ დაყოფის ფარდობითობა მდგომარეობს არა მხოლოდ და არც ისე ბევრში. ეს საკმაოდ თვითნებურად შერჩეული ინტერვალები, მაგრამ ასევე ბევრად უფრო არსებითი ვითარებაში.
მიუხედავად DP-ისა და ცალკეული სითხის დიპოლური მომენტის კავშირისა, რომელიც საკმაოდ მკაფიოდ არის დადგენილი თეორიით, უნდა გაფრთხილდეს კატეგორიულად ცალსახა პარალელიზმი და μ სიდიდეებს შორის. . საქმე იმაშია, რომ დიპოლების ანტიპარალელური (მაგრამ არა ჯაჭვის) კავშირი იწვევს ასოციაციების დიპოლური მომენტის შემცირებას ერთი მოლეკულის დიპოლურ მომენტთან შედარებით და, შესაბამისად, სითხის გამტარობის დაქვეითებას. ამიტომ შედარებით დიდი დიპოლური მომენტის მქონე მოლეკულების მიერ წარმოქმნილი სითხეების DP შეიძლება საკმაოდ დაბალი იყოს.
გამხსნელის სტრუქტურული მახასიათებლები მნიშვნელოვან გავლენას ახდენს გამხსნელის პოლარობაზე. სტრუქტურირებულ გამხსნელებს, როგორც წესი, აქვთ მაღალი DP.
ნებართვა, ჰომომოლეკულური ქიმიური ბმების წარმოქმნასთან ერთად, არის ერთ-ერთი ყველაზე მნიშვნელოვანი ფაქტორი, რომელიც განსაზღვრავს ცალკეული სითხეების თვისებებს, რომლებიც დამოკიდებულია ინტერმოლეკულური ურთიერთქმედების ენერგიაზე. ეს უკანასკნელი განისაზღვრება რეაქტიული ურთიერთქმედებით, რომლის ენერგია დამოკიდებულია სტატიკური DP (), DP, ექსტრაპოლირებულია უსასრულოდ გრძელ ტალღის სიგრძეზე ( ) და მიღებული ტოლი? 1.1 n D, ასევე დიპოლური მომენტი μ და მოლური მოცულობა?:
E R = 
რიგი გამხსნელების დიპოლური მოლეკულების რეაქტიული ურთიერთქმედების ენერგიების მნიშვნელობები მოცემულია ცხრილში 1.
როგორც M. I. Shakhparonov ხაზს უსვამს, პოლარული მოლეკულების რეაქტიული ველი არ იწვევს ქიმიური სტრუქტურების (ჰომოლეკულური ასოციაციების) წარმოქმნას, რომელთა არსებობა განისაზღვრება ქიმიური ურთიერთქმედებით. ამ უკანასკნელის სტაბილურობა მცირდება რეაქტიული ველის ენერგიის მატებასთან ერთად.
რეაქტიული ველის ენერგია ხსნის გამხსნელების უამრავ ფიზიკურ მახასიათებელს და, შესაბამისად, შეიძლება სასარგებლო იყოს გამხსნელების კლასიფიკაცია მნიშვნელობის მიხედვით. - ერ .
ცხადია, ყველა გამხსნელი, რომელთა მოლეკულებს არ აქვთ დიპოლური მომენტი, შეადგენენ არარეაქტიულთა კლასს. სითხეები. გამხსნელები რეაქტიული ველის ენერგიით ინტერვალში - ერ = 0h5 kJmol -1 შეადგენს დაბალი რეაქტიულების კლასს, დიაპაზონში - Er = 5h15 kJ mol -1 - საშუალო რეაქტიული და ბოლოს, გამხსნელები - E R 25 kJ mol -1 შეადგენს კლასს. მაღალი რეაქტიული გამხსნელები.
როგორც წესი, მაღალრეაქტიული სითხეები კარგად ხსნიან როგორც არაელექტროლიტებს, ასევე ელექტროლიტებს და ეს უკანასკნელი მათში უკეთ ნაწილდება გამხსნელების სხვა კლასებთან შედარებით (ამ კლასიფიკაციის სისტემის მიხედვით). ეს აიხსნება იმით, რომ მაღალრეაქტიული გამხსნელები აერთიანებენ DP და დიპოლური მომენტის მაღალ მნიშვნელობებს.
მაგიდა 2
ზოგიერთი გამხსნელის რეაქტიული ველის ენერგია 298,15 კ.
| გამხსნელი | -E R, kJ მოლი -1 | გამხსნელი | -E R, kJ მოლი -1 |
| ანილინი | 2,9 | მეთილის ეთილის კეტონი | 3,4 |
| აცეტონი | 9,1 | ჭიანჭველა მჟავა | 5,2 |
| აცეტონიტრილი | 20,9 | ნიტრობენზოლი | 17,1 |
| ბუტილის სპირტი | 2,9 | ნიტრომეთანი | 17,5 |
| წყალი | 18,6 | პირიდინი | 5,7 |
| Hexen-1 | 0,15 | პროპილენის კარბონატი | 43,8 |
| N,N-დიმეთილაცეტამიდი | 15,8 | პროპილ ალკოჰოლი | 3,6 |
| დიმეთილ სულფოქსიდი | 6,4 | ტოლუენი | 0,05 |
| დიმეთილფორმამიდი | 19,5 | ძმარმჟავა | 3,7 |
| დიოქსანი | 0,07 | ტეტრაჰიდროფურანი | 2,9 |
| 1,2 - დიქლოროეთანი | 4,2 | ქლორობენზოლი | 1,8 |
| o - ქსილენი | 0,12 | ეთილის აცეტატი | 2,45 |
| n - ქსილენი | 0,05 | ეთილენგლიკოლი | 8,9 |
| N-მეთილაქეტამიდი | 24,1 | ეთანოლი | 4,7 |
| მეთილის ფორმატი | 4,0 |
სიბლანტის მიხედვით (უფრო ზუსტად, სიბლანტის კოეფიციენტით ) სითხეები იყოფა დაბალი სიბლანტის 10 -2 Pa s.
სპეციფიკური ელექტრული გამტარობის მიხედვით სითხეები იყოფა "გამტარ" სითხეებად დაახლოებით 10 2 - 10 -1 სმ მ -1 და ზემოთ; "ზომიერად გამტარი" - -ით დაახლოებით 10 -1 - 10 -4 და -ით 10 -4 სმ -1 მოიხსენიება როგორც "არაგამტარი".
ნახსენებია აგრეთვე გამხსნელების კლასიფიკაცია დუღილის წერტილების მიხედვით, რომელშიც გამხსნელები იყოფა დაბალ დუღილებად (150 0 C).
გამხსნელების აორთქლების უნარის მიხედვით კლასიფიკაციისთვის, შემოთავაზებულია აორთქლების სიცხეებზე დაფუძნებული შედარებითი მასშტაბი. აქედან გამომდინარე, განასხვავებენ არასტაბილურ (ფარდობითი არასტაბილურობა 35) გამხსნელებს. თუ პირდაპირ გავამახვილებთ ყურადღებას აორთქლების სიცხეებზე, მაშინ აქროლადი გამხსნელები უნდა კლასიფიცირდეს გამხსნელებად, რომლებიც ხასიათდება აორთქლების სითბოთი H გამოყენება ცხრილი 3
გამხსნელების კლასიფიკაცია დიელექტრიკული მუდმივის მიხედვით
| უაღრესად პოლარული |
|||
| გამხსნელი |  რ რ | გამხსნელი | რ |
| წყალი | 78,30 | DMF | 36,71 |
| ეთილენგლიკოლი | 37,7 | ბენზონიტრილი | 26,20 |
| მეთანოლი | 32,66 | ნიტრობენზოლი | 34,78 |
| DMSO | 46,45 | გლიცერინი | 51,7 |
| დაბალი პოლარული |
|||
| THF | 7,58 | ძმარმჟავას ანჰიდრიდი | 20,7 |
| დიეთილის ეთერი | 4,20 | ბუტანონი - 2 | 18,51 |
| აცეტონი | 20,70 | პენტანონი - 2 | 15,38 |
| ეთანოლი | 24,55 | პირიდინი | 12,91 |
| ძმარმჟავა | 6,17 | მეთილის აცეტატი | 6,68 |
| პროპანოლი - 1 | 20,45 | ციკლოჰექსანონი | 16,10 |
| ბუტანოლი - 1 | 17,51 | ქინალინი | 8,95 |
| იზოამილის სპირტი | 15,19 | ქლოროფორმი | 4,81 |
| ანილინი | 6,71 | ამილის სპირტი | 13,9 |
| არაპოლარული |
|||
| 1,4 - დიოქსანი | 2,21 | ციკლოჰექსანი | 2,02 |
| ტრიქლორეთილენი | 3,42 | H - პენტანი | 1,84 |
| ბენზოლი | 2,27 | ნახშირბადის დისულფიდი | 2,64 |
| ტოლუენი | 2,38 | დიეთილამინი | 3,78 |
| ნახშირბადის ტეტრაქლორიდი | 2,23 | დიეთილის კარბონატი | 2,82 |
| ტრიეთილამინი | 2,42 | ||
| n-ჰეპტანი | 1,92 | ||
| n-ჰექსანი | 1,88 | ||
1.6.2 გამხსნელების კლასიფიკაციის სისტემები მათი ქიმიური თვისებების მიხედვით
ქიმიური მახასიათებლების მიხედვით გამხსნელების კლასიფიკაციის სისტემების უმეტესობა, აშკარად ან ირიბად, ითვალისწინებს მათ მჟავა-ტუტოვან თვისებებს. ამიტომ, ყველაზე ზოგადი სისტემაგამხსნელების კლასიფიკაცია ითვალისწინებს მათ დაყოფას ორ ფართო კლასად - დონორად
(ძირითადი) და აქცეპტორი (მჟავა), რომელთა განმარტება, ცხადია, წინასწარ განსაზღვრავს სხვა კლასის ინდიფერენტული გამხსნელების იზოლაციას. თითოეული კონკრეტული გამხსნელის რომელიმე ამ კლასზე მინიჭების პირობითობა, თუ მხოლოდ იმიტომ, რომ გამხსნელის მოლეკულის უნარი შეწიროს ან მიიღოს ელექტრონული წყვილი პარტნიორისგან, დამოკიდებულია როგორც გამხსნელის, ასევე გახსნილი ნაერთის თვისებებზე. ამიტომაც ეს კლასიფიკაცია ითვალისწინებს გამხსნელის დამახასიათებელ ქცევას რეაქციებში ან ხსნარის პროცესებში.
დონორი გამხსნელების საერთო მახასიათებელია კათიონების, როგორც ნაწილაკების უპირატესი ხსნარი, რომელსაც ახასიათებს ელექტრონების დეფიციტი. ანალოგიურად, მიმღები გამხსნელები უპირატესად სოლვატირებენ ანიონებს, როგორც სახეობებს ელექტრონების ჭარბი რაოდენობით.
დონორი გამხსნელების მრავალფეროვნება განისაზღვრება ელემენტების შედარებით დიდი რაოდენობით, რომელთა ატომებს შეუძლიათ იმოქმედონ როგორც ელექტრონული წყვილის დონორები და ამ ელემენტების ქიმიური ნაერთების მრავალფეროვნება. ამიტომ გამხსნელების ამ კლასის წარმომადგენლები იყოფა N- ფუძეებად (სხვადასხვა ტიპის ამინები ან ამიდები), 0-ბაზები (ეთერები და ეთერები, ალკოჰოლები, კეტონები, ნაკლებად ხშირად ალდეჰიდები), S- ბაზები (თიოეთერები, თიოალკოჰოლები, სულფოქსიდები). P- ფუძეები (ტრიალკილ-, ტრიარილ-ან ალკილარილფოსფინები) და მსგავსი.
მიმღები გამხსნელები იყოფა პროტიკებად და აპროტიკული.
გამხსნელებს, რომლებსაც შეუძლიათ მონაწილეობა მიიღონ პროტოლიზურ წონასწორობაში, მათი ფუნქციის მიხედვით, ხშირად ასევე უწოდებენ პროტოფილურ (ძირითად) და პროტოგენურს. (მჟავა). გამხსნელებს, რომლებიც თანაბრად ადვილად ავლენენ ორივე ფუნქციას (ალკოჰოლი, კეტონები), ამფიპროტიულს უწოდებენ.
მრავალი გამხსნელის მოლეკულა მონაწილეობს ხსნარში წყალბადის (H-) ბმის წარმოქმნით. ამის შესაბამისად, შემოთავაზებულია გამხსნელების კლასიფიკაცია H- ბმების წარმოქმნის უნარის მიხედვით.
ამ კლასიფიკაციის სისტემის პირველი კლასი შედგება სითხეებისგან, რომლებშიც არსებობს H- ბმების სამგანზომილებიანი ქსელი. ამ კლასის გამხსნელებს (წყალი, ჭიანჭველა, გოგირდის მჟავა, გლიკოლები) ახასიათებთ ძალიან მაღალი DP და შედარებით მაღალი სიბლანტე და ბლანტი ნაკადის აქტივაციის ენერგიით. როგორც წესი, ამ კლასის გამხსნელები კარგად იხსნება ერთმანეთში და ქმნიან ჰეტერომოლეკულურ ასოციაციებს H- ბმის მეშვეობით.
მეორე კლასი არის სითხეები H- ბმების ორგანზომილებიანი ქსელით. როგორც წესი, ამ კლასის გამხსნელების მოლეკულები შეიცავს ერთ ჰიდროქსილის ჯგუფს (მონოჰიდრული სპირტები, მონობაზური კარბოქსილის მჟავები, ფონოლები და ა.შ.). გამხსნელების ამ ჯგუფში ჰეტერომოლეკულური ასოციაციების შექმნის სურვილი ზოგადად ნაკლებად გამოხატულია, ვიდრე პირველი კლასის წარმომადგენლებში.
მესამე კლასში შედის სითხეები, რომელთა მოლეკულები შეიცავს აზოტის, ჟანგბადის, გოგირდის, ფტორის და ა.შ. ატომებს, რომლებსაც შეუძლიათ შექმნან H-ბმები პროტონის დონორებთან. ამ კლასში შედის ეთერები, ამინები, კეტონები, ალდეჰიდები და ა.შ.
მეოთხე კლასში შედის სითხეები, რომელთა მოლეკულები შეიძლება იყვნენ პროტონის დონორები. მათ შორისაა ქლოროფორმი, დიქლოროეთანი და მსგავსი.
მეხუთე კლასში შედის სითხეები, რომელთა მოლეკულებს არ შეუძლიათ მონაწილეობა მიიღონ H- ბმის წარმოქმნაში ნორმალურ პირობებში. ამ ჯგუფში შედის ალკანები, ნახშირბადის ტეტრაქლორიდი, პერჰალოალკანები და ა.შ.
პარკერმა შესთავაზა გამხსნელების კლასიფიკაცია იონების დაშლის უნარის მიხედვით. ამ კლასიფიკაციის ფარგლებში, გამხსნელები იყოფა ჯგუფებად.
აპოლარული აპროტიკი - სითხეები დაბალი DP (
დიპოლარული აპროტიკი - სითხეები შედარებით მაღალი მნიშვნელობებით DP ( > 15) და დიპოლური მომენტებით (µ > 2D) ,
არ შეიცავს წყალბადს, რომელსაც შეუძლია შექმნას H- ბმა. გამხსნელების ამ ჯგუფის წარმომადგენლები არიან გოგირდის დიოქსიდი, ნიტრობენზოლი, ნიტრომეთანი, აცეტონიტრილი, პროპილენ კარბონატი, DMSO და ა.შ.
პროტიკი - სითხეები, რომელთა მოლეკულები შეიცავს ჯგუფებს, სადაც წყალბადის ატომი დაკავშირებულია ელექტროუარყოფით ატომთან. ამ ჯგუფში შემავალი ნაერთები (კარბოქსილის მჟავები, სპირტები, ფენოლები და სხვ.) გამოირჩევიან H- ბმის წარმოქმნის გამოხატული უნარით.
გამხსნელების გამხსნელების სიმძლავრე ძირითადად იზრდება პირველი ჯგუფიდან მესამემდე.
ბრონსტედმა შესთავაზა გამხსნელების კლასიფიკაცია ნებართვის და პროტოგენურობის კომბინაციის საფუძველზე. ამ მახასიათებლების შესაბამისად, მან გამხსნელები დაყო რვა ჯგუფად.
ბრენსტედის კლასიფიკაციის სხვადასხვა ჯგუფის გამხსნელების მაგალითებია: I - წყალი; II - გოგირდის მჟავა, ჭიანჭველა მჟავა; III - ჰიდრაზინი, DMSO; IV - პროპილენის კარბონატი, ნიტრობენზოლი, აცეტონიტრილი, ნიტრომეთანი; V - ბუტანოლი; VI - თხევადი ბრომო- და წყალბადის იოდი, VII - ტრიეთილამინი, პირიდინი, VIII - ჰექსანი, ქლორბენზოლი.
ბრონსტედის კლასიფიკაცია შესაძლებელს ხდის თითოეული ჯგუფის გამხსნელებში გახსნილი ნაერთების მჟავა-ტუტოვანი თვისებების პროგნოზირებას. ასე რომ, II ჯგუფის გამხსნელში ფუძეების სიძლიერე მნიშვნელოვნად მაღალია, ვიდრე III ჯგუფის გამხსნელში; III ჯგუფის გამხსნელებში მჟავების სიძლიერე ზოგადად უფრო მაღალია, ვიდრე VII ჯგუფის გამხსნელებში და ა.შ.
ცხრილი 4
გამხსნელების ბრონსტედი კლასიფიკაცია.
| საკუთრება | გამხსნელის ტიპი |
|||||||
| მე | II | III | IV | ვ | VI | VII | VIII |
|
| DP | + | + | + | + | - | - | - | - |
| პროტოგენურობა | + | + | - | - | + | + | - | - |
| Ოქმი | + | - | + | - | + | - | + | - |
* ნიშნები + და - პირველ რიგში შეესაბამება მაღალ და დაბალ DP-ს, სხვა სტრიქონებში - ამ თვისების არსებობას ან არარსებობას.
ასევე შემოთავაზებულია გამხსნელების კლასიფიკაცია, რომელიც დაფუძნებულია რვა ფიზიკურ მახასიათებლებზე: კირკვუდის ფუნქცია, მოლური რეფრაქცია, ჰილდებრანდის ხსნადობის პარამეტრი, გარდატეხის ინდექსი, დუღილის წერტილი, დიპოლური მომენტი, ასევე ყველაზე შევსებული და ყველაზე დაბალი შეუვსებელი მოლეკულური ორბიტალების ენერგია. ამ თვისებების კომბინაციის მიხედვით, შემოთავაზებულია გამხსნელების დაყოფა ცხრა ჯგუფად:
1) აპროტური დიპოლარული (მაგალითად, აცეტონიტრილი, ნიტრომეთანი, აცეტონი, 1,2-დიქლოროეთანი);
2) აპროტური მაღალდიპოლარული (DMSO, DMF, DMAA, პროპილენის კარბონატი, ნიტრობენზოლი);
3) აპროტიკული უაღრესად დიპოლარული და ძლიერ პოლარიზებადი (სულფოლანი, HMFTA);
4) არომატული არაპოლარული (ბენზოლი, ტოლუოლი);
არომატული შედარებით პოლარული (ქლორბენზოლი, ო-დიქლორბენზოლი, აცეტოფენონი);
ელექტრონის დონორი (ტრიეთილამინი, ეთერები, დიოქსანი);
გამხსნელები H-ბმა (ალკოჰოლი, კარბოქსილის მჟავები);
მტკიცედ დაკავშირებული გამხსნელები H- ბმასთან (ფორმამიდი,
დიეთილენ გლიკოლი, წყალი);
განუსაზღვრელი ფუნქციის მქონე გამხსნელები (ნახშირბადის დისულფიდი, ქლოროფორმი).
1.7 მყარი ნივთიერებების ხსნადობის განსაზღვრის მეთოდის მიმოხილვა
1.7.1 ხსნადობის გრავიმეტრული განსაზღვრა
მეთოდი შედგება გამხსნელის გარკვეულ მასაში გახსნილი ნივთიერების მასის განსაზღვრაში (სპეციფიკური ხსნადობა P ` ) და ხსნადობის გამოთვლა, როგორც ნივთიერების მასა, რომელიც შეიძლება გაიხსნას 100 გრამ მოცემულ გამხსნელში. მეთოდი შეფასებულია.ტექნოქიმიურ სასწორზე აწონეთ საცდელი ნივთიერების ნაწილი (გ 1 ` ). აწონეთ გამხსნელის ნიმუში (g p). განსაზღვრეთ მშრალი ფილტრის წონა (გ 2). ჩაასხით ნივთიერების აწონილი ნაწილი გამხსნელში, თუ ნივთიერება მთლიანად დაიშალა, მაშინ საჭიროა მისი დამატება, სანამ დაშლა არ შეჩერდება, გაითვალისწინეთ გამხსნელში ჩასხმული ნივთიერების სრული წონა (გ 1). გაფილტრეთ გაუხსნელი ნივთიერება ფილტრის მეშვეობით და განსაზღვრეთ სველი ფილტრის წონა ნივთიერების ნარჩენებით (გ 3). გააშრეთ ფილტრი ნივთიერების ნარჩენებით მუდმივ წონამდე (გ 4). გამოთვალეთ სპეციფიკური ხსნადობა ფორმულის გამოყენებით:
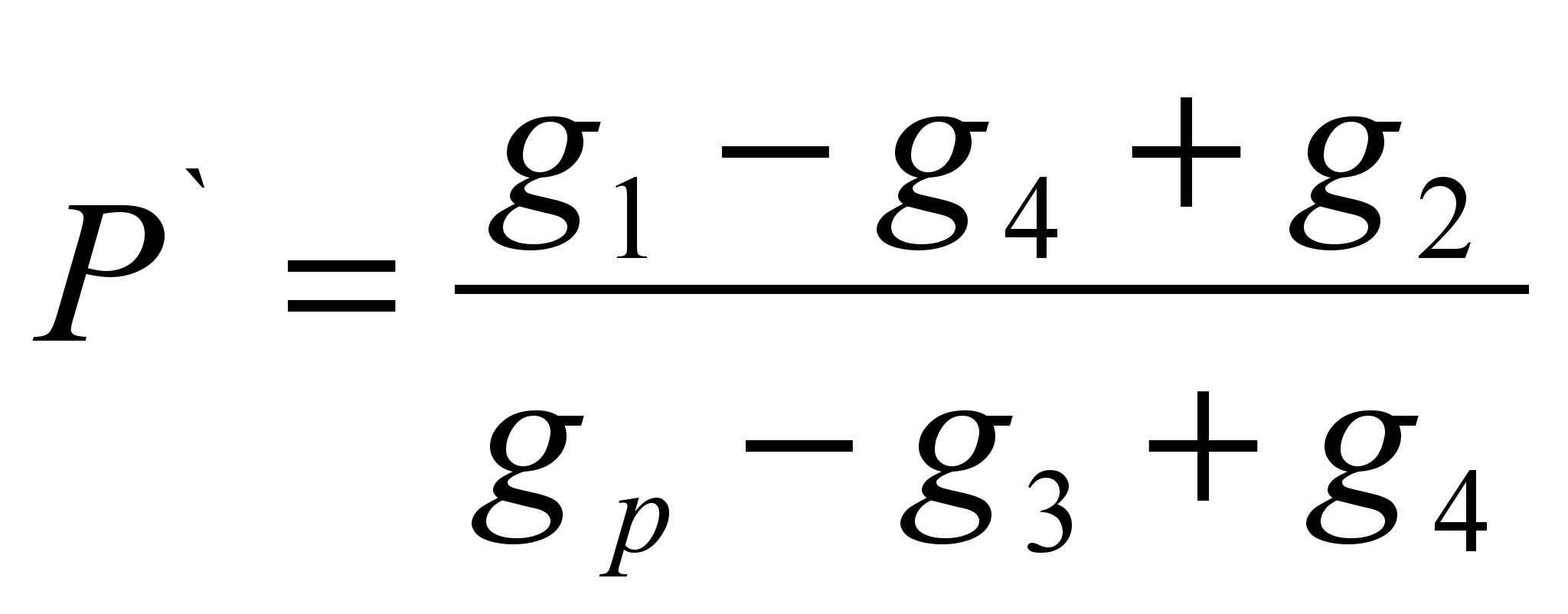
P \u003d P` 100 (გ / 100 გ)
ცხრილი 5
ფენოლფთალეინის ხსნადობა ზოგიერთ გამხსნელებში
| გამხსნელი | ხსნადობა | რ |
| ძლიერ პოლარული |
||
| წყალი | 0,0002 | 78,30 |
| მეთილის სპირტი | 19,42 | 52,66 |
| სუსტად პოლარული |
||
| ეთანოლი | 17,29 | 24,55 |
| აცეტონი | 16,98 | 20,70 |
| ქლოროფორმი | 2,97 | 4,81 |
| არაპოლარული |
||
| ქსილენი | 0,19 | 2,43 |
| ტოლუენი | 0,17 | 2,38 |
| ბენზოლი | 0,16 | 2,27 |
1.7.2 ელექტროქიმიური მეთოდი.
1. აკრიფეთ დანადგარი ელექტროლიტური ხსნარის მოცულობის წინააღმდეგობის დასადგენად სქემის მიხედვით (იხ. სურ. 3).
2. საზომ ჭურჭელში ასხამენ გარკვეული კონცენტრაციის კალიუმის ქლორიდის წყალხსნარს და ელექტროდებით ჭურჭელს ათავსებენ მოცემულ ტემპერატურაზე თერმოსტატში. 15-20 წუთის შემდეგ, ჭურჭელი უკავშირდება B და D წერტილებს ინსტალაციას.
3. წინაღობის ყუთისა და მოძრავი კონტაქტის C-ის დახმარებით ხდება ხიდის დაბალანსება, მიიღწევა ან უმცირესი ხმა ტელეფონში, ან სინუსოიდის მინიმალურ ამპლიტუდას ოსილოსკოპის ეკრანზე. კომპენსაციის პუნქტს უახლოვდება ჯერ რეოკორდის ერთი ბოლოდან, შემდეგ მეორედან. R x-ის გაზომვა და შემდგომი გამოთვლა:
R x = R 1 
გაიმეორეთ 3-4 ჯერ სხვადასხვა წინააღმდეგობებზე R 1. ამ შემთხვევაში მოძრავი კონტაქტი არ უნდა მიუახლოვდეს რეოკორდის ბოლოებს. თუ გაზომვებში გადახრები ნაკლებია 0,5% -ზე, მაშინ შედეგები განიხილება დამაკმაყოფილებლად და გადადით ჭურჭლის მუდმივის გამოთვლაზე ფორმულის გამოყენებით:
K=  /
ვ =
Rx
/
ვ =
Rx
სადაც R x არის ხსნარის წინააღმდეგობა; -
სპეციფიკური ელექტრული გამტარობა.
4. მცირე რაოდენობით მარილს ასხამენ 100 მლ წყალში და კოლბას მჭიდროდ ხურავს საცობით, განუწყვეტლივ შეანჯღრიეთ 20 წუთის განმავლობაში. მიღებული სუსპენზია იწოვება მინის ფილტრის მეშვეობით და ნალექი გამოიყენება გაჯერებული ხსნარის მოსამზადებლად. მიღებულ ხსნარს ასხამენ ჭურჭელში ელექტრული გამტარობის გასაზომად და ტემპერატურის კონტროლის შემდეგ იზომება ხსნარის წინააღმდეგობა.
=
კ /
Rx  = /
C
= /
C
სადაც C არის ხსნარის ნორმალურობა, კგ ეკვივი / მ 3.
ვინაიდან გაჯერებულ ხსნარში მარილის კონცენტრაცია დაბალია, მაშინ = . განტოლების საფუძველზე:
C = ( რ - in ) /
სად რარის მარილის ხსნარის ელექტრული გამტარობა.
ხსნადობის პროდუქტი მონოვალენტური ელექტროლიტისთვის:
![]() = ( C) 2
= ( C) 2
6. ჩაწერეთ შედეგები ცხრილში:
| მარილი | t, C0 | , სმ/მ | წინააღმდეგობა, ოჰ | კ | | | C | ლ |
|||
| R1 | R2 (AC) | R3 (CB) | R X |
||||||||
ცხრილი 6
KCI ხსნარის სპეციფიკური გამტარობა
| t, C0 | 1 N KCI | 0.1N | 0.02N | 0.01N |
| 10 4, Ohm -1 სმ -1 |
||||
| 0 | 654,1 | 71,5 | 15,21 | 7,76 |
| 10 | 831,9 | 93,3 | 19,94 | 10,20 |
| 14 | 906,3 | 102,5 | 21,93 | 11,21 |
| 16 | 944,1 | 107,2 | 22,94 | 11,73 |
| 18 | 982,2 | 111,9 | 23,97 | 12,25 |
| 20 | 1020,7 | 116,7 | 25,01 | 12,78 |
| 22 | 1055,4 | 121,5 | 26,06 | 13,32 |
| 24 | 1098,4 | 126,4 | 27,12 | 13,86 |
| 25 | 1118,0 | 128,8 | 27,65 | 14,13 |
| 26 | 1137,7 | 131,8 | 28,19 | 14,41 |
| 28 | 136,2 | 29,27 | 14,96 |
|
| 30 | 141,2 | 30,36 | 15,52 |
|
| 32 | 146,2 | 31,46 | 16,09 |
|
| 34 | 151,3 | 32,56 | 16,67 |
|
| 36 | 156,4 | 33,68 | ||
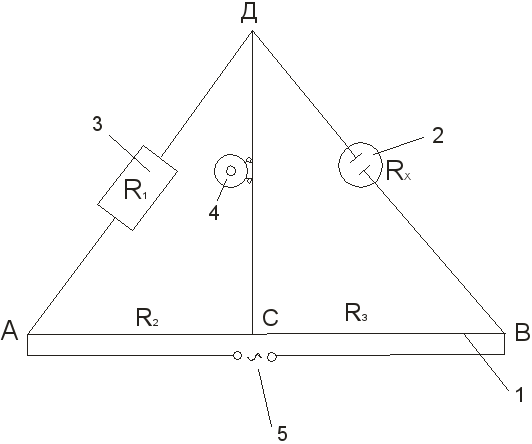
ნახ.3ელექტრული გამტარობის განსაზღვრის ინსტალაციის სქემა:
1 - სახაზავზე გადაჭიმული მავთული; 2 – საზომი ჭურჭელი ელექტროდებით; 3 - რეოსტატი; 4 - დაბალი წინააღმდეგობის ტელეფონი; 5 - მიმდინარე წყარო.
1.7.3
ფოტოელექტროკალომეტრიული მეთოდი.
მეთოდი ეფუძნება ოპტიკური სიმკვრივის დანამატის კანონს, რომელიც ექვემდებარება სინათლის შთანთქმის ძირითად კანონს.
პროგრესი
1. ოპტიმალური სინათლის ფილტრების არჩევანი.
1.1. მოათავსეთ 25 მლ მოცულობით კოლბაში:
შეურიეთ ხსნარები და გაზომეთ ოპტიკური სიმკვრივე შერჩეულ გამხსნელთან მიმართებაში სხვადასხვა სინათლის ფილტრებით ამისთვის ყველაზე შესაფერის კუვეტებში. მიუთითეთ კუვეტის ზომა. FEC-ზე მუშაობის პროცედურა იხილეთ ინსტრუმენტის პასპორტში.
1.2. შეიყვანეთ ცხრილში მიღებული მონაცემები:
1.3. გრაფიკულ ქაღალდზე დახაზეთ სინათლის შთანთქმის მრუდები A \u003d f (, nm) და განსაზღვრეთ რომელი ფილტრები რომელ ტალღის სიგრძეზეა საუკეთესოდ გამოყენებული მუშაობისას.
2. შეთქმულება.
2.1. მოამზადეთ სტანდარტული გადაწყვეტილებების სერია. გაზომეთ სტანდარტული ხსნარების თითოეული მომზადებული სერიის ოპტიკური სიმკვრივე ადრე შერჩეული ფილტრების გამოყენებით.
2.2. ცალ-ცალკე შეიყვანეთ ექსპერიმენტული მონაცემები ცხრილში (იხ. ქვემოთ) ხსნარების თითოეული სერიისთვის, განახორციელეთ შედეგების სტატისტიკური დამუშავება.
2.3. გრაფიკულ ქაღალდზე ცხრილის მონაცემების გამოყენებით დახაზეთ A = f (C ნივთიერებები) და გამოთვალეთ ფენოლფთალეინის ხსნადობა გამხსნელებში.
ფენოლფთალეინის ხსნადობის შესახებ ლიტერატურის შესწავლის შემდეგ შეირჩა ზემოთ მითითებული მეთოდები. და ჩვენს ლაბორატორიულ პირობებში გამოყენების შესაძლებლობის, ხანგრძლივობის, განხორციელების სიმარტივის მხრივ მათი შედარების შემდეგ შეირჩა ხსნადობის გრავიმეტრული განსაზღვრის მეთოდი.
2. ექსპერიმენტული ნაწილი
2.1 ფენოლფთალეინის სინთეზი
სინთეზი განხორციელდა ლიტერატურის მიმოხილვაში მითითებული მეთოდის მიხედვით (პუნქტი 1.4.1).
| მოქმედება | დაკვირვება |
| 1. აწონილი: 5 გ -ფთალიუმის ანჰიდრიდი (ქიმიურად სუფთა) | თეთრი კრისტალური ფხვნილი ვარდისფერი, დელიკატური კრისტალები |
| 2. რეაგენტები მოვათავსე ბრტყელძირიან კონუსურ კოლბაში (100 მლ), თერმომეტრთან ერთად მორევით. | ჩამოყალიბდა ფაფის მსგავსი მასა და ნარევი ოდნავ თბება (t ≥ 37 0 C). |
| 3. კოლბა დავდე ქვიშის აბაზანაზე (ტემპერატურა 125 - 130 0 C დიაპაზონში). თბება 1,5 საათის განმავლობაში. | 45 0 C ტემპერატურაზე ფენოლი დნება, ფტალის ანჰიდრიდი (თეთრი ფანტელები) ცურავს მოყავისფრო დნებაში. 30 წუთის გახურების შემდეგ (t ≥ 130 0 C) წარმოიქმნა ერთგვაროვანი ყავისფერი-ჟოლოსფერი დნობა. გახურებიდან 1 საათის შემდეგ - სისხლის წითელი ფერის ერთგვაროვანი დნება. გათბობა შეწყდა 1,5 საათის შემდეგ. |
| 4. მან დაასხა ცხელი დნობა კოლბაში მდუღარე წყლით და გამოხდილი ფენოლი წყლის ორთქლით (იხ. სამონტაჟო ნახაზი ლიტერატურის მიმოხილვის შესაბამის ნაწილში). | კოლბაში მდუღარე წყალში, ცხელი დნობის ჩამოსხმის შემდეგ, ფენოლფთალეინის ღია ყვითელი ჩამოუყალიბებელი ნაჭრები დაიწყო ცურვა, ხდება წყლის უმნიშვნელო დაბინდვა, ტ ? 99 0 C. გამოიყოფა მოღრუბლული დისტილატი (V = 50 მლ). 15 წუთის გამოხდის შემდეგ, გამჭვირვალე დისტილატმა დაიწყო წვეთოვანი. |
| 5. დაასხით ხსნარი ფენოლფთალეინთან ერთად ბუხნერის ძაბრზე ნალექის ფილტრში გადატანის გარეშე. ნალექი გავრეცხე სამი პორცია ცივი წყლით, თითო 100 მლ. | ხსნარის ტემპერატურაა 26 0 С, ხსნარში (V? 170 მლ) ფენოლფთალეინის მარცვლისებრი ნაჭრები, ოდნავ მოყვითალო ფერის. |
| 6. გახსნილი გაფილტრული ფენოლფთალეინი 15 მლ თბილ ნატრიუმის ჰიდროქსიდის ხსნარში (? = 5%). | T NaOH ?42 0 С, ხსნარის ფერი დაფიქსირდა - მუქი წითელი. |
| 7. გაფილტრული მუქი წითელი ხსნარი. | ხსნარის ტემპერატურა? 35 0 C. ფილტრაციის შემდეგ, ფილტრზე დგას ნივთიერების თხელი, მოვარდისფრო-თეთრი, წვრილად კრისტალური ფენა (სავარაუდოდ, ეს არის ურეაქციო ფთალიური ანჰიდრიდი). |
| 8. ფილტრატს (V? 50 მლ) დაუმატეთ 5 მლ ძმარმჟავა (ც.), 1 მლ ნაწილებად, აურიეთ. | დაფიქსირდა ხსნარის ფერის ცვლილება მუქი წითელიდან ნაცრისფერ-თეთრ, მოღრუბლული (ქერქოვანი) ხსნარით. ხსნარი არ გაცხელდა. ხსნარის ტემპერატურა? 31 0 C. |
| 9. დამატებულია 2 წვეთი მარილმჟავა (c.) | ვიზუალური ცვლილებებიარ მომხდარა |
| 10. გააჩერეთ 1 საათი. | შუშის ძირში იყო ფანტელები, ნალექის ზემოთ გამჭვირვალე ხსნარი, ნაცრისფერ-თეთრი ფერის ფანტელები. |
| 11. გაფილტრული მიღებული ნალექი. | ფილტრზე არის თეთრ-ნაცრისფერი ლაქა. M ow? 5.07 |
სულ მიღებული იქნა 5,07გრ სველი პრეპარატი.
2.2 რეკრისტალიზაცია ცხელი სპირტიდან
ხელახალი კრისტალიზაცია განხორციელდა ლიტერატურის მიმოხილვაში მითითებული მეთოდის მიხედვით (პუნქტი 1.4.4). განხორციელდა ერთი გამეორება. მოწყობილობის ნახაზი ნაჩვენებია ლიტერატურის მიმოხილვის 1.4.4 პუნქტში.
| მოქმედება | დაკვირვება |
| ფენოლფთალეინის აწონილი ნაწილი (5,07 გ) მოათავსეს კოლბაში და დაუმატეს 50 მლ 96% ეთანოლი. | ფეოლფთალეინის მცირე ნაწილი დაიშალა. ალკოჰოლი ოდნავ მოღრუბლულია. |
| კოლბა გაცხელდა რბილ ადუღებამდე. ალკოჰოლს უმატებდნენ მანამ, სანამ ფენოლფთალეინი მთლიანად არ დაიშალა (თითოეული 0,5 მლ). VETOH = 7 მლ. | ფენოლფთალეინი მთლიანად იხსნება. ალკოჰოლი მოღრუბლულია. t ნარევი = 85 o C. |
| ნარევი ნელ-ნელა გაცივდა ოთახის ტემპერატურამდე. | t ნარევი = 19 o C. ბევრი თეთრი კრისტალები ამოვარდა ხსნარიდან პატარა კრისტალების სახით. გამოსავალი გამჭვირვალეა. |
| დალექილი კრისტალები ამოიღეს და გარეცხეს ფილტრზე ყინულის წყლით, გააშრეს ფილტრის ქაღალდის ფურცლებს შორის. | ჰაერის კრისტალების სახით მიღებული ფენოლფთალეინი თეთრ-ნაცრისფერი, წვრილმარცვლოვანი. მ (ფენოლფთალეინი) = 4,08 გ. რეკრისტალიზაციის გამოსავლიანობა იყო 83,5%. |
რეკრისტალიზაციის გაანგარიშება:
რეკრისტალიზაციის გამოსავალი:
W,% \u003d (მ (ფენოლფთალეინი) მშრალი 100%) / მ (ფენოლფთალეინი) სველი
W,% =  % = 83,5 %
% = 83,5 %
სინთეზის მოსავლიანობის გაანგარიშება:
0,0388 მოლი ფენოლფთალეინის მისაღებად (თეორიული) ან m = 0,0338 მოლი 318 გ/მოლი = 10,7 გ.
გამომავალი თეორიიდან:
W=  100 % = 40, 5 %
100 % = 40, 5 %
ამრიგად, პრინციპში საკმარისიფენოლფთალეინი (დაახლოებით 4,08 გ) შემდგომი კვლევისთვის. სინთეზი განხორციელდა პროდუქტის მისაღები მოსავლიანობით.
2.3 ხსნადობის განსაზღვრა
ფენოლფთალეინის ხსნადობის განსაზღვრა განხორციელდა გრავიმეტრიით (იხ. პუნქტი 1.7.1).
გამხსნელებად შეირჩა ქლოროფორმი, ბენზოლი და ქსილენი. ვინაიდან ლიტერატურული მონაცემების მიხედვით (იხ. ცხრილი 5), მათში ფენოლფთალეინს აქვს მისაღები ხსნადობა ფენოლფთალეინის ხელმისაწვდომი მასისთვის. წყალი არ გამომიყენებია, რადგან ფენოლფთალეინს აქვს ძალიან დაბალი ხსნადობა (დაახლოებით 10-4 გ 100 გ-ზე). ასევე არ გამომიყენებია ეთანოლი, რადგან ფენოლფთალეინს აქვს ძალიან კარგი ხსნადობა ალკოჰოლში და საჭიროა ნივთიერების დიდი მოხმარება. განსაზღვრა განხორციელდა 21 ± 1°C (თხევადი ფაზის ტემპერატურა). ინფუზია გაგრძელდა 30 ± 1 წუთი, ენერგიული მორევით.
გაანგარიშების ფორმულები:
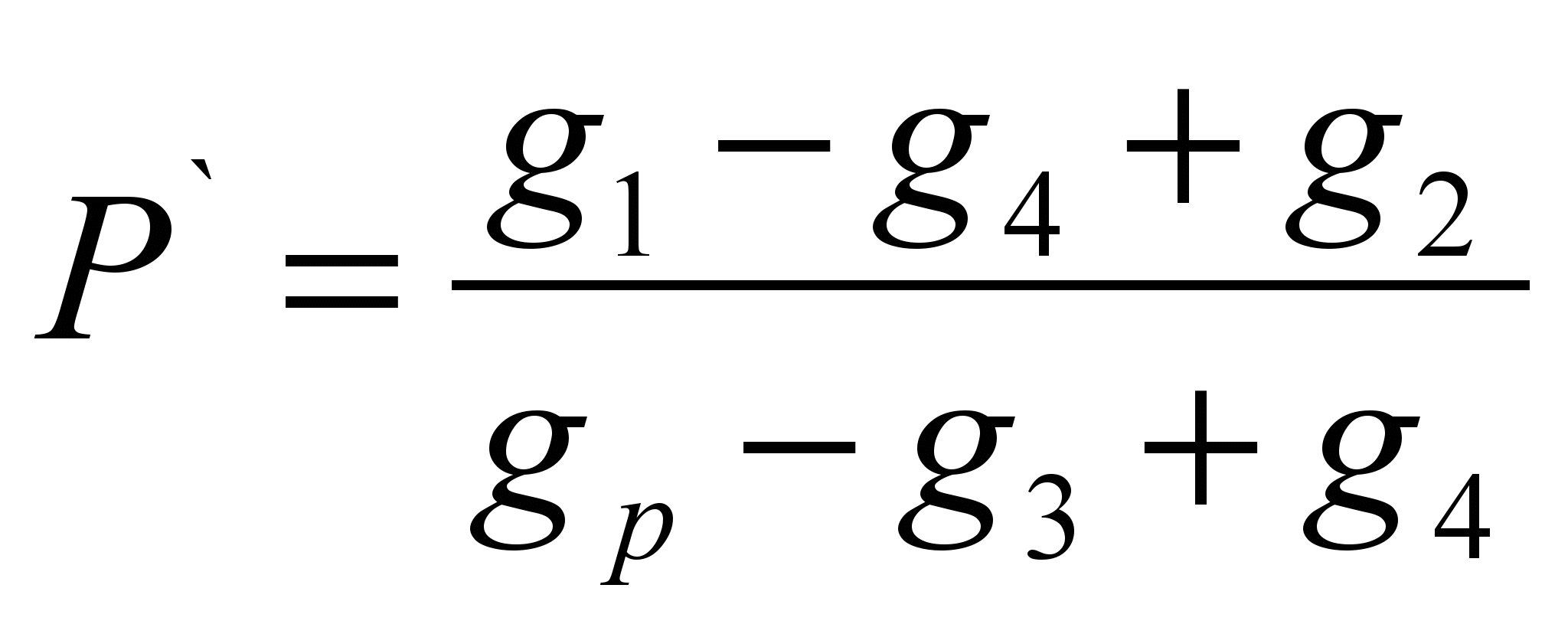 ; P \u003d P` 100 (გ / 100 გ)
; P \u003d P` 100 (გ / 100 გ)
სადაც, g 1 - ფენოლფთალეინის ნიმუში, გ;
G 2 - მშრალი ფილტრის წონა, გ;
G 3 - სველი ფილტრის წონა ფენოლფთალეინის ნარჩენებით, გ;
G 4 - მშრალი ფილტრის წონა ფენოლფთალეინის ნარჩენებით, გ;
G p – გამხსნელის ნიმუში, გ;
Р – ხსნადობა, გ/100გრ ხსნარი;
Р`- სპეციფიკური ხსნადობა, გ/1გ სოლ.
განმარტების შედეგები:
P (ფენოლფთალეინი / ქლოროფორმი) = (3.0 ± 0.03) გ / 100 გ ქლოროფორმი; ? = 1%.
P (ფენოლფთალეინი / ქსილენი) = (0,22 ± 0,01) გ / 100 გ ქსილენი; ? = 6%.
P (ფენოლფთალეინი / ბენზოლი) \u003d (0,19 0,01) გ / 100 გ ბენზოლი; = 6%.
ექსპერიმენტის მიხედვით აშენდა კრებსითი ცხრილი და გრაფიკი.
ცხრილი 7
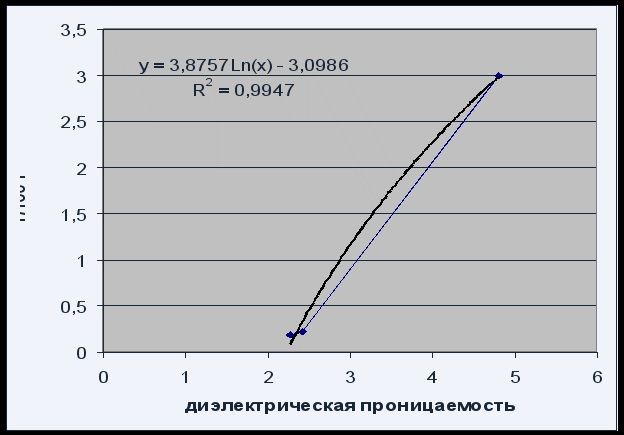
ნახ.4ხსნადობის დამოკიდებულება გამხსნელის გამხსნელზე
ხსნადობის დამოკიდებულება გამხსნელის ნებადართულობაზე შეიძლება აღწერილი იყოს ლოგარითმული განტოლებით P = 3,8757 Ln(x) - 3,0986 R 2 = 0,995 დამაკმაყოფილებელი ხარისხით.
გამომდინარე იქიდან, რომ ფენოლფთალეინის ხსნადობა იზრდება გამხსნელის დიელექტრიკული მუდმივის მატებასთან ერთად (მისი პოლარობის ზრდა), შეგვიძლია ვთქვათ, რომ ფენოლფთალეინი არის პოლარული ნაერთი.
დასკვნა
ნაშრომის მსვლელობისას გაანალიზდა 26 ლიტერატურული წყარო. აღწერილია ზოგადი პოზიციამიღება ფენოლისა და ფტალის ანჰიდრიდის ურთიერთქმედების რეაქციის გამოყენებით. ჩატარდა სინთეზის მეთოდების მიმოხილვა (გამოვლინდა ერთი მეთოდი, სხვადასხვა ლიტერატურულ წყაროებში მეთოდი განსხვავდებოდა რეაგენტების დატვირთვის მასით) ფენოლფთალეინის. ამ მეთოდით სინთეზის განხორციელება არ არის გართულებული გვერდითი პროცესებით. განისაზღვრება ძირითადი საფრთხეები გამოყენებული ნივთიერებების სინთეზისა და დამუშავებისას. შეირჩა ხსნადობის განსაზღვრის მეთოდები. ქლოროფორმი, ქსილენი და ბენზოლი არჩეულ იქნა გამხსნელებად ხსნადობის დასადგენად.
ფენოლფთალეინი სინთეზირებული იყო 40,5% გამოსავლით. სინთეზის, გაწმენდისა და იზოლაციის პირობები დაცული იყო მეთოდის მონაცემების მკაცრი დაცვით.
ფენოლფთალეინის ხსნადობა (გრავიმეტრული განსაზღვრის მიხედვით) იყო: 3,00 ± 0,03 გ/100 გ ქლოროფორმი, 0,22 ± 0,01 გ/100 გ ქსილენი, 0,19 ± 0,01 გ/100 გ ბენ.
ფენოლფთალეინის ხსნადობის ზრდა გამხსნელის დიელექტრიკული მუდმივის მატებასთან ერთად ადასტურებს, რომ ფენოლფთალეინი არის პოლარული ნაერთი.
გამოყენებული ლიტერატურის სია
1.აგრონომოვი ა.ე. ლაბორატორიული მუშაობა ორგანულ ქიმიაში. – მ.: განმანათლებლობა, 1977. 230 გვ.2. ასტახოვა ლ.ი., კრივენკო ა.პ. სემინარი ორგანულ ქიმიაზე. – მ.: მირი, 1990. 180 გვ.
3. Bishot E. ინდიკატორები. – მ.: მირი, 1976. 356 გვ.
4. Buhler K., Pearson D. Organic syntheses. მ.: უმაღლესი. შ.კ., 1973. 340 გვ.
5. გერასიმოვი ია.ი. ხსნარების თერმოდინამიკა. – M.: Izd – v MGU, 1980. 170 გვ.
6. Gitis S. S. სემინარი ორგანული ქიმიის შესახებ /S. ს.გიტისი, ა.ი.გლაზი, ა.ი.ივანოვი. – მ.: ვშ, 1991 წ.
7.გოლოდნიკოვი გ.ვ. სემინარი ორგანულ ქიმიაზე. – მ.: ქიმია, 1978. 160-იანი წლები.
8. Grandberg I. I. პრაქტიკული სამუშაოები და სემინარები ორგანულ ქიმიაში: სახელმძღვანელო სტუდენტებისთვის. უნივერსიტეტები. – მე-4 გამოცემა, შესწორებული. და დამატებითი – M.: Bustard, 2001 წ.
9. Ivanov V. G. სემინარი ორგანული ქიმიის შესახებ: პროკ. შემწეობა სტუდენტებისთვის. უფრო მაღალი პედ. სახელმძღვანელო დაწესებულებები /ვ. გ.ივანოვი, ო.ნ.გევა, იუ.გ.გავეროვა. - მ .: საგამომცემლო ცენტრი "აკადემია", 2000 წ.
10. კარაპეტიანცი მ.ხ. ქიმიური პროცესების თეორიის შესავალი. - მ .: უმაღლესი. შ.კ., 1975. 280 გვ.
11. კირილინი ვ.ა. ხსნარების თერმოდინამიკა. – მ.: ენერგია, 1980. 80გვ.
12. კოგანი ვ.ბ. ხსნადობის სახელმძღვანელო. - M.: L. მეცნიერებათა აკადემიის გამომცემლობა, 1961. 300 გვ.
13. Levina R. Ya. პრაქტიკული მუშაობა ორგანულ ქიმიაში. – მ.: ქიმია, 1980 წ.
14.Organicum: პრაქტიკული მუშაობა ორგანულ ქიმიაზე. - მ.: მირი, 1979 - V.2.
15. პეტროვი ა.ა. ორგანული ქიმია: სახელმძღვანელო უნივერსიტეტებისთვის /A. ა. პეტროვი, ჰ.ვ.ბალიანი, ა.ტ.ტროშჩენკო. – მე-5 გამოცემა, შესწორებული. და დამატებითი - პეტერბურგი: ივან ფედოროვი, 2002 წ.
16. Reichard K. გამხსნელები და საშუალო ეფექტი ორგანულ ქიმიაში. – მ.: მირი, 1991. 182 გვ.
17. ლაბორატორიული კვლევების გზამკვლევი ორგანულ ქიმიაში: გზამკვლევი უნივერსიტეტებისთვის /ნ. ნ.არტემიევა, ვ.ლ.ბელობოროდოვა, ს.ე.ზურაბიანი და სხვები; რედ. N.A. ტიუკავკინა. - მე-2 გამოცემა, შესწორებული. და დამატებითი – M.: Bustard, 2002 წ.
18.თვისებები ორგანული ნაერთები: საცნობარო წიგნი / რედ. ა.ა.პოტეხინა. - ლ.: ქიმია, 1984 წ.
19. Smolina T. A. პრაქტიკული სამუშაო ორგანულ ქიმიაში: მცირე სახელოსნო /T. ა.სმოლინა, ნ.ვ.ვასილიევა, ნ.ბ.კუპლეცკაია. - მე-2 გამოცემა, შესწორებული. – მ.: განმანათლებლობა, 1986 წ.
20.ქიმიკოსის სახელმძღვანელო / რედ. ბ.ნ. ნიკოლსკი და სხვები - ლ.: ქიმია, 1964 წ.
21. Stromberg A. G. ფიზიკური ქიმია: პროკ. ქიმ. სპეციალისტი. უნივერსიტეტები /ა. გ.სტრომბერგი, დ.პ.სემჩენკო; რედ. A. G. Stromberg. - მე-5 გამოცემა, რევ. – მ.: ვშ, 2003 წ.
22. Traven VF ორგანული ქიმია: სახელმძღვანელო უნივერსიტეტებისთვის. - M .: ICC "აკადემკნიგა", 2004. - T.1.
23. ფიზიკური ქიმია. 2 წიგნში. Წიგნი. 1. მატერიის აგებულება. თერმოდინამიკა: პროკ. უნივერსიტეტებისთვის /კ. ს.კრასნოვი, ნ.კ.ვორობიოვი, ი.ი.გოდნევი და სხვები; რედ. K. S. Krasnova - 3th ed., Rev. – მ.: ვშ, 2001 წ.
24. ფიალკოვი იუ.ა. გამხსნელი, როგორც კონტროლის საშუალება ქიმიური პროცესი. - ლ.: ქიმია, 1990. 240 გვ.
25.ქიმიური ენციკლოპედიური ლექსიკონი/ რედ. ი.ლ.კნუნიანცი და სხვები - მ .: საბჭოთა ენციკლოპედია, 1983.
26. ხრამკინა მ.ნ. სემინარი ორგანულ სინთეზზე. - მ.: მოსკოვის სახელმწიფო უნივერსიტეტის გამომცემლობა, 1985. 473 გვ.
ფენოლფთალეინის ემპირიული ფორმულა: C20H14O4 .
რა არის ფენოლფთალეინი?
ვიკიპედიის მიხედვით, 4,4'-დიოქსიფთალოფენონი ან 3,3-ბის-(4-ჰიდროქსიფენილ)ფტალიდი წარმოადგენს მჟავა-ტუტოვანი მაჩვენებელი .
ნივთიერებები, როგორიცაა ლაკმუსი, ფენოლფთალეინი, მეთილის ფორთოხალი ფართოდ გამოიყენება ქიმიაში ხსნარების მჟავიანობის დასადგენად.
უცვლელი სახით, აგენტი არის გამჭვირვალე კრისტალები, რომლებიც ცუდად იხსნება წყალში, მაგრამ ძალიან ხსნადია ალკოჰოლებში და დიეთილის ეთერი . შესაძლებელია ნივთიერების სინთეზირება ფენოლი და ფთალიური ანჰიდრიდი კონდენსაციის რეაქციის საშუალებით, გამოყენებით თუთიის ქლორიდი Როგორ კატალიზატორი (შეგიძლიათ გამოიყენოთ კონცენტრირებულიც გოგირდის მჟავა ).
ეს ნივთიერება მჟავე გარემოში ( pH 0-დან 3-მდე) იძენს გამოხატულ ნარინჯისფერ ელფერს. ოდნავ მჟავე და ნეიტრალურ გარემოში ( pH 4-დან 7-მდე) ხსნარი არ იცვლის ფერს. ფენოლფთალეინის დახმარებით შესაძლებელია ტუტე გარემოს ამოცნობა. ვინაიდან პროდუქტი ხსნარში ჟოლოსფერ ფერს იღებს, pH რაც არის 8-დან 10-მდე ( ტუტე ხსნარი). თუ ღირებულებები pH 11-დან 14-მდე, მაშინ მაჩვენებელი არ იმოქმედებს პრეპარატის ფერზე. ფენოლფთალეინი გამოიყენება ტიტრაცია სხვადასხვა წყალხსნარები in ანალიზური ქიმია , ჩვეულებრივ გამოიყენება ალკოჰოლში გახსნილი ნივთიერება.
ფენოლფთალეინი ასევე ფართოდ გამოიყენება მედიცინაში. Რა პურგენი ? ეს არის ფენოლფთალეინის სინონიმი. გასულ საუკუნეში ნივთიერება აქტიურად გამოიყენებოდა როგორც საფაღარათო საშუალება. პრეპარატი აქტიურად ასტიმულირებს ნაწლავის მოძრაობას. ახლა პურგენ-საფაღარათო საშუალება იშვიათად გამოიყენება ორგანიზმში დაგროვების და თირკმელების ფუნქციონირებაზე უარყოფითად ზემოქმედების უნარის გამო.
ფარმაკოლოგიური ეფექტი
საფაღარათო საშუალება.
ფარმაკოდინამიკა და ფარმაკოკინეტიკა
ფენოლფთალეინი, რა არის ეს?
პურგენი ძლიერი საფაღარათო საშუალებაა. მისი მოქმედების მექანიზმი ეფუძნება პერისტალტიკა ნაწლავები. ეს ხდება ნივთიერების ინჰიბირების უნარის გამო ნატრიუმ-კალიუმის ატფ-აზა , მასტიმულირებელი ადენილციკლაზა და ამაღლება ბიოსინთეზი . ნივთიერება ასტიმულირებს სინაფსებს და ნაწლავის კედლების ნერვულ დაბოლოებებს, ირღვევა წყლის და ელექტროლიტური ბალანსი in კუჭ-ნაწლავის ტრაქტი სითხე გროვდება.
პირველი დოზის შემდეგ, საშუალების ეფექტი ხდება ერთი დღის განმავლობაში. ნივთიერება მიდრეკილია ორგანიზმში დაგროვებისკენ, აქვს გამაღიზიანებელი ეფექტი თირკმელებზე, აქვს პროკანცეროგენული თვისებები.
გამოყენების ჩვენებები
ამ ნივთიერების შემცველ პრეპარატებს იყენებენ ქრონიკულ საფაღარათო საშუალებად.
უკუჩვენებები
საფაღარათო პურგენი უკუნაჩვენებია:
- თირკმლის დაავადებით;
- პაციენტებთან ერთად ნაწლავის გაუვალობა ;
- როდესაც ფენოლფთალეინზე;
- როდესაც პაციენტს აქვს სიმპტომების კომპლექსი" მწვავე მუცელი ”.
პრეპარატი არ უნდა იქნას გამოყენებული დიდი ხნის განმავლობაში. განსაკუთრებული სიფრთხილეა საჭირო ხანდაზმულთა წამლით მკურნალობისას.
Გვერდითი მოვლენები
პურგენის ტაბლეტებმა შეიძლება გამოიწვიოს:
- გულის პალპიტაციების გამო წყლის და ელექტროლიტური ბალანსი ;
- ალბუმინურია ;
- კოლაფსი ;
- სისხლში კალიუმის დონის დაქვეითება;
- შარდის ფერის შეცვლა ყვითელიდან ვარდისფერში ან ყავისფერში;
- კანის გამონაყარი და
პურგენის ინსტრუქცია (მეთოდი და დოზა)
საფაღარათო საშუალება ხელმისაწვდომია ტაბლეტების, სხვადასხვა დოზის ან ფხვნილის სახით პერორალური მიღებისთვის.
ფენოლფთალეინის გამოყენების ინსტრუქცია
საშუალოდ, დღიური დოზა ზრდასრული ადამიანისთვის არის 100 მგ.
ბავშვებს ენიშნებათ 50-200 მგ დღეში, ასაკისა და წონის მიხედვით.
ნივთიერების მაქსიმალური რაოდენობა, რომლის მიღებაც შესაძლებელია 24 საათის განმავლობაში, არის 300 მგ.
მკურნალობის კურსს განსაზღვრავს სპეციალისტი. ამ კომპონენტის შემცველი პრეპარატები არ უნდა იქნას მიღებული დიდი ხნის განმავლობაში.
დოზის გადაჭარბება
წამალმა შეიძლება გამოიწვიოს ჰემოროიდული სისხლდენა , მნიშვნელოვანი შემცირება, მდე კოლაფსი ცილის გამოჩენა შარდში. დოზის გადაჭარბების შემთხვევაში რეკომენდებულია ექიმთან კონსულტაცია.
ურთიერთქმედება
ფენოლფთალეინმა შეიძლება გამოიწვიოს ორგანიზმში კალიუმის შეკავება, თუ თერაპია ტარდება პარალელურად. კალიუმის შემნახველი შარდმდენები .
გაყიდვის პირობები
არ არის საჭირო რეცეპტი.
შენახვის პირობები
შეინახეთ ფენოლფთალეინზე დაფუძნებული პრეპარატები მშრალ, ბნელ ადგილას, ბავშვებისგან დაცულ, ოთახის ტემპერატურაზე.
შენახვის ვადა
ფხვნილს აქვს შეუზღუდავი შენახვის ვადა, ტაბლეტების შენახვა შესაძლებელია 10 წლის განმავლობაში (თუ მწარმოებლის მიერ შეფუთვაზე სხვა რამ არ არის მითითებული).
სპეციალური მითითებები
ახლა ფენოლფთალეინის შემცველი პრეპარატები იშვიათად გამოიყენება მედიცინაში. ყველაზე ხშირად უპირატესობას ანიჭებენ სხვა თანამედროვე, უსაფრთხო საფაღარათო საშუალებებს.
ბავშვები
ნივთიერება ინიშნება სიფრთხილით. საჭიროა დოზის კორექცია ბავშვის ასაკისა და წონის მიხედვით.
Მოხუცები
პირები სიბერეამ საშუალების მიღების ეფექტი ვლინდება 24-72 საათში.
წონის დაკლებისთვის
გასული საუკუნის დასაწყისში ნივთიერებას იყენებდნენ წონის დასაკლებად. ახლა არის სხვა პრეპარატები, რომლებსაც აქვთ მსგავსი ეფექტი. ბევრი გოგონა ამინდი იდეალური ფიგურა ბოროტად საფაღარათო, რომელიც არ უნდა გაკეთდეს. ეს შეიძლება იყოს საშიში თქვენი ჯანმრთელობისთვის.
შემცველი პრეპარატები (ანალოგები)
დამთხვევა მე-4 დონის ATX კოდში:
Ex Lax, Purgen, Purgofen, Purgil, Fenaloin, Laxatol, Laxoil.
Purgen ფასი, სად ვიყიდო
საფაღარათო საფაღარათო საშუალება ფენოლფთალეინის ფხვნილის სახით საბითუმო ვაჭრობაში დაახლოებით 1700 რუბლს შეადგენს 1 კგ-ზე.
მოსკოვში წამლის ყიდვა თითქმის შეუძლებელია, რადგან მასზე დაფუძნებული პრეპარატები დიდი ხანია არ მიეწოდებათ აფთიაქებში.
ფენოლფთალეინის ფასი შეიძლება განსხვავდებოდეს მწარმოებლის მიხედვით.
