ხსნარების გაყინვა. ხსნარები იყინება უფრო დაბალ ტემპერატურაზე, ვიდრე სუფთა გამხსნელი.
ხსნარები ადუღდება უფრო მეტზე მაღალი ტემპერატურაროგორ სუფთა გამხსნელი;
დასკვნა რაულტის კანონიდან
გადაწყვეტილებები, რომლებიც მკაცრად ემორჩილება რაულტის კანონს, იდეალურია. არაელექტროლიტების რეალური ხსნარებისთვის რაულის კანონი უფრო ზუსტად არის დაცული, რაც უფრო განზავებულია ეს ხსნარი. ხსნარის კონცენტრაციის მატებასთან ერთად, ხსნარების უმეტესობა ავლენს გადახრებს რაულტის კანონისგან.
გამხსნელის გაჯერებული ორთქლის წნევის შედარებით შემცირება ხსნარის ზემოთ ტოლია გამხსნელის მოლური ფრაქციის ტოლფასი.
ელექტროლიტების ხსნარები (მჟავები, ფუძეები, მარილები) არ ემორჩილება რაულტის კანონს. უფრო მეტიც, იმ შემთხვევებშიც კი, როდესაც ისინი განზავებულია. ამ ფენომენის მიზეზი მოგვიანებით იქნება განხილული.
რაულტის კანონიდან გამომდინარეობს ორი მნიშვნელოვანი შედეგი:
მოდით შევხედოთ მათ უფრო დეტალურად.
დუღილი არის ფიზიკური პროცესისითხის გადასვლა აირისებრ მდგომარეობაში ან ორთქლში, რომელშიც გაზის ბუშტები წარმოიქმნება სითხის მთელ მოცულობაში.
სითხე ადუღდება, როდესაც მისი გაჯერებული ორთქლის წნევა გარეგანი წნევის ტოლი ხდება. თუ გარე წნევა (მაგალითად, ატმოსფერული) არ იცვლება და სითხე თავისთავად ინდივიდუალური და ქიმიურად სუფთა ნივთიერებაა, მაშინ ის მუდმივ ტემპერატურაზე ღია გახურებულ ჭურჭელში დუღდება, სანამ თხევადი ფაზა მთლიანად არ გაქრება.
ასე რომ, 101,325 კპა ატმოსფერული წნევის დროს, გაწმენდილი (გამოხდილი) წყლის დუღილის წერტილი არის 100 o C ან 373,16 კ.
თუ ზოგიერთი არაასტაბილური ნივთიერება იხსნება H 2 O-ში, მაშინ მისი გაჯერებული ორთქლის წნევა შემცირდება. იმისათვის, რომ მიღებული ხსნარი ადუღდეს, აუცილებელია მისი გაცხელება 373,16 K-ზე მაღალ ტემპერატურაზე, რადგან მხოლოდ ასეთ პირობებში გამხსნელის გაჯერებული ორთქლის წნევა კვლავ გახდება ატმოსფერული წნევის ტოლი.
გაყინვა ან კრისტალიზაცია არის ფიზიკური ფენომენი, რომელსაც თან ახლავს სითხის მყარად გადაქცევა. უფრო მეტიც, კრისტალური სტრუქტურები იქმნება სითხის მთელ მოცულობაში.
გაყინვის პროცესი იწყება მაშინ, როდესაც გაჯერებული ორთქლის წნევა სითხეზე ტოლი ხდება მისი მყარი კრისტალების ზემოთ გაჯერებული ორთქლის წნევის ტოლი.
თუ გარე (ატმოსფერული) წნევა რჩება მუდმივი და სითხე არ შეიცავს უცხო მინარევებს, მაშინ კრისტალიზაციის პროცესში გაციებული სითხის ტემპერატურა მუდმივი დარჩება მანამ, სანამ თხევადი ფაზა მთლიანად არ გადაიქცევა მყარად.
101,325 კპა ტოლი ატმოსფერული წნევის დროს გამოხდილი წყალი იყინება 0 o C-ზე (273,16 კ). წყლის გაჯერებული ორთქლის წნევა ყინულისა და სითხის ზემოთ ამ შემთხვევაში არის 613.3 Pa.
წყალხსნარისთვის, გამხსნელის გაჯერებული ორთქლის წნევა 0 o C-ზე იქნება 613,3 Pa-ზე ნაკლები, ხოლო ყინულის ზემოთ ის უცვლელი რჩება. ასეთ ხსნარში ჩავარდნილი ყინული სწრაფად დნება მასზე ჭარბი ორთქლის კონდენსაციის გამო.
მხოლოდ ტემპერატურის შემცირებით შეიძლება გაჯერებული ორთქლის წნევა თხევად და მყარ ფაზებზე მაღლა გათანაბრება და კრისტალიზაციის პროცესის დაწყება.
ექსპერიმენტულად დადგინდა, რომ დუღილის წერტილის მატება (Dt bp) და ხსნარის გაყინვის წერტილის შემცირება (Dt sub) სუფთა გამხსნელთან შედარებით პირდაპირპროპორციულია გახსნილი ნივთიერების მოლური კონცენტრაციისა. მათემატიკურად, ეს შეიძლება დაიწეროს შემდეგნაირად:
ტ კიპ. ხსნარი - თ ადუღება. პ-სხეული = Dt ბალი. = ემ
ტ მოადგილე რ-ტელ – თ მოადგილე გამოსავალი = Dt მოადგილე = კმ
სადაც m არის გახსნილი ნივთიერების მოლური კონცენტრაცია; E და K, შესაბამისად, არის ბულიოსკოპიული (ლათინური ebbulio - დუღილი) და კრიოსკოპული (ბერძნული "krios" - ცივი) მუდმივები, რომელთა მნიშვნელობები დამოკიდებულია მხოლოდ გამხსნელის ბუნებაზე (ცხრილი 7).
ცხრილი 7.ზოგიერთი გამხსნელის Ebullioscopic E და კრიოსკოპული K მუდმივები (deg/mol)
ბრინჯი. 7.12. წყლის ორთქლის წნევის შემცირება ხსნარის ზემოთ
მყარი ხაზები გამოხატავს ფაზის ველების საზღვრებს სუფთა წყლისთვის. შეგახსენებთ, რომ ხაზი 1 აჩვენებს სითხე-ორთქლის წონასწორობას. წყალში არამდგრადი ხსნარის დამატების შემდეგ, ორთქლის წნევა ხსნარის ზემოთ (გამოწყვეტილი ხაზი 2 ) მცირდება ნებისმიერ ტემპერატურაზე.
ნებისმიერი სითხე გაიყინება (გამყარდება), როდესაც მასზე ორთქლის წნევა შედარებულია მყარი ფაზის ზემოთ ორთქლის წნევასთან (წყლის შემთხვევაში, ყინულის ზემოთ). ამიტომ, ხსნარის გაყინვის ტემპერატურა თ მოადგილე გაყინვის ტემპერატურაზე ნაკლები იქნება თ მოადგილის შესახებ სუფთა გამხსნელი - წყალი.
ფ.მ. რაულმა (1883) ექსპერიმენტულად დაადგინა, რომ გაყინვის ტემპერატურის შემცირება (წინააღმდეგ შემთხვევაში - გაყინული დეპრესია)
DT მოადგილე = თ მოადგილის შესახებ - თ მოადგილე ,
გამოწვეული სხვადასხვა ხსნარებით, რომლებიც მიღებულია იმავე მოლარულ რაოდენობებში, იგივეა მოცემული გამხსნელისთვის. ასე რომ, 0.1 მ წყალხსნარებიზოგიერთი ნივთიერებისთვის შეინიშნება გამაგრების შემდეგი ტემპერატურა:
ნივთიერება თ მოადგილე , o C
წყალბადის ზეჟანგი H 2 O 2 - 0.186
მეთილის სპირტი CH 3 OH - 0,181
ეთილის სპირტი C 2 H 5 OH - 0.183
საქაროზა C 12 H 22 O 11 - 0.186
დექსტროზა C6H12O6 - 0,188
ხსნარის სხვადასხვა კონცენტრაციით DT მოადგილე მათი მოლური კონცენტრაციის პროპორციულია მ :
DT მოადგილე = კ კრ მ (7.1)
პროპორციულობის ფაქტორი კ კრ განტოლებაში (7.1), ე.წ კრიოსკოპიული მუდმივი, წარმოადგენს გაყინვის წერტილის მოლარულ შემცირებას. ეს მნიშვნელობა რიცხობრივად უდრის 1 კილოგრამ გამხსნელში გახსნილი ნივთიერების 1 მოლი ხსნარის გაყინვის წერტილის შემცირებას, იმ პირობით, რომ ხსნარს აქვს იდეალურის თვისებები. კრიოსკოპიული მუდმივი არის გამხსნელის მახასიათებელი, მისი მნიშვნელობა არ არის დამოკიდებული გამხსნელის ბუნებაზე.
მოლალის კონცენტრაცია შეიძლება გამოიხატოს ხსნარის მასის მიხედვით ( ბ)და გამხსნელი ( ა)გრამებში (იხ. პუნქტი 7.3):
სად მ - გახსნილი ნივთიერების მოლური მასა (გ/მოლი). ამ გამოთქმის (7.1) განტოლებით ჩანაცვლებით მივიღებთ
ამ განტოლებიდან გამომდინარეობს ერთი ძალიან მნიშვნელოვანი გარემოება, კერძოდ: განზავებული ხსნარის ზუსტი შემადგენლობის ცოდნით და სუფთა გამხსნელისა და ხსნარის გაყინვის ტემპერატურის გაზომვით, შეგიძლიათ გამოთვალოთ გახსნილი ნივთიერების მოლური მასა:
განტოლება (7.2) არის საფუძველი კრიოსკოპიული(ან კრიომეტრიული)მეთოდინივთიერებების მოლური მასის განსაზღვრა მათი ხსნარების გაყინვის წერტილის შემცირებით კრიომეტრიული მეთოდი ფართოდ გამოიყენება ლაბორატორიულ პრაქტიკაში, მათ შორის ფარმაციაში.
მისი პრინციპი ასეთია. პირველ რიგში, ზუსტი ნიმუშის დნობის (ან გაყინვის) ტემპერატურა იზომება აშერჩეული გამხსნელი. შემდეგ საცდელი ნივთიერების ზუსტი აწონილი ნაწილი ემატება გამხსნელს. ბდა მიღებული ნარევის დნობის წერტილი იზომება (ან გაყინვის წერტილი, თუ გამხსნელად არჩეულ ნივთიერებას აქვს დაბალი დნობის წერტილი). გამხსნელის წონა უნდა იყოს ბევრად ნაკლები, ვიდრე გამხსნელის წონა, რათა ხსნარი განზავდეს. მიღებული ღირებულება DT მოადგილე ჩანაცვლებულია (7.2) განტოლებით და მისი დახმარებით გამოითვლება შესასწავლი ნივთიერების მოლური მასა. უმარტივეს შემთხვევაში, გამოხდილი წყალი შეიძლება გამოვიყენოთ გამხსნელად. თუმცა, კრიოსკოპიული მუდმივის მცირე მნიშვნელობისა და დაბალი გაყინვის წერტილის გამო, რაც მოითხოვს კრიოსტატების ან სპეციალური გამაგრილებელი ნარევების გამოყენებას, წყალი გამოიყენება მხოლოდ ნივთიერებების მოლური მასის სავარაუდო შეფასებისთვის. როგორც წესი, განსაკუთრებით დიდი მოლური მასის რთული ორგანული ნივთიერებების შესწავლისას, გამხსნელად ირჩევენ სხვა ნივთიერებებს. ამ შემთხვევაში განსაკუთრებული მნიშვნელობა აქვს ქაფურს თავისი დიდი კრიოსკოპიული მუდმივით. კრიომეტრიული განსაზღვრის მთავარი პირობაა საცდელი ნივთიერების სრული ხსნადობა შერჩეულ გამხსნელში. ქვემოთ მოცემულია ზოგიერთი ნივთიერების კრიოსკოპიული მუდმივები (ნორმალური ატმოსფერული წნევის დროს):
ნივთიერება T pl o C კრიოსკოპიული
მუდმივი კ კრ
ბენზოლი 5.5 5.12
ძმარმჟავა 16,8 3,90
ციკლოჰექსანი 6.5 20
კამფორი 178,5 39,7
კრიოსკოპიული მეთოდი ასევე გამოიყენება ნივთიერებების სისუფთავის დასადგენად. ეს ეფუძნება იმ ფაქტს, რომ თუნდაც მცირე მინარევების არსებობა ამცირებს შესასწავლი ნივთიერების ნიმუშის დნობის წერტილს. მაშასადამე, ქიმიაში (ისევე როგორც ფარმაციაში), ნივთიერების სისუფთავის ერთ-ერთი კრიტერიუმია დნობის მაქსიმალური ტემპერატურის მიღწევა, რომელიც შემდგომში არ იზრდება დამატებითი გამწმენდი ოპერაციების შემდეგ.
კრიოსკოპიული ეფექტის კიდევ ერთი მნიშვნელოვანი გამოყენება არის გამაგრილებელი ნარევების მომზადება. წყლის (ან თოვლის) და ზოგიერთი არაორგანული მარილის გარკვეული თანაფარდობით, შეგიძლიათ მიიღოთ დაბალი ტემპერატურა, შენარჩუნებულია საკმაოდ დიდი ხნის განმავლობაში. მაგალითად, ნარევი, რომელიც შედგება 100 გრ თოვლისა და 143 გრ CaCl 2 6H 2 O, საშუალებას გაძლევთ მიიღოთ ტემპერატურა -55 o C.
ცივი კლიმატის მქონე ადგილებში, მანქანის რადიატორებში გამოყენებულ წყალს უმატებენ ანტიფრიზის ნივთიერებებს, როგორიცაა ალკოჰოლი, გლიცერინი ან ეთილენგლიკოლი, რათა არ მოხდეს მისი გაყინვა ზამთარში. გზებზე და ტროტუარებზე გაყინული ყინული ადვილად დნება, როცა დაასხით სუფრის მარილიან ნაცარი, რომელიც ასევე ეფუძნება კრიოსკოპიულ ეფექტს. თქვენ უბრალოდ უნდა გახსოვდეთ, რომ მარილის გადაჭარბებულმა გამოყენებამ ამ მიზნებისათვის შეიძლება გამოიწვიოს მიმდებარე წყალსაცავებისა და ნიადაგების დამლაშება მათ ნაპირებზე და, შედეგად, გარემოს დარღვევა.
გაყინვა არის ფაზის გადასვლა, რომლის დროსაც სითხე იქცევა მყარად. სითხის გაყინვის წერტილი არის ტემპერატურა, რომლის დროსაც გაჯერებული ორთქლის წნევა სითხეზე უდრის გაჯერებული ორთქლის წნევას მისგან ამოვარდნილი მყარი ფაზის კრისტალების ზემოთ.
ამ ტემპერატურაზე და შესაბამის გაჯერებული ორთქლის წნევაზე, კრისტალიზაციის სიჩქარე უდრის დნობის სიჩქარეს და ორივე ეს ფაზა შეიძლება დიდი ხნის განმავლობაში თანაარსებობდეს.
ასევე მ.ვ. ლომონოსოვმა შენიშნა, რომ განზავებული ხსნარი იყინება სუფთა გამხსნელზე დაბალ ტემპერატურაზე. ამრიგად, ზღვის წყალი იყინება არა 273 K, არამედ ოდნავ დაბალ ტემპერატურაზე. მრავალრიცხოვანმა ექსპერიმენტებმა აჩვენა, რომ ხსნარის გაყინვის ტემპერატურის ასეთი ცვლილება შეიძლება ჩაითვალოს ზოგად წესად.
გაყინვისა და დუღილის პროცესები დეტალურად შეისწავლა რაულმა და წარმოადგინა კანონის სახით, რომელსაც მოგვიანებით რაულტის მეორე კანონი უწოდეს.
განვიხილოთ ამ კანონის უმარტივესი წარმოშობა. სურათი 2 გვიჩვენებს დიაგრამას, რომელიც გამოხატავს გაჯერებული ორთქლის წნევის დამოკიდებულებას სუფთა გამხსნელის და ხსნარის ზემოთ ტემპერატურაზე.
მრუდი 0A არის სუფთა წყლის გაჯერებული ორთქლის წნევის დამოკიდებულება ტემპერატურაზე.
მრუდი BC, DE - წყლის გაჯერებული ორთქლის წნევის დამოკიდებულება გახსნილი ნივთიერების სხვადასხვა კონცენტრაციის მქონე ხსნარებზე.
0D - გამოხატავს წყლის გაჯერებული ორთქლის წნევის ტემპერატურ დამოკიდებულებას ყინულზე.
2-დან ირკვევა, რომ ორთქლის წნევა ხსნარზე 273 K-ზე დაბალია, ვიდრე წყლის ზემოთ, მაგრამ ის არ არის ტოლი ორთქლის წნევა ყინულის ზემოთ იმავე ტემპერატურაზე. მხოლოდ 273 K (T'z) დაბალ ტემპერატურაზე ხსნარის ზემოთ ორთქლის წნევა იმდენად მცირდება, რომ ყინულის ზემოთ ორთქლის წნევის ტოლი ხდება. ეს შეესაბამება B წერტილს. ხსნარის უფრო მაღალი კონცენტრაციის დროს, მრუდები, რომლებიც გამოხატავს წყლის ორთქლის წნევის დამოკიდებულებას ხსნარზე ტემპერატურაზე, მდებარეობს BC მრუდის ქვემოთ, მაგრამ მის პარალელურად.
წარმოგიდგინოთ შემდეგი აღნიშვნა:
Р 0 А – ორთქლის წნევა სუფთა გამხსნელზე 273 კ-ზე
P A - ორთქლის წნევა ხსნარის ზემოთ მისი გაყინვის ტემპერატურაზე T'z
დან მართკუთხა სამკუთხედიჩვენ განვსაზღვრავთ FOC-ს
სურათი 2-დან ირკვევა, რომ სად არის ხსნარის გაყინვის ტემპერატურის შემცირება.
ამ მნიშვნელობების ზემოაღნიშნულ განტოლებაში ჩანაცვლებით, მივიღებთ

 (3)
(3)
რაულის პირველი კანონიდან ძალიან განზავებული ხსნარებისთვის გვაქვს
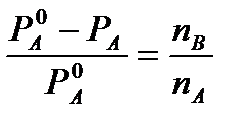
 და
და  (4)
(4)
სადაც n A, n B, m A ინარჩუნებს ადრე მინიჭებულ აღნიშვნებს (იხ. ზემოთ). თუ გამხსნელის მოლურ მასას M 0 A-ით აღვნიშნავთ, მაშინ

ამ გამოთქმის (4) განტოლებით ჩანაცვლებით ვიღებთ

გაამრავლეთ და გაყავით ამ გამოხატვის მარჯვენა მხარე 1000-ზე, შემდეგ
 (5)
(5)
მოდით გავაერთიანოთ ყველა მუდმივი სიდიდე (5) განტოლებაში ერთ მუდმივ K-ში (  ), ვიღებთ შემდეგ გამონათქვამს
), ვიღებთ შემდეგ გამონათქვამს
 (6)
(6)
გამოხატულება  წარმოადგენს ხსნარის მოლალობას წმ.
წარმოადგენს ხსნარის მოლალობას წმ.
ამ გამოთქმის (6) განტოლებით ჩანაცვლებით, მივიღებთ საბოლოო განტოლებას.
 (7)
(7)
ეს არის რაულტის მეორე კანონის მათემატიკური გამოხატულება: ხსნარის გაყინვის წერტილის შემცირება ან დუღილის წერტილის ზრდა პირდაპირპროპორციულია მისი მოლური კონცენტრაციისა.
კოეფიციენტს K განტოლებაში (7) ეწოდება კრიოსკოპიული მუდმივი, აჩვენებს ხსნარის გაყინვის ტემპერატურის მოლარულ შემცირებას, არის ინდივიდუალური მახასიათებლებიგამხსნელი (K H2O = 1,86º) და აქვს იგივე განზომილება, როგორც E (Kº კგ მოლი -1)
კვლევის მეთოდს, რომელიც ეფუძნება ხსნარების გაყინვის წერტილის შემცირების გაზომვას, ეწოდება კრიოსკოპიული. ის, ისევე როგორც ბულიოსკოპიული, საშუალებას გაძლევთ გამოთვალოთ გახსნილი ნივთიერების მოლური მასა

სურათი 3 გვიჩვენებს მოწყობილობას, რომელიც შექმნილია ხსნარების გაყინვის წერტილის გასაზომად.
 |
ოსმოსი და ოსმოსური წნევა.
ხსნარების ძალიან მნიშვნელოვანი ბიოლოგიურად მნიშვნელოვანი თვისებაა ოსმოზი.
ბუნებაში, ხსნარები ხშირად გამოყოფილია გამხსნელისაგან მემბრანებით, რომლებიც გამჭოლია მხოლოდ გამხსნელის ნაწილაკებისთვის. ამ შემთხვევაში გამხსნელში გამხსნელი ვერ გავრცელდება და შეინიშნება მხოლოდ გამხსნელის ხსნარში გადასვლა, ე.ი. გამხსნელი მოძრაობს ორივე მიმართულებით, მაგრამ მაინც ცოტა მეტი შევა ხსნარში, ვიდრე შიგნით საპირისპირო მიმართულება.
ოსმოსის მექანიზმი ადვილი წარმოსადგენია იზოთერმული დისტილაციის საფუძველზე. მიეცით მიკროფორების მქონე ნახევრად გამტარი მემბრანა გამოყოფს გამხსნელს და ხსნარს C კონცენტრაციით (ნახ. 4)

ფორებში, რომელიც შემოიფარგლება ერთი მხრიდან გამხსნელით, ხოლო მეორეზე ხსნარით, ხდება აორთქლება. რაულტის კანონის მიხედვით გაჯერებული ორთქლის ელასტიურობის გაზრდის გამო, ორთქლის ფაზაში ორთქლის წნევა კონცენტრირდება გამხსნელის მხრიდან და გადადის ხსნარში.
ოსმოსის შედეგად იზრდება ხსნარის მოცულობა და თანდათან მცირდება მისი კონცენტრაცია; მემბრანის მეშვეობით ხსნარში შეღწევადი გამხსნელი ზრდის სითხის სვეტს h და, შესაბამისად, ზრდის ჰიდროსტატიკური წნევას (იხ. სურ. 5). ამავდროულად, მემბრანაში საპირისპირო მიმართულებით მოძრავი გამხსნელების მოლეკულების რაოდენობა გაიზრდება, ე.ი. ხსნარიდან გამხსნელამდე. თანდათანობით, ხსნარის ჰიდროსტატიკური წნევა და განზავება მიაღწევს მნიშვნელობებს, რომლებშიც ორივე მიმართულებით მოძრავი გამხსნელების რაოდენობა გათანაბრდება და მოხდება ოსმოსური წონასწორობა. ოსმოსის შედეგად განვითარებულ ჭარბი ჰიდროსტატიკური წნევა, რომელიც იზომება h სიმაღლის ხსნარის სვეტით, სადაც ოსმოსური წონასწორობაა დამყარებული, ოსმოსური წნევა ეწოდება.
![]() ბრინჯი. 5
ბრინჯი. 5
კოლოდიონის, ცელოფნის, რკინა-სინოქსიდის სპილენძის და ა.შ. მემბრანები ნახევრად გამტარია მრავალი ხსნარის მიმართ.
ოსმოტური წნევის კანონები.
ოსმოსური წნევის კანონების შესწავლამ გამოავლინა მათი სრული ანალოგია გაზის კანონებთან. არაელექტროლიტების განზავებული ხსნარებისთვის, ისინი შეიძლება ჩამოყალიბდეს შემდეგნაირად:
მუდმივ ტემპერატურაზე, ოსმოსური წნევა პირდაპირპროპორციულია ხსნარის მოლური კონცენტრაციისა (ანალოგია ბოილ-მარიოტის კანონთან):

მუდმივი მოლარული კონცენტრაციის დროს ოსმოსური წნევა პირდაპირპროპორციულია აბსოლუტური ტემპერატურისა (ანალოგია გეი-ლუსაკის კანონთან):

ამ ორი კანონიდან გამომდინარეობს, რომ ერთსა და იმავე მოლარულ კონცენტრაციებსა და ტემპერატურაზე, სხვადასხვა არაელექტროლიტების ხსნარი ქმნის ერთსა და იმავე ოსმოსურ წნევას, ე.ი. არაელექტროლიტების ეკვმოლარული ხსნარები იზოტონურია (ავოგადროს კანონის ანალოგია).
ვან ჰოფმა შემოგვთავაზა ხსნარებში ოსმოსური წნევის ერთიანი კანონი (მენდელეევ-კლაიპერონის გაზის ერთიანი კანონის მსგავსი): არაელექტროლიტების განზავებული ხსნარების ოსმოსური წნევა პირდაპირპროპორციულია მოლარის კონცენტრაციის, პროპორციულობის კოეფიციენტისა და აბსოლუტური ტემპერატურისა:
ვინაიდან c=n/V, სადაც n არის არაელექტროლიტის მოლების რაოდენობა, ხოლო V არის ხსნარის მოცულობა, მაშინ  ან
ან ![]()
განზავდეს არაელექტროლიტების ხსნარები.
ხსნარების კოლიგატური თვისებები
გაჯერებული ორთქლის წნევა
"ინდივიდუალური სითხე-ორთქლის" წონასწორობა აღწერილია წონასწორობის მუდმივით
K p =p ჩვენს შესახებ. წყვილი /a o f (1)
აქედან გამომდინარე, ვინაიდან ინდივიდუალური სითხის აქტივობა a o x = 1, გაჯერებული ორთქლის წნევა უდრის
p o წყვილი = K p (2)
და დამოკიდებულია მხოლოდ ტემპერატურაზე.
ვინაიდან გამხსნელის აქტივობა ტოლია a ox მისი მოლური ფრაქციის N 1 ან (1 - N 2) პროდუქტის, სადაც N 2 არის გახსნილი ნივთიერების მოლური ფრაქცია, წონასწორობის მუდმივი უდრის:
K p =p 1 o =(p 1 /a o x N 1) =(p 1 /1-N 2) (3)
აქედან ვიღებთ რაულის კანონი (1886):
p 1 = p 1 o (1-N 2) = p 1 o N 1 (4)
(p 1 o -p 1)/p 1 o) = N 2 (5)
ხსნარის გაჯერებული ორთქლის წნევა უდრის მის წნევას სუფთა გამხსნელის ზემოთ გამრავლებული გამხსნელის მოლურ ფრაქციაზე.
გამხსნელის გაჯერებული ორთქლის წნევის ფარდობითი შემცირება სუფთა ხსნარზე უდრის გამხსნელის მოლურ ნაწილს.
ამრიგად, ორთქლის წნევა უკვე დამოკიდებულია ხსნარის შემცველობაზე. რაულის კანონი შეიძლება გამოყენებულ იქნას ხსნარის მოლური მასის დასადგენად:
Dp/p 1 ° =N 2 =n 2 /n 1 +n 2 ≈m 2 M 1 /m 1 M 2 (6)
ხსნარების დუღილის წერტილი
სითხე დუღს, როდესაც გაჯერებული ორთქლის წნევა გარე წნევის ტოლი ხდება. რაულის კანონის თანახმად, ორთქლის წნევა ხსნარზე ნაკლებია ვიდრე ორთქლის წნევა სუფთა გამხსნელის ზემოთ, ხსნარის დუღილის წერტილი უფრო მაღალია ვიდრე სუფთა გამხსნელის დუღილის წერტილი.
ექსპერიმენტებმა აჩვენა, რომ არაელექტროლიტების განზავებული ხსნარებისთვის:
სადაც DT არის ხსნარის დუღილის მატება სუფთა გამხსნელთან შედარებით, b არის მოლილობა ([E] = K. კგ/მოლი) E არის ებულიოსკოპიური მუდმივი (ებბულიოდან (ლათ.) - დუღილი), დამოკიდებულია მხოლოდ გამხსნელის თვისებებზე (მისი ტემპერატურის დუღილის ტემპერატურა T o და აორთქლების სპეციფიკური სითბო L 1):
E=RT o 2 /1000ლ 1 (8)
სუფთა გამხსნელის დუღილის წერტილს აქვს გარკვეული მნიშვნელობა ფიქსირებული გარე წნევის დროს. ხსნარის დუღილის წერტილი არ არის მუდმივი - ის იზრდება დუღილის დროს, რადგან გამხსნელის აორთქლების გამო იზრდება ხსნარის კონცენტრაცია. ამავდროულად, გაჯერებული ორთქლის წნევა მუდმივად მცირდება. ამრიგად, ხსნარის დუღილის წერტილად ითვლება ტემპერატურა, რომელიც შეესაბამება მასში პირველი ორთქლის ბუშტის გამოჩენას.
ხსნარების გაყინვის წერტილი
ხსნარის ზემოთ, გამხსნელის ორთქლის წნევა უფრო დაბალია, ვიდრე ორთქლის წნევა სუფთა გამხსნელის ზემოთ. ორთქლის წნევა მყარი და თხევადი ფაზების ზემოთ ასევე ნაკლები იქნება. ეს შეიძლება მოხდეს მხოლოდ ხსნარის უფრო დაბალ გაყინვის წერტილში სუფთა გამხსნელთან შედარებით. არაელექტროლიტური ხსნარების გაყინვის წერტილის დაქვეითება სუფთა გამხსნელის გაყინვის წერტილთან შედარებით პროპორციულია ხსნარის მოლალობისა:
სადაც K არის კრიოსკოპული მუდმივი (ბერძნულიდან "krios" - ცივი), დამოკიდებულია მხოლოდ გამხსნელის თვისებებზე:
K=RT o 2 /1000ლ 1, (10)
სადაც T o, L * 1 არის სუფთა გამხსნელის შერწყმის გაყინვის წერტილი და სპეციფიკური სითბო.
ვინაიდან გახსნილი ნივთიერების კონცენტრაცია იზრდება გამხსნელის გამაგრებით, ხსნარის გაყინვის წერტილი არ არის მუდმივი და მცირდება პროცესის დროს. ამიტომ, პირველი ბროლის წარმოქმნის ტემპერატურა მიიღება ხსნარის გაყინვის ტემპერატურად.
ცხრილი 2 გვიჩვენებს E და K მნიშვნელობებს ზოგიერთი გამხსნელისთვის.
ცხრილი 2.
გამხსნელი კრისტალები წონასწორობაში იქნებიან ხსნართან მხოლოდ მაშინ, როდესაც გაჯერებული ორთქლის წნევა კრისტალების ზემოთ და ხსნარის ზემოთ ერთნაირია. ვინაიდან გამხსნელის ორთქლის წნევა ხსნარის ზემოთ ყოველთვის დაბალია, ვიდრე სუფთა გამხსნელის ზემოთ, ამ მდგომარეობის შესაბამისი ტემპერატურა ყოველთვის დაბალი იქნება სუფთა გამხსნელის გაყინვის წერტილზე. ამ შემთხვევაში ΔT ხსნარის გაყინვის ტემპერატურის დაქვეითება არ არის დამოკიდებული გახსნილი ნივთიერების ბუნებაზე და განისაზღვრება მხოლოდ გამხსნელისა და გახსნილი ნივთიერების ნაწილაკების რაოდენობის თანაფარდობით.
შეიძლება აჩვენოს, რომ ΔT ხსნარის გაყინვის ტემპერატურის შემცირება პირდაპირპროპორციულია ხსნარის მოლური კონცენტრაციისა:
რაულის მეორე კანონი: დუღილის წერტილის მატება და ცამის ხსნარის შემცირება პროპორციულია გახსნილი ნივთიერების ნაწილაკების რაოდენობისა და არ არის დამოკიდებული მის ბუნებაზე.
სამუშაოს დასასრული -
ეს თემა ეკუთვნის განყოფილებას:
ლექცია No5. ფაზის წონასწორობა. არაელექტროლიტური ხსნარები
ნივთიერების აირისებრ მდგომარეობას ახასიათებს ნაწილაკებს შორის სუსტი ურთიერთქმედება და მათ შორის დიდი მანძილი, ამიტომ აირები ერევა... აირის ნარევის მთლიანი წნევა უდრის ყველა კომპონენტის ნაწილობრივი წნევის ჯამს.
თუ საჭიროა დამატებითი მასალაამ თემაზე, ან ვერ იპოვნეთ ის, რასაც ეძებდით, გირჩევთ გამოიყენოთ ძებნა ჩვენს სამუშაოთა მონაცემთა ბაზაში:
რას ვიზამთ მიღებულ მასალასთან:
თუ ეს მასალა თქვენთვის სასარგებლო იყო, შეგიძლიათ შეინახოთ იგი თქვენს გვერდზე სოციალურ ქსელებში:
| ტვიტი |
ყველა თემა ამ განყოფილებაში:
ლექცია No5. ფაზის წონასწორობა. არაელექტროლიტური ხსნარები.
ფაზის წონასწორობა.
ბოლო ლექციაზე ჩვენ შევხედეთ ქიმიურ წონასწორობას, წონასწორობის მუდმივას, მის ურთიერთობას ა.შ. რაოდენობები და ფაქტორები, რომლებიც გავლენას ახდენენ წონასწორობის ცვლილებაზე.
ორკომპონენტიანი სისტემები.
ხსნარი არის ერთგვაროვანი სისტემა, რომელიც შედგება ორი ან მეტი კომპონენტისგან, რომლის შემადგენლობა შეიძლება მუდმივად შეიცვალოს გარკვეულ საზღვრებში მისი თვისებების მკვეთრი ცვლილების გარეშე.
ხსნარის ფორმირება რთული ფიზიკური და ქიმიური პროცესია. დაშლის პროცესს ყოველთვის თან ახლავს სისტემის ენტროპიის ზრდა; როდესაც ხსნარები იქმნება, ხშირად ხდება რომელიმეს გათავისუფლება
ხსნადობა
დაშლის პროცესი დაკავშირებულია დიფუზიასთან, ანუ ერთი ნივთიერების ნაწილაკების სპონტანურ განაწილებასთან მეორის ნაწილაკებს შორის. როდესაც ხსნადი ემატება გამხსნელს, ხდება დაშლის პროცესი
აირების ხსნადობა სითხეებში
სითხეებში აირების ხსნადობა დამოკიდებულია მთელ რიგ ფაქტორებზე: აირისა და სითხის ბუნებაზე, წნევაზე, ტემპერატურაზე, სითხეში გახსნილი ნივთიერებების კონცენტრაციაზე (განსაკუთრებით აირების ხსნადობაზე).
არაელექტროლიტური ხსნარები.
ხსნარების თვისებები განიხილება განზავებული ხსნარების მაგალითის გამოყენებით, რომელთა ფორმირებისას თერმული და მოცულობითი ეფექტი ტოლია 0-ის (იდეალური ხსნარები). ასეთ ხსნარებში ნაწილაკი განლაგებულია დიდზე
გაჯერებული ორთქლის წნევის ფარდობითი შემცირება ხსნარის ზემოთ ტოლია გამხსნელის მოლური ფრაქციის ტოლფასი.
ნებისმიერი სითხე იწყებს ადუღებას იმ ტემპერატურაზე, რომლის დროსაც მისი გაჯერებული ორთქლის წნევა აღწევს გარე წნევას. T boil - T, რომლის დროსაც ორთქლის წნევა = 101,3 kPa, წყალი დუღს 100 C ტემპერატურაზე.
ოსმოსური წნევა
თუ ორი განსხვავებული კონცენტრაციის ხსნარი გამოყოფილია ნახევრად გამტარი დანაყოფით, რომელიც გამხსნელის მოლეკულებს საშუალებას აძლევს გაიარონ, მაგრამ ხელს უშლის გამხსნელი ნივთიერების ნაწილაკების გავლას, მე დავაკვირდები
