કઈ સિસ્ટમોને ઉકેલો કહેવામાં આવે છે. વિષય: ઉકેલોનો સિદ્ધાંત. ઉકેલોનું વર્ગીકરણ
ઉકેલો- પ્રવાહી, નક્કર અથવા વાયુયુક્ત પદાર્થોને યોગ્ય દ્રાવકમાં ઓગાળીને મેળવવામાં આવેલ પ્રવાહી ડોઝ ફોર્મ. ડિસ્પર્સોલોજિકલ વર્ગીકરણ મુજબ, ઉકેલો પ્રવાહી વિક્ષેપ માધ્યમ સાથે મુક્તપણે વિખેરાયેલી સિસ્ટમો છે.
ફાર્માસ્યુટિકલ પ્રેક્ટિસમાં, ઉકેલો કુલ ફાર્મસી ફોર્મ્યુલેશનના સરેરાશ 30% જેટલા હિસ્સો ધરાવે છે. મોટા ચોક્કસ ગુરુત્વાકર્ષણસોલ્યુશન્સ, જેમ કે તમામ પ્રવાહી ડોઝ સ્વરૂપો, અન્ય ડોઝ સ્વરૂપો કરતાં તેમના ઘણા ફાયદાઓ દ્વારા સમજાવવામાં આવે છે.
નક્કર ડોઝ સ્વરૂપોની તુલનામાં ઉકેલોના ફાયદા:
ઉચ્ચ જૈવઉપલબ્ધતા;
ઘટાડો બળતરા ગુણધર્મો;
રોગનિવારક અસરની ઝડપી શરૂઆત;
સ્વાદ સુધારણાની શક્યતા;
સરળતા અને ઉપયોગમાં સરળતા.
નક્કર ડોઝ સ્વરૂપોની તુલનામાં ઉકેલોના ગેરફાયદા:
ટૂંકા શેલ્ફ જીવન;
એક્સિપિયન્ટ્સની રચના વિકસાવવાની જરૂર છે. ઉકેલોના સહજ ગેરફાયદા તેમના વ્યાપક ઉપયોગને અસર કરતા નથી.
ઉકેલોનું વર્ગીકરણ આકૃતિમાં રજૂ કરેલ છે.
ઉકેલોના ગુણધર્મો કોષ્ટકમાં રજૂ કરવામાં આવ્યા છે. 12.1.
કોષ્ટક 12.1.ઉકેલોના ગુણધર્મો
ઉકેલોના નામ | વિખરાયેલો તબક્કો | કણોનું કદ | SDF ના ઉદાહરણો | ગુણધર્મો |
ઓછા પરમાણુ વજનના પદાર્થોના સાચા ઉકેલો | આયનોના પરમાણુઓ | 1 એનએમ | ગ્લુકોઝ, સોડિયમ ક્લોરાઇડના ઉકેલો | તેઓ ફિલ્ટરમાંથી પસાર થાય છે, ડાયાલિસીંગ મેમ્બ્રેન દ્વારા, અને જ્યારે સેન્ટ્રીફ્યુજ અથવા ગરમ થાય ત્યારે તેમના ગુણધર્મો બદલાતા નથી. આલ્કોહોલ, એસિટોન, સંતૃપ્ત ઇલેક્ટ્રોલાઇટ્સ સાથે વરસાદ (સલ્ટિંગ આઉટ) શક્ય છે |
સાચું ઉકેલો નેવી | પરમાણુઓ | 1-100 nm | ઉકેલ પેપ્સિન જિલેટીન | તેઓ ફિલ્ટરમાંથી પસાર થાય છે, ડાયાલિસીંગ મેમ્બ્રેનમાંથી પસાર થતા નથી અને જ્યારે સેન્ટ્રીફ્યુજ અથવા ગરમ થાય છે ત્યારે ગુણધર્મો બદલાય છે. આલ્કોહોલ, એસીટોન, સંતૃપ્ત ઇલેક્ટ્રોલાઇટ્સ સાથે શક્ય સૉલ્ટિંગ આઉટ (કોસરવેશન). |
કોલોઇડલ સોલ્યુશન્સ | મિસેલ્સ | 1-100 nm | કોલરગોલ સોલ્યુશન્સ |
12.1. દ્રાવક
સોલ્યુશન બનાવવા માટે, ઔષધીય પદાર્થો અને દ્રાવકોની જરૂર છે.
દ્રાવક- વ્યક્તિગત રાસાયણિક સંયોજનો અથવા તેના મિશ્રણો ઓગળવા માટે સક્ષમ છે વિવિધ પદાર્થો, એટલે કે તેમની સાથે ફોર્મ કરો સજાતીય સિસ્ટમો- ઉકેલો.
સોલવન્ટને 2 વર્ગોમાં વહેંચવામાં આવે છે:
પાણી (શુદ્ધ અથવા ઈન્જેક્શન માટે);
કાર્બનિક દ્રાવક (ઇથિલ આલ્કોહોલ, ગ્લિસરીન, ક્લોરોફોર્મ, ઈથર, વગેરે).
દ્રાવક માટેની મૂળભૂત આવશ્યકતાઓ:
દ્રાવક શક્તિ;
રાસાયણિક ઉદાસીનતા અને જૈવિક હાનિકારકતા;
કોઈ અપ્રિય સ્વાદ અથવા ગંધ નથી;
માઇક્રોબાયોલોજીકલ શુદ્ધતા;
ઓછી કિંમત અને ઉપલબ્ધતા.
12.1.1. પાણી
ફાર્મસીમાં, ડોઝ સ્વરૂપોના ઉત્પાદનમાં મુખ્ય સોલવન્ટ્સ શુદ્ધ પાણી અને ઈન્જેક્શન માટે પાણી છે.
12.1.2. શુદ્ધ પાણી
અગાઉ, "નિસ્યંદિત પાણી" શબ્દનો ઉપયોગ થતો હતો, એટલે કે. નિસ્યંદન દ્વારા મેળવેલ પાણી. હાલમાં, નવી તકનીકો વિકસાવવામાં આવી છે જે પટલ દ્વારા આયનોને ફિલ્ટર કરીને જરૂરી ગુણવત્તાનું પાણી મેળવવાનું શક્ય બનાવે છે. તેથી GF X! "નિસ્યંદિત પાણી" શબ્દને વધુ સામાન્ય શબ્દ "શુદ્ધ પાણી" દ્વારા બદલવામાં આવ્યો. આ શબ્દ વ્યાખ્યાને બાકાત રાખે છે
પાણી મેળવવાની પદ્ધતિ અને સ્થાપના સામાન્ય જરૂરિયાતોતેની ગુણવત્તા માટે.
શુદ્ધ પાણી મેળવવાની 2 રીતો છે:
નિસ્યંદન;
રિવર્સ ઓસ્મોસિસ. પાણી ઉત્પાદન માટે સાધનો
શુદ્ધ
પાણી નિસ્યંદન DE વોટર ડિસ્ટિલર્સ (ફિગ. 12.1) શુદ્ધ પાણી ઉત્પન્ન કરવા માટે રચાયેલ છે. શરીર અને મુખ્ય ભાગો બનેલા છે સ્ટેનલેસ સ્ટીલ. તકનીકી લાક્ષણિકતાઓ કોષ્ટકમાં રજૂ કરવામાં આવી છે. 12.2.
ડિસ્ટિલરમાં નીચેના મુખ્ય બ્લોક્સનો સમાવેશ થાય છે (ફિગ. 12.2): કૂલર (કન્ડેન્સર), બરાબરી, બાષ્પીભવન ચેમ્બર (બાષ્પીભવન કરનાર), ઇલેક્ટ્રિક હીટર, લેવલ સેન્સર, કંટ્રોલ યુનિટ.
શુદ્ધ પાણીના નાના જથ્થાના ઉત્પાદન માટે તે આગ્રહણીય છે

ચોખા. 12.1.DE વોટર ડિસ્ટિલર્સનો દેખાવ
કોષ્ટક 12.2.મૂળભૂત તકનીકી વિશિષ્ટતાઓડીઇ ડિસ્ટિલર્સ

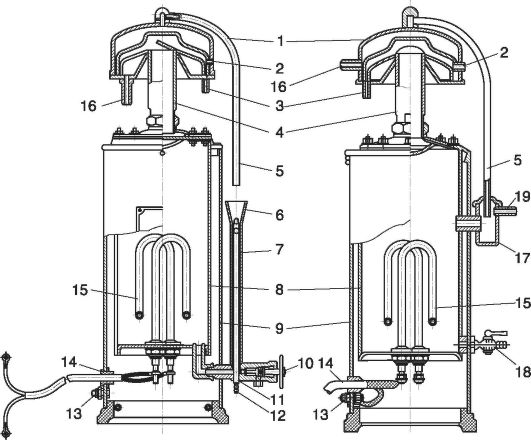
ચોખા. 12.2.ડિસ્ટિલર:
1 - કેપેસિટર; 2 - છિદ્ર; 3 - સ્તનની ડીંટડી; 4 - પાઇપ; 5 - ડ્રેઇન ટ્યુબ; 6 - ફનલ; 7 - બરાબરી; 8 - બાષ્પીભવન કરનાર; 9 - કેસીંગ; 10 - ટેપ; 11 - ક્રોસ; 12 - સ્તનની ડીંટડીમાં છિદ્ર; 13 - ગ્રાઉન્ડિંગ બોલ્ટ; 14 - વાયર; 15 - હીટિંગ તત્વ; 16 - સ્તનની ડીંટડી; 17 - બરાબરી ટાંકી; 18 - ડ્રેઇન વાલ્વ; 19 - પાણીની ડ્રેઇન ફિટિંગ

ચોખા. 12.3.ટેબલટોપ વોટર ડિસ્ટિલર
MELAdest જેવા કાઉન્ટરટૉપ ડિસ્ટિલર્સનો ઉપયોગ કરો છો? MELAG માંથી 65 (ફિગ. 12.3). ડિસ્ટિલર તમને શુદ્ધ પાણી મેળવવાની મંજૂરી આપે છે જે ફાર્માકોપિયાની જરૂરિયાતોને પૂર્ણ કરે છે. ઉત્પાદકતા - 0.7 l/કલાક. કદ - 23. 38 સે.મી. - 500 ડબ્લ્યુ. મુખ્ય ફાયદાઓ ઓછી ઉર્જા વપરાશ અને ઉત્પાદકતા છે, જે ડિસ્ટિલરને માત્ર થોડી વાનગીઓ બનાવવા માટે ઉપયોગમાં લેવાની મંજૂરી આપે છે.
નિસ્યંદન દ્વારા શુદ્ધ પાણી મેળવવાના નિયમો
1. શુદ્ધ પાણીની પ્રાપ્તિ અને સંગ્રહ વિશેષ રીતે હાથ ધરવામાં આવવો જોઈએ
વોટર ડિસ્ટિલર અથવા આ હેતુ માટે પરવાનગી આપવામાં આવેલ અન્ય ઇન્સ્ટોલેશનનો ઉપયોગ કરીને આ હેતુ માટે ખાસ સજ્જ રૂમમાં.
2. એક્વા ડિસ્ટિલરનો ઉપયોગ કરીને પાણી મેળવતી વખતે, કામ શરૂ કરતા પહેલા દરરોજ:
ડિસ્ટિલર અને પાઈપલાઈનને 10-15 મિનિટ માટે ઉકાળવામાં આવે છે બંધ વાલ્વકન્ડેન્સરને પાણી પૂરું પાડવું;
15-20 મિનિટની અંદર, પાણીના પ્રથમ ભાગોને કાઢી નાખવામાં આવે છે.
3. પરિણામી પાણી, શુદ્ધ અને ઇન્જેક્શન માટે, સ્વચ્છ, વંધ્યીકૃત અથવા વરાળ-ઉપચારિત ઔદ્યોગિક સંગ્રાહકોમાં એકત્રિત કરવામાં આવે છે જે પાણીના ગુણધર્મોને બદલતા નથી અને તેને વિદેશી કણો અને માઇક્રોબાયોલોજીકલ દૂષણોથી સુરક્ષિત કરે છે (એક અપવાદ તરીકે - કાચમાં સિલિન્ડર). સંગ્રહોમાં સ્પષ્ટ શિલાલેખ હોવું આવશ્યક છે: "શુદ્ધ પાણી", "ઇન્જેક્શન માટે પાણી". એક ટેગ જે તે પ્રાપ્ત થયો તે તારીખ દર્શાવે છે, વિશ્લેષણ નંબર અને તપાસ કરનાર વ્યક્તિની સહી પાણી સંગ્રહ સાથે જોડાયેલ છે. જો એકસાથે અનેક સંગ્રહોનો ઉપયોગ કરવામાં આવે, તો તે ક્રમાંકિત છે. ઈન્જેક્શન માટે પાણી એકત્ર કરવા અને સંગ્રહિત કરવા માટેના કન્ટેનરનું લેબલ સૂચવે છે કે તેમની સામગ્રી વંધ્યીકૃત નથી.
4. કાચના સંગ્રહને 2 છિદ્રોવાળા સ્ટોપર્સ સાથે કડક રીતે બંધ કરવામાં આવે છે: એક તે નળી માટે કે જેના દ્વારા પાણી વહે છે, બીજી કાચની નળી માટે જેમાં જંતુરહિત કપાસના સ્વેબ નાખવામાં આવે છે (રોજ બદલાય છે).
5. શુદ્ધ કરેલ પાણીનો ઉપયોગ તાજી રીતે તૈયાર કરવામાં આવે છે અથવા બંધ કન્ટેનરમાં 3 દિવસથી વધુ સમય માટે સંગ્રહિત થાય છે.
શુદ્ધ પાણીની ગુણવત્તા માટે રાજ્ય ભંડોળની જરૂરિયાતો
ક્લોરાઇડ, સલ્ફેટ અને કેલ્શિયમ ક્ષારની ગેરહાજરી માટે દરેક સિલિન્ડરમાંથી શુદ્ધ પાણીનું દરરોજ વિશ્લેષણ કરવામાં આવે છે. ત્રિમાસિક, શુદ્ધ પાણી સંપૂર્ણ રાસાયણિક વિશ્લેષણ માટે પ્રાદેશિક નિયંત્રણ અને વિશ્લેષણાત્મક પ્રયોગશાળામાં મોકલવામાં આવે છે.
શુદ્ધ કરેલ પાણી રંગહીન, પારદર્શક, ગંધહીન અને સ્વાદહીન હોવું જોઈએ. pH મૂલ્ય 5.0-6.8 ની વચ્ચે વધઘટ થઈ શકે છે. શુષ્ક અવશેષો 0.001% (એટલે કે 100 મિલી પાણીમાં 1 મિલિગ્રામ) કરતાં વધુ ન હોવા જોઈએ. પાણીમાં ઘટાડતા પદાર્થો ન હોવા જોઈએ (જ્યારે 100 મિલી પાણીને 2 મિલી પાતળું સલ્ફ્યુરિક એસિડ અને 1 મિલી 0.01 એમ પોટેશિયમ પરમેંગેનેટ દ્રાવણ સાથે 10 મિનિટ માટે ઉકાળવામાં આવે છે, ત્યારે પાણી રંગીન રહેવું જોઈએ. ગુલાબી), નાઈટ્રેટ્સ, નાઈટ્રાઈટ, ક્લોરાઈડ, સલ્ફેટ, કેલ્શિયમ, ભારે ધાતુઓ, કાર્બન ડાયોક્સાઇડ. માત્ર એમોનિયાના નિશાનની મંજૂરી છે (0.00002% થી વધુ નહીં).
શુદ્ધ પાણીની માઇક્રોબાયોલોજીકલ શુદ્ધતાએ પીવાના પાણીની જરૂરિયાતોને પૂર્ણ કરવી આવશ્યક છે. કુટુંબના બેક્ટેરિયાની ગેરહાજરીમાં તેને પ્રતિ મિલી દીઠ 100 થી વધુ સુક્ષ્મસજીવો ન રાખવાની મંજૂરી છે. એન્ટરબેક્ટેરિયાસી, પી. એરુગિનોસા, એસ. ઓરેયસ.
12.1.3. ઈન્જેક્શન માટે પાણી
ઈન્જેક્શન માટેના સોલ્યુશનના ઉત્પાદન માટે, ઈન્જેક્શન માટેના પાણીનો ઉપયોગ કરવામાં આવે છે, જે શુદ્ધ પાણીની કસોટીમાંથી પસાર થવું જોઈએ, અને તે જંતુરહિત અને પાયરોજન-મુક્ત પણ હોવું જોઈએ.
શું આરોગ્ય મંત્રાલયના આદેશના આધારે એસેપ્ટિક સ્થિતિમાં ઈન્જેક્શન માટે પાણી મેળવવામાં આવે છે? 309. ઈન્જેક્શન માટે પાણીની તૈયારી એસેપ્ટિક યુનિટના નિસ્યંદન રૂમમાં હાથ ધરવામાં આવે છે, જ્યાં પાણીના નિસ્યંદન સાથે સંબંધિત ન હોય તેવું કોઈપણ કાર્ય કરવા માટે સખત પ્રતિબંધિત છે.
ઇન્જેક્શન માટેનું પાણી વોટર ડિસ્ટિલર્સ અથવા રિવર્સ ઓસ્મોસિસ યુનિટનો ઉપયોગ કરીને તેમની સાથે જોડાયેલ સૂચનાઓ અનુસાર મેળવવામાં આવે છે.
તે જાણીતું છે કે પાયરોજેનિક પદાર્થો બિન-અસ્થિર હોય છે અને તેને પાણીની વરાળથી નિસ્યંદિત કરી શકાતા નથી. પાયરોજેનિક પદાર્થો સાથે નિસ્યંદનનું દૂષણ પાણીના નાના ટીપાંના સ્થાનાંતરણ દ્વારા અથવા કન્ડેન્સરમાં વરાળના પ્રવાહ દ્વારા તેને દૂર કરવાથી થાય છે. તેથી, ઈન્જેક્શન માટે પાણી મેળવવાનું મુખ્ય કાર્ય વરાળના તબક્કામાંથી પાણીના ટીપાંને અલગ કરવાનું છે. આ હેતુ માટે, AA-1 વોટર ડિસ્ટિલર્સ (ફિગ. 12.4) પાસે વિભાજક (8) હોય છે, જ્યાં વરાળ લાંબા વિન્ડિંગ પાથમાંથી પસાર થાય છે અને કન્ડેન્સરના માર્ગ પર ધીમે ધીમે ટીપું-પ્રવાહી તબક્કો ગુમાવે છે.
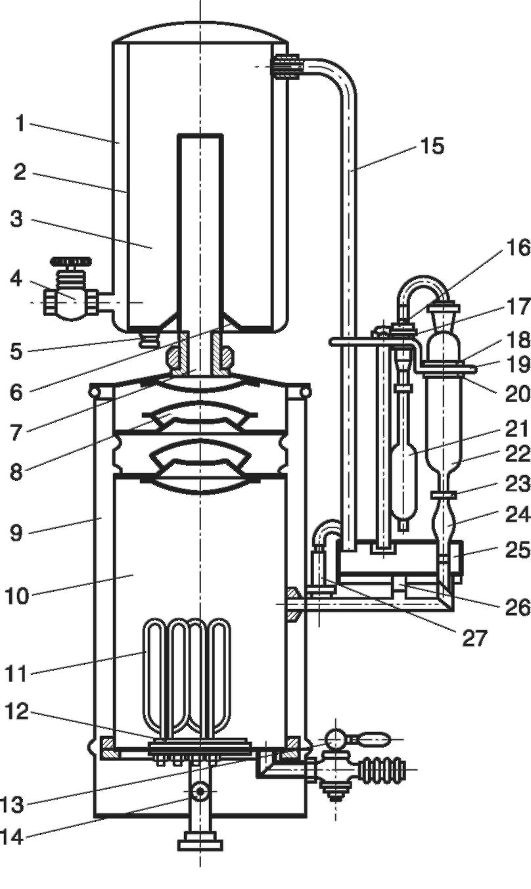
ચોખા. 12.4.પાણી ગાળનાર AA-1
AA-1 વોટર ડિસ્ટિલરના મુખ્ય ભાગો બાષ્પીભવન ચેમ્બર છે (10 ) વિભાજક (8), કન્ડેન્સર સાથે (1-6 ), બરાબરી કલેક્ટર (25) અને ઇલેક્ટ્રિકલ પેનલ. બાષ્પીભવન ચેમ્બર (10) સ્ટીલના આવરણ (9) દ્વારા બહારથી સુરક્ષિત છે, જે ગરમીના નુકસાનને ઘટાડવા અને કાર્યકારી કર્મચારીઓને બળી જવાથી બચાવવા માટે રચાયેલ છે. તળિયે (12 ) ચેમ્બર ચાર ઇલેક્ટ્રિક હીટર (11) અને રીસેટ કિનારીઓ (B) થી સજ્જ છે. બાષ્પીભવન ચેમ્બરમાં (10) પાણી (ઉમેરેલા રસાયણો સાથે) (14 ), ઇલેક્ટ્રિક હીટર (11) દ્વારા ગરમ, વરાળમાં ફેરવાય છે, જે વિભાજક દ્વારા (8) અને સ્ટીમ ટ્યુબ (7) કન્ડેન્સેશન ચેમ્બર (3) માં પ્રવેશે છે, ઠંડુ થાય છે

ચોખા. 12.5.ગ્લાસ સ્ટિલ
શૂટ ઠંડુ પાણી (15), અને, ઘનીકરણ, પાયરોજન-મુક્ત પાણીમાં ફેરવાય છે.
ડિમિનરલાઇઝેશનની ઉચ્ચતમ ડિગ્રીનું પાયરોજન-મુક્ત પાણી મેળવવા માટે, સાન્યો ગ્લાસ ડિસ્ટિલર્સનો ઉપયોગ કરવામાં આવે છે (ફિગ. 12.5). ડિસ્ટિલરમાં પેટન્ટ વરાળની જાળ હોય છે, જે ઉચ્ચતમ શુદ્ધતાના પાયરોજન-મુક્ત નિસ્યંદન પ્રદાન કરે છે; pH 5.6-6.0. ઉત્પાદકતા - 8 l/h.
ઇન્જેક્શન માટે શુદ્ધ પાણી (ડિમિનરલાઇઝ્ડ)
ડિમિનરલાઈઝ્ડ વોટર (એક્વા ડિમિનરલિસેટા)તબીબી પ્રેક્ટિસમાં તેનો ઉપયોગ ઈન્જેક્શન સોલ્યુશન બનાવવા માટે ઈન્જેક્શન માટે પાણી સાથે થાય છે.
ઈન્જેક્શન સોલ્યુશન્સ માટે ડિમિનરલાઈઝ્ડ વોટર રિવર્સ ઓસ્મોસિસ યુનિટ અને જંતુરહિત ફિલ્ટર દ્વારા સ્ત્રોત પાણીને પસાર કરીને મેળવવામાં આવે છે. સ્ટેજ પર રિવર્સ ઓસ્મોસિસપાણી સાફ થાય છે કાર્બનિક સંયોજનોઅને ક્ષાર. અશુદ્ધિઓનું નિરાકરણ ઓસ્મોટિક દબાણ કરતાં વધુ દબાણ પર અર્ધ-પારગમ્ય પટલમાંથી પાણી પસાર કરીને થાય છે. પ્રક્રિયાની કાર્યક્ષમતા વધારવા માટે, પુનઃપરિભ્રમણ દરમિયાન પટલની સપાટી પર પાણીના સ્પર્શક પુરવઠાનો ઉપયોગ થાય છે. સાધનસામગ્રીમાં શ્રેણીમાં જોડાયેલા કૉલમનો સમાવેશ થાય છે (ફિગ. 12.6), જેમાં ચોક્કસ રીતે વળેલા પટલ ફિલ્ટર્સની સિસ્ટમનો સમાવેશ થાય છે. પટલમાં છિદ્રનું કદ 0.0005-0.001 મીમી હોય છે. રિવર્સ ઓસ્મોસિસ સિસ્ટમ્સનું નિરીક્ષણ સિસ્ટમમાંથી બહાર નીકળતા પાણીની ચોક્કસ વિદ્યુત વાહકતાને માપીને કરવામાં આવે છે.
ઇન્જેક્શન માટે પાણીનો સંગ્રહ
ઈન્જેક્શન માટેનું પરિણામી પાણી સ્વચ્છ, જંતુરહિત અથવા સ્ટીમ-ટ્રીટેડ ગ્લાસ કન્ટેનરમાં અથવા ખાસ જહાજોમાં એકત્રિત કરવામાં આવે છે (ફિગ. 12.7). કન્ટેનર પર સ્પષ્ટપણે "ઇન્જેક્શન માટે પાણી" લેબલ હોવું આવશ્યક છે. ઈન્જેક્શન માટે પાણી સંગ્રહવા માટેનું કન્ટેનર આનાથી સજ્જ હોવું જોઈએ:
સ્ટિરર;
વરાળ અને ઠંડુ પાણી પૂરું પાડવા માટે જેકેટ;
જહાજની સમગ્ર આંતરિક સપાટીની સતત ભીનાશને સુનિશ્ચિત કરવા માટે શાવરિંગ સિસ્ટમ;
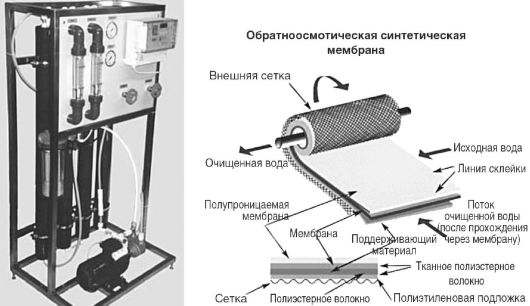
ચોખા. 12.6.રિવર્સ ઓસ્મોસિસ એકમો "એપીરોજન-20" અને રિવર્સ ઓસ્મોસિસ મેમ્બ્રેન

ચોખા. 12.7.ઔદ્યોગિક ઉત્પાદન માટે સતત પરિભ્રમણ પાણી ઇન્જેક્શન સંગ્રહ ટાંકી
થર્મોસ્ટેટ સિસ્ટમ;
હાઇડ્રોફોબિક એર ફિલ્ટર;
વિસ્ફોટક પટલ;
પ્રેશર ગેજ;
સ્તર નિયંત્રણ સિસ્ટમ. ઈન્જેક્શન માટે પાણીનો ઉપયોગ થાય છે
5 થી 10 સે તાપમાને અથવા 80 થી 95 સે સુધીના તાપમાને સંગ્રહિત કરવામાં આવે છે જે 24 કલાકથી વધુ સમય માટે પાણીના ગુણધર્મોને બદલી શકતા નથી? જો જરૂરી હોય તો ઈન્જેક્શન માટે પાણીના લાંબા ગાળાના સંગ્રહ માટે, તેનું પરિભ્રમણ 85-90 સે.ના તાપમાને ગોઠવવું જરૂરી છે.
ઈન્જેક્શન A. પિરોજેનિક પદાર્થોની ગેરહાજરી માટે પાણીની ગુણવત્તા માટેની આવશ્યકતાઓ
પાયરોજેનિક પદાર્થો (ગ્રીક. પીર- આગ, lat. પેઢી- જન્મ)ને મહત્વપૂર્ણ પ્રવૃત્તિના ઉત્પાદનો અને સુક્ષ્મસજીવોના સડો, મૃત માઇક્રોબાયલ કોષો કહેવામાં આવે છે. રાસાયણિક રચનાની દ્રષ્ટિએ, પાયરોજેનિક પદાર્થો 50 એનએમથી 1 માઇક્રોન સુધીના કણોના કદ સાથે લિપોપોલિસેકરાઇડ પ્રકૃતિના ઉચ્ચ-પરમાણુ સંયોજનો છે. તે સ્થાપિત કરવામાં આવ્યું છે કે પાયરોજેનિક પદાર્થો મુખ્યત્વે ગ્રામ-નેગેટિવ બેક્ટેરિયા દ્વારા રચાય છે.
પાયરોજેનિક પદાર્થો ધરાવતા સોલ્યુશનને ઇન્જેક્ટ કરવાથી પાયરોજેનિક અસર થાય છે (શરીરના તાપમાનમાં વધારો, તાવ). સૌથી ગંભીર પાયરોજેનિક પ્રતિક્રિયાઓ ઇન્ટ્રાવાસ્ક્યુલર, કરોડરજ્જુ અને ઇન્ટ્રાક્રેનિયલ ઇન્જેક્શન સાથે જોવા મળે છે.
પાયરોજેનિક પદાર્થો થર્મોસ્ટેબલ પદાર્થો છે; જ્યારે તેઓ 250 સે.ના તાપમાને 30 મિનિટ સુધી સૂકા હવાના જંતુરહિતમાં ગરમ થાય ત્યારે જ નાશ પામે છે. સંભવિત પાયરોજેનિક અસરના ભયને કારણે, 10 મિલી અથવા વધુ (GF) ના જથ્થામાં નસમાં સંચાલિત સોલ્યુશન્સનું પાયરોજેનિસિટી માટે પરીક્ષણ કરવામાં આવે છે. 5% ગ્લુકોઝ સોલ્યુશન, આઇસોટોનિક સોડિયમ ક્લોરાઇડ અને જિલેટીન સોલ્યુશન તપાસવું આવશ્યક છે. એક ક્વાર્ટરમાં એકવાર, જૈવિક પદ્ધતિ (એમએફ) નો ઉપયોગ કરીને આઇસોટોનિક સોલ્યુશનના સ્વરૂપમાં ઇન્જેક્શન માટે સોલ્યુશન અને પાણીની પાયરોજેનિસિટી માટે પરીક્ષણ હાથ ધરવામાં આવે છે.
જૈવિક પદ્ધતિ. ટેસ્ટ સોલ્યુશન 1.5-2.5 કિગ્રા વજનવાળા 3 સ્વસ્થ સસલાને કાનની નસમાં 10 મિલી પ્રતિ 1 કિલો સસલાના શરીરના વજનના દરે આપવામાં આવે છે. ઔષધીય પદાર્થ અથવા પાણીના સોલ્યુશનને પાયરોજન-મુક્ત ગણવામાં આવે છે, જો વહીવટ પછી, 3 માંથી 1 માપમાં 3 પ્રાયોગિક સસલાંમાંથી કોઈના શરીરના તાપમાનમાં પ્રારંભિક શરીરના તાપમાનની સરખામણીમાં 0.6 °C થી વધુ વધારો થયો ન હતો, અને કુલ તાપમાનમાં વધારો 3 સસલા 1.4?C થી વધુ ન હતો.
લિમ્યુલસ ટેસ્ટ.પાયરોજેનિસિટી માટે પરીક્ષણની સત્તાવાર જૈવિક પદ્ધતિ ઉપરાંત, એમેબોસાઇટ લિસેટ સાથે બેક્ટેરિયલ પાયરોજેન્સની ક્રિયાપ્રતિક્રિયા દરમિયાન જેલની રચના પર આધારિત લિમ્યુલસ ટેસ્ટ (LALtest), વ્યાપકપણે ઉપયોગમાં લેવાય છે. લિમ્યુલસ પોલિફેમસ.એલએએલ પરીક્ષણ એમ્બોસાઇટ લિસેટ (અવશેષ પ્રાણીઓના હેમોલિમ્ફ કોષો - ઘોડાની કરચલીઓ) ની ખાસ કરીને ગ્રામ-નેગેટિવ બેક્ટેરિયાના એન્ડોટોક્સિન સાથે પ્રતિક્રિયા કરવાની ક્ષમતા પર આધારિત છે. હાલમાં
LAL પરીક્ષણને ઘણા દેશોના ફાર્માકોપીઆ દ્વારા કાયદેસર કરવામાં આવે છે, અને 2009 થી તેને રશિયન ફેડરેશનના ફાર્માકોપીઆમાં પાયરોજેનિક પદાર્થોને ઓળખવા માટે વૈકલ્પિક પદ્ધતિ તરીકે સમાવેશ કરવા માટે પ્રસ્તાવિત કરવામાં આવ્યો છે. ડિપાયરોજનેશન પદ્ધતિઓ:
રાસાયણિક;
ભૌતિક-રાસાયણિક;
એન્ઝાઈમેટિક.
ડિપાયરોજનેશનની રાસાયણિક પદ્ધતિઓ:
થર્મોસ્ટેબલ પદાર્થોમાં પાયરોજેનિક પદાર્થોનું પાયરોલિટીક વિઘટન (સોડિયમ ક્લોરાઇડનું ડિપાયરોજનેશન
180-200 સી);
6% હાઇડ્રોજન પેરોક્સાઇડ સોલ્યુશનને 100 પર ગરમ કરવું? 1 કલાક માટે સી;
પોટેશિયમ પરમેંગેનેટના 0.5-1% સોલ્યુશનમાં 25-30 મિનિટ માટે સલ્ફ્યુરિક એસિડ સાથે એસિડિફાઇડ રાખવું. સોલ્યુશન તૈયાર કરવા માટે, પોટેશિયમ પરમેંગેનેટના 1% સોલ્યુશનના 10 ભાગોમાં 1.5% સલ્ફ્યુરિક એસિડ સોલ્યુશનના 6 ભાગો ઉમેરો. સારવાર પછી, જહાજો અને નળીઓને ઇન્જેક્શન માટે તાજા તૈયાર પાણીથી સારી રીતે ધોવામાં આવે છે.
ભૌતિક-રાસાયણિક પદ્ધતિઓ:
સક્રિય કાર્બન અને સેલ્યુલોઝ સાથે કૉલમ દ્વારા ઉકેલો પસાર કરવો;
નકારાત્મક ઝેટા સંભવિત સાથે પટલ અલ્ટ્રાફિલ્ટરનો ઉપયોગ. આ પદ્ધતિઈન્જેક્શન સોલ્યુશનના ઔદ્યોગિક ઉત્પાદન માટે અનુકૂળ.
B. ઈન્જેક્શન માટે પાણીનું ગુણવત્તા નિયંત્રણ
રશિયન ફેડરેશનના આરોગ્ય મંત્રાલયના આદેશના આધારે? 309 અને MU-78-113 “ઇન્જેક્શન માટે શુદ્ધ પાણી અને પાણીની તૈયારી, સંગ્રહ અને વિતરણ” તારીખ 22 મે, 1998, રાજ્ય ભંડોળ “શુદ્ધ પાણી” અને “પાણી માટે પાણી” ના લેખો અનુસાર દરરોજ ઇન્જેક્શન માટેના પાણીનું નિરીક્ષણ કરવામાં આવે છે. ઈન્જેક્શન” ફાર્માકોપોઇયલ મોનોગ્રાફ (કોષ્ટક 12.3) અનુસાર.
જો ફાર્મસીમાં પાઇપલાઇન્સ દ્વારા પાણી વિતરણ વ્યવસ્થા હોય, તો પછી ઇન્જેક્શન માટેનું પાણી પાઇપલાઇન્સમાં વધારાના નિયંત્રણને આધિન છે. શુદ્ધ પાણી વિતરણ પ્રણાલીમાં, પ્રવાહ દર (લૂપ સિસ્ટમ માટે), તાપમાન (ગરમ સિસ્ટમો માટે) અને પાણીની વિદ્યુત વાહકતા સતત દેખરેખને આધીન છે. વધુમાં, કાર્બનિક કાર્બન સામગ્રીનું નિયંત્રણ ઇચ્છનીય છે.
કોષ્ટક 12.3. FS-2619 અને FS-2620 અનુસાર ઇન્જેક્શન માટે શુદ્ધ પાણી અને પાણીના ગુણવત્તા સૂચક
સૂચક | માપનના એકમો | શુદ્ધ પાણી | ઈન્જેક્શન માટે પાણી |
દેખાવ | રંગહીન પારદર્શક પ્રવાહી, ગંધહીન અને સ્વાદહીન |
||
pH | 5,0-7,0 | 5,0-7,0 |
|
સુકા અવશેષ | <0,001 | <0,001 |
|
ઘટાડતા એજન્ટો | એફએસ પદ્ધતિ અનુસાર | એફએસ પદ્ધતિ અનુસાર |
|
કાર્બન ડાયોક્સાઇડ | એફએસ પદ્ધતિ અનુસાર | એફએસ પદ્ધતિ અનુસાર |
|
નાઈટ્રેટ્સ અને નાઈટ્રેટ્સ | mg/ml | <0,0002 | <0,0002 |
એમોનિયા | mg/ml | <0,0002 | <0,0002 |
ક્લોરાઇડ્સ | mg/ml | <0,0001 | <0,0001 |
સલ્ફેટસ | mg/ml | <0,003 | <0,003 |
કેલ્શિયમ | mg/ml | <0,0035 | <0,0035 |
ભારે ધાતુઓ | mg/ml | <0,0005 | <0,0005 |
સૂક્ષ્મજીવો | એકમો/મિલી | <100 при отсутствии бактерий семейства એન્ટરબેક્ટેરિયા, સ્ટેફાયલોકોકસ, સ્યુડોમોનાસ એરુગિનોસા. | કોઈ નહિ |
પિરોજેનિસિટી | બિન-પાયરોજેનિક |
12.2. GF દ્વારા પદાર્થોની દ્રાવ્યતા
ઉકેલો બનાવવા માટેની તકનીક માત્ર દ્રાવકના ગુણધર્મો પર જ નહીં, પરંતુ દવાના પદાર્થની દ્રાવ્યતા પર પણ આધારિત છે.
દ્રાવ્યતા- આપેલ તાપમાન અને દબાણ પર આપેલ દ્રાવકમાં સંપૂર્ણપણે ઓગળી શકાય તેવા પદાર્થની મહત્તમ સાંદ્રતા. ઔષધીય પદાર્થને ઓગળેલા માનવામાં આવે છે જો પ્રસારિત પ્રકાશમાં જોવામાં આવે ત્યારે તેના કણો દ્રાવણમાં શોધી ન શકાય.
ગ્લોબલ ફંડ મુજબ, 7 શરતો સ્થાપિત કરવામાં આવી છે જે દવાઓની દ્રાવ્યતા દર્શાવે છે (કોષ્ટક 12.4).
કોષ્ટક 12.4.GF અનુસાર દ્રાવ્યતા લાક્ષણિકતાઓ
12.2.1. દ્રાવ્યતાને અસર કરતા પરિબળો
A. તાપમાન
કોઈપણ પદાર્થની દ્રાવ્યતા તાપમાન પર આધાર રાખે છે. મોટા ભાગના પદાર્થો એન્ડોથર્મિક હોય છે, જે ઓગળી જતાં ગરમીને શોષી લે છે. આ પદાર્થો માટે, દ્રાવણને ગરમ કરવાથી દ્રાવ્યતા વધે છે. કેટલાક પદાર્થો (હાઈડ્રોક્સાઇડ અથવા કેલ્શિયમ ગ્લાયસેરોફોસ્ફેટ અને સોડિયમ કાર્બેનિસિલિન) વિસર્જન પ્રક્રિયા દરમિયાન ગરમી ઉત્પન્ન કરે છે. આવા પદાર્થોની દ્રાવ્યતા વધતા તાપમાન સાથે ઘટે છે.
B. અન્ય આયનોની હાજરી
જ્યારે દ્રાવણમાં વધારાના પદાર્થો અથવા આયનો દાખલ કરવામાં આવે છે ત્યારે દ્રાવ્યતા લગભગ હંમેશા ઘટે છે. જો કે, જ્યારે સોલ્યુશનમાં આયનો દાખલ કરવામાં આવે છે ત્યારે દ્રાવ્યતામાં વધારો વચ્ચે વિપરીત સંબંધ છે:
- ગ્લોબ્યુલિન પ્રોટીનની દ્રાવ્યતામાં વધારો, જે પાણી કરતાં સોડિયમ ક્લોરાઇડના દ્રાવણમાં વધુ સારી રીતે દ્રાવ્ય હોય છે;
- પોટેશિયમ આયોડાઈડના સંતૃપ્ત દ્રાવણમાં આયોડિનને ઓગાળીને KJ 3 કોમ્પ્લેક્સ રચાય છે;
- સોડિયમ ક્લોરાઇડના દ્રાવણમાં મર્ક્યુરિક ક્લોરાઇડને ઓગાળીને જટિલ સંયોજન Na 2 HgCl 4 રચાય છે.


તે આનાથી અનુસરે છે કે સોડિયમ ફેનોબાર્બીટલ 8.3 કરતા વધારે pH પર ઓગળેલી સ્થિતિમાં છે. pH માં ઘટાડો ફેનોબાર્બીટલને અવક્ષેપનું કારણ બનશે.
D. સોલવન્ટ પોલેરિટી
આપેલ દ્રાવકમાં દવાની દ્રાવ્યતા મોટાભાગે દ્રાવકની ધ્રુવીયતા પર આધાર રાખે છે. ડાઇલેક્ટ્રિક સ્થિરાંકના આધારે, દ્રાવકને ધ્રુવીય (e > 50), અર્ધ-ધ્રુવીય (e = 20-50) અથવા બિન-ધ્રુવીય (e = 1-20) (કોષ્ટક 12.5) તરીકે વર્ગીકૃત કરવામાં આવે છે.
કોષ્ટક 12.5.દ્રાવકનો ડાઇલેક્ટ્રિક સ્થિરાંક
દ્રાવક | ડાઇલેક્ટ્રિક કોન્સ્ટન્ટ, e, 20 ?C |
એન-મિથાઈલફોર્માઈડ | |
પાણી | |
સોર્બીટોલ સોલ્યુશન (70%) | |
સીરપ (64%) | |
ગ્લિસરોલ | |
પ્રોપીલીન ગ્લાયકોલ | 32,1 |
ઇથેનોલ | |
પોલિઇથિલિન ગ્લાયકોલ 400 | 12,4 |
ક્લોરોફોર્મ | |
એરંડા તેલ | |
ઈથર | |
ઓલિવ તેલ |
ધ્રુવીય દ્રાવક ક્ષાર અથવા અત્યંત ધ્રુવીય (દ્વિધ્રુવીય) અણુઓને ઓગાળે છે. બિનધ્રુવીય દ્રાવક બિનધ્રુવીય અણુઓને ઓગાળે છે. અર્ધ-ધ્રુવીય દ્રાવક (આલ્કોહોલ અને કીટોન્સ) તેમના ગુણધર્મોના આધારે બંનેને ઓગાળી શકે છે. આમ, ફાર્મસીમાં દ્રાવક પસંદ કરવા માટે એક સાર્વત્રિક નિયમ છે: "લાઇક લાઇકમાં ઓગળી જાય છે."
અર્ધ-ધ્રુવીય દ્રાવકોમાં પદાર્થોની દ્રાવ્યતા વધારવાની 2 રીતો છે:
1. પદાર્થ (મીઠું અથવા આધાર) ની ધ્રુવીયતા બદલવા માટે pH ને બદલીને. મીઠાની સાંદ્રતામાં વધારો થવાથી વધારો થાય છે
ધ્રુવીય દ્રાવકોમાં ક્ષારની દ્રાવ્યતા, બિન-ધ્રુવીય રાશિઓમાં પાયા.
2. દ્રાવકની ધ્રુવીયતા બદલવા માટે વિવિધ ધ્રુવીયતાના દ્રાવકનું મિશ્રણ.

ઉદાહરણ 2
ફ્યુરાટસિલિન સોલ્યુશન 1:1500 માં આલ્કોહોલને ગ્લિસરીન સાથે બદલો. દ્રાવકનું ડાઇલેક્ટ્રિક સ્થિરાંક નક્કી કરવા માટે, ઇથેનોલ અને પાણીનું મિશ્રણ તૈયાર કરવામાં આવે છે. પછી આ મિશ્રણમાં સોલ્યુશન તૈયાર કરવામાં આવે છે, વરસાદનું નિરીક્ષણ કરીને, રાતોરાત છોડી દેવામાં આવે છે (કોષ્ટક 12.6).
ઉદાહરણ તરીકે, 60/40 અથવા વધુના મિશ્રણમાં ફ્યુરાટસિલિનનો વરસાદ જોવા મળ્યો ન હતો; પ્રયોગોના પરિણામો નીચે પ્રસ્તુત છે: + (હા), - (ના).
કોષ્ટક 12.6.ફ્યુરાટસિલિનના અવક્ષેપ પર આલ્કોહોલની અસર
% v/v આલ્કોહોલ | |||||||||||
વરસાદ |


સુરક્ષા પ્રશ્નો
1. dispersological વર્ગીકરણના દૃષ્ટિકોણથી ઉકેલોને વ્યાખ્યાયિત કરો.
2. શુદ્ધ પાણી મેળવવા માટે કઈ પદ્ધતિઓ અસ્તિત્વમાં છે?
3. શુદ્ધ પાણીની ગુણવત્તા માટે શું જરૂરિયાતો છે?
4. ઈન્જેક્શન માટે પાણીની ગુણવત્તા માટેની જરૂરિયાતો શું છે?
5. ઈન્જેક્શન માટે પાણી મેળવવા માટે કઈ પદ્ધતિઓ અસ્તિત્વમાં છે?
6. ઇન્જેક્શન માટે શુદ્ધ પાણી અને પાણી કેવી રીતે સંગ્રહિત થાય છે?
ટેસ્ટ
1. સોલ્યુશન્સ - ઓગાળીને મેળવવામાં આવેલ પ્રવાહી ડોઝ ફોર્મ:
1. પ્રવાહી.
2. ઘન.
3. યોગ્ય દ્રાવકમાં વાયુયુક્ત પદાર્થો
2. ઓછા પરમાણુ વજનવાળા પદાર્થોના સાચા ઉકેલો:
1. ફિલ્ટરમાંથી પસાર થવું.
2. ડાયાલિસીંગ મેમ્બ્રેનમાંથી પસાર થવું.
3. સેન્ટ્રીફ્યુગેશન દરમિયાન ગુણધર્મો બદલશો નહીં.
4. તેઓ ગરમ થાય છે.
3. શુદ્ધ પાણી મેળવવાની રીતો:
1. નિસ્યંદન.
2. રિવર્સ ઓસ્મોસિસ.
3. આયન વિનિમય.
4. ડિસ્ટિલરમાં નીચેના મુખ્ય બ્લોક્સનો સમાવેશ થાય છે:
1. કુલર (કન્ડેન્સર).
2. બરાબરી.
3. ફિલર.
4. બાષ્પીભવન ચેમ્બર (બાષ્પીભવન કરનાર).
5. ઇલેક્ટ્રિક હીટર.
6. લેવલ સેન્સર.
7. નિયંત્રણ એકમ.
5. દરરોજ, કામ શરૂ કરતા પહેલા, કન્ડેન્સરને પાણી પુરવઠાના વાલ્વ સાથે ડિસ્ટિલર અને પાઈપલાઈન બંધ કરવામાં આવે છે:
1.5 મિનિટ
2. 10 મિનિટ
3. 15 મિનિટ
4. 20 મિનિટ
5. પછી પાણીના પ્રથમ ભાગોને 15-20 મિનિટ માટે કાઢી નાખવામાં આવે છે.
6. પાયરોજન-મુક્ત પાણી AA-1 ઉત્પન્ન કરવા માટે વોટર ડિસ્ટિલર્સ પાસે વિભાજક છે:
1. યાંત્રિક સમાવેશનો વિભાગ.
2. વરાળમાંથી ટીપું-પ્રવાહી તબક્કાને દૂર કરવા.
3. સુક્ષ્મસજીવો દૂર કરવા.
7. શું સાચું છે:
1. ઈન્જેક્શન માટે તાજી તૈયાર પાણીનો ઉપયોગ કરો;
2. 5 થી 10 સે તાપમાને સ્ટોર કરો?
3. 80 થી 95 સે તાપમાને સ્ટોર કરો?
8. નીચેના ઉત્પાદનોને પાયરોજેનિક પદાર્થો કહેવામાં આવે છે:
1. સુક્ષ્મસજીવોની મહત્વપૂર્ણ પ્રવૃત્તિ.
2. સુક્ષ્મસજીવોનો સડો.
3. મૃત માઇક્રોબાયલ કોષો.
4. સધ્ધર સુક્ષ્મસજીવો.
9. પાયરોજેનિક પદાર્થોનો નાશ થાય છે:
1. 6 કલાક માટે ઉકાળો.
2. 30 મિનિટ માટે 132°C તાપમાને વંધ્યીકરણ.
3. શુષ્ક હવા સ્ટીરલાઈઝરમાં 250 સે.ના તાપમાને 30 મિનિટ સુધી ગરમ કરવું?
10. ઈન્જેક્શન માટે પાણી હોવું જોઈએ:
1 જંતુરહિત. 2. નોન-પાયરોજેનિક.
9. ઉકેલો. ઉકેલોનું વર્ગીકરણ
તેમની એકત્રીકરણની સ્થિતિ અનુસાર, ઉકેલો વાયુયુક્ત, પ્રવાહી અને ઘન હોઈ શકે છે.
કોઈપણ ઉકેલમાં ઓગળેલા પદાર્થો અને દ્રાવકનો સમાવેશ થાય છે, જો કે આ ખ્યાલો અમુક હદ સુધી મનસ્વી છે. ઉદાહરણ તરીકે, આલ્કોહોલ અને પાણીના ગુણોત્તરના આધારે, આ સિસ્ટમ પાણીમાં આલ્કોહોલ અથવા આલ્કોહોલમાં પાણીનો ઉકેલ હોઈ શકે છે.
સામાન્ય રીતે, દ્રાવકને તે ઘટક તરીકે ગણવામાં આવે છે જે દ્રાવણમાં વિસર્જન પહેલાની જેમ એકત્રીકરણની સમાન સ્થિતિમાં હોય છે.
ઉકેલોનો અભ્યાસ ચિકિત્સકો માટે ખાસ રસ ધરાવે છે કારણ કે સૌથી મહત્વપૂર્ણ જૈવિક પ્રવાહી - લોહી, લસિકા, પેશાબ, લાળ, પરસેવો - પાણીમાં ક્ષાર, પ્રોટીન, કાર્બોહાઇડ્રેટ્સ, લિપિડ્સના ઉકેલો છે.
જૈવિક પ્રવાહી પોષક તત્વો (ચરબી, એમિનો એસિડ, ઓક્સિજન), અવયવો અને પેશીઓમાં દવાઓના પરિવહનમાં તેમજ શરીરમાંથી ચયાપચય (યુરિયા, બાય-લિરૂબિન, કાર્બન ડાયોક્સાઇડ, વગેરે) ના વિસર્જનમાં સામેલ છે. રક્ત પ્લાઝ્મા કોશિકાઓ માટેનું એક માધ્યમ છે - લિમ્ફોસાઇટ્સ, એરિથ્રોસાઇટ્સ, પ્લેટલેટ.
શરીરના પ્રવાહી માધ્યમોમાં, સતત એસિડિટી, ક્ષાર અને કાર્બનિક પદાર્થોની સાંદ્રતા જાળવવામાં આવે છે. આ સ્થિરતાને એકાગ્રતા હોમિયોસ્ટેસિસ કહેવામાં આવે છે.
ઉકેલોનું વર્ગીકરણ
5000 ગ્રામ/મોલ કરતા ઓછા દાળના દળવાળા પદાર્થોના ઉકેલોને ઓછા પરમાણુ વજન સંયોજનો (LMC) અને 5000 ગ્રામ/મોલથી વધુ દાળના દળવાળા પદાર્થોના દ્રાવણોને ઉચ્ચ પરમાણુ વજન સંયોજનોના ઉકેલો કહેવામાં આવે છે. HMC).
ઇલેક્ટ્રોલાઇટિક ડિસોસિએશનની હાજરી અથવા ગેરહાજરીના આધારે, NMS સોલ્યુશન્સને બે વર્ગોમાં વહેંચવામાં આવે છે - ઇલેક્ટ્રોલાઇટ્સ અને નોન-ઇલેક્ટ્રોલાઇટ્સના ઉકેલો.
ઇલેક્ટ્રોલાઇટ સોલ્યુશન્સ એ ક્ષાર, એસિડ, પાયા અને એમ્ફોલાઇટ્સના ઉકેલો છે જે આયનોમાં વિભાજિત થાય છે. ઉદાહરણ તરીકે, KNO 3, HCl, KOH, Al(OH) 3, ગ્લાયસીનના ઉકેલો.
ઇલેક્ટ્રોલાઇટ સોલ્યુશન્સની વિદ્યુત વાહકતા દ્રાવક કરતા વધારે છે.
નોન-ઇલેક્ટ્રોલાઇટ્સના સોલ્યુશન્સ એ પદાર્થોના ઉકેલો છે જે વ્યવહારીક રીતે પાણીમાં વિસર્જન કરતા નથી. ઉદાહરણ તરીકે, સુક્રોઝ, ગ્લુકોઝ, યુરિયાના ઉકેલો. નોન-ઇલેક્ટ્રોલાઇટ સોલ્યુશનની વિદ્યુત વાહકતા દ્રાવક કરતા થોડી અલગ હોય છે.
એનએમએસ (ઇલેક્ટ્રોલાઇટ્સ અને નોન-ઇલેક્ટ્રોલાઇટ્સ) ના ઉકેલોને કોલોઇડલ સોલ્યુશન્સથી વિપરીત સાચું કહેવામાં આવે છે. સાચા ઉકેલો રચનાની એકરૂપતા અને દ્રાવક અને દ્રાવક વચ્ચેના ઇન્ટરફેસની ગેરહાજરી દ્વારા વર્ગીકૃત થયેલ છે. ઓગળેલા કણો (આયનો અને પરમાણુઓ) નું કદ 10 -9 મીટર કરતા ઓછું છે.
મોટા ભાગના BMCs પોલિમર હોય છે, જેના પરમાણુઓ (મેક્રોમોલેક્યુલ્સ) રાસાયણિક બોન્ડ દ્વારા એકબીજા સાથે જોડાયેલા પુનરાવર્તિત જૂથો અથવા મોનોમર એકમોનો સમાવેશ કરે છે. IUD સોલ્યુશન્સને પોલિઇલેક્ટ્રોલાઇટ સોલ્યુશન કહેવામાં આવે છે.
પોલીઈલેક્ટ્રોલાઈટ્સમાં પોલિએસિડ્સ (હેપરિન, પોલિએડેનિલિક એસિડ, પોલિઆસ્પર્ટિક એસિડ, વગેરે), પોલિબેઝ (પોલીલીસીન), પોલિએમ્ફોલિટ્સ (પ્રોટીન, ન્યુક્લિક એસિડ) નો સમાવેશ થાય છે.
IUD સોલ્યુશનના ગુણધર્મો NMS સોલ્યુશનના ગુણધર્મોથી નોંધપાત્ર રીતે અલગ છે. તેથી, તેઓને એક અલગ વિભાગમાં ધ્યાનમાં લેવામાં આવશે. આ પ્રકરણ ઓછા પરમાણુ વજનના ઈલેક્ટ્રોલાઈટ્સ, એમ્ફોલાઈટ્સ અને નોન-ઈલેક્ટ્રોલાઈટ્સના ઉકેલો માટે સમર્પિત છે.
10. દ્રાવક તરીકે પાણી
આપણા ગ્રહ પર સૌથી સામાન્ય દ્રાવક પાણી છે. સરેરાશ 70 કિલો વજન ધરાવતા વ્યક્તિના શરીરમાં અંદાજે 40 કિલો પાણી હોય છે. આ કિસ્સામાં, લગભગ 25 કિગ્રા પાણી એ કોશિકાઓની અંદરનો પ્રવાહી છે, અને 15 કિગ્રા એ બાહ્યકોષીય પ્રવાહી છે, જેમાં રક્ત પ્લાઝ્મા, ઇન્ટરસેલ્યુલર પ્રવાહી, સેરેબ્રોસ્પાઇનલ પ્રવાહી, ઇન્ટ્રાઓક્યુલર પ્રવાહી અને જઠરાંત્રિય માર્ગના પ્રવાહી સમાવિષ્ટોનો સમાવેશ થાય છે. પ્રાણી અને વનસ્પતિ સજીવોમાં, પાણી સામાન્ય રીતે 50% થી વધુ બનાવે છે, અને કેટલાક કિસ્સાઓમાં પાણીનું પ્રમાણ 90-95% સુધી પહોંચે છે.
તેના વિસંગત ગુણધર્મોને લીધે, પાણી એક અનન્ય દ્રાવક છે, જે જીવન માટે સંપૂર્ણ રીતે અનુકૂળ છે.
સૌ પ્રથમ, પાણી આયનીય અને ઘણા ધ્રુવીય સંયોજનોને સારી રીતે ઓગાળી દે છે. પાણીની આ ગુણધર્મ મોટે ભાગે તેના ઉચ્ચ ડાઇલેક્ટ્રિક કોન્સ્ટન્ટ (78.5)ને કારણે છે.
અન્ય મોટા વર્ગના પદાર્થો કે જે પાણીમાં સરળતાથી દ્રાવ્ય હોય છે તેમાં ધ્રુવીય કાર્બનિક સંયોજનો જેમ કે શર્કરા, એલ્ડીહાઇડ્સ, કીટોન્સ અને આલ્કોહોલનો સમાવેશ થાય છે. પાણીમાં તેમની દ્રાવ્યતા આ પદાર્થોના ધ્રુવીય કાર્યાત્મક જૂથો સાથે ધ્રુવીય બોન્ડ બનાવવાની પાણીના અણુઓની વૃત્તિ દ્વારા સમજાવવામાં આવે છે, ઉદાહરણ તરીકે આલ્કોહોલ અને શર્કરાના હાઇડ્રોક્સિલ જૂથો સાથે અથવા એલ્ડીહાઇડ્સ અને કીટોન્સના કાર્બોનિલ જૂથના ઓક્સિજન અણુ સાથે. નીચે હાઇડ્રોજન બોન્ડના ઉદાહરણો છે જે જૈવિક પ્રણાલીઓમાં પદાર્થોની દ્રાવ્યતા માટે મહત્વપૂર્ણ છે. તેની ઉચ્ચ ધ્રુવીયતાને લીધે, પાણી પદાર્થોના હાઇડ્રોલિસિસનું કારણ બને છે.
પાણી શરીરના આંતરિક વાતાવરણનો મુખ્ય ભાગ હોવાથી, તે શરીરમાં શોષણ, પોષક તત્ત્વોની હિલચાલ અને મેટાબોલિક ઉત્પાદનોની પ્રક્રિયાઓને સુનિશ્ચિત કરે છે.
એ નોંધવું જોઇએ કે પાણી એ પદાર્થોના જૈવિક ઓક્સિડેશનનું અંતિમ ઉત્પાદન છે, ખાસ કરીને ગ્લુકોઝ. આ પ્રક્રિયાઓના પરિણામે પાણીની રચના મોટી માત્રામાં ઊર્જાના પ્રકાશન સાથે છે - આશરે 29 kJ/mol.
પાણીના અન્ય વિસંગત ગુણધર્મો પણ મહત્વપૂર્ણ છે: ઉચ્ચ સપાટી તણાવ, ઓછી સ્નિગ્ધતા, ઉચ્ચ ગલન અને ઉત્કલન બિંદુઓ, અને ઘન અવસ્થા કરતાં પ્રવાહી સ્થિતિમાં ઉચ્ચ ઘનતા.
પાણી એ સહયોગીઓની હાજરી દ્વારા વર્ગીકૃત થયેલ છે - હાઇડ્રોજન બોન્ડ દ્વારા જોડાયેલા પરમાણુઓના જૂથો.
પાણી માટેના આકર્ષણના આધારે, દ્રાવ્ય કણોના કાર્યાત્મક જૂથોને હાઇડ્રોફિલિક (પાણીને આકર્ષતા), પાણી દ્વારા સરળતાથી ઉકેલી શકાય તેવા, હાઇડ્રોફોબિક (પાણીને દૂર કરવા) અને ડિફિલિકમાં વિભાજિત કરવામાં આવે છે.
હાઇડ્રોફિલિક જૂથોમાં ધ્રુવીય કાર્યાત્મક જૂથોનો સમાવેશ થાય છે: હાઇડ્રોક્સિલ -ઓએચ, એમિનો -એનએચ 2, થિઓલ -એસએચ, કાર્બોક્સિલ -સીઓઓએચ. હાઇડ્રોફોબિક જૂથોમાં બિન-ધ્રુવીય જૂથોનો સમાવેશ થાય છે, ઉદાહરણ તરીકે હાઇડ્રોકાર્બન રેડિકલ: CH3-(CH2) p -, C6H5-. હાઇફિલિકમાં પદાર્થો (એમિનો એસિડ, પ્રોટીન) નો સમાવેશ થાય છે, જેનાં પરમાણુઓમાં હાઇડ્રોફિલિક જૂથો (-OH, -NH 2, -SH, -COOH) અને હાઇડ્રોફોબિક જૂથો બંને હોય છે: (CH 3 - (CH 2) p, - C 6 H 5 -).
જ્યારે ડિફિલિક પદાર્થો ઓગળી જાય છે, ત્યારે હાઇડ્રોફોબિક જૂથો સાથે ક્રિયાપ્રતિક્રિયાના પરિણામે પાણીની રચના બદલાય છે. હાઇડ્રોફોબિક જૂથોની નજીક સ્થિત પાણીના અણુઓના ક્રમની ડિગ્રી વધે છે, અને હાઇડ્રોફોબિક જૂથો સાથે પાણીના અણુઓનો સંપર્ક ન્યૂનતમ થઈ જાય છે. હાઇડ્રોફોબિક જૂથો, જ્યારે સંકળાયેલા હોય છે, ત્યારે પાણીના અણુઓને તેમના સ્થાનની બહાર ધકેલી દે છે.
11. ઉકેલની સાંદ્રતા અને તેને વ્યક્ત કરવાની પદ્ધતિઓ
ઉકેલસંતુલનની સ્થિતિમાં બે કે તેથી વધુ પદાર્થોનો સમાવેશ કરતી ચલ રચનાની સજાતીય સિસ્ટમ કહેવામાં આવે છે. જે પદાર્થો દ્રાવણ બનાવે છે તેને ઉકેલ ઘટકો કહેવામાં આવે છે.
ઉકેલની એક મહત્વપૂર્ણ લાક્ષણિકતા તેની સાંદ્રતા છે. આ મૂલ્ય સોલ્યુશનના ઘણા ગુણધર્મો નક્કી કરે છે.
પદાર્થની સાંદ્રતા(સોલ્યુશન કમ્પોનન્ટ) એ ચોક્કસ સમૂહ અથવા સોલ્યુશન અથવા દ્રાવકના જથ્થામાં સમાવિષ્ટ ઓગળેલા પદાર્થની માત્રા દ્વારા માપવામાં આવેલ જથ્થો છે.
એકાગ્રતા વ્યક્ત કરવા માટે સૌથી વધુ ઉપયોગમાં લેવાતી રીતો છે: સમૂહ અપૂર્ણાંક, દાઢ સાંદ્રતા, દાઢ સમકક્ષ સાંદ્રતા, દાઢ અપૂર્ણાંક, વોલ્યુમ અપૂર્ણાંક, ટાઇટર.
સમૂહ અપૂર્ણાંક ડબલ્યુ(X) એકમના ભાગો, ટકા (%), ppm (ટકાનો હજારમો ભાગ) અને ભાગો દીઠ મિલિયન (ppm) માં વ્યક્ત થાય છે. સમૂહ અપૂર્ણાંકની ગણતરી સૂત્રો દ્વારા કરવામાં આવે છે:
W (X) = m (X) / m (કદ),
W (X) = m (X) / m (કદ) × 100%,
જ્યાં m (X) એ આપેલ ઘટક X (ઓગળેલા પદાર્થ), kg (g) નો સમૂહ છે;
m (સોલ્યુશન) - સોલ્યુશનનો સમૂહ, kg (g).
મોલર સાંદ્રતા mol/m3, mol/dm3, mol/cm3, mol/l, mol/ml માં દર્શાવવામાં આવે છે. દવામાં, mol/l એકમોનો ઉપયોગ પ્રાધાન્યક્ષમ છે. સૂત્રનો ઉપયોગ કરીને દાઢ સાંદ્રતાની ગણતરી કરવામાં આવે છે:
સી(X) = n (X) /વી(p-p) = m (X) /એમ(X)× વી(rr) ,
જ્યાં n (X) એ સિસ્ટમમાં ઓગળેલા પદાર્થની માત્રા છે, mol;
એમ(X) – ઓગળેલા પદાર્થનો દાઢ સમૂહ, kg/mol અથવા g/mol;
m (X) – ઓગળેલા પદાર્થનું દળ, અનુક્રમે kg અથવા g;
વી(સોલ્યુશન) - સોલ્યુશનનું પ્રમાણ, l. દાઢ એકાગ્રતા
b (X) mol/kg ના એકમોમાં દર્શાવવામાં આવે છે.
રેકોર્ડિંગ ફોર્મ, ઉદાહરણ તરીકે: b(HCl) = 0.1 mol/kg. સૂત્રનો ઉપયોગ કરીને દાળની સાંદ્રતાની ગણતરી કરો:
b (X) = n (X) / m (r-l) = m (X) /એમ(X) × m (પરિમાણ)
જ્યાં m (ઉકેલ) એ દ્રાવકનું દળ છે, kg.
રસાયણશાસ્ત્રમાં, સમકક્ષ અને સમાનતા પરિબળની વિભાવનાનો વ્યાપકપણે ઉપયોગ થાય છે.
સમકક્ષપદાર્થ X ના વાસ્તવિક અથવા શરતી કણ કહેવાય છે, જે આપેલ એસિડ-બેઝ પ્રતિક્રિયામાં એક હાઇડ્રોજન આયનની સમકક્ષ હોય છે અથવા આપેલ રેડોક્સ પ્રતિક્રિયામાં - એક ઇલેક્ટ્રોન, અથવા ક્ષાર વચ્ચે આપેલ વિનિમય પ્રતિક્રિયામાં - ચાર્જનું એકમ.
વોલ્યુમ અપૂર્ણાંક f ( એક્સ) એકમના અપૂર્ણાંકમાં અથવા ટકાવારીમાં વ્યક્ત થાય છે, તે સૂત્રનો ઉપયોગ કરીને ગણવામાં આવે છે:
F (X) = વી(X) /વી(આરઆર)
જ્યાં વી(X) એ સોલ્યુશનના આપેલ ઘટક Xનું વોલ્યુમ છે;
વી(р-р) - દ્રાવકની કુલ માત્રા.
સોલ્યુશનનું ટાઇટર T (X) દ્વારા સૂચવવામાં આવે છે, માપનનું એકમ kg/cm3, g/cm3, g/ml છે. સૂત્રનો ઉપયોગ કરીને સોલ્યુશનના ટાઇટરની ગણતરી કરી શકાય છે:
T (X) = m (X) /વી(આરઆર)
જ્યાં m (X) એ પદાર્થનો સમૂહ છે, સામાન્ય રીતે g;
વી(સોલ્યુશન) - સોલ્યુશનનું પ્રમાણ, મિલી.
12. વિસર્જન પ્રક્રિયા
વિસર્જન પ્રક્રિયાની પ્રકૃતિ જટિલ છે. સ્વાભાવિક રીતે, પ્રશ્ન ઊભો થાય છે કે શા માટે કેટલાક પદાર્થો કેટલાક દ્રાવકોમાં સરળતાથી દ્રાવ્ય હોય છે અને અન્યમાં નબળા દ્રાવ્ય અથવા વ્યવહારીક રીતે અદ્રાવ્ય હોય છે.
ઉકેલોની રચના હંમેશા અમુક શારીરિક પ્રક્રિયાઓ સાથે સંકળાયેલી હોય છે. આ પ્રક્રિયાઓમાંની એક દ્રાવ્ય અને દ્રાવકનું પ્રસરણ છે. પ્રસરણ માટે આભાર, કણો (પરમાણુઓ, આયનો) ઓગળતા પદાર્થની સપાટી પરથી દૂર કરવામાં આવે છે અને દ્રાવકના સમગ્ર જથ્થામાં સમાનરૂપે વિતરિત થાય છે. તેથી જ, હલાવવાની ગેરહાજરીમાં, વિસર્જનનો દર પ્રસરણના દર પર આધાર રાખે છે. જો કે, એકલા ભૌતિક પ્રક્રિયાઓ વિવિધ દ્રાવકોમાં પદાર્થોની અસમાન દ્રાવ્યતાને સમજાવી શકતી નથી.
મહાન રશિયન રસાયણશાસ્ત્રી ડી.આઈ. મેન્ડેલીવ (1834-1907) માનતા હતા કે રાસાયણિક પ્રક્રિયાઓ વિસર્જનમાં મહત્વપૂર્ણ ભૂમિકા ભજવે છે. તેમણે સલ્ફ્યુરિક એસિડ હાઇડ્રેટનું અસ્તિત્વ સાબિત કર્યું
H 2 SO 4 H 2 O, H 2 SO 4 2H 2 O, H 2 SO 4 4H 2 O અને કેટલાક અન્ય પદાર્થો, ઉદાહરણ તરીકે, C 2 H 5 OH3H 2 O. આ કિસ્સાઓમાં, વિસર્જન ની રચના સાથે થાય છે. ઓગળેલા પદાર્થ અને દ્રાવકના કણો વચ્ચેના રાસાયણિક બંધનો. આ પ્રક્રિયાને સોલવેશન કહેવામાં આવે છે જ્યારે દ્રાવક પાણી હોય ત્યારે તેને હાઇડ્રેશન કહેવામાં આવે છે.
જેમ જેમ સ્થાપિત કરવામાં આવ્યું છે, ઓગળેલા પદાર્થની પ્રકૃતિના આધારે, ભૌતિક ક્રિયાપ્રતિક્રિયાઓના પરિણામે સોલ્વેટ્સ (હાઈડ્રેટ) ની રચના થઈ શકે છે: આયન-દ્વિધ્રુવી ક્રિયાપ્રતિક્રિયા (ઉદાહરણ તરીકે, આયનીય બંધારણ (NaCI, વગેરે) સાથે પદાર્થોના વિસર્જન દરમિયાન. );
રાસાયણિક ક્રિયાપ્રતિક્રિયાઓ દાતા-સ્વીકાર બોન્ડ દ્વારા હાથ ધરવામાં આવે છે. અહીં, ઓગળેલા પદાર્થના આયનો ઇલેક્ટ્રોન સ્વીકારનાર છે, અને દ્રાવક (H 2 O, NH 3) એ ઇલેક્ટ્રોન દાતા છે (ઉદાહરણ તરીકે, એક્વા કોમ્પ્લેક્સની રચના), તેમજ હાઇડ્રોજન બોન્ડની રચનાના પરિણામે (માટે ઉદાહરણ તરીકે, પાણીમાં આલ્કોહોલનું વિસર્જન).
દ્રાવક સાથે ઓગળેલા પદાર્થની રાસાયણિક ક્રિયાપ્રતિક્રિયાનો પુરાવો એ વિસર્જન સાથે થર્મલ અસરો અને રંગ ફેરફારો છે.
ઉદાહરણ તરીકે, જ્યારે પોટેશિયમ હાઇડ્રોક્સાઇડ પાણીમાં ઓગળવામાં આવે છે, ત્યારે ગરમી છોડવામાં આવે છે:
KOH + xH 2 O = KOH (H 2 O) x; ΔН° સોલ = –55 kJ/mol.
અને જ્યારે સોડિયમ ક્લોરાઇડ ઓગળી જાય છે, ત્યારે ગરમી શોષાય છે:
NaCI + xH 2 O = NaCI (H 2 O) x; ΔН° સોલ = +3.8 kJ/mol.
જ્યારે પદાર્થનો 1 મોલ ઓગળવામાં આવે છે ત્યારે બહાર નીકળેલી અથવા શોષાયેલી ગરમી કહેવાય છે ઉકેલ Q ઉકેલની ગરમી
થર્મોડાયનેમિક્સના પ્રથમ નિયમ અનુસાર
Q ઉકેલ = ΔН ઉકેલ ,
જ્યાં ΔН વિસર્જન એ પદાર્થની આપેલ માત્રાને ઓગાળીને એન્થાલ્પીમાં થતો ફેરફાર છે.
પાણીમાં સફેદ નિર્જળ કોપર સલ્ફેટ ઓગળવાથી તીવ્ર વાદળી રંગ દેખાય છે. સોલ્વેટ્સનું નિર્માણ, રંગ પરિવર્તન, થર્મલ અસરો, તેમજ અન્ય સંખ્યાબંધ પરિબળો, તેની રચના દરમિયાન સોલ્યુશનના ઘટકોની રાસાયણિક પ્રકૃતિમાં ફેરફાર સૂચવે છે.
આમ, આધુનિક ખ્યાલો અનુસાર, વિસર્જન એ એક ભૌતિક રાસાયણિક પ્રક્રિયા છે જેમાં ભૌતિક અને રાસાયણિક બંને પ્રકારની ક્રિયાપ્રતિક્રિયા ભૂમિકા ભજવે છે.
13. વિસર્જન પ્રક્રિયાની થર્મોડાયનેમિક્સ
થર્મોડાયનેમિક્સના બીજા નિયમ મુજબ, p, T = const પર, પદાર્થો કોઈપણ દ્રાવકમાં સ્વયંભૂ ઓગળી શકે છે જો, આ પ્રક્રિયાના પરિણામે, સિસ્ટમની ગિબ્સ ઊર્જા ઘટે છે, એટલે કે.
ΔG = (ΔН – TΔS)< 0.
ΔH મૂલ્યને એન્થાલ્પી પરિબળ કહેવામાં આવે છે, અને TΔS મૂલ્યને વિસર્જનનું એન્ટ્રોપી પરિબળ કહેવામાં આવે છે.
જ્યારે પ્રવાહી અને નક્કર પદાર્થો ઓગળી જાય છે, ત્યારે સિસ્ટમની એન્ટ્રોપી સામાન્ય રીતે વધે છે (ΔS > 0), કારણ કે ઓગળેલા પદાર્થો વધુ ક્રમાંકિત સ્થિતિમાંથી ઓછા ક્રમમાં પસાર થાય છે. એન્ટ્રોપી પરિબળનું યોગદાન, જે દ્રાવ્યતામાં વધારો કરવા માટે ફાળો આપે છે, તે એલિવેટેડ તાપમાને ખાસ કરીને નોંધનીય છે, કારણ કે આ કિસ્સામાં પરિબળ T મોટો છે અને TΔS ઉત્પાદનનું સંપૂર્ણ મૂલ્ય પણ મોટું છે, અને ગિબ્સ ઊર્જામાં ઘટાડો તે મુજબ વધે છે.
જ્યારે વાયુઓ પ્રવાહીમાં ઓગળી જાય છે, ત્યારે સિસ્ટમની એન્ટ્રોપી સામાન્ય રીતે ઘટે છે (ΔS< 0), так как растворяемое вещество из менее упорядоченного состояния (боль–шого объема) переходит в более упорядоченное (ма–лый объем). Снижение температуры благоприятствует растворению газов, потому что в этом случае множи–тель Т мал и абсолютное значение произведения TΔS будет тем меньше, а убыль энергии Гиббса тем больше, чем ниже значение Т.
સોલ્યુશનની રચના દરમિયાન, સિસ્ટમની એન્થાલ્પી કાં તો વધી શકે છે (NaCI) અથવા ઘટાડો (KOH). વિસર્જન પ્રક્રિયાના એન્થાલ્પીમાં ફેરફારને હેસના કાયદા અનુસાર વિસર્જન પ્રક્રિયા સાથેની તમામ પ્રક્રિયાઓના એન્ડોથર્મિક અને એક્ઝોથર્મિક યોગદાનના બીજગણિત સરવાળા તરીકે ગણવામાં આવવો જોઈએ. આ પદાર્થોના સ્ફટિક જાળીના વિનાશની એન્ડોથર્મિક અસરો છે, પરમાણુઓના બંધન તોડવા, દ્રાવકની પ્રારંભિક રચનાનો વિનાશ અને સોલ્વેટ્સ સહિત વિવિધ ક્રિયાપ્રતિક્રિયા ઉત્પાદનોની રચનાની એક્ઝોથર્મિક અસરો છે.
પ્રસ્તુતિની સરળતા માટે, સોલ્યુશનના વિસર્જન ΔH ના એન્થાલ્પીમાં વધારો એ દ્રાવ્યની સ્ફટિક જાળીના વિનાશ પર ખર્ચવામાં આવતી ઊર્જા E cr અને કણોના ઉકેલ દરમિયાન મુક્ત થતી ઊર્જા E sol વચ્ચેના તફાવત તરીકે રજૂ કરી શકાય છે. દ્રાવક પરમાણુઓ દ્વારા દ્રાવ્ય. બીજા શબ્દોમાં કહીએ તો, એન્થાલ્પીમાં ફેરફાર એ સ્ફટિક જાળીના વિનાશના પરિણામે એન્થાલ્પી ΔН cr માં ફેરફારનો બીજગણિત સરવાળો છે અને દ્રાવક કણો દ્વારા ઉકેલને કારણે એન્થાલ્પી ΔН sol માં ફેરફાર:
ΔН સોલ = ΔН cr + ΔН સોલ,
જ્યાં ΔН ડિસ્ટ એ વિસર્જન દરમિયાન એન્થાલ્પીમાં ફેરફાર છે.
જો કે, કાર્બનિક દ્રાવકોમાં ઉમદા વાયુઓનું વિસર્જન ઘણીવાર ગરમીના શોષણ સાથે થાય છે, ઉદાહરણ તરીકે, એસીટોન, બેન્ઝીન, ઇથેનોલ અને સાયક્લોહેક્સેનમાં હિલીયમ અને નિયોન.
જ્યારે પરમાણુ સ્ફટિકીય માળખું અને પ્રવાહી સાથે ઘન પદાર્થોને ઓગાળી રહ્યા હોય, ત્યારે મોલેક્યુલર બોન્ડ ખૂબ મજબૂત હોતા નથી, અને તેથી સામાન્ય રીતે ΔH sol > ΔH cr આ હકીકત તરફ દોરી જાય છે કે, ઉદાહરણ તરીકે, આલ્કોહોલ અને શર્કરાનું વિસર્જન એ એક્ઝોથર્મિક પ્રક્રિયા છે (ΔH sol< 0).
જ્યારે ઘન પદાર્થોને આયનીય જાળી સાથે ઓગાળી રહ્યા હોય, ત્યારે ઊર્જા ગુણોત્તર E cr અને E sol અલગ હોઈ શકે છે. જો કે, મોટા ભાગના કિસ્સાઓમાં, આયનોના નિરાકરણ દરમિયાન છોડવામાં આવતી ઊર્જા સ્ફટિક જાળીના વિનાશ પર ખર્ચવામાં આવતી ઊર્જાને વળતર આપતી નથી, તેથી, વિસર્જન પ્રક્રિયા એન્ડોથર્મિક છે.
આમ, થર્મોડાયનેમિક ડેટા થર્મોડાયનેમિક્સના પ્રથમ અને બીજા નિયમોના આધારે વિવિધ પદાર્થોના સ્વયંસ્ફુરિત વિસર્જનની આગાહી કરવાનું શક્ય બનાવે છે.
14. દ્રાવ્યતા
જો કોઈ દ્રાવ્ય પદાર્થ દ્રાવકના સંપર્કમાં આવે છે, તો ઘણા કિસ્સાઓમાં દ્રાવણની રચનાની પ્રક્રિયા સ્વયંભૂ થાય છે જ્યાં સુધી ચોક્કસ મર્યાદિત સાંદ્રતા પહોંચી ન જાય (સંતૃપ્તિ થાય છે). આ ત્યારે થાય છે જ્યારે સંતુલન પહોંચી જાય છે, જ્યારે એન્થાલ્પી અને એન્ટ્રોપી પરિબળો સમાન બને છે, એટલે કે ΔН = TΔS.
ઉદાહરણ તરીકે, જ્યારે સ્ફટિકોને પ્રવાહીમાં દાખલ કરવામાં આવે છે, ત્યારે પરમાણુઓ અથવા આયનો સ્ફટિકની સપાટી પરથી દ્રાવણમાં જાય છે. પ્રસરણને લીધે, કણો દ્રાવકના સમગ્ર જથ્થામાં સમાનરૂપે વિતરિત થાય છે. વિસર્જન સંતૃપ્તિ સુધી આગળ વધે છે.
સુપરસેચ્યુરેટેડ સોલ્યુશન એ એક દ્રાવણ છે જેની સાંદ્રતા સંતૃપ્ત કરતાં વધુ હોય છે.
સંતૃપ્ત કરતાં ઓછી સાંદ્રતાવાળા દ્રાવણને અસંતૃપ્ત કહેવામાં આવે છે.
પદાર્થની ચોક્કસ દ્રાવકમાં ઓગળવાની ક્ષમતાને દ્રાવ્યતા કહે છે. આંકડાકીય રીતે, પદાર્થની દ્રાવ્યતા તેના સંતૃપ્ત દ્રાવણની સાંદ્રતા જેટલી હોય છે.
દ્રાવ્યતા એકાગ્રતા તરીકે સમાન એકમોમાં વ્યક્ત કરી શકાય છે, ઉદાહરણ તરીકે, સંતૃપ્ત દ્રાવણના 1 લિટર, mol/l, અથવા સંતૃપ્ત દ્રાવણના 100 ગ્રામમાં દ્રાવ્યના સમૂહના સંદર્ભમાં. દ્રાવ્યતાનું એકમ દ્રાવકના 100 ગ્રામ દીઠ ગ્રામ છે. અનુરૂપ મૂલ્યને દ્રાવ્યતા ગુણાંક કહેવામાં આવે છે.
દ્રાવ્યતા દ્રાવ્ય અને દ્રાવકની પ્રકૃતિ, તાપમાન, દબાણ અને દ્રાવણમાં અન્ય પદાર્થોની હાજરી પર આધાર રાખે છે.
14b ઘટકોની પ્રકૃતિની દ્રાવ્યતા પર પ્રભાવ
પદાર્થોની વિસર્જન કરવાની ક્ષમતા X 1 અને X 2 ના ઘટકોના પરમાણુઓ વચ્ચેની ક્રિયાપ્રતિક્રિયા દળોની પ્રકૃતિ દ્વારા નક્કી કરવામાં આવે છે: દ્રાવક - દ્રાવક (X 1 - X 1), દ્રાવક - દ્રાવ્ય (X 2 - X 2), દ્રાવક - દ્રાવ્ય ( X 1 – X 2) (બિંદુઓ પરમાણુ બોન્ડ સૂચવે છે).
પદાર્થોની દ્રાવ્યતા વિશાળ મર્યાદામાં બદલાય છે. ઉદાહરણો સમાન દ્રાવક (પાણી) માં વિવિધ ક્ષારની દ્રાવ્યતા અને એક જ પદાર્થ (AgNO 3) ની વિવિધ દ્રાવકોમાં દ્રાવ્યતા દર્શાવે છે.
આયનીય પ્રકારના બોન્ડ ધરાવતા પદાર્થો અને ધ્રુવીય અણુઓ ધરાવતા પદાર્થો પાણી અને આલ્કોહોલ જેવા ધ્રુવીય દ્રાવકોમાં વધુ સારી રીતે ઓગળી જાય છે. આ દ્રાવકો ઉચ્ચ ડાઇલેક્ટ્રિક સ્થિરાંક દ્વારા વર્ગીકૃત થયેલ છે.
પદાર્થોની ઉચ્ચ દ્રાવ્યતા ઘણી વાર ઇન્ટરમોલેક્યુલર, ખાસ કરીને હાઇડ્રોજન, બોન્ડની રચનાને કારણે હોય છે. આમ, પાણી અને આલ્કોહોલની અમર્યાદિત પરસ્પર દ્રાવ્યતા પાણી અને આલ્કોહોલના પરમાણુઓ વચ્ચેના હાઇડ્રોજન બોન્ડની રચના દ્વારા સમજાવવામાં આવે છે, અને એમોનિયાના જલીય દ્રાવણમાં AgcI સ્ફટિકોના વિસર્જનને રાસાયણિક દાતા-સ્વીકાર બોન્ડની રચના દ્વારા સમજાવવામાં આવે છે. એમોનિયાના પરમાણુઓ સાથે સિલ્વર આયન (પાણીમાં એજીસીઆઈ વ્યવહારીક રીતે અદ્રાવ્ય). આ જ કારણસર, પાયરિડિન, નીચા ડાઇલેક્ટ્રિક સ્થિરાંક સાથેનું દ્રાવક, ખૂબ જ ઊંચી દ્રાવ્યતા દર્શાવે છે.
દ્રાવ્યતા સાચા સંતુલનની લાક્ષણિકતા હોવાથી, આ સ્થિતિ (દબાણ, તાપમાન) પર બાહ્ય પરિસ્થિતિઓના પ્રભાવને લે ચેટેલિયરના સિદ્ધાંતનો ઉપયોગ કરીને ગુણાત્મક રીતે મૂલ્યાંકન કરી શકાય છે. ડીપ-સી ડાઇવિંગની પ્રેક્ટિસમાં, ગરમ દુકાનોમાં કામ કરતી વખતે, વગેરેમાં આવા મૂલ્યાંકન જરૂરી છે.
15. પ્રવાહીમાં વાયુઓની દ્રાવ્યતા. હેનરી-ડાલ્ટન અને સેચેનોવ કાયદા
પ્રવાહીમાં વાયુઓનું વિસર્જન લગભગ હંમેશા ગરમીના પ્રકાશન સાથે હોય છે. તેથી, લે ચેટેલિયરના સિદ્ધાંત અનુસાર વધતા તાપમાન સાથે વાયુઓની દ્રાવ્યતા ઘટે છે. આ પેટર્નનો ઉપયોગ ઘણીવાર પાણીમાંથી ઓગળેલા વાયુઓને દૂર કરવા માટે થાય છે (ઉદાહરણ તરીકે, C0 2 ) ઉકાળીને. કેટલીકવાર ગેસનું વિસર્જન ગરમીના શોષણ સાથે થાય છે (ઉદાહરણ તરીકે, કેટલાક કાર્બનિક દ્રાવકોમાં ઉમદા વાયુઓનું વિસર્જન). આ કિસ્સામાં, તાપમાનમાં વધારો ગેસની દ્રાવ્યતામાં વધારો કરે છે.
ગેસ પ્રવાહીમાં અનિશ્ચિતપણે ઓગળતો નથી. ચોક્કસ ગેસ સાંદ્રતા X પર, સંતુલન સ્થાપિત થાય છે:
જ્યારે ગેસ પ્રવાહીમાં ઓગળી જાય છે, ત્યારે સિસ્ટમના જથ્થામાં નોંધપાત્ર ઘટાડો થાય છે. તેથી, લે ચેટેલિયરના સિદ્ધાંત મુજબ, દબાણમાં વધારો, સંતુલનને જમણી તરફ, એટલે કે, ગેસની દ્રાવ્યતામાં વધારો તરફ દોરી જવું જોઈએ. જો કોઈ વાયુ આપેલ પ્રવાહીમાં થોડો દ્રાવ્ય હોય અને દબાણ ઓછું હોય, તો વાયુની દ્રાવ્યતા તેના દબાણના પ્રમાણસર હોય છે. આ અવલંબન હેનરીના કાયદા (1803) દ્વારા વ્યક્ત કરવામાં આવે છે: આપેલ તાપમાને પ્રવાહીના ચોક્કસ જથ્થામાં, સંતુલનમાં ઓગળેલા ગેસનું પ્રમાણ, ગેસના દબાણના સીધા પ્રમાણસર હોય છે.
હેનરીના કાયદાને નીચેના સ્વરૂપમાં લખી શકાય છે:
સાથે(X) = કે r(X) × P(X)
સંતૃપ્ત દ્રાવણમાં ગેસની સાંદ્રતા ક્યાં છે, mol/l;
P (X) – દ્રાવણની ઉપર ગેસનું દબાણ X, Pa;
કે r(X) – ગેસ X, mol×l-1 × Pa -1 માટે હેન્રીનો સ્થિરાંક.
હેન્રીનો સ્થિરાંક ગેસની પ્રકૃતિ, દ્રાવક અને તાપમાન પર આધાર રાખે છે.
હેન્રીનો કાયદો માત્ર પ્રમાણમાં પાતળું ઉકેલો માટે માન્ય છે, ઓછા દબાણમાં અને ઓગળેલા વાયુ અને દ્રાવકના પરમાણુઓ વચ્ચે રાસાયણિક ક્રિયાપ્રતિક્રિયાની ગેરહાજરી.
હેન્રીનો કાયદો એ ડાલ્ટનના સામાન્ય કાયદાનો વિશેષ કેસ છે. જો આપણે એક વાયુ પદાર્થના વિસર્જન વિશે નહીં, પરંતુ વાયુઓના મિશ્રણ વિશે વાત કરી રહ્યા છીએ, તો દરેક ઘટકની દ્રાવ્યતા ડાલ્ટનના નિયમનું પાલન કરે છે: સતત તાપમાને ગેસ મિશ્રણના દરેક ઘટકોની દ્રાવ્યતા આંશિક દબાણના પ્રમાણસર છે. પ્રવાહીની ઉપરના ઘટકનો અને મિશ્રણના કુલ દબાણ અને અન્ય ઘટકોની વ્યક્તિગતતા પર આધાર રાખતો નથી.
બીજા શબ્દોમાં કહીએ તો, પ્રવાહીમાં વાયુઓના મિશ્રણને ઓગળવાના કિસ્સામાં, આંશિક દબાણ p ને હેનરીના નિયમની ગાણિતિક અભિવ્યક્તિમાં બદલવામાં આવે છે! આ ઘટકના.
ઘટકના આંશિક દબાણને ગેસ મિશ્રણના કુલ દબાણમાંથી ઘટક દબાણના અપૂર્ણાંક તરીકે સમજવામાં આવે છે:
P i / P કુલ
સૂત્રનો ઉપયોગ કરીને ઘટકના આંશિક દબાણની ગણતરી કરવામાં આવે છે
ઇલેક્ટ્રોલાઇટ્સની હાજરીમાં પ્રવાહીમાં વાયુઓની દ્રાવ્યતાનો અભ્યાસ કરતા, રશિયન ચિકિત્સક-ફિઝિયોલોજિસ્ટ આઇએમ સેચેનોવ (1829-1905) એ નીચેની પેટર્ન (સેચેનોવનો કાયદો) સ્થાપિત કરી: ઇલેક્ટ્રોલાઇટ્સની હાજરીમાં પ્રવાહીમાં વાયુઓની દ્રાવ્યતા ઘટે છે; વાયુઓ મુક્ત થાય છે.
Р i = Р કુલ ×(X i)
જ્યાં p i એ ઘટક X i નું આંશિક દબાણ છે;
Ptot - ગેસ મિશ્રણનું કુલ દબાણ;
x(X i) – i-th ઘટકનો છછુંદર અપૂર્ણાંક.
ઇલેક્ટ્રોલાઇટ્સની હાજરીમાં પ્રવાહીમાં વાયુઓની દ્રાવ્યતાનો અભ્યાસ કરતા, રશિયન ચિકિત્સક અને ફિઝિયોલોજિસ્ટ આઇએમ સેચેનોવ (1829-1905) એ નીચેની પેટર્ન (સેચેનોવનો કાયદો) સ્થાપિત કરી: ઇલેક્ટ્રોલાઇટ્સની હાજરીમાં પ્રવાહીમાં વાયુઓની દ્રાવ્યતા ઘટે છે; વાયુઓ મુક્ત થાય છે.
તેમની એકત્રીકરણની સ્થિતિ અનુસાર, ઉકેલો વાયુયુક્ત, પ્રવાહી અને ઘન હોઈ શકે છે.
કોઈપણ ઉકેલમાં ઓગળેલા પદાર્થો અને દ્રાવકનો સમાવેશ થાય છે, જો કે આ ખ્યાલો અમુક હદ સુધી મનસ્વી છે. ઉદાહરણ તરીકે, આલ્કોહોલ અને પાણીના ગુણોત્તરના આધારે, આ સિસ્ટમ પાણીમાં આલ્કોહોલ અથવા આલ્કોહોલમાં પાણીનો ઉકેલ હોઈ શકે છે.
સામાન્ય રીતે, દ્રાવકને તે ઘટક તરીકે ગણવામાં આવે છે જે દ્રાવણમાં વિસર્જન પહેલાની જેમ એકત્રીકરણની સમાન સ્થિતિમાં હોય છે.
ઉકેલોનો અભ્યાસ ચિકિત્સકો માટે ખાસ રસ ધરાવે છે કારણ કે સૌથી મહત્વપૂર્ણ જૈવિક પ્રવાહી - લોહી, લસિકા, પેશાબ, લાળ, પરસેવો - પાણીમાં ક્ષાર, પ્રોટીન, કાર્બોહાઇડ્રેટ્સ, લિપિડ્સના ઉકેલો છે.
જૈવિક પ્રવાહી પોષક તત્વો (ચરબી, એમિનો એસિડ, ઓક્સિજન), અવયવો અને પેશીઓમાં દવાઓના પરિવહનમાં તેમજ શરીરમાંથી ચયાપચય (યુરિયા, બાય-લિરૂબિન, કાર્બન ડાયોક્સાઇડ, વગેરે) ના વિસર્જનમાં સામેલ છે. રક્ત પ્લાઝ્મા કોશિકાઓ માટેનું એક માધ્યમ છે - લિમ્ફોસાઇટ્સ, એરિથ્રોસાઇટ્સ, પ્લેટલેટ.
શરીરના પ્રવાહી માધ્યમોમાં, સતત એસિડિટી, ક્ષાર અને કાર્બનિક પદાર્થોની સાંદ્રતા જાળવવામાં આવે છે. આ સ્થિરતાને એકાગ્રતા હોમિયોસ્ટેસિસ કહેવામાં આવે છે.
ઉકેલોનું વર્ગીકરણ
5000 ગ્રામ/મોલ કરતા ઓછા દાળના દળવાળા પદાર્થોના ઉકેલોને ઓછા પરમાણુ વજન સંયોજનો (LMC) અને 5000 ગ્રામ/મોલથી વધુ દાળના દળવાળા પદાર્થોના દ્રાવણોને ઉચ્ચ પરમાણુ વજન સંયોજનોના ઉકેલો કહેવામાં આવે છે. HMC).
ઇલેક્ટ્રોલાઇટિક ડિસોસિએશનની હાજરી અથવા ગેરહાજરીના આધારે, NMS સોલ્યુશન્સને બે વર્ગોમાં વહેંચવામાં આવે છે - ઇલેક્ટ્રોલાઇટ્સ અને નોન-ઇલેક્ટ્રોલાઇટ્સના ઉકેલો.
ઇલેક્ટ્રોલાઇટ સોલ્યુશન્સ એ ક્ષાર, એસિડ, પાયા અને એમ્ફોલાઇટ્સના ઉકેલો છે જે આયનોમાં વિભાજિત થાય છે. ઉદાહરણ તરીકે, KNO 3, HCl, KOH, Al(OH) 3, ગ્લાયસીનના ઉકેલો.
ઇલેક્ટ્રોલાઇટ સોલ્યુશન્સની વિદ્યુત વાહકતા દ્રાવક કરતા વધારે છે.
નોન-ઇલેક્ટ્રોલાઇટ્સના સોલ્યુશન્સ એ પદાર્થોના ઉકેલો છે જે વ્યવહારીક રીતે પાણીમાં વિસર્જન કરતા નથી. ઉદાહરણ તરીકે, સુક્રોઝ, ગ્લુકોઝ, યુરિયાના ઉકેલો. નોન-ઇલેક્ટ્રોલાઇટ સોલ્યુશનની વિદ્યુત વાહકતા દ્રાવક કરતા થોડી અલગ હોય છે.
એનએમએસ (ઇલેક્ટ્રોલાઇટ્સ અને નોન-ઇલેક્ટ્રોલાઇટ્સ) ના ઉકેલોને કોલોઇડલ સોલ્યુશન્સથી વિપરીત સાચું કહેવામાં આવે છે. સાચા ઉકેલો રચનાની એકરૂપતા અને દ્રાવક અને દ્રાવક વચ્ચેના ઇન્ટરફેસની ગેરહાજરી દ્વારા વર્ગીકૃત થયેલ છે. ઓગળેલા કણો (આયનો અને પરમાણુઓ) નું કદ 10 -9 મીટર કરતા ઓછું છે.
મોટા ભાગના BMCs પોલિમર હોય છે, જેના પરમાણુઓ (મેક્રોમોલેક્યુલ્સ) રાસાયણિક બોન્ડ દ્વારા એકબીજા સાથે જોડાયેલા પુનરાવર્તિત જૂથો અથવા મોનોમર એકમોનો સમાવેશ કરે છે. IUD સોલ્યુશન્સને પોલિઇલેક્ટ્રોલાઇટ સોલ્યુશન કહેવામાં આવે છે.
પોલીઈલેક્ટ્રોલાઈટ્સમાં પોલિએસિડ્સ (હેપરિન, પોલિએડેનિલિક એસિડ, પોલિઆસ્પર્ટિક એસિડ, વગેરે), પોલિબેઝ (પોલીલીસીન), પોલિએમ્ફોલિટ્સ (પ્રોટીન, ન્યુક્લિક એસિડ) નો સમાવેશ થાય છે.
IUD સોલ્યુશનના ગુણધર્મો NMS સોલ્યુશનના ગુણધર્મોથી નોંધપાત્ર રીતે અલગ છે. તેથી, તેઓને એક અલગ વિભાગમાં ધ્યાનમાં લેવામાં આવશે. આ પ્રકરણ ઓછા પરમાણુ વજનના ઈલેક્ટ્રોલાઈટ્સ, એમ્ફોલાઈટ્સ અને નોન-ઈલેક્ટ્રોલાઈટ્સના ઉકેલો માટે સમર્પિત છે.
ઉકેલો હોઈ શકે છે પ્રવાહી, ઘન અને ગેસ .
દ્રાવકઘન, પ્રવાહી અને ગેસ હોઈ શકે છે.
લગભગ તમામ વાયુઓ એકબીજામાં ઓગળી જાય છે. પ્રવાહી, વાયુઓ અને ઘન પદાર્થો પ્રવાહીમાં ભળે છે. માત્ર ઘન પદાર્થોમાં જ ભળે છે. નક્કર ઉકેલોમાં, નક્કર ઘટકોની સજાતીય સિસ્ટમ રચાય છે.
ગેસ સોલ્યુશન્સવાયુઓમાં વાયુઓ, પ્રવાહી અને ઘન પદાર્થોના ઉકેલો છે. શૂન્ય દબાણની મર્યાદામાં, કોઈપણ વાસ્તવિક ગેસ એકબીજાથી સ્વતંત્ર કણોની સિસ્ટમનું પ્રતિનિધિત્વ કરે છે, એટલે કે. આદર્શ સિસ્ટમની લાક્ષણિકતાઓ ધરાવે છે. આ વાયુઓનું મિશ્રણ કહેવાય છે આદર્શ ગેસ, પાળે છે ડાલ્ટનનો કાયદો:(ક્યાં આર- કુલ દબાણ; આર i- આંશિક દબાણ iમી ઘટક). વધતા દબાણ સાથે, કણો વચ્ચેની ક્રિયાપ્રતિક્રિયા દેખાય છે, પછી વાસ્તવિક વાયુઓ, પ્રવાહી વરાળ અને ઘન પદાર્થોના મિશ્રણને ગેસ સોલ્યુશન તરીકે ગણવામાં આવે છે.
સૌથી વધુ વ્યાપક પ્રવાહી, ખાસ કરીને, જલીય ઉકેલો. "લિક્વિડ-ગેસ" અને "લિક્વિડ-સોલિડ" સોલ્યુશનના કિસ્સામાં, દ્રાવકને સામાન્ય રીતે પ્રવાહી ગણવામાં આવે છે. પ્રવાહી-પ્રવાહી દ્રાવણમાં, દ્રાવક એ ઘટક છે જે અન્ય ઘટકોની તુલનામાં વધુ હોય છે, જેને દ્રાવ્ય કહેવાય છે.
દ્રાવ્ય ના ગુણધર્મો પર આધાર રાખીને, ત્યાં છે પ્રવાહી ઉકેલોઇલેક્ટ્રોલાઇટ્સ, ઇલેક્ટ્રોલાઇટ્સ અને ઉચ્ચ પરમાણુ વજન સંયોજનો નથી(નૌકાદળ). બાદમાં કોલોઇડ રસાયણશાસ્ત્રમાં વિચારણાનો વિષય છે.
દ્રાવકના આપેલ જથ્થામાં ઓગળેલા પદાર્થની માત્રા કહેવામાં આવે છે એકાગ્રતા
એકાગ્રતા વ્યક્ત કરવાની રીતો:
1) દાઢ સાંદ્રતા એમ(અથવા મોલેરિટી) - 1 મીટર 3 (અથવા લિટર) દ્રાવણમાં ઓગળેલા પદાર્થના મોલ્સની સંખ્યા:
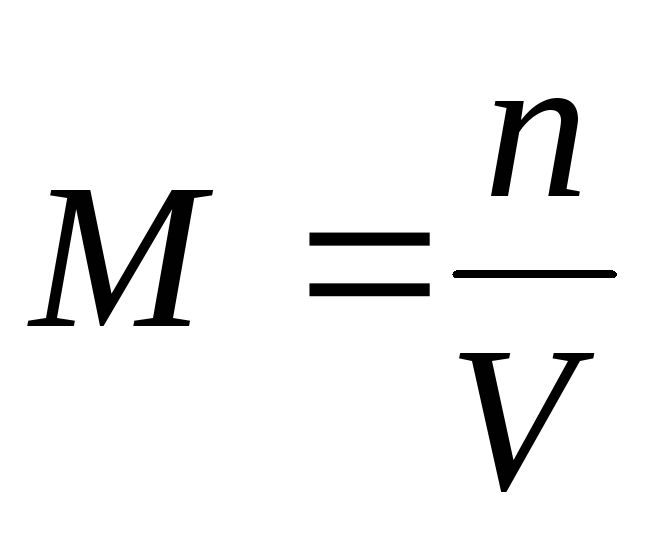
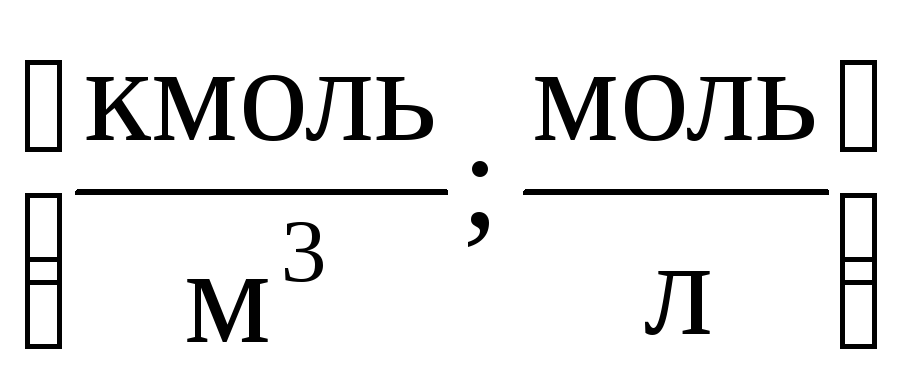
2) દાઢ સાંદ્રતાટી (અથવા મોલેલિટી) - 1 કિલો અથવા 1000 ગ્રામ દ્રાવકમાં ઓગળેલા પદાર્થના મોલ્સની સંખ્યા:
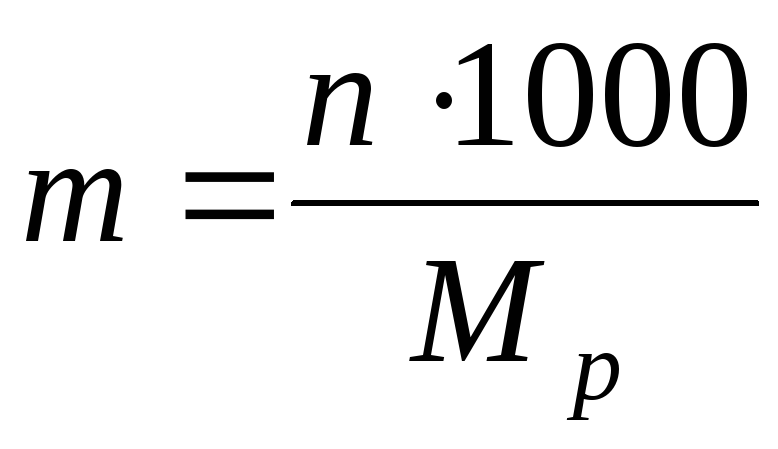

જ્યાં એમ પી - દ્રાવકનો સમૂહ.
3) ટકાવારી એકાગ્રતા ω સોલ્યુશનના 100 ગ્રામ (વજન દ્વારા) અથવા 100 મિલી (વોલ્યુમ દ્વારા) માં પદાર્થના ગ્રામની સંખ્યા દ્વારા નિર્ધારિત:
 અથવા
અથવા 
4) છછુંદર અપૂર્ણાંકએન- એક ઘટકના મોલ્સ n ની સંખ્યા અને સોલ્યુશનના તમામ ઘટકોના મોલ્સ n ની કુલ સંખ્યાનો ગુણોત્તર:
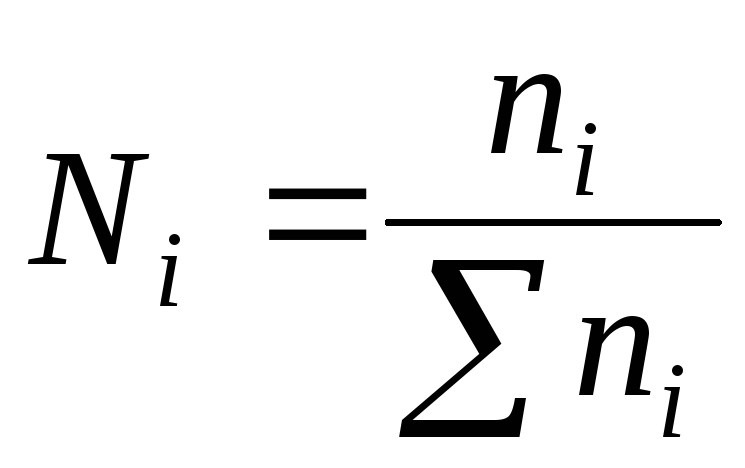
ઉકેલના તમામ ઘટકોના છછુંદર અપૂર્ણાંકનો સરવાળો એકતા સમાન છે:
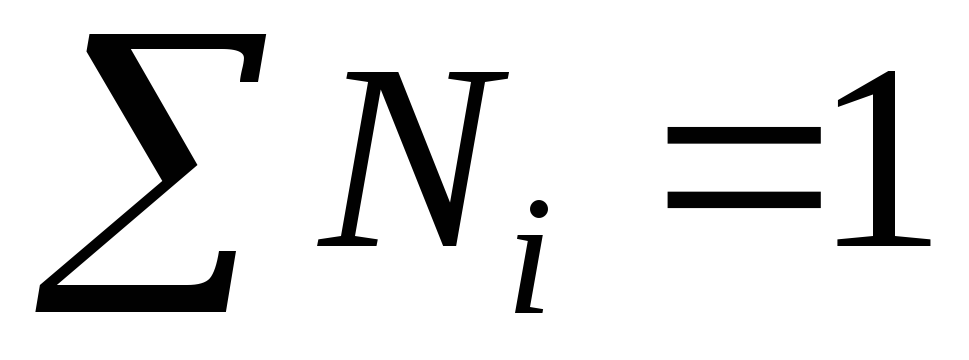
ઉદાહરણ.ચાલો સલ્ફ્યુરિક એસિડ ω = 98% ની જાણીતી સામૂહિક સાંદ્રતાના આધારે M, m અને N ની ગણતરી કરીએ, દ્રાવણની ઘનતા 1.84 g/l છે; સોલ્યુશનના ઘટકોના દાઢ સમૂહ સમાન છે 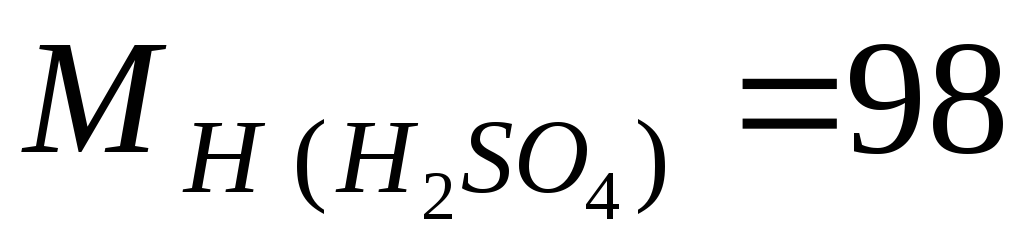 g/mol;
g/mol; 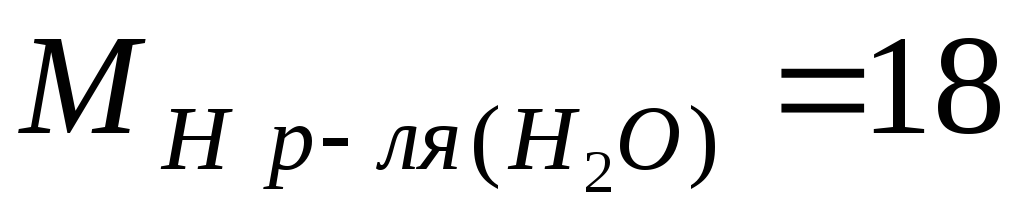 g/mol
g/mol
સોલ્યુશનની મોલેરિટી છે:
સોલ્યુશનની મોલેલિટી છે:
સલ્ફ્યુરિક એસિડનો છછુંદર અપૂર્ણાંક છે:
II. દ્રાવક અને દ્રાવક વચ્ચેની ક્રિયાપ્રતિક્રિયાની ડિગ્રી અનુસાર ઉકેલોને પણ વિભાજિત કરવામાં આવે છે.
આદર્શ ઉકેલો આ એવા ઉકેલો છે કે જેમાં સમાન અને વિપરીત પરમાણુઓ વચ્ચે ક્રિયાપ્રતિક્રિયાની તાકાત સમાન હોય છે.
A - ઓગળેલા પદાર્થ, f એ - એ
બી - દ્રાવક, f વી-વી
એબી સોલ્યુશન f એ - એ = f વી-વી = f એ -IN
આદર્શ ઉકેલોમાં, વિવિધ ઘટકોના પરમાણુઓ વચ્ચેની ક્રિયાપ્રતિક્રિયાની ઊર્જા સમાન હોય છે; દ્રાવણના તમામ પરમાણુઓ (દ્રાવક અને દ્રાવક) સમાન બળ ક્ષેત્ર ધરાવે છે, અને તમામ ઘટકોના પરમાણુઓની માત્રા સમાન છે. આદર્શ પ્રવાહી દ્રાવણમાં, આદર્શ ગેસથી વિપરીત, અણુઓ વચ્ચે ક્રિયાપ્રતિક્રિયા હોય છે. સોલ્યુશનમાં તમામ પરમાણુઓની ક્રિયાપ્રતિક્રિયાની સમાન ઊર્જા વોલ્યુમમાં તેમના સમાન વિતરણ તરફ દોરી જાય છે. તેથી, આદર્શ ઉકેલના ઘટકોના મિશ્રણની એન્ટ્રોપી છે ΔSઆદર્શ ગેસના મિશ્રણની એન્ટ્રોપી જેટલી ΔS ઉ.દા. .
બધા પરમાણુઓની સમાન માત્રા એ સુનિશ્ચિત કરે છે કે આદર્શ ઉકેલની રચના દરમિયાન સિસ્ટમનું પ્રમાણ સ્થિર રહે છે. આદર્શ ઉકેલની આ રચના દરમિયાન થર્મલ અસર શૂન્ય છે. આ સંદર્ભમાં, અમે આદર્શ પ્રવાહી ઉકેલોની બીજી વ્યાખ્યા આપી શકીએ છીએ. આદર્શ આવા સોલ્યુશન્સ હશે, જેનું નિર્માણ એકત્રીકરણની સમાન સ્થિતિમાં અને કોઈપણ ગુણોત્તરમાં લેવામાં આવેલા ઘટકોમાંથી વોલ્યુમ અને થર્મલ અસરમાં ફેરફાર સાથે નથી, અને એન્ટ્રોપીમાં ફેરફાર એ આદર્શ મિશ્રણ કરતી વખતે એન્ટ્રોપીમાં ફેરફાર સમાન છે. વાયુઓ, એટલે કે
Δ વી=0; ΔH=0; ΔS= ΔS ઉ.દા.
આદર્શ સોલ્યુશનની માત્રા અને એન્થાલ્પી એ એડિટિવ હોય છે અને સોલ્યુશનની રચના પર આધાર રાખે છે.
તે ધ્યાનમાં રાખવું જોઈએ કે જ્યારે ઉપરોક્ત તમામ શરતો પૂરી થાય ત્યારે ઉકેલોને આદર્શ ગણી શકાય અને વધુમાં, ઘટકોના આંશિક દબાણ સમાન હોવા જોઈએ, તેમનું તાપમાન સમાન હોવું જોઈએ અને એકત્રીકરણની સમાન સ્થિતિ હોવી જોઈએ.
આદર્શ ઉકેલોને આદર્શ કહેવામાં આવે છે કારણ કે તે વાસ્તવિકતામાં અસ્તિત્વમાં નથી. જો કે, આદર્શ ઉકેલોની નજીકના ગુણધર્મો સાથે નોંધપાત્ર સંખ્યામાં ઉકેલો છે. આમાં પાતળા ઉકેલોનો સમાવેશ થાય છે.
ગિબ્સની ઊર્જા iમી આદર્શ સોલ્યુશનનો ઘટક સંખ્યાત્મક રીતે રાસાયણિક સંભવિતતા જેટલો હોય છે અને તેને નીચે પ્રમાણે રજૂ કરી શકાય છે:
જ્યારે ∆ એચ i =0, રાસાયણિક સંભવિત iમી આદર્શ ઉકેલમાં ઘટક સમાન છે:
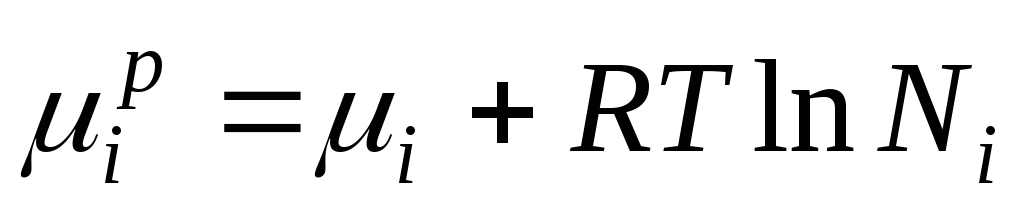 , ક્યાં
, ક્યાં
µ i , µ i પી- રાસાયણિક સંભવિતતા iઉકેલમાં વ્યક્તિગત ઘટક; એન i -મોલ અપૂર્ણાંક iમી ઘટક.
ચાલો આ સમીકરણને અલગ પાડીએ અને મેળવીએ:
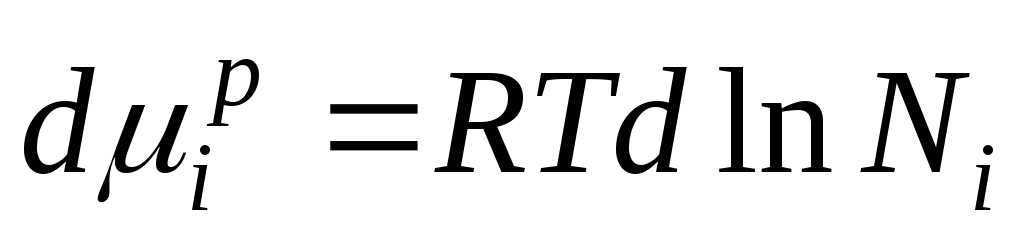
હકીકત એ છે કે 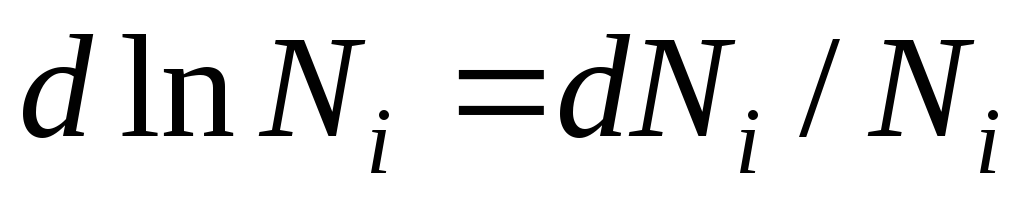 અમને મળે છે:
અમને મળે છે:
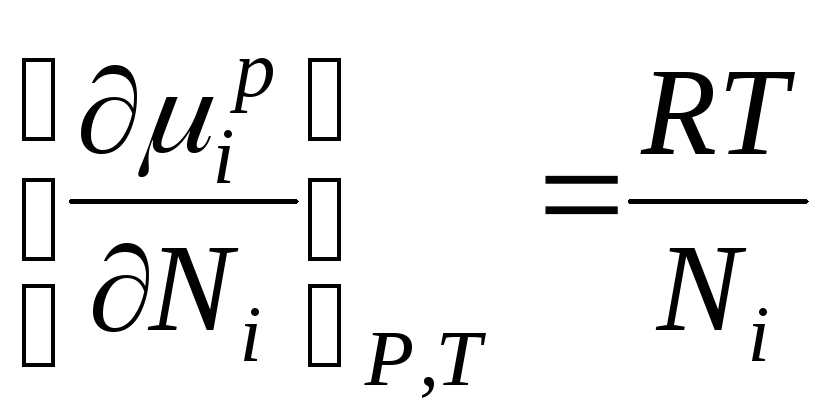
આ સમીકરણ આદર્શ ઉકેલના ઘટકોની રાસાયણિક સંભવિતતા અને તેની રચના વચ્ચેનો સંબંધ દર્શાવે છે, જે ઉકેલના ઘટકોના છછુંદર અપૂર્ણાંક દ્વારા નિર્ધારિત થાય છે.
ચાલો વિચાર કરીએ અત્યંત પાતળા ઉકેલો, જેને ઘણીવાર સરળ રીતે પાતળું કહેવામાં આવે છે. અત્યંત પાતળા ઉકેલો આ એવા ઉકેલો છે જેમાં દ્રાવક આદર્શ ઉકેલોના કાયદાનું પાલન કરે છે, અને દ્રાવ્ય પદાર્થ વાસ્તવિક ઉકેલોના નિયમોનું પાલન કરે છે.
પાતળું દ્રાવણમાં દ્રાવ્યની સાંદ્રતા અનંત છે, તેથી તેના પરમાણુઓ વચ્ચેની ક્રિયાપ્રતિક્રિયાને અવગણી શકાય છે. પછી આદર્શ ઉકેલો માટે માન્ય એવા કાયદાઓ અને સમીકરણો દ્વારા અત્યંત મંદ ઉકેલોનું વર્ણન કરી શકાય છે.
બિન-આદર્શ (વાસ્તવિક) ઉકેલો આ એવા ઉકેલો છે કે જેમાં સમાન અને વિપરીત પરમાણુઓ વચ્ચે ક્રિયાપ્રતિક્રિયા દળો અલગ હોય છે.
એબી સોલ્યુશન f એ - એ ≠ f વી-વી ≠ f એ -IN
વાસ્તવિક ઉકેલો આદર્શ અને અત્યંત મંદ ઉકેલોના નિયમોનું પાલન કરતા નથી. જો કે, સહાયક જથ્થાઓ રજૂ કરીને, આદર્શ ઉકેલોના કાયદા દ્વારા બિન-આદર્શ ઉકેલોના ગુણધર્મો પણ વ્યક્ત કરી શકાય છે.
દ્રાવ્યતા. ઉકેલોની સાંદ્રતા વ્યક્ત કરવાની પદ્ધતિઓ. ભૌતિક અને રાસાયણિક પ્રક્રિયા તરીકે વિસર્જન.
લક્ષ્યો:
શૈક્ષણિક:
- ખ્યાલોની સમજણ રચવા માટે: "ઉકેલ", "વિસર્જન", "દ્રાવ્યતા", "એકાગ્રતા".
- ઉકેલોના ભૌતિક, રાસાયણિક અને આધુનિક સિદ્ધાંતને ધ્યાનમાં લો.
- માનવ જીવનમાં ઉકેલોનું મહત્વ બતાવો.
શૈક્ષણિક:
- ઉકેલોના વિષય પર સમસ્યાઓ ઉકેલવામાં વિદ્યાર્થીઓના જ્ઞાન, કૌશલ્યો અને ક્ષમતાઓને એકીકૃત કરવા.
શિક્ષકો:
- વિદ્યાર્થીઓની અવલોકન કૌશલ્ય, તાર્કિક વિચારસરણી, તારણો અને તારણો કાઢવાની ક્ષમતાનો વિકાસ.
વ્યાખ્યાનની પ્રગતિ
I. સંસ્થાકીય ક્ષણ. રાસાયણિક પ્રતિક્રિયાની ઝડપ પર જ્ઞાનનું પરીક્ષણ.
II. નવી સામગ્રીની સમજૂતી.
શિક્ષક:પ્રકૃતિ, ટેકનોલોજી અને વિજ્ઞાનમાં સોલ્યુશન્સ મહત્વની ભૂમિકા ભજવે છે.
ઉકેલો ક્યાં વપરાય છે? (વિદ્યાર્થીઓના જવાબો)
શિક્ષક:પૃથ્વી પર જીવનના ઉદભવ અને વિકાસમાં ઉકેલોની ભૂમિકા મહાન છે. સજીવોની ઉત્પત્તિના સિદ્ધાંતોમાંની એક એ પ્રાથમિક મહાસાગરમાં જીવનની ઉત્પત્તિનો સિદ્ધાંત છે, જે તેમાં ઓગળેલા પદાર્થો સાથેનું પાણી હતું. આ સોલ્યુશનમાંથી, સજીવોએ વૃદ્ધિ અને વિકાસ માટે જરૂરી આયનો અને પરમાણુઓ મેળવ્યા.
માનવ શરીરમાં શારીરિક રીતે મહત્વપૂર્ણ ઉકેલો છે. જે? (રક્ત, હોજરીનો રસ, વગેરે)
ઉકેલએક સજાતીય સિસ્ટમ છે જેમાં બે કે તેથી વધુ ઘટકોનો સમાવેશ થાય છે, જેની સામગ્રી એકરૂપતાને ખલેલ પહોંચાડ્યા વિના ચોક્કસ મર્યાદામાં બદલી શકાય છે.
સોલ્યુશન એ એક સમાન (સમાન્ય) સિસ્ટમ છે જેમાં ઓગળેલા પદાર્થના કણો, દ્રાવક અને તેમની ક્રિયાપ્રતિક્રિયાના ઉત્પાદનોનો સમાવેશ થાય છે.
ઉકેલોનું વર્ગીકરણ
એકત્રીકરણની સ્થિતિ અનુસાર:ગેસ (હવા), પ્રવાહી (સમુદ્રનું પાણી), ઘન (એલોય)
દ્રાવક રચના દ્વારા(પાણી, એમોનિયા, બેન્ઝીન, વગેરે)
કણોના કદ અથવા ગ્રાઇન્ડીંગની ડિગ્રી દ્વારા (વિખેરાઈ):
સસ્પેન્ડ કરો(બરછટ સિસ્ટમો) - કણોનું કદ 10-3 -10-5 સેમી સસ્પેન્શન ખૂબ જ નાજુક, વિજાતીય સિસ્ટમો છે. બરછટ વિખેરાયેલી સિસ્ટમો સામાન્ય રીતે છે
સસ્પેન્શન, પ્રવાહી મિશ્રણ, એરોસોલ્સના સ્વરૂપમાં.
કુદરતી બરછટ પ્રણાલીના ઉદાહરણો આપો?
કોલોઇડલ સોલ્યુશન્સ- કણોનું કદ
10-5 - 10-7 સેમી કોલોઇડલ ડીએસના ઉદાહરણો ગુંદર અને જિલેટીનના ઉકેલો છે.
કોલોઇડલ સોલ્યુશન્સ એ હકીકત દ્વારા અલગ પડે છે કે તેમના કણો તેમનામાંથી પસાર થતા પ્રકાશને મજબૂત રીતે વેરવિખેર કરે છે અને પ્રસારિત પ્રકાશ બીમના માર્ગને ધ્યાનપાત્ર બનાવે છે (ટિન્ડલ અસર).
સાચા ઉકેલો -કણોનું કદ 10-7 - 10-8 સેમી છે, આ સજાતીય, સ્થિર ડીએસ છે.
સંતૃપ્ત દ્રાવણની સાંદ્રતા કહેવાય છે દ્રાવ્યતા જે તાપમાન નક્કી કરે છે તે દર્શાવે છે.
n દ્રાવ્યતા - એક લિટર દ્રાવણમાં ઓગળેલા પદાર્થના મોલ્સની સંખ્યા (સંતૃપ્તિની સ્થિતિમાં)
દ્રાવ્યતા- અન્ય પદાર્થો સાથે સજાતીય સિસ્ટમો બનાવવા માટે પદાર્થની ક્ષમતા - ઉકેલો જેમાં પદાર્થ વ્યક્તિગત અણુઓ, આયનો, પરમાણુઓ અથવા કણોના સ્વરૂપમાં હોય છે. દ્રાવ્યતા તેના સંતૃપ્ત દ્રાવણમાં દ્રાવ્યની સાંદ્રતા તરીકે વ્યક્ત કરવામાં આવે છે, ક્યાં તો ટકાવારી તરીકે અથવા વજન અથવા વોલ્યુમ એકમોમાં. પ્રવાહીમાં વાયુઓની દ્રાવ્યતા તાપમાન અને દબાણ પર આધારિત છે. પ્રવાહી અને ઘન પદાર્થોની દ્રાવ્યતા લગભગ સંપૂર્ણપણે તાપમાન પર આધાર રાખે છે.
n કોફ. દ્રાવ્યતા- સોલ્યુશનના 100 ગ્રામમાં સોલ્યુશન ઘટકનો સમૂહ
સાચા ઉકેલો થર્મોડાયનેમિકલી સ્થિર સિસ્ટમો છે જે સમયસર અનિશ્ચિત રૂપે સ્થિર હોય છે.
ઉકેલોની રચના માટેના પ્રેરક દળો એ એન્ટ્રોપી અને એન્થાલ્પી પરિબળો છે. જ્યારે વાયુઓ પ્રવાહીમાં ઓગળી જાય છે, ત્યારે એન્ટ્રોપી હંમેશા ΔS ઘટે છે< 0, а при растворении кристаллов возрастает (ΔS >0). દ્રાવક અને દ્રાવક વચ્ચેની ક્રિયાપ્રતિક્રિયા જેટલી મજબૂત છે, ઉકેલોની રચનામાં એન્થાલ્પી પરિબળની ભૂમિકા વધારે છે. વિસર્જનની એન્થાલ્પીમાં ફેરફારની નિશાની વિસર્જન સાથેની પ્રક્રિયાઓની તમામ થર્મલ અસરોના સરવાળાના સંકેત દ્વારા નક્કી કરવામાં આવે છે, જેમાંથી મુખ્ય યોગદાન સ્ફટિક જાળીના મુક્ત આયનોમાં વિનાશ દ્વારા કરવામાં આવે છે (ΔH > 0) અને દ્રાવક પરમાણુઓ સાથે પરિણામી આયનોની ક્રિયાપ્રતિક્રિયા (સોલ્ટિવેશન, ΔH< 0). При этом независимо от знака энтальпии при растворении (абсолютно нерастворимых веществ нет) всегда ΔG = ΔH – T·ΔS < 0, т. к. переход вещества в раствор сопровождается значительным возрастанием энтропии вследствие стремления системы к разупорядочиванию. Для жидких растворов (расплавов) процесс растворения идет самопроизвольно (ΔG < 0) до установления динамического равновесия между раствором и твердой фазой.
