ફિનોલ્ફથાલિન શું છે. વરાળ નિસ્યંદનમાં મુખ્ય જોખમો.
(દસ્તાવેજ)
n2.doc
શિક્ષણ માટે ફેડરલ એજન્સી
સામાન્ય પ્રયોગ 1: ટાઇટ્રેશન
પાણીના છેલ્લા થોડા ટીપાં ઉમેરતી વખતે તમારે શા માટે ખાતરી કરવી જોઈએ કે તમારી આંખો ચિહ્ન સાથે સમાન છે?
- આ પ્રમાણભૂત ઉકેલની સાંદ્રતા કેટલી છે?
- બીકર અને ફનલને પાણીથી કોગળા કરવાનો હેતુ શું છે?
- વોલ્યુમેટ્રિક ફ્લાસ્કની અંદરના ભાગને પાણીથી ધોવાનો હેતુ શું છે?
ગરમ આલ્કોહોલમાંથી પુનઃસ્થાપનની પદ્ધતિ
કોષ્ટકમાંથી, આ પ્રયોગ માટે સરેરાશ ટાઇટ્રેશન વોલ્યુમ નક્કી કરો અને તમારી બાકીની ગણતરીઓમાં આ મૂલ્યનો ઉપયોગ કરો. આપેલ અગાઉના ઉદાહરણોનો ઉપયોગ કરીને, સરકોના નમૂનામાં એસિટિક એસિડની સાંદ્રતા નક્કી કરો. યાદ રાખો કે તમારી પાસે નીચેની માહિતી છે: ગ્રેપવાઈન સોડિયમ હાઇડ્રોક્સાઇડ સોલ્યુશનનું પ્રમાણ, સોડિયમ હાઇડ્રોક્સાઇડ સોલ્યુશનની સાંદ્રતા. અજ્ઞાત સાંદ્રતા સાથે સોડિયમ હાઇડ્રોક્સાઇડ સોલ્યુશનની સાંદ્રતા નક્કી કરો.
રાજ્ય શૈક્ષણિક સંસ્થાઉચ્ચ વ્યાવસાયિક શિક્ષણ
પોમેરેનિયન સ્ટેટ યુનિવર્સિટીએમ.વી. લોમોનોસોવ પછી નામ આપવામાં આવ્યું
રસાયણશાસ્ત્ર વિભાગ
કોર્સ વર્ક
ફિનોલ્ફથાલિનનું સંશ્લેષણ.
વિવિધ ડાઇલેક્ટ્રિક સ્થિરાંકો સાથે દ્રાવકોમાં દ્રાવ્યતાનો અભ્યાસ
પૂર્ણ:
કેન્દ્રિત એસિડ અને પાયા ગંભીર બર્નનું કારણ બની શકે છે. એસિડ અથવા બેઝ સાથે કામ કરતી વખતે અમે મોજા અને સલામતી ચશ્માનો ઉપયોગ કરવાનું સૂચન કરીએ છીએ. બ્યુરેટ બંધ છે તેની ખાતરી કર્યા પછી, બ્યુરેટ ભરાઈ ન જાય ત્યાં સુધી બ્યુરેટમાં પ્રમાણભૂત ઓક્સાલિક એસિડ સોલ્યુશન કાળજીપૂર્વક ઉમેરો. બ્યુરેટની નીચે સ્વચ્છ બીકર મૂકો અને કાળજીપૂર્વક તેમાં ઓક્સાલિક એસિડના દ્રાવણનો ભાગ મૂકો. આ સુનિશ્ચિત કરશે કે બ્યુરેટમાં હવાના પરપોટા નથી. સોલ્યુશનની ટોચ હવે 0 અને 1 સેમી 3 ગુણ વચ્ચે હોવી જોઈએ. બીજા દશાંશ સ્થાન પર મૂલ્ય લખો. શંક્વાકાર ફ્લાસ્કમાં 20 સેમી 3 \\ સોલ્યુશન માપવા માટે પિપેટનો ઉપયોગ કરો. શંક્વાકાર ફ્લાસ્કમાં ફિનોલ્ફથાલિન સૂચકના 3-4 ટીપાં ઉમેરો. શંક્વાકાર ફ્લાસ્કમાં ઝડપથી ઓક્સાલિક એસિડ ઉમેરીને અને શંક્વાકાર ફ્લાસ્કને સતત ફેરવીને રફ ટાઇટ્રેશન પ્રયોગ કરો. સોલ્યુશનનો રંગ બદલાતાની સાથે જ બંધ કરો અને ફરતા પછી તે બદલાઈ જાય છે. જો ફ્લાસ્ક કાંતવામાં આવે ત્યારે રંગ બદલાતો રહેતો નથી, તો રંગ ન રહે ત્યાં સુધી વધુ ઓક્સાલિક એસિડ ઉમેરો. બીજા શંક્વાકાર ફ્લાસ્ક સાથે 4-7 પગલાંઓનું પુનરાવર્તન કરો. જ્યાં સુધી તમે તમારા ક્રૂડ ટાઇટ્રેશન વોલ્યુમ કરતાં 2 cc ઓછું ઉમેર્યું ન હોય ત્યાં સુધી શંક્વાકાર ફ્લાસ્કમાં ઝડપથી ઓક્સાલિક એસિડ ઉમેરો. ચાલુ આ ક્ષણકોઈ કાયમી રંગ પરિવર્તન ન હોવું જોઈએ. ધીમે ધીમે ઓક્સાલિક એસિડ ઉમેરો. દરેક ટીપાની વચ્ચે ઘૂમરો અને જો જરૂરી હોય તો, ફ્લાસ્કની બાજુઓને પાણીથી ધોઈ લો. જ્યારે સોલ્યુશન રંગ બદલે છે અને નવો રંગ રહે છે, ત્યારે બ્યુરેટ પરના વોલ્યુમ પર ધ્યાન આપો. યાદ રાખો કે ટાઇટ્રેટેડ વોલ્યુમ છે: -. ચોકસાઈ માટે, જ્યાં સુધી તમારી પાસે 0.1 cm3 થી વધુ ના તફાવત સાથે ત્રણ રીડિંગ્સ ન હોય ત્યાં સુધી પગલાં 9-11 પુનરાવર્તન કરો.
- ચશ્મામાંથી એકને લેબલ કરો \\.
- એક ગ્લાસમાં 100 સેમી 3 પાણી માપવા માટે પાઈપેટનો ઉપયોગ કરો.
- એક ગ્લાસમાં લગભગ 4 g\\ ઉમેરો અને હલાવો.
- રિટોર્ટ સ્ટેન્ડ સાથે બ્યુરેટ જોડો અને ટોચ પર એક નાનું ફનલ મૂકો.
- જ્યારે ફિનોલ્ફથાલિન ઉમેરવામાં આવ્યું ત્યારે સોડિયમ હાઇડ્રોક્સાઇડ સોલ્યુશન કયો રંગ હતો?
- જ્યારે પૂરતું એસિડ ઉમેરવામાં આવ્યું ત્યારે રંગ કેવો હતો?
3 જી વર્ષનો વિદ્યાર્થી
રસાયણશાસ્ત્ર વિભાગ
અલ્ફેરોવ વ્લાદિમીર ઇવાનોવિચ
તપાસેલ:
એસોસિયેટ પ્રોફેસર, સાયન્સના ઉમેદવાર રસાયણ વિજ્ઞાન
લેવન્ડોવસ્કાયા ટી.વી.
એસોસિયેટ પ્રોફેસર, સાયન્સના ઉમેદવાર ટેક વિજ્ઞાન
છગીના એન. બી.
અરખાંગેલ્સ્ક
1. સાહિત્ય સમીક્ષા………………………………………………..5
ફિનોલ્ફથાલીનનો દેખાવ અને ભૌતિક ગુણધર્મો………….5
ફિનોલ્ફથાલીનનો ઉપયોગ………………………………………….6
રાસાયણિક ગુણધર્મો ……………………………………………………………… 8
ફિનોલ્ફથાલિનની તૈયારી………………………………………11
1.4.2 ભૌતિક ગુણધર્મોસંશ્લેષણમાં વપરાતા પદાર્થો….15
આપેલ અગાઉના ઉદાહરણોનો ઉપયોગ કરીને, સોડિયમ હાઇડ્રોક્સાઇડ સોલ્યુશનની સાંદ્રતા નક્કી કરો. યાદ રાખો કે તમારી પાસે નીચેની માહિતી છે: સોડિયમ હાઇડ્રોક્સાઇડ સોલ્યુશનનું વોલ્યુમ ઓક્સાલિક એસિડ સોલ્યુશનનું વોલ્યુમ ઓક્સાલિક એસિડ સોલ્યુશનની સાંદ્રતા. આ પ્રતિક્રિયા માટે સંતુલિત રાસાયણિક સમીકરણ.
ઓક્સાલિક એસિડના સમૂહની ગણતરી કરો કે જે વિદ્યાર્થીએ જરૂરી પ્રમાણભૂત સોલ્યુશન બનાવવા માટે ઓગળવું જોઈએ. તેમનું માનવું છે કે 40 સેમી 3 ઓક્સાલિક એસિડ સોલ્યુશન 35 સેમી 3 સોડિયમ હાઇડ્રોક્સાઇડ સોલ્યુશનને સંપૂર્ણપણે બેઅસર કરશે.
- આપણને ઓક્સાલિક એસિડની ખૂબ જરૂર છે.
- જો કે, અમને હજુ સુધી મોલ્સની સંખ્યા ખબર નથી.
1.4.3 વરાળ નિસ્યંદન તકનીક……………………….16
1.4.4 ગરમ આલ્કોહોલમાંથી પુનઃસ્થાપિત કરવાની પદ્ધતિ………….18
1.5 સુરક્ષા સાવચેતીઓ………………………………………………20
1.5.1 સંકેન્દ્રિત એસિડ સાથે કામ કરતી વખતે મુખ્ય જોખમો………………………………………………………………..20
1.5.2 વરાળ નિસ્યંદન દરમિયાન મુખ્ય જોખમો……..21
- પ્રતિક્રિયા માટે સંતુલિત રાસાયણિક સમીકરણ લખો.
- એસિડ સાંદ્રતાની ગણતરી કરો.
આ વારંવાર એસિડિક વરસાદની નોંધ ઓગણીસમી સદીમાં કરવામાં આવી હતી, પરંતુ વીસમી સદી સુધી આ એસિડિટી જોખમી સ્તરે વ્યાપક બની ન હતી જેને આપણે "એસિડ વરસાદ" શબ્દ સાથે સાંકળીએ છીએ. મુખ્ય ગુનેગાર અશુદ્ધતા તરીકે સલ્ફર ધરાવતો કોલસો હોવાનું બહાર આવ્યું છે. જ્યારે પાવર પ્લાન્ટમાં સળગાવવામાં આવે છે, ત્યારે આ સલ્ફર ઓક્સિજન સાથે મળીને સલ્ફર ડાયોક્સાઈડ બનાવે છે, જે ચીમનીમાંથી ઉગે છે અને વાતાવરણમાં વિખેરી નાખે છે.
1.5.3 ગરમ આલ્કોહોલમાંથી પુનઃસ્થાપન દરમિયાન મુખ્ય જોખમો………………………………………………………………………………….21
1.5.4 સંશ્લેષણમાં વપરાતા પદાર્થો સાથે કામ કરવાની વિશેષતાઓ………………………………………………………………………………22
1.6 દ્રાવકની લાક્ષણિકતાઓ………………………………….24
1.6.1 ભૌતિક ગુણધર્મો દ્વારા દ્રાવકનું વર્ગીકરણ...25
સલ્ફ્યુરિક એસિડ ખૂબ જ મજબૂત એસિડ છે, અને જ્યારે પાણી હવામાંથી ઘનીકરણ કરીને વરસાદના ટીપાં બનાવે છે, ત્યારે એસિડ પાણીમાં ઓગળી જાય છે. પછી વરસાદ પડે છે અને શરીરમાં ભેગો થાય છે તાજા પાણી, તેમની એસિડિટી વધે છે. ઉત્તરપૂર્વીય યુનાઇટેડ સ્ટેટ્સ આનાથી સૌથી વધુ સહન કરે છે કારણ કે ઓહિયો અને પેન્સિલવેનિયાના વિસ્તારો સહિત ઓહિયો વેલી, જ્યાં છેલ્લી દોઢ સદીના મોટા ભાગનો કોલસા ઉદ્યોગ થયો છે. પ્રવર્તમાન હવામાન પરિસ્થિતિઓને લીધે, આ ધુમાડો વાયુઓ ઓહાયો ખીણમાં વાતાવરણમાં પ્રવેશ કરે છે, પરંતુ વરસાદ ન્યુયોર્ક અને ન્યુ ઈંગ્લેન્ડના ઉપરના ભાગમાં પડે છે.
1.6.2 તેમના આધારે સોલવન્ટ વર્ગીકરણ પ્રણાલીઓ રાસાયણિક ગુણધર્મો………………………………………………..30
1.7 ઘન પદાર્થોની દ્રાવ્યતા નક્કી કરવા માટેની પદ્ધતિઓની સમીક્ષા………………………………………………………………..35
1.7.1 ગ્રેવિમેટ્રિક પદ્ધતિ ……………………………………….35
1.7.2 ઇલેક્ટ્રોકેમિકલ પદ્ધતિ………………………………………37
1.7.3 ફોટોઈલેક્ટ્રોકેલોરીમેટ્રિક પદ્ધતિ………………………..41
વરસાદમાં એસિડિટી વધવાથી ભયંકર પરિણામો આવી શકે છે. માટીમાં રહેલા ધાતુના દૂષકો, જે સામાન્ય રીતે અન્ય સંયોજનો સાથે ચુસ્તપણે બંધાયેલા હોય છે, તે એસિડ વરસાદ દ્વારા તળાવો અને પ્રવાહોમાં ધોવાઇ શકે છે; એક સમયે ન્યુ ઇંગ્લેન્ડમાં ઘણા તળાવો આ કારણે બ્રુક ટ્રાઉટને ટેકો આપી શકતા ન હતા. છોડ પણ જમીનના pH માટે ખૂબ જ સંવેદનશીલ હોય છે. ફાયદાકારક પોષક તત્ત્વો પણ જમીનમાંથી ધોવાઇ જાય છે, જેનાથી છોડ તેમાં ટકી શકતા નથી. ખાસ કરીને સખત અસરગ્રસ્ત વિસ્તારોમાં, ઉપર બતાવ્યા પ્રમાણે ડઝનેક મૃત વૃક્ષો મળી શકે છે.
2. પ્રાયોગિક ભાગ……………………………………………………43
2.1 ફિનોલ્ફથાલિનનું સંશ્લેષણ………………………………………………………………43
2.2 ગરમ આલ્કોહોલમાંથી પુનઃસ્થાપન………………………..45
2.3 દ્રાવ્યતાનું નિર્ધારણ……………………………………….47
નિષ્કર્ષ………………………………………………………50
ગ્રંથસૂચિ…………………………………………………….51
ઈમારતો અને મૂર્તિઓને પણ એસિડ વરસાદથી નુકસાન થયું છે, જે પથ્થર, ખાસ કરીને ચૂનાના પત્થરને ખાય છે. શિલ્પો, સમાધિના પત્થરો અને કેટલીક ઇમારતોના ધોવાણમાં વધારો થવાથી ભારે નુકસાન થયું છે - કલાના કેટલાક કાર્યો સંપૂર્ણપણે નાશ પામ્યા છે.
ત્યારથી, ઉત્સર્જનમાં નોંધપાત્ર ઘટાડો થયો છે અને એસિડ વરસાદ પણ છે. જો કે, સમસ્યા હજી દૂર થઈ નથી અને આ ગંભીર પર્યાવરણીય સમસ્યા વિશે ઘણું કરવાનું બાકી છે. ચાલો જોઈએ હાઈડ્રોક્લોરિક એસિડ, જે પેટના એસિડનું મુખ્ય ઘટક છે, અને સોડિયમ હાઈડ્રોક્સાઇડ, જેને ઘણીવાર "લાય" તરીકે ઓળખવામાં આવે છે અને તેનો ઉપયોગ સાબુમાં થાય છે. જો કે, લગભગ તમામ હાઇડ્રોનિયન અને હાઇડ્રોક્સાઇડ પાણીના અણુઓ બનાવવા માટે ભેગા થાય છે, માત્ર ક્લોરાઇડ સ્પેક્ટેટર અને સોડિયમ આયનો પાછળ રહી જાય છે.
પરિચય
ફેનોલ્ફથાલિન એ રસાયણશાસ્ત્રમાં સૌથી વધુ ઉપયોગમાં લેવાતા એસિડ-બેઝ સૂચકાંકોમાંનું એક છે. તે ટ્રાયરીલમેથેન રંગોથી સંબંધિત છે જેને ફેથેલિન ડાયઝ કહેવાય છે.
આ કાર્યનો હેતુ ફિનોલ્ફથાલિનનું સંશ્લેષણ કરવાનો અને વિવિધ ડાઇલેક્ટ્રિક સ્થિરાંકો સાથેના દ્રાવકોમાં તેની દ્રાવ્યતાનો અભ્યાસ કરવાનો છે. આ ધ્યેય હાંસલ કરવા માટે, નીચેના કાર્યો હલ કરવા જરૂરી છે:
જો મોલ્સમાં હાઇડ્રોક્લોરિક એસિડનું પ્રમાણ સોડિયમ હાઇડ્રોક્સાઇડના જથ્થા જેટલું જ હોય, તો દરેક હાઇડ્રોનિયમમાં પ્રતિક્રિયા કરવા માટે હાઇડ્રોક્સાઇડ હોવું આવશ્યક છે જે હવે તટસ્થ છે. હવે તે 7 પીએચ સાથે સ્વચ્છ પાણીનો ગ્લાસ હોવો જોઈએ અને તેમાં નિયમિત ટેબલ મીઠું ઓગળવું જોઈએ. અમે બે અત્યંત કોસ્ટિક પદાર્થોથી શરૂ કરીએ છીએ અને સૌમ્ય ઉત્પાદનો સાથે સમાપ્ત કરીએ છીએ.
સામાન્ય રીતે, જ્યારે એસિડ અને પાયા એકબીજા સાથે ક્રિયાપ્રતિક્રિયા કરે છે, ત્યારે તેઓ એકબીજાને તટસ્થ કરે છે અને સોલ્યુશનનો pH આની નજીક આવે છે. તેને "." કહેવાય છે. માત્ર ત્યારે જ જ્યારે મજબૂત એસિડ અને મજબૂત આધારની સમાન માત્રા એકસાથે ઉમેરવામાં આવે ત્યારે જ pH સચોટ હશે. પરંતુ ઘણા કિસ્સાઓમાં, નબળા એસિડ અને નબળા પાયા ભેગા થાય છે. જો કે, pH 7 નો સંપર્ક કરશે, પરંતુ ઉકેલ તટસ્થ રહેશે નહીં. એસિડ વરસાદના કિસ્સામાં, મોટાભાગે ખડકો અને માટી મુખ્ય હોય છે, ખાસ કરીને દેશના કેટલાક ભાગોમાં જોવા મળતા કાર્બોનેટ ખડકો.
1. આ મુદ્દા પર સાહિત્યનું વિશ્લેષણ કરો;
2. સંશ્લેષણ પદ્ધતિઓ પસંદ કરો અને સૌથી યોગ્ય પસંદ કરો;
3. ઉત્પાદનનું સંશ્લેષણ, અલગતા અને શુદ્ધિકરણ હાથ ધરવા;
4. વિવિધ ડાઇલેક્ટ્રિક સ્થિરાંકો સાથે સોલવન્ટ્સમાં દ્રાવ્યતાની તપાસ કરો, સાહિત્યના ડેટા સાથે મેળવેલા પરિણામોની તુલના કરો;
એસિડ વરસાદમાં નબળા એસિડ ખડક પર પડતા હોવાથી, તેઓ પાંદડા, ગંદકી અને ખડકોમાં પાયા દ્વારા તટસ્થ થઈ જાય છે. જો કે, આમાંના ઘણા પાયા, જેમ કે ખડકોમાં જોવા મળતા, નવીનીકરણીય નથી. એસિડ વરસાદની સદી પછી, ખડકો ખડકોના તમામ પાયાને તટસ્થ કરે છે, એસિડ વરસાદ ફક્ત ઇકોસિસ્ટમમાં પ્રવેશ કરે છે અને કંઈપણ તેને તટસ્થ કરતું નથી.
ફેનોલ્ફથાલિન: સામાન્ય પ્રયોગશાળા સૂચક
ફિનોલ્ફથાલિન પરમાણુ એસિડની હાજરીમાં પારદર્શક હોય છે અને આધારની હાજરીમાં ગુલાબી હોય છે. સરળ એસિડ માટે એસિડ-બેઝ ટાઇટ્રેશનમાં સમાનતા બિંદુ શોધવા માટે આ એક ઉત્તમ સૂચક છે. વિભાગ 5 માં વિભાગ 8 ટાઇટ્રેશનને નિયંત્રિત સ્ટોઇકિયોમેટ્રિક પ્રતિક્રિયા માટે બે ઉકેલોને એકસાથે જોડવાના માર્ગ તરીકે રજૂ કરવામાં આવ્યા હતા. તેને જાણીતા સાંદ્રતાના ઉકેલની જરૂર છે, સામાન્ય રીતે બ્યુરેટમાં, જે નીચે બીકરમાં અજ્ઞાત સાંદ્રતાના ઉકેલ સાથે પ્રતિક્રિયા કરશે. કોઈપણ પ્રતિક્રિયા ટાઇટ્રેશન માટે કાર્ય કરશે, પરંતુ પ્રતિક્રિયા ક્યારે પૂર્ણ થાય છે તે કહેવા માટે સક્ષમ થવા માટે ત્યાં દૃશ્યમાન અંતિમ બિંદુ હોવું આવશ્યક છે.
5.
કરેલા કામ વિશે નિષ્કર્ષ દોરો.
1. સાહિત્ય સમીક્ષા
1.1 ફિનોલ્ફથાલિનનો દેખાવ અને ભૌતિક ગુણધર્મો
ફેનોલ્ફથાલીન (Di-n-dioxydiphenylphthalide, 2,2-bis(n-hydroxyphenyl)phthalide) - સફેદ અથવા સહેજ પીળો સ્ફટિકીય પાવડર; પાતળું ઇથિલ આલ્કોહોલનું પુનઃસ્થાપન રંગહીન, રોમ્બિક સોય બનાવે છે. ફેનોલ્ફથાલિન ગંધહીન છે અને હવામાં સ્થિર નથી. મોલેક્યુલર વજન 318.3 ગ્રામ/મોલ છે. ફેનોલ્ફથાલિન 250 0 સે (258 0 સે) અને વધુ તાપમાને પીગળે છે ઉચ્ચ તાપમાનઉત્કૃષ્ટ
વજન ઘટાડવાના સાધન તરીકે ફેનોલ્ફથાલિન
એસિડ બેઝ પ્રતિક્રિયાઓ માટે, સૂચકાંકો અંતિમ બિંદુ દર્શાવવા માટે રંગ પરિવર્તન સાથે આ પ્રકારની માહિતી પ્રદાન કરી શકે છે. તેથી, એસિડ બેઝ તટસ્થતા પ્રતિક્રિયાઓ ટાઇટ્રેશન એસેસમાં ઉપયોગમાં લેવાતી પ્રતિક્રિયાઓના સૌથી સામાન્ય પ્રકારોમાંની એક છે. આમ, ટાઇટ્રેશનનો ઉપયોગ અજાણ્યા દ્રાવણમાં એસિડ અથવા બેઝની માત્રા નક્કી કરવા માટે થઈ શકે છે.
મજબૂત પાયા સાથે મજબૂત એસિડને ટાઇટ્રેટ કરતી વખતે, જ્યારે pH બરાબર 7 હોય ત્યારે અંતિમ બિંદુએ પહોંચી જાય છે કારણ કે દ્રાવણ ફક્ત તટસ્થ ઇલેક્ટ્રોલાઇટ્સ સાથેનું શુદ્ધ જલીય દ્રાવણ હોવું જોઈએ. એકવાર એસિડ નીકળી જાય પછી, અમે ફ્લાસ્કમાં કોઈપણ આધાર ઉમેરીશું તે તટસ્થ થશે નહીં અને સોલ્યુશનનો pH વધવા લાગશે. જો કે, વધારાના મજબૂત આધારના બ્યુરેટ ડ્રોપનો એક નાનો અપૂર્ણાંક પણ pH ને બદલી નાખશે. એક અથવા આવા સૂચક, ફિનોલ્ફથાલિન, એસિડિક દ્રાવણમાં સ્પષ્ટ અને રંગહીન હોય છે, પરંતુ જો pH 2 થી ઉપર હોય તો મૂળભૂત ઉકેલોમાં ઘેરો ગુલાબી થઈ જાય છે.
ફેનોલ્ફથાલીન ઇથેનોલ, ડાયથાઈલ ઈથર, ક્લોરોફોર્મ, એસીટોન, પેટ્રોલિયમ ઈથર, બેન્ઝીન, ટોલ્યુઈન અને પાણીમાં ખરાબ રીતે દ્રાવ્ય છે.
1.2 ફિનોલ્ફથાલિનનો ઉપયોગ
ખાસ કરીને નબળા એસિડના વોલ્યુમેટ્રિક નિર્ધારણ માટે, ફેનોલ્ફથાલિન એ સૌથી વધુ ઉપયોગમાં લેવાતા સૂચકાંકોમાંનું એક છે.
તેના અસંખ્ય ફાયદા છે: તે એલિવેટેડ તાપમાન માટે સંવેદનશીલ નથી, પ્રોટીન પદાર્થો અને કોલોઇડ્સની હાજરીથી ભૂલ નજીવી છે. આલ્કોહોલ ધરાવતા દ્રાવણમાં પણ તેનો વ્યાપકપણે ઉપયોગ કરી શકાય છે, માત્ર આલ્કલાઇન દ્રાવણનો રંગ જલીય દ્રાવણની વાયોલેટ ટોનથી અલગ છે. કેન્દ્રિત આલ્કોહોલ સોલ્યુશન્સમાં, મુખ્ય સ્વરૂપમાં વાદળી-વાયોલેટ રંગ હોય છે. ફિનોલ્ફથાલિનનો ઉપયોગ આલ્કોહોલિક દ્રાવણમાં કાર્બનિક એસિડના ટાઇટ્રેશનમાં અથવા આલ્કોહોલ અને એસ્ટરની એસિડિટી નક્કી કરવા માટે થઈ શકે છે. હેજોર્ટ અને હેમ ફિનોલ્ફથાલિનની હાજરીમાં બેઝ ટાઇટર્સ સ્થાપિત કરવા માટે પોલિસોડિયમ ગ્લાયકોલેટના ઉપયોગની દરખાસ્ત કરે છે. ફિનોલ્ફથાલિનની હાજરીમાં 2.7•10 -6 - 40•10 -6 l ના જથ્થામાં 2•10 -6 - 30•10 -6 ગ્રામ કાર્બનિક એસિડને ટાઇટ્રેટિંગ કરીને સંતોષકારક પરિણામો મેળવવામાં આવે છે. મિકના સંશોધન મુજબ, સૂચક એકાગ્રતા માઇક્રોએસિડિમેટ્રીમાં ખૂબ જ મહત્વપૂર્ણ ભૂમિકા ભજવે છે. ફેનોલ્ફથાલિન એ ઘણા મિશ્ર સૂચકાંકોનો એક ઘટક છે. તેના ગુણધર્મોને લીધે, તે બફર સોલ્યુશન્સનો ઉપયોગ કરીને અથવા બફર સોલ્યુશન વિના માઇકલિસ પદ્ધતિનો ઉપયોગ કરીને pH ના કેલરીમેટ્રિક નિર્ધારણ માટે યોગ્ય છે. રંગીન સ્વરૂપ સાંદ્રતાની વિશાળ શ્રેણી પર બીયરના કાયદાનું પાલન કરે છે.
એસિડ સૂચકાંકો ઘણા પ્રકારોમાં આવે છે
હકીકત એ છે કે ફેનોલ્ફથાલીન 0 થી સહેજ ઉપરનો રંગ બદલે છે તે સામાન્ય રીતે પ્રયોગમાં બહુ ઓછી ભૂલમાં પરિણમે છે. ફિનોલ્ફથાલિન ઉપરાંત, અન્ય સૂચકોમાં બ્રોમોથાઇમોલ વાદળી અને મિથાઈલ નારંગીનો સમાવેશ થાય છે. ઉકેલો માટે કે જે તેમના અંતિમ બિંદુથી થોડા અલગ હોય છે, બ્રોમોથીમોલ વાદળી એક સારો સૂચક છે. 7 ના pH મૂલ્યની નીચે, ઉકેલ પીળો રંગનો છે, જે pH ની બરાબર ઉપર વાદળી થઈ જાય છે. જ્યારે ટાઇટ્રેશનનો અંતિમ બિંદુ એકદમ એસિડિક હોય છે, ત્યારે મિથાઈલ નારંગીનો ઉપયોગ થાય છે.
ગુણાત્મક પૃથ્થકરણમાં ફેનોલ્ફથાલીનનો ઉપયોગ રીએજન્ટ તરીકે પણ થઈ શકે છે. Sachs અનુસાર, કેટલાક અદ્રાવ્ય ધાતુના હાઇડ્રોક્સાઇડ્સ, જેમ કે સીસું, કેડમિયમ, ઝીંક, મેગ્નેશિયમ, વગેરે, જ્યારે ફિનોલ્ફથાલિન સાથે છાંટવામાં આવે છે, ત્યારે રંગ આપે છે, જે સૂચકના શોષણ દ્વારા સમજાવવામાં આવે છે. પ્રતિક્રિયાઓનો બીજો જૂથ એ હકીકત પર આધારિત છે કે આલ્કલાઇન વાતાવરણમાં ફિનોલ્ફથાલિન ઝીંક દ્વારા રંગહીન ફિનોલ્ફથાલિનમાં ઘટાડો થાય છે. આ લ્યુકો સંયોજન ચોક્કસ પદાર્થો દ્વારા ઓક્સિડાઇઝ થાય છે, અને પછી ફેનોલ્ફથાલિનનો લાલ રંગ ફરીથી દેખાય છે. કોપર સલ્ફેટના નિશાનની હાજરીમાં ખૂબ જ ઓછી માત્રામાં સાયનાઇડ આયન (0.01-0.05 mg/l) સાથે સમાન અસર જોવા મળે છે. ખૂબ જ ઓછી માત્રામાં તાંબા (10 -4 - 10 -5%) સાથે, સિસ્ટમમાં હાઇડ્રોજન પેરોક્સાઇડનો પ્રવેશ લ્યુકો સંયોજનના ઓક્સિડેશનના દરમાં વધારો તરફ દોરી જાય છે.
ફેનોલ્ફથાલીન ડેરિવેટિવ્સમાંના એક, ફેનોલ્ફથાલિન ફોસ્ફેટનો ઉપયોગ ફોસ્ફેટ એન્ઝાઇમની પ્રવૃત્તિ નક્કી કરવા માટે થાય છે. ફેનોલ્ફથાલિન ફોસ્ફેટ પોતે સૂચક ગુણધર્મો ધરાવતું નથી, પરંતુ એન્ઝાઇમની ક્રિયા દ્વારા નાશ પામે છે; ફોસ્ફેટ જૂથો સબસ્ટ્રેટની ક્રિયા દ્વારા બંધ થઈ જાય છે, અને ફિનોલ્ફથાલિનનો લાલ રંગ દેખાય છે.
દવામાં, ફિનોલ્ફથાલિનનો ઉપયોગ રેચક તરીકે થાય છે, અને દવાને પ્યુર્જેન કહેવામાં આવે છે.
1.3 રાસાયણિક ગુણધર્મો
ફિનોલ્ફથાલિનનો રંગ સંક્રમણ અંતરાલ pH 8.2 (રંગહીન) થી pH 9.8 (જાંબલી) સુધીનો છે. સંક્રમણ અંતરાલ નક્કી કરવા માટે, નીચેના pH મૂલ્યો સાથે બફર ઉકેલોની શ્રેણીનો ઉપયોગ થાય છે: 7.8-8.0-8.2-8.4-9.0-9.6-9.8-10.0-10.2. પીએચ મૂલ્યો કે જેના પર પ્રથમ ગુલાબી રંગ દેખાય છે તે સૂચકની સાંદ્રતા પર આધારિત છે. જાંબલી રંગની તીવ્રતા ધીમે ધીમે pH 9.8 સુધી વધે છે: pH 1/2 9.53.
ક્વિનોઇડ સ્ટ્રક્ચર (III) ના રંગીન ડાયનિયનની રચનાની પ્રક્રિયા, જે પાતળું આલ્કલી દ્રાવણ (pH8.5) સાથે ફિનોલ્ફથાલિનની ક્રિયાપ્રતિક્રિયાના પરિણામે રચાય છે, તેને નીચે પ્રમાણે રજૂ કરી શકાય છે:
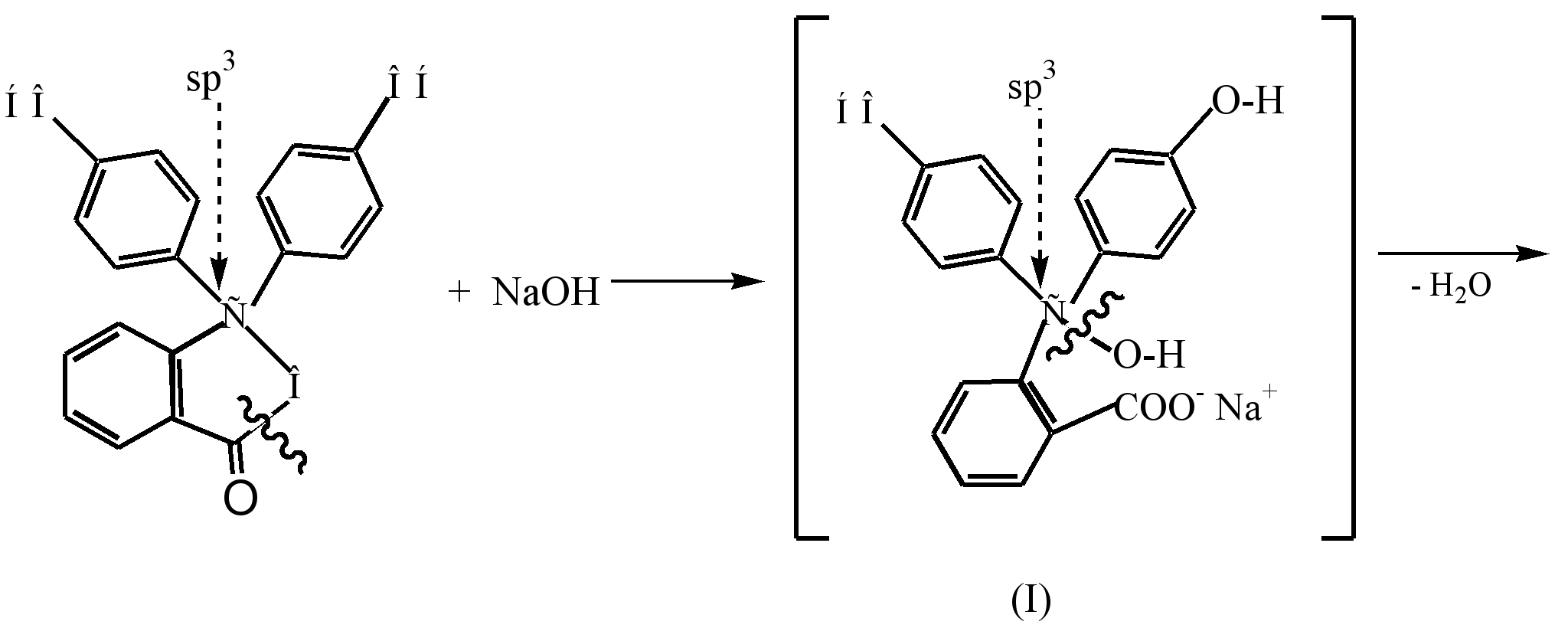

રંગહીન ફિનોલ્ફથાલિનમાં આલ્કલીના પ્રભાવ હેઠળ, β-લેક્ટોન રિંગ ખુલે છે (હાઈડ્રોલિઝ), અને પરિણામી રંગહીન આલ્કોહોલ (I) સ્વયંભૂ રીતે પાણીના અણુમાંથી વિભાજીત થઈને મોનોસોડિયમ મીઠું (II) બનાવે છે. પીળો રંગ. આલ્કલી સાથે વધુ ક્રિયાપ્રતિક્રિયા ડિસોડિયમ મીઠું (III) ની રચના તરફ દોરી જાય છે અને કિરમજી રંગના રંગને ઊંડો બનાવે છે, જે જોડાણ સાંકળને લંબાવવાને કારણે છે.
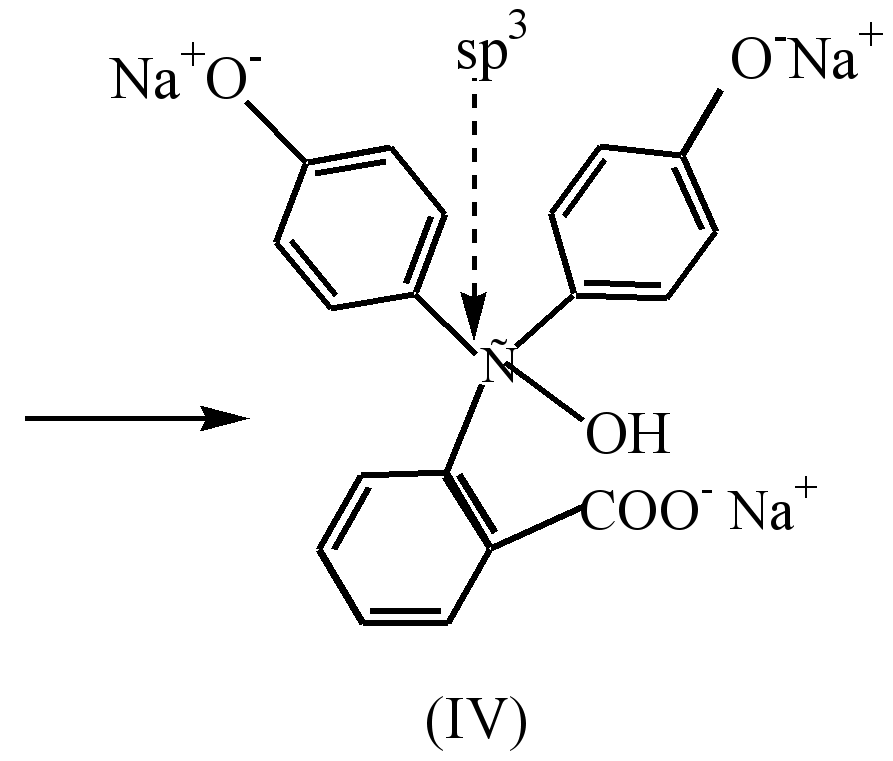
અત્યંત આલ્કલાઇન વાતાવરણમાં (pH10), ડિસોડિયમ મીઠું (III) થી ટ્રાઇસોડિયમ મીઠું (IV) માં સંક્રમણના પરિણામે દ્રાવણનું વિકૃતિકરણ જોવા મળે છે, જેમાં રિંગ્સ એકબીજા સાથે જોડાયેલા નથી.
એસિડિક વાતાવરણમાં તે રંગહીન હોય છે, કારણ કે નબળા બેન્ઝીન ક્રોમોફોર્સ અલગ, સ્વાયત્ત અને?,? - નીચેના એકબીજા સાથે ક્રિયાપ્રતિક્રિયા (ઇન્ટરફેસ) કરતા નથી:
શું તેઓ sp 3 થી અલગ છે - એક કાર્બન અણુ જે ઇન્સ્યુલેટર છે અને વાહક નથી? - ઇલેક્ટ્રોન. આલ્કલાઇન વાતાવરણમાં, લેક્ટોન ચક્ર તૂટી જાય છે, ફેનોલિક હાઇડ્રોક્સિલ્સમાંથી એક આયનાઇઝ થાય છે, અને C sp 3 અણુ C sp 2 રૂપરેખા મેળવે છે, વાહક બને છે? – બેન્ઝીન ક્રોમોફોર્સ વચ્ચેના ઇલેક્ટ્રોન, ધ્રુવીકૃત ઓક્સોક્રોમ્સ ઉપરાંત – COO - અને –O -. કેન્દ્રિત સલ્ફ્યુરિક એસિડમાં સૂચક વળે છે નારંગી રંગ. જાંબલી આલ્કલાઇન સોલ્યુશનની રંગની તીવ્રતા સ્ટેન્ડિંગ પર ઘટે છે, આંશિક રીતે રંગહીન કાર્બોક્સિલ બેઝની રચનાને કારણે (આ એક ઉલટાવી શકાય તેવું પરિવર્તન છે), અંશતઃ હવા દ્વારા બદલી ન શકાય તેવા ઓક્સિડેશનને કારણે.
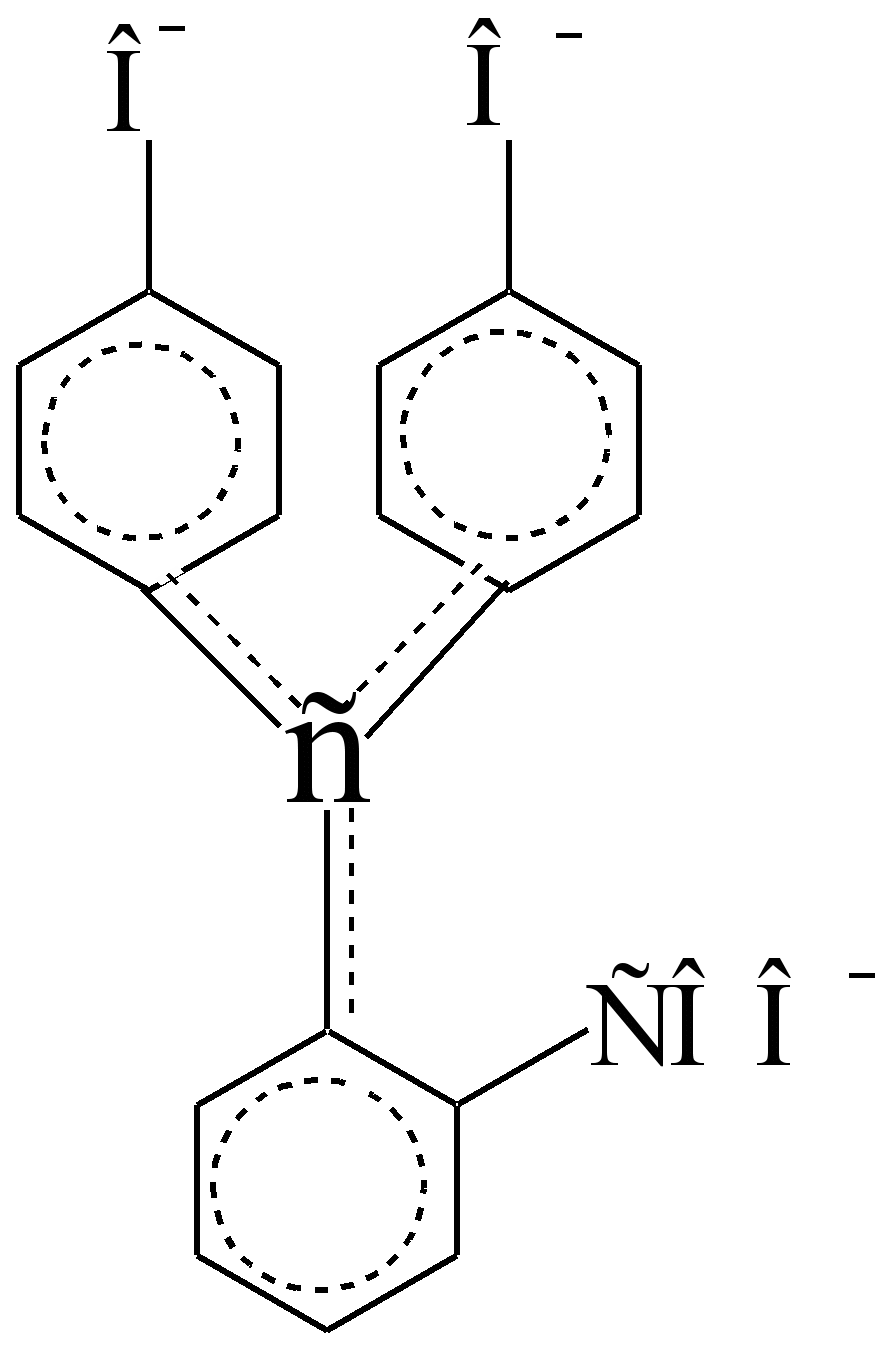
ફેનોલ્ફથાલીન ક્રોમોફોર
(આલ્કલાઇન સ્વરૂપ, 1 = 553 nm, 1 = 9000)
1.4 phenolphthalein ની તૈયારી
ફેનોલ્ફથાલીન ઉત્પન્ન કરવાની મુખ્ય પદ્ધતિ એ છે કે ફેનોલનું phthalic anhydride સાથે ઘનીકરણ. આ પ્રતિક્રિયા Friedel-Crafts acylation નો વિશેષ કેસ છે. પ્રતિક્રિયા ત્યારે થાય છે જ્યારે એસિડ ઉત્પ્રેરક (કેન્દ્રિત સલ્ફ્યુરિક એસિડઅથવા ઝીંક ક્લોરાઇડ):
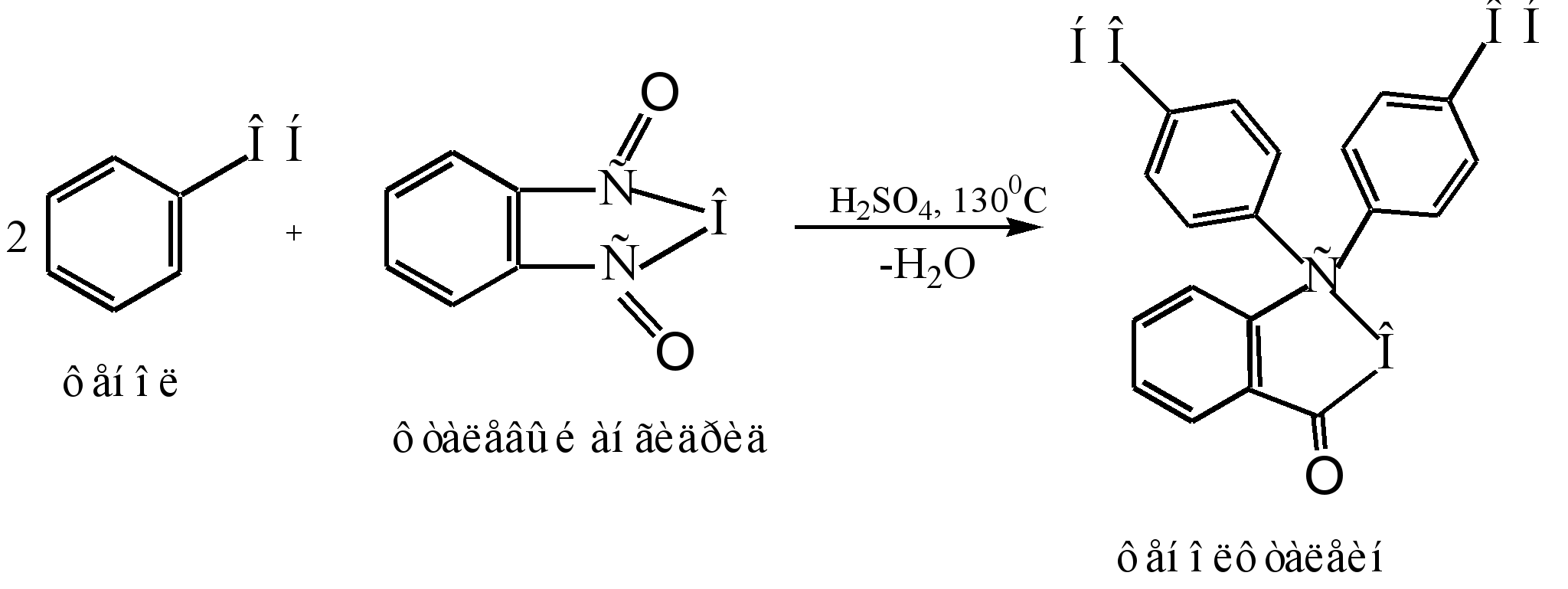
પ્રતિક્રિયા પદ્ધતિ નીચે પ્રમાણે રજૂ કરી શકાય છે:

સિગ્મા - જટિલ
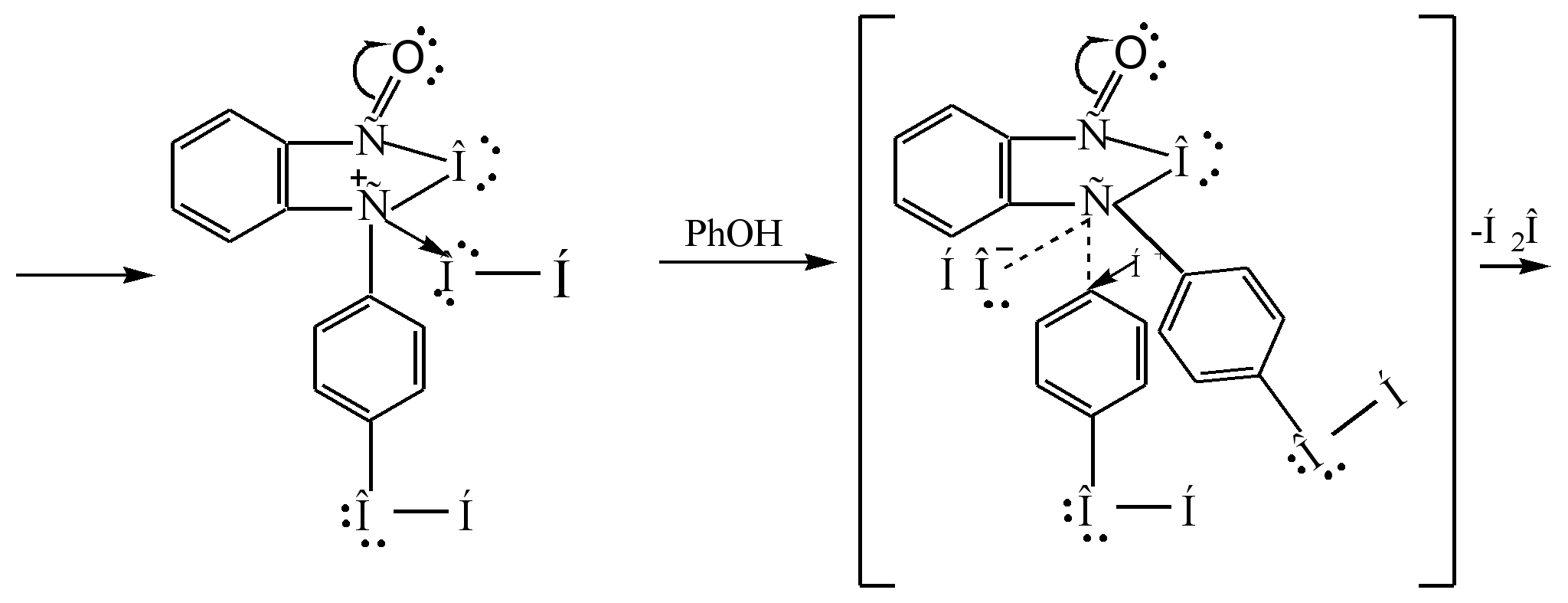
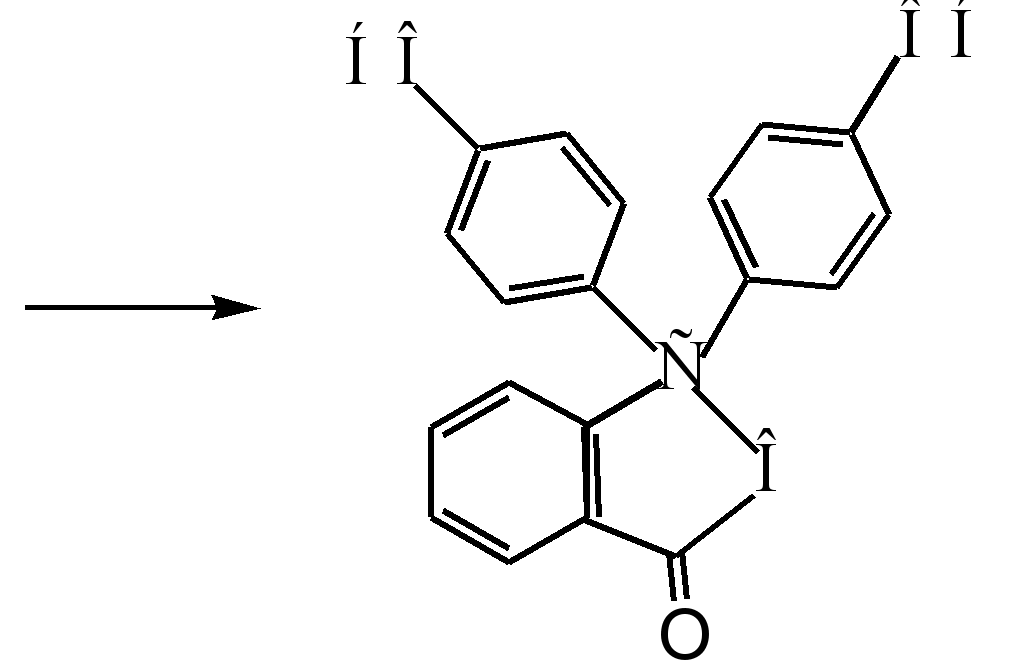
ફેનોલ્ફથાલીન
1.4.1 ફિનોલ્ફથાલિન મેળવવા માટેની પદ્ધતિઓ
આ મુદ્દા પર સાહિત્યિક સ્ત્રોતોનું વિશ્લેષણ કર્યા પછી, એવું જાણવા મળ્યું કે તમામ પદ્ધતિસરની માર્ગદર્શિકાઓ ફિનોલ્ફથાલિન મેળવવા માટે સમાન પદ્ધતિ પ્રદાન કરે છે. તે ઉપર પ્રસ્તુત પ્રતિક્રિયા પર આધારિત છે. તકનીક અમારી પ્રયોગશાળાની પરિસ્થિતિઓ માટે સંપૂર્ણપણે યોગ્ય છે.
સંશ્લેષણ માટે તમારે નીચેના રીએજન્ટ્સ, કાચનાં વાસણો અને સાધનોની જરૂર પડશે:
Phthalic anhydride-5g; ફિનોલ - 10 ગ્રામ; સલ્ફ્યુરિક એસિડ - 2 મિલી; સોડિયમ હાઇડ્રોક્સાઇડ - 4-5%; એસિટિક એસિડ (કેન્દ્રિત); હાઇડ્રોક્લોરિક એસિડ (કેન્દ્રિત); ઇથિલ આલ્કોહોલ (સંપૂર્ણ).
રાઉન્ડ-બોટમ ફ્લાસ્ક (50ml) - 1 ટુકડો; ગ્લાસ (100 મિલી) - 1 પીસી.; પોર્સેલેઇન કપ - 1 પીસી.; શંક્વાકાર ફ્લાસ્ક (250 મિલી) - 2 પીસી.; થર્મોમીટર; વરાળ નિસ્યંદન ઉપકરણ; રેતી સ્નાન.
પ્રગતિ સંશ્લેષણ:
5 ગ્રામ ફેથેલિક એનહાઇડ્રાઇડ, 10 ગ્રામ ફિનોલ અને 2 મિલી સલ્ફ્યુરિક એસિડનું મિશ્રણ ફ્લાસ્કમાં મૂકવામાં આવે છે અને તેને રેતીના સ્નાનમાં 1.5 કલાક માટે ગરમ કરવામાં આવે છે, સખત રીતે 125 - 130 C 0 તાપમાન જાળવી રાખે છે (ઓગળવામાં થર્મોમીટર અને સમયાંતરે સામગ્રીને હલાવો). ગરમ મિશ્રણને 100 મિલી ઉકળતા પાણી સાથે ફ્લાસ્કમાં રેડવામાં આવે છે, ફિનોલ કે જેણે પ્રતિક્રિયા આપી નથી તેને વરાળથી નિસ્યંદિત કરવામાં આવે છે. સ્પ્લેશિંગ અને પરિણામી પદાર્થના નુકશાનને ટાળવા માટે, પ્રવાહીને હંમેશા હલાવતા રહેવું જોઈએ. નિસ્યંદનનો અંત નિસ્યંદનની ગંદકીમાં ફેરફાર દ્વારા નોંધી શકાય છે: જો નિસ્યંદન કંઈક અંશે વાદળછાયું વહેતું હોય, તો નિસ્યંદન ચાલુ રાખવું જોઈએ, જો નિસ્યંદન સ્પષ્ટ હોય, તો નિસ્યંદન બંધ કરી શકાય છે. સોલ્યુશનને ઠંડુ થવા દેવામાં આવે છે, તે પછી તેને બ્યુકનર ફનલ પર ડીકેંટ કરવામાં આવે છે, જો શક્ય હોય તો, અવક્ષેપને ફિલ્ટરમાં સ્થાનાંતરિત ન કરવાનો પ્રયાસ કરો. પછી ઉત્પાદનને બે નાના ભાગોમાં ડીકેન્ટ કરીને ધોવામાં આવે છે ઠંડુ પાણિ, ગ્લાસમાં ઘન પદાર્થના જથ્થામાં ફિલ્ટર પર શું સમાપ્ત થયું તે ઉમેરો, તેમાં વિસર્જન કરો નાની માત્રાગરમ 4-5% સોડિયમ હાઇડ્રોક્સાઇડ અને બિનપ્રક્રિયા વિનાનું phthalic એનહાઇડ્રાઇડ ગાળણ દ્વારા અલગ કરવામાં આવે છે. ફિનોલ્ફથાલીન સંપૂર્ણપણે અવક્ષેપિત થાય ત્યાં સુધી ઘાટા લાલ ફિલ્ટ્રેટમાં એસિટિક એસિડ ઉમેરવામાં આવે છે, પછી હાઇડ્રોક્લોરિક એસિડના 1-2 ટીપાં ઉમેરવામાં આવે છે અને 1 કલાક માટે છોડી દેવામાં આવે છે.
પીળી રંગની રેતીના રૂપમાં મુક્ત થયેલ ફિનોલ્ફથાલિનને બુચનર ફનલનો ઉપયોગ કરીને ચૂસવામાં આવે છે. ક્રૂડ પ્રોડક્ટને ગ્લાસમાં ટ્રાન્સફર કરવામાં આવે છે અને લગભગ 10 મિલી આલ્કોહોલમાં ગરમ કરીને ઓગળી જાય છે. ગરમ દ્રાવણને ચૂસવામાં આવે છે અને ફિલ્ટર પરનો અવક્ષેપ ગરમ આલ્કોહોલથી ધોવાઇ જાય છે. તેલના કોઈપણ ટીપાંને દૂર કરવા માટે આલ્કોહોલથી ભેજવાળા ફિલ્ટર દ્વારા ફિલ્ટર કરો. ફિલ્ટ્રેટને પોર્સેલેઇન કપમાં સ્થાનાંતરિત કરવામાં આવે છે અને મોટા ભાગના આલ્કોહોલને દૂર કરવા માટે ગરમ રેતીના સ્નાનમાં ગરમ કરવામાં આવે છે. કપમાં મિશ્રણને 30 મિનિટ સુધી રહેવા માટે છોડી દેવામાં આવે છે. છૂટા પડેલા રંગહીન અથવા આછા પીળા સ્ફટિકોને ચુસવામાં આવે છે અને ફિલ્ટર પેપરની શીટ વચ્ચે હવામાં સૂકવવામાં આવે છે.
1.4.2 સંશ્લેષણમાં વપરાતા પદાર્થોના ભૌતિક ગુણધર્મો
કોષ્ટક 1
સંશ્લેષણમાં વપરાતા પદાર્થોના ભૌતિક ગુણધર્મો
| નામ | ફોર્મ્યુલા | દેખાવ | T pl, 0 C | ટી બોઇલ, 0 સે | દ્રાવ્યતા |
|
| પાણીમાં | એક અલગ માં |
|||||
| ફેનોલ્ફથાલિન | C 20 H 14 O 4 | રંગહીન અથવા રેતાળ રંગની હીરાના આકારની સોય, ગંધહીન, હવામાં સ્થિર નથી | 261 | આગ- એવું જણાય છે કે | સહેજ દ્રાવ્ય (100 ગ્રામ પાણીમાં 0.0002 ગ્રામ) | ઇથેનોલમાં સારું, ડાયથાઇલ ઇથરમાં મધ્યમ, આલ્કલાઇન દ્રાવણમાં પણ દ્રાવ્ય. |
| ફિનોલ | C 6 H 5 OH | રંગહીન અથવા ગુલાબી રોમ્બિક સોય | 41-43 | 182 | ઠંડીમાં - મધ્યમ ગરમ - સારું | ઇથેનોલ, ઇથર, ક્લોરોફોર્મ, ગ્લિસરીન, કાર્બન ડાયસલ્ફાઇડમાં સારું |
| પ્થાલિક એનહાઇડ્રાઇડ | C 8 H 4 O 3 | સફેદ હીરાની સોય | 130,8 | વોઝગ 284.3 | ખરાબ રીતે | ઇથેનોલ, ઈથર, ક્લોરોફોર્મમાં |
| સલ્ફ્યુરિક એસિડ | H2SO4 | રંગહીન, ચીકણું પ્રવાહી, એક અપ્રિય ગંધ સાથે | 10,37 | 330 | | પ્રતિક્રિયા આપે છે |
| સોડિયમ હાઇડ્રોક્સાઇડ | NaOH | સફેદ ફેલાવો, રોમ્બિક સ્ફટિકો | 320 | 1378 | ગરમીના પ્રકાશન સાથે દ્રાવ્ય | આલ્કોહોલમાં ગ્લિસરીન, ફિનોલ, ઈથર, એસીટોન |
| એસિટિક એસિડ | CH 3 COOH | તીવ્ર અપ્રિય ગંધ સાથે રંગહીન પ્રવાહી | 16,6 | 118,1 | | ઇથેનોલમાં, ઈથર |
| હાઇડ્રોક્લોરિક એસિડ | HCI | પીળો પ્રવાહી, હવામાં ધૂમ્રપાન કરે છે, એક અપ્રિય ગંધ સાથે | -15,35 | - | દંડ | દારૂ માં |
1.4.3 વરાળ નિસ્યંદન તકનીક
કારણ કે સંશ્લેષણ દરમિયાન વરાળ નિસ્યંદનનો ઉપયોગ કરીને બિનપ્રક્રિયા વિનાના ફિનોલને નિસ્યંદન કરવું જરૂરી રહેશે, તેના અમલીકરણ માટેની પદ્ધતિને ધ્યાનમાં લેવી જરૂરી છે.
નિસ્યંદન એ ઉપકરણમાં હાથ ધરવામાં આવે છે જેમાં સેફ્ટી ટ્યુબ સાથે સ્ટીમ જનરેટર, ક્લેસેન ડિસ્ટિલેશન ફ્લાસ્ક (250 મિલી), થર્મોમીટર, ડાયરેક્ટ લિબિગ કન્ડેન્સર, એલોન્જ અને રીસીવર હોય છે. સ્ટીમ જનરેટર અને નિસ્યંદન ફ્લાસ્ક એક શાખાઓમાંથી એક સાથે ટી દ્વારા જોડાયેલા હોય છે જેમાં હોફમેન ક્લેમ્પ સાથેની રબરની ટ્યુબ મૂકવામાં આવે છે અને તેને રેતીના સ્નાનમાં ગરમ કરવામાં આવે છે.
નિસ્યંદન (નિસ્યંદન) ની પ્રગતિ: ગરમ ઓગળવું એ નિસ્યંદન ફ્લાસ્કમાં 100 મિલી ઉકળતા પાણી સાથે મૂકવામાં આવે છે. સ્ટીમ જનરેટર અને નિસ્યંદન ફ્લાસ્કને ગરમ કરીને, બિનપ્રક્રિયા વિનાનું ફિનોલ ધરાવતું નિસ્યંદન એકત્રિત કરવામાં આવે છે. તેની હાજરી નિસ્યંદનની ટર્બિડિટી દ્વારા સૂચવવામાં આવે છે. એકવાર વાદળછાયું નિસ્યંદન બંધ થઈ જાય, એટલે કે જ્યાં સુધી સ્પષ્ટ નિસ્યંદન ન દેખાય ત્યાં સુધી નિસ્યંદન બંધ કરવામાં આવે છે. 
ફિગ.1વરાળ નિસ્યંદન ઉપકરણ
1- સલામતી ટ્યુબ; 2 - સ્ટીમ સપ્લાય ટ્યુબ; 3 - ટી; 4 - ક્લેમ્બ; 5 - વરાળ જનરેટર; 6 - ક્લેસેન ફ્લાસ્ક; 7 - થર્મોમીટર; 8 - લીબિગ રેફ્રિજરેટર; 9 - એલોન્જ; 10 - રીસીવર; 11 - હીટિંગ મેન્ટલ; 12 - ટાઇલ.
1.4.4 ગરમ આલ્કોહોલમાંથી પુનઃસ્થાપનની પદ્ધતિ
પ્રાયોગિક રીતે, પુનઃસ્થાપન નીચે પ્રમાણે હાથ ધરવામાં આવે છે: પદાર્થને રાઉન્ડ-બોટમ ફ્લાસ્કમાં મૂકવામાં આવે છે અને તેમાં થોડું દ્રાવક ઉમેરવામાં આવે છે. હોટપ્લેટ પર ગરમ પાણીના સ્નાનમાં મિશ્રણને રિફ્લક્સ હેઠળ ગરમ કરવામાં આવે છે.
મોટાભાગના પ્રવાહી વધુ ગરમ થાય છે અને તેથી તે હિંસક રીતે ઉકળે છે. આને અવગણવા માટે, ગરમી શરૂ થાય તે પહેલાં ફ્લાસ્કમાં ઉકળતા પાણી ઉમેરવામાં આવે છે.રિફ્લક્સ કન્ડેન્સર દ્વારા, દ્રાવક ધીમે ધીમે નાના ભાગોમાં ઉમેરવામાં આવે છે જ્યાં સુધી પદાર્થ સંપૂર્ણપણે ઓગળી ન જાય.
પદાર્થ સંપૂર્ણપણે ઓગળી જાય પછી, ગરમ કરવાનું બંધ કરવામાં આવે છે અને સ્નાનમાં પાણી સાથે મિશ્રણને ઠંડું કરવાની મંજૂરી આપવામાં આવે છે. અવક્ષેપિત પદાર્થને ફિલ્ટર કરવામાં આવે છે.
મોટા ભાગના કિસ્સાઓમાં, બે-પગલાની પુનઃસ્થાપન છે વિશ્વસનીય રીતેપદાર્થોનું શુદ્ધિકરણ. 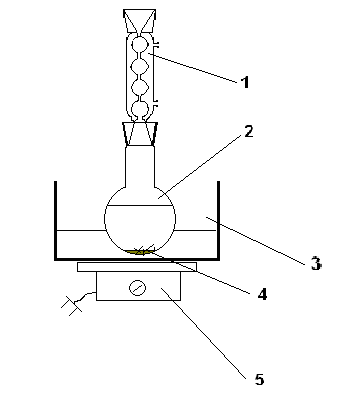
ફિગ.2પુનઃસ્થાપન ઉપકરણ
1- રિફ્લક્સ રેફ્રિજરેટર; 2 – ગોળ તળિયાવાળું ફ્લાસ્ક; 3 - પાણી સ્નાન; 4 - ઉકળતા પોટ્સ; 5 - ટાઇલ.
1.5 સંશ્લેષણ કરતી વખતે સલામતીની સાવચેતીઓ
1.5.1 સંકેન્દ્રિત એસિડ સાથે કામ કરતી વખતે મુખ્ય જોખમો
1. જો તે ત્વચાના સંપર્કમાં આવે તો મજબૂત અકાર્બનિક એસિડ રાસાયણિક બળે છે.ત્વચાના સંપર્કમાં આવતા સંકેન્દ્રિત એસિડના કારણે થતા રાસાયણિક બર્ન માટે, બળેલા વિસ્તારને પાણીના મજબૂત પ્રવાહથી અને પછી સોડિયમ બાયકાર્બોનેટના 1% સોલ્યુશન (પ્રથમ એઇડ કીટમાં જોવા મળે છે) સાથે ધોવા. જો એસિડ તમારી આંખોમાં પ્રવેશ કરે છે, તો તેને તરત જ સોડિયમ બાયકાર્બોનેટના 1% સોલ્યુશન અને ઓરડાના તાપમાને નિસ્યંદિત પાણીથી ધોવા જોઈએ. ડૉક્ટરની મદદ લો.
2. એ હકીકતને કારણે કે કેન્દ્રિત હાઇડ્રોક્લોરિક એસિડ હાઇડ્રોજન ક્લોરાઇડ સાથે વરાળ કરે છે, તેની સાથે સારી રીતે કાર્યરત ડ્રાફ્ટ અને નીચા ડ્રાફ્ટ પડદા હેઠળ કામ કરવું જરૂરી છે. જો તમને હાઇડ્રોજન ક્લોરાઇડ વરાળ દ્વારા ઝેર આપવામાં આવે છે, તો તમારે તરત જ તાજી હવામાં જવું જોઈએ.
3. ગેસ ઉત્ક્રાંતિ બંધ ન થાય ત્યાં સુધી સ્પિલ્ડ એસિડ રેતીથી ઢંકાયેલું હોવું જોઈએ અને ઘન સોડિયમ કાર્બોનેટથી તટસ્થ થવું જોઈએ. સંપૂર્ણ નિષ્ક્રિયકરણ પછી, નળના મોટા જથ્થાના પાણીથી રેતીને કોગળા કરો, ધોવાની સંપૂર્ણતા તપાસો (Cl માટે ટેસ્ટ લો - AgNO 3 નો ઉપયોગ કરીને) અને, તેને સૂકવવાના કેબિનેટમાં સૂક્યા પછી, તેને રેતી સાથેના બૉક્સમાં પાછું આપો.
1.5.2 વરાળ નિસ્યંદન દરમિયાન મુખ્ય જોખમો
નિસ્યંદન દરમિયાન મુખ્ય જોખમો ઇલેક્ટ્રિક હીટિંગ ઉપકરણો (ઇલેક્ટ્રિક સ્ટોવ, મેન્ટલ હીટર) ના ઉપયોગ સાથે સંકળાયેલા છે.1. દોરી (તમે ચીંથરાથી લપેટેલી દોરી સાથે સ્ટોવનો ઉપયોગ કરી શકતા નથી), પ્લગ અને ઇલેક્ટ્રિક સ્ટોવના શરીરને દેખીતું નુકસાન ન હોવું જોઈએ.
2. તમારા હાથથી ગરમી-ઉત્સર્જન કરતી સપાટીનું તાપમાન તપાસવું અસ્વીકાર્ય છે.
3. તમારે પ્લગ દાખલ કરીને અને દૂર કરીને, એક હાથે સોકેટ અને બીજા હાથે પ્લગ પકડીને નેટવર્કમાંથી ઇલેક્ટ્રિક સ્ટોવને ચાલુ અને બંધ કરવો જોઈએ. હીટિંગને સમાયોજિત કરવા માટે સ્વીચનો ઉપયોગ કરો.
4. થર્મલ બર્નના કિસ્સામાં, પોટેશિયમ પરમેંગેનેટના 0.5% સોલ્યુશન સાથે બળી ગયેલી જગ્યા પર લાંબા ગાળાના પલાળીને લાગુ કરવું જરૂરી છે, પછી તેને જંતુરહિત પટ્ટીથી ઢાંકી દો અને ડૉક્ટરની સલાહ લો. 3 જી અને 4 થી ડિગ્રી બર્ન માટે, તરત જ જંતુરહિત પાટો લાગુ કરો અને ડૉક્ટરની સલાહ લો.
1.5.3 ગરમ આલ્કોહોલથી પુનઃસ્થાપન દરમિયાન મુખ્ય જોખમો
1. ઉમેરવામાં આવેલા આલ્કોહોલનું કુલ પ્રમાણ 200 મિલીથી વધુ ન હોવું જોઈએ અને ફ્લાસ્કના જથ્થાના 1/3 કરતા વધારે ન હોવું જોઈએ.2.પાણીના સ્નાનનું કદ હોવું જોઈએ મોટા કદટાઇલની ગરમી ફેલાવતી સપાટી.
1.5.4 સંશ્લેષણમાં વપરાતા પદાર્થો સાથે કામ કરવાની સુવિધાઓ
બહુમતી રાસાયણિક પદાર્થોએક અથવા બીજી ડિગ્રી માટે ઝેરી. તેમની સાથે કામ કરતી વખતે સાવચેતીઓનો હેતુ મોં, ફેફસાં અને ત્વચા દ્વારા શરીરમાં આ પદાર્થોના પ્રવેશને રોકવાનો છે.સંશ્લેષણ દરમિયાન, સંભવિત જોખમી પદાર્થોનો ઉપયોગ કરવામાં આવશે: ફિનોલ, સલ્ફ્યુરિક એસિડ, એસિટિક એસિડ અને હાઇડ્રોક્લોરિક એસિડ.
ફિનોલ એ રંગહીન (ગુલાબી), સ્ફટિકીય પદાર્થ છે જેમાં લાક્ષણિક ગંધ છે. કાર્યક્ષેત્રની હવામાં મહત્તમ અનુમતિપાત્ર સાંદ્રતા 0.3 mg/m 3 છે. સંકટ વર્ગ બે. ફિનોલ સાથેનું તમામ કાર્ય ફ્યુમ હૂડમાં હાથ ધરવામાં આવે છે. ઝેરી અસર: ચેતા ઝેર, એક મજબૂત સ્થાનિક બળતરા અને સફાઈકારક અસર ધરાવે છે, જે સામાન્ય ગંભીર ઝેરનું કારણ બને છે. સંભવિત મૃત્યુ. પરિસ્થિતિ એ હકીકત દ્વારા જટિલ છે કે પદાર્થ સ્થાનિક એનેસ્થેસિયાનું કારણ બને છે. પ્રાથમિક સારવાર: જો તે કપડાં પર ચડી જાય, તો તેને તરત જ બદલો, જો તે ત્વચા પર આવી જાય, તો તેને ધોઈ નાખો. વનસ્પતિ તેલઅથવા ઇથેનોલ 10 - 40% ના સમૂહ અપૂર્ણાંક સાથેનો ઉકેલ.
હાઇડ્રોક્લોરિક એસિડ બીજા જોખમી વર્ગનું છે (કામના વિસ્તારની હવામાં મહત્તમ સાંદ્રતા HCl ની દ્રષ્ટિએ 5 mg/m 3 છે); સંકેન્દ્રિત હાઇડ્રોક્લોરિક એસિડ સાથેના તમામ કાર્ય પણ ફ્યુમ હૂડમાં હાથ ધરવામાં આવશ્યક છે કારણ કે તે હાઇડ્રોજન ક્લોરાઇડ વરાળનું ઉત્સર્જન કરે છે. જો તમને હાઇડ્રોજન ક્લોરાઇડ વરાળ દ્વારા ઝેર આપવામાં આવ્યું હોય, તો તમારે તાજી હવામાં જવું જોઈએ; અન્ય જોખમો ઉપર સૂચિબદ્ધ છે.
સલ્ફ્યુરિક એસિડ ( = 1.84 g/cm 3) – MPC рз = 1 mg/m 3. સંકટ વર્ગ બે. લગભગ 5 સેકંડ પછી, ટીશ્યુનું જોરશોરથી નિર્જલીકરણ શરૂ થાય છે જ્યાં ડ્રોપ દાખલ થાય છે. પ્રથમ સહાય: ત્વચા ધોવા વહેતુ પાણીતટસ્થીકરણ દ્વારા અનુસરવામાં આવે છે.
એસિટિક એસિડ - MPC рз = 5 mg/m3. સંકટ વર્ગ 37. વરાળ ઉપલા શ્વસન માર્ગમાં બળતરા કરે છે; પદાર્થના સામૂહિક અપૂર્ણાંક સાથેના ઉકેલો ત્વચા પર 30% થી વધુ અને આંખો પર 2% થી વધુ કાર્ય કરે છે. પ્રાથમિક સારવાર: (જુઓ સલ્ફ્યુરિક એસિડ અને હાઇડ્રોક્લોરિક એસિડ).
1.6 દ્રાવકની લાક્ષણિકતાઓ
દ્રાવકની લાક્ષણિકતાઓમાં ડાઇલેક્ટ્રિક સતત વિશેષ સ્થાન ધરાવે છે. અન્ય માપદંડો પર બાદનો ફાયદો સોલ્વેશનના ઇલેક્ટ્રોસ્ટેટિક મોડલ્સની સરળતાને કારણે છે, અને તેથી ડાઇલેક્ટ્રિક કોન્સ્ટન્ટ દ્રાવક ધ્રુવીયતાનું એક ઉપયોગી માપ બની ગયું છે. આ સંદર્ભમાં, તે સ્પષ્ટપણે જાણવું મહત્વપૂર્ણ છે કે દ્રાવકની મેક્રોસ્કોપિક અભેદ્યતા, જેને સંબંધિત ડાઇલેક્ટ્રિક સ્થિરાંક પણ કહેવાય છે, તે બરાબર શું પ્રતિબિંબિત કરે છે:
આર = 0 /
0 - શૂન્યાવકાશનો ડાઇલેક્ટ્રિક સ્થિરાંક.
કેપેસિટરની બે ચાર્જ પ્લેટ વચ્ચે દ્રાવક મૂકીને ડાઇલેક્ટ્રિક સ્થિરાંક નક્કી કરવામાં આવે છે. દ્રાવકની હાજરીમાં, તાણ ઇલેક્ટ્રિક ક્ષેત્રશૂન્યાવકાશમાં માપવામાં આવતા તણાવ E 0 ની સરખામણીમાં પ્લેટો વચ્ચે E ઘટે છે, અને ગુણોત્તર E 0 / દ્રાવકના ડાઇલેક્ટ્રિક સ્થિરાંકને રજૂ કરે છે. જો દ્રાવક પરમાણુઓ પાસે તેમની પોતાની કાયમી દ્વિધ્રુવી ક્ષણ નથી, તો પછી બાહ્ય ક્ષેત્રના પ્રભાવ હેઠળ ઇન્ટ્રામોલેક્યુલર ચાર્જ અલગ થઈ જાય છે, દ્વિધ્રુવને પ્રેરિત કરે છે.
IN ઇલેક્ટ્રિક ક્ષેત્રકાયમી અથવા પ્રેરિત દ્વિધ્રુવ સાથેના પરમાણુઓ ચોક્કસ રીતે લક્ષી હોય છે; આ ઘટનાને ધ્રુવીકરણ કહેવામાં આવે છે. ધ્રુવીકરણની ડિગ્રી જેટલી વધારે છે, ઇલેક્ટ્રિક ક્ષેત્રની શક્તિમાં ઘટાડો વધારે છે. તેથી, ડાઇલેક્ટ્રિક સ્થિરાંક દ્રાવકની ચાર્જને અલગ કરવાની અને તેના પોતાના દ્વિધ્રુવને દિશામાન કરવાની ક્ષમતા સાથે સીધો સંબંધ ધરાવે છે.
1.6.1 ભૌતિક ગુણધર્મો દ્વારા દ્રાવકનું વર્ગીકરણ.
સોલ્યુશનનો ડાઇલેક્ટ્રિક કોન્સ્ટન્ટ (DP) એ સૌથી વધુ હોય તેવા પરિબળોમાંનું એક સૌથી મહત્વપૂર્ણ પરિબળ છે મજબૂત પ્રભાવસોલ્યુશનમાં થતી પ્રક્રિયાની લાક્ષણિકતાઓ પર.
વ્યક્તિગત દ્રાવકોના ડીપી મૂલ્યો ખૂબ જ નોંધપાત્ર મર્યાદામાં બદલાય છે - -1.8 (આલ્કેન) થી 170-180 (એલિફેટિક કાર્બોક્સિલિક એસિડના એન-આલ્કીલામાઇડ્સ). ડીપી અનુસાર સોલવન્ટના ગ્રેડેશન અંતર્ગત પરિભાષા સંપૂર્ણપણે સ્પષ્ટ અને સુસંગત નથી. ઉચ્ચ ડીપીવાળા દ્રાવકને ધ્રુવીય કહેવામાં આવે છે અને ઉચ્ચ પણ ધ્રુવીય, જો કે, સખત રીતે કહીએ તો, "ધ્રુવીય" શબ્દ દ્રાવક પરમાણુના દ્વિધ્રુવીય ક્ષણ µ નો સંદર્ભ આપે છે, એટલે કે તે મેક્રોને નહીં પરંતુ દ્રાવકની માઇક્રોપ્રોપર્ટીનું લક્ષણ આપે છે.
જો કે, µ સાથે ને જોડતા સિદ્ધાંત પરથી નીચે મુજબ છે, સામાન્ય કિસ્સામાં આ જથ્થાઓમાં સહાનુભૂતિપૂર્ણ ફેરફાર જોવા મળે છે. વધુમાં, દ્રાવકોને તેમના પરમાણુઓમાં દ્વિધ્રુવીય ક્ષણની હાજરી અથવા ગેરહાજરી દ્વારા દર્શાવવા માટે, પરિભાષા "દ્વિધ્રુવ" (µ0) રજૂ કરવામાં આવી હતી. અને “એપોલર” (µ = 0) દ્રાવક.
નિમ્ન-ધ્રુવીયતામાં એવા દ્રાવકોનો સમાવેશ થાય છે જેનું ડીપી = l.8h12 રેન્જમાં હોય, મધ્યમ-ધ્રુવીય - = 12h50 સાથે, ઉચ્ચ-ધ્રુવીયતા - > 50 ની રેન્જમાં હોય. આ વિભાજનની સાપેક્ષતા માત્ર એટલી જ નથી અને એટલી બધી નથી. આ બદલે મનસ્વી રીતે પસંદ કરેલ અંતરાલો, પણ વધુ નોંધપાત્ર સંજોગોમાં.
DP અને વ્યક્તિગત પ્રવાહીના દ્વિધ્રુવીય ક્ષણ વચ્ચે જોડાણ હોવા છતાં, જે સિદ્ધાંત દ્વારા તદ્દન સ્પષ્ટ રીતે સ્થાપિત થયેલ છે, વ્યક્તિએ અને µ ની માત્રા વચ્ચે સ્પષ્ટપણે અસ્પષ્ટ સમાનતા સામે સાવધાની રાખવી જોઈએ. . હકીકત એ છે કે દ્વિધ્રુવોનું એન્ટિસમાંતર (પરંતુ સાંકળ નહીં) જોડાણ એક પરમાણુના દ્વિધ્રુવીય ક્ષણની તુલનામાં સહયોગીઓના દ્વિધ્રુવ ક્ષણમાં ઘટાડો તરફ દોરી જાય છે અને પરિણામે, પ્રવાહીના ડીપીમાં ઘટાડો થાય છે. આ કારણે પ્રમાણમાં મોટા દ્વિધ્રુવીય ક્ષણ સાથેના પરમાણુઓ દ્વારા રચાયેલા પ્રવાહીનો DP ઘણો ઓછો હોઈ શકે છે.
દ્રાવકની ધ્રુવીયતા તેની માળખાકીય સુવિધાઓથી નોંધપાત્ર રીતે પ્રભાવિત થાય છે. સ્ટ્રક્ચર્ડ સોલવન્ટ્સ, એક નિયમ તરીકે, ઉચ્ચ ડીપી ધરાવે છે.
ડાઇલેક્ટ્રિક કોન્સ્ટન્ટ, હોમોમોલેક્યુલર રાસાયણિક બોન્ડની રચના સાથે, વ્યક્તિગત પ્રવાહીના ગુણધર્મોને નિર્ધારિત કરતા સૌથી મહત્વપૂર્ણ પરિબળોમાંનું એક છે, જે આંતરપરમાણુ ક્રિયાપ્રતિક્રિયાની ઊર્જા પર આધારિત છે. બાદમાં પ્રતિક્રિયાશીલ ક્રિયાપ્રતિક્રિયા દ્વારા નિર્ધારિત કરવામાં આવે છે, જેની ઊર્જા સ્થિર ડીપી () પર આધાર રાખે છે, ડીપી અનંત લાંબી તરંગલંબાઇ ( ) પર એક્સ્ટ્રાપોલેટેડ અને તેની બરાબર લેવામાં આવે છે? 1.1 n D, તેમજ દ્વિધ્રુવીય ક્ષણ µ અને દાઢ વોલ્યુમ?:
E R = 
સંખ્યાબંધ દ્રાવકોના દ્વિધ્રુવીય અણુઓની પ્રતિક્રિયાશીલ ક્રિયાપ્રતિક્રિયાના ઊર્જા મૂલ્યો કોષ્ટક 1 માં આપવામાં આવ્યા છે.
M.I. Shakhparonov ભારપૂર્વક જણાવે છે તેમ, ધ્રુવીય અણુઓનું પ્રતિક્રિયાશીલ ક્ષેત્ર રાસાયણિક બંધારણ (હોમોમોલેક્યુલર એસોસિએટ્સ) ની રચના તરફ દોરી જતું નથી, જેનું અસ્તિત્વ રાસાયણિક ક્રિયાપ્રતિક્રિયાઓ દ્વારા નક્કી કરવામાં આવે છે. પ્રતિક્રિયાશીલ ક્ષેત્રની વધતી ઊર્જા સાથે બાદની સ્થિરતા ઘટે છે.
પ્રતિક્રિયાશીલ ક્ષેત્ર ઊર્જા દ્રાવકના અસંખ્ય ભૌતિક ગુણધર્મોને સમજાવે છે, અને તેથી તે તેમના મૂલ્ય અનુસાર દ્રાવકનું વર્ગીકરણ કરવા માટે ઉપયોગી થઈ શકે છે. - એર .
દેખીતી રીતે, બધા દ્રાવક કે જેના પરમાણુઓમાં દ્વિધ્રુવીય ક્ષણ નથી હોતી તે બિન-પ્રતિક્રિયાશીલ વર્ગની રચના કરશે. પ્રવાહી શ્રેણીમાં પ્રતિક્રિયાશીલ ક્ષેત્ર ઊર્જા સાથે સોલવન્ટ - એર = 0h5 kJ·mol -1 એ નીચા-પ્રતિક્રિયાવાળા વર્ગની રચના કરે છે, શ્રેણીમાં - Er =5h15 kJ mol-1 - મધ્યમ-પ્રતિક્રિયાશીલ અને અંતે, દ્રાવક – E R 25 kJ mol -1 વર્ગની રચના કરે છે અત્યંત પ્રતિક્રિયાશીલ દ્રાવક.
નિયમ પ્રમાણે, અત્યંત પ્રતિક્રિયાશીલ પ્રવાહી નોનઈલેક્ટ્રોલાઈટ્સ અને ઈલેક્ટ્રોલાઈટ્સ બંનેને સારી રીતે ઓગાળી નાખે છે, અને બાદમાં સોલવન્ટના અન્ય વર્ગો (આ વર્ગીકરણ પ્રણાલી અનુસાર) ની સરખામણીમાં તેમાં વધુ સારી રીતે અલગ પડે છે. આ હકીકત દ્વારા સમજાવવામાં આવે છે કે અત્યંત પ્રતિક્રિયાશીલ દ્રાવક ડીપી અને દ્વિધ્રુવીય ક્ષણના ઉચ્ચ મૂલ્યોને જોડે છે.
કોષ્ટક 2
298.15 K પર કેટલાક દ્રાવકની પ્રતિક્રિયાશીલ ક્ષેત્ર ઊર્જા.
| દ્રાવક | -E R , kJ mol -1 | દ્રાવક | -E R , kJ mol -1 |
| એનિલિન | 2,9 | મિથાઈલ એથિલ કેટોન | 3,4 |
| એસીટોન | 9,1 | ફોર્મિક એસિડ | 5,2 |
| એસેટોનિટ્રિલ | 20,9 | નાઇટ્રોબેન્ઝીન | 17,1 |
| બ્યુટાઇલ આલ્કોહોલ | 2,9 | નાઈટ્રોમિથેન | 17,5 |
| પાણી | 18,6 | પિરિડીન | 5,7 |
| હેક્સેન-1 | 0,15 | પ્રોપીલીન કાર્બોનેટ | 43,8 |
| એન,એન-ડાઇમેથાઇલસેટામાઇડ | 15,8 | પ્રોપીલ આલ્કોહોલ | 3,6 |
| ડાઇમેથાઇલ સલ્ફોક્સાઇડ | 6,4 | ટોલ્યુએન | 0,05 |
| ડાયમેથાઈલફોર્મામાઈડ | 19,5 | એસિટિક એસિડ | 3,7 |
| ડાયોક્સેન | 0,07 | ટેટ્રાહાઇડ્રોફ્યુરન | 2,9 |
| 1,2 - ડિક્લોરોઇથેન | 4,2 | ક્લોરોબેન્ઝીન | 1,8 |
| o - ઝાયલીન | 0,12 | ઇથાઇલ એસિટેટ | 2,45 |
| n - ઝાયલીન | 0,05 | ઇથિલિન ગ્લાયકોલ | 8,9 |
| એન-મેથિલેસેટામાઇડ | 24,1 | ઇથેનોલ | 4,7 |
| મિથાઈલ ફોર્મેટ | 4,0 |
સ્નિગ્ધતા દ્વારા (વધુ સ્પષ્ટ રીતે, સ્નિગ્ધતા ગુણાંક દ્વારા ) પ્રવાહીને 10 -2 Pa s સાથે ઓછી સ્નિગ્ધતામાં વિભાજિત કરવામાં આવે છે.
ચોક્કસ વિદ્યુત વાહકતાના આધારે પ્રવાહીને સાથે "વાહક" પ્રવાહીમાં વિભાજિત કરવામાં આવે છે. લગભગ 10 2 - 10 -1 cm·m -1 અને ઉચ્ચ; "સાધારણ વાહક" – સાથે લગભગ 10 -1 - 10 -4 અને સાથે 10 -4 cm·m -1 ને "નૉન-કન્ડક્ટિંગ" તરીકે વર્ગીકૃત કરવામાં આવે છે.
ઉકળતા બિંદુઓ દ્વારા દ્રાવકનું વર્ગીકરણ પણ ઉલ્લેખિત છે, જેમાં દ્રાવકોને ઓછા ઉકળતા (150 0 સે) માં વિભાજિત કરવામાં આવે છે.
દ્રાવકોને તેમની બાષ્પીભવન કરવાની ક્ષમતા અનુસાર વર્ગીકૃત કરવા માટે, બાષ્પીભવનની ગરમી પર આધારિત સાપેક્ષ ધોરણની દરખાસ્ત કરવામાં આવી છે. તેથી, અત્યંત અસ્થિર (સાપેક્ષ અસ્થિરતા 35) દ્રાવકોને અલગ પાડવામાં આવે છે. જો આપણે બાષ્પીભવનની ગરમી પર સીધું ધ્યાન કેન્દ્રિત કરીએ, તો અત્યંત અસ્થિર દ્રાવક એવા હોવા જોઈએ જે બાષ્પીભવનની ગરમી દ્વારા દર્શાવવામાં આવે છે H બાષ્પીભવન કોષ્ટક 3
ડાઇલેક્ટ્રિક સ્થિરાંક દ્વારા દ્રાવકનું વર્ગીકરણ
| અત્યંત ધ્રુવીય |
|||
| દ્રાવક |  આર આર | દ્રાવક | આર |
| પાણી | 78,30 | ડીએમએફ | 36,71 |
| ઇથિલિન ગ્લાયકોલ | 37,7 | બેન્ઝોનિટ્રિલ | 26,20 |
| મિથેનોલ | 32,66 | નાઇટ્રોબેન્ઝીન | 34,78 |
| ડીએમએસઓ | 46,45 | ગ્લિસરોલ | 51,7 |
| નબળું ધ્રુવીય |
|||
| THF | 7,58 | એસિટિક એનહાઇડ્રાઇડ | 20,7 |
| ડાયથાઈલ ઈથર | 4,20 | બ્યુટેનોન - 2 | 18,51 |
| એસીટોન | 20,70 | પેન્ટેનોન - 2 | 15,38 |
| ઇથેનોલ | 24,55 | પિરિડીન | 12,91 |
| એસિટિક એસિડ | 6,17 | મિથાઈલ એસીટેટ | 6,68 |
| પ્રોપેનોલ - 1 | 20,45 | સાયક્લોહેક્સોનોન | 16,10 |
| બ્યુટેનોલ - 1 | 17,51 | ક્વિનાલિન | 8,95 |
| આઇસોઆમિલ આલ્કોહોલ | 15,19 | ક્લોરોફોર્મ | 4,81 |
| એનિલિન | 6,71 | એમીલ આલ્કોહોલ | 13,9 |
| નોન-પોલર |
|||
| 1,4 - ડાયોક્સેન | 2,21 | સાયક્લોહેક્સેન | 2,02 |
| ટ્રાઇક્લોરેથિલિન | 3,42 | એન - પેન્ટેન | 1,84 |
| બેન્ઝીન | 2,27 | કાર્બન ડિસલ્ફાઇડ | 2,64 |
| ટોલ્યુએન | 2,38 | ડાયથિલામાઇન | 3,78 |
| કાર્બન ટેટ્રાક્લોરાઇડ | 2,23 | ડાયથાઈલ કાર્બોનેટ | 2,82 |
| ટ્રાયથિલામાઇન | 2,42 | ||
| n - હેપ્ટેન | 1,92 | ||
| n - હેક્સેન | 1,88 | ||
1.6.2 તેમના રાસાયણિક ગુણધર્મોના આધારે સોલવન્ટ વર્ગીકરણ પ્રણાલી
રાસાયણિક લાક્ષણિકતાઓ દ્વારા દ્રાવકને વર્ગીકૃત કરવા માટેની મોટાભાગની પ્રણાલીઓ, સ્પષ્ટ અથવા ગર્ભિત રીતે, તેમના એસિડ-બેઝ ગુણધર્મોને ધ્યાનમાં લે છે. તેથી સૌથી વધુ સામાન્ય સિસ્ટમદ્રાવકનું વર્ગીકરણ તેમના બે વ્યાપક વર્ગોમાં વિભાજન માટે પ્રદાન કરે છે - દાતા
(મૂળભૂત) અને સ્વીકારનાર (એસિડિક), જેની વ્યાખ્યા, દેખીતી રીતે, ઉદાસીન દ્રાવકના અન્ય વર્ગની ઓળખ પૂર્વનિર્ધારિત કરે છે. દરેક વિશિષ્ટ દ્રાવકને આ વર્ગોમાંના એક તરીકે વર્ગીકૃત કરવું પરંપરાગત છે, જો માત્ર એટલા માટે કે દ્રાવક પરમાણુની ભાગીદાર પાસેથી ઇલેક્ટ્રોન જોડી દાન અથવા સ્વીકારવાની ક્ષમતા દ્રાવક અને ઓગળેલા સંયોજન બંનેના ગુણધર્મો પર આધારિત છે. તેથી જ આ વર્ગીકરણ પ્રતિક્રિયાઓ અથવા ઉકેલની પ્રક્રિયાઓમાં દ્રાવકના લાક્ષણિક વર્તન માટે પ્રદાન કરે છે.
દાતા દ્રાવકનું એક સામાન્ય લક્ષણ ઇલેક્ટ્રોનની ઉણપ દ્વારા વર્ગીકૃત થયેલ કણો તરીકે કેશનનું પ્રેફરન્શિયલ સોલ્વેશન છે. તેવી જ રીતે, સ્વીકારનાર સોલવન્ટ્સ પ્રાધાન્યરૂપે વધારાના ઇલેક્ટ્રોન સાથે પ્રજાતિઓ તરીકે આયનોને ઉકેલે છે.
દાતા દ્રાવકની વિવિધતા પ્રમાણમાં મોટી સંખ્યામાં એવા તત્વો દ્વારા નક્કી કરવામાં આવે છે કે જેના પરમાણુ ઇલેક્ટ્રોન જોડીના દાતા તરીકે કાર્ય કરી શકે છે અને આ તત્વોના રાસાયણિક સંયોજનોની વિવિધતા. દ્રાવકના આ વર્ગના પ્રતિનિધિઓને તેથી એન-બેઝ (એમાઈન્સ અથવા વિવિધ પ્રકારના એમાઈડ્સ), 0-બેઝ (ઈથર્સ અને એસ્ટર્સ, આલ્કોહોલ, કીટોન્સ, ઓછી વાર એલ્ડીહાઈડ), એસ-બેઝ (થિયોથર્સ, થિયોઆલ્કોહોલ્સ, સલ્ફોક્સાઈડ્સ) માં વિભાજિત કરવામાં આવે છે. પી-બેઝ (ટ્રાયલકીલ-, ટ્રાયરીલ- અથવા આલ્કીલેરીલફોસ્ફાઈન્સ), વગેરે.
સ્વીકારનાર દ્રાવકને પ્રોટિકમાં વિભાજિત કરવામાં આવે છે અને એપ્રોટિક.
પ્રોટોલિટીક સંતુલનમાં ભાગ લેવા સક્ષમ સોલવન્ટ્સ, તેઓ જે કાર્ય પ્રદર્શિત કરે છે તેના આધારે, ઘણીવાર પ્રોટોફિલિક (મૂળભૂત) અને પ્રોટોજેનિક કહેવાય છે. (એસિડિક). સોલવન્ટ કે જે બંને કાર્યોને સમાન રીતે સરળતાથી પ્રદર્શિત કરે છે (આલ્કોહોલ, કીટોન્સ) તેને એમ્ફિપ્રોટિક કહેવામાં આવે છે.
ઘણા દ્રાવક પરમાણુઓ હાઇડ્રોજન (H-) બોન્ડની રચના દ્વારા ઉકેલમાં ભાગ લે છે. આને અનુરૂપ, H-બોન્ડ બનાવવાની તેમની ક્ષમતા અનુસાર દ્રાવકનું વર્ગીકરણ પ્રસ્તાવિત કરવામાં આવ્યું છે.
આ વર્ગીકરણ પ્રણાલીમાં પ્રથમ વર્ગમાં પ્રવાહીનો સમાવેશ થાય છે જેમાં એચ-બોન્ડનું ત્રિ-પરિમાણીય નેટવર્ક હોય છે. આ વર્ગના સોલવન્ટ્સ (પાણી, ફોર્મિક એસિડ, સલ્ફ્યુરિક એસિડ, ગ્લાયકોલ) ખૂબ ઊંચા ડીપી અને પ્રમાણમાં ઊંચી સ્નિગ્ધતા અને સ્નિગ્ધ પ્રવાહની સક્રિયકરણ ઊર્જા દ્વારા વર્ગીકૃત થયેલ છે. નિયમ પ્રમાણે, આ વર્ગના દ્રાવક એકબીજામાં સારી રીતે ઓગળી જાય છે, H-બોન્ડ દ્વારા હેટરોમોલેક્યુલર એસોસિએટ્સ બનાવે છે.
બીજો વર્ગ એચ-બોન્ડના દ્વિ-પરિમાણીય નેટવર્ક સાથે પ્રવાહી છે. નિયમ પ્રમાણે, આ વર્ગના દ્રાવક પરમાણુઓમાં એક હાઇડ્રોક્સિલ જૂથ (મોનોહાઇડ્રિક આલ્કોહોલ, મોનોબેસિક કાર્બોક્સિલિક એસિડ, ફોનોલ્સ, વગેરે) હોય છે. દ્રાવકના આ જૂથમાં હેટરોમોલેક્યુલર એસોસિએટ્સ બનાવવાની વૃત્તિ સામાન્ય રીતે પ્રથમ વર્ગના પ્રતિનિધિઓની તુલનામાં ઓછી ઉચ્ચારવામાં આવે છે.
ત્રીજો વર્ગ એવા પ્રવાહીને એક કરે છે કે જેના પરમાણુઓમાં નાઇટ્રોજન, ઓક્સિજન, સલ્ફર, ફ્લોરિન વગેરેના અણુઓ હોય છે, જે પ્રોટોન દાતાઓ સાથે એચ-બોન્ડ બનાવવા સક્ષમ હોય છે. આ વર્ગમાં એસ્ટર્સ, એમાઇન્સ, કેટોન્સ, એલ્ડીહાઇડ્સ વગેરેનો સમાવેશ થાય છે.
ચોથા વર્ગમાં એવા પ્રવાહીનો સમાવેશ થાય છે જેના પરમાણુ પ્રોટોન દાતા હોઈ શકે છે. આમાં ક્લોરોફોર્મ, ડિક્લોરોઇથેન વગેરેનો સમાવેશ થાય છે.
પાંચમો વર્ગ એવા પ્રવાહીને એક કરે છે કે જેના પરમાણુ સામાન્ય સ્થિતિમાં H-બોન્ડની રચનામાં ભાગ લેવા સક્ષમ નથી. આ જૂથમાં અલ્કેન્સ, કાર્બન ટેટ્રાક્લોરાઇડ, પરહેલોઆલ્કેન વગેરેનો સમાવેશ થાય છે.
પાર્કરે આયનોને ઉકેલવાની તેમની ક્ષમતા અનુસાર દ્રાવકનું વર્ગીકરણ કરવાની દરખાસ્ત કરી. આ વર્ગીકરણની અંદર, દ્રાવકને જૂથોમાં વિભાજિત કરવામાં આવે છે.
એપોલર એપ્રોટિક - નીચા ડીપી સાથે પ્રવાહી (
ડીપોલર એપ્રોટિક - ડીપી ( > 15) અને દ્વિધ્રુવી ક્ષણો (µ > 2D) ના પ્રમાણમાં ઊંચા મૂલ્યો સાથે પ્રવાહી ,
H-બોન્ડ બનાવવા માટે સક્ષમ હાઇડ્રોજન ધરાવતું નથી. દ્રાવકના આ જૂથના પ્રતિનિધિઓ સલ્ફર ડાયોક્સાઇડ, નાઇટ્રોબેન્ઝીન, નાઇટ્રોમેથેન, એસેટોનાઇટ્રાઇલ, પ્રોપીલીન કાર્બોનેટ, ડીએમએસઓ વગેરે છે.
પ્રોટિક - પ્રવાહી કે જેના પરમાણુઓમાં એવા જૂથો હોય છે જ્યાં હાઇડ્રોજન અણુ ઇલેક્ટ્રોનેગેટિવ અણુ સાથે જોડાયેલ હોય છે. આ જૂથમાં સમાવિષ્ટ સંયોજનો (કાર્બોક્સિલિક એસિડ્સ, આલ્કોહોલ, ફિનોલ્સ, વગેરે) એચ-બોન્ડ બનાવવાની સ્પષ્ટ રીતે વ્યક્ત ક્ષમતા દ્વારા અલગ પડે છે.
દ્રાવકની ઉકેલવાની ક્ષમતા સામાન્ય રીતે પ્રથમ જૂથથી ત્રીજા જૂથ સુધી વધે છે.
બ્રૉન્સ્ટેડે ડાઇલેક્ટ્રિક કોન્સ્ટન્ટ અને પ્રોટોજેનિસિટીના સંયોજનના આધારે દ્રાવકનું વર્ગીકરણ કરવાની દરખાસ્ત કરી. આ લાક્ષણિકતાઓ અનુસાર, તેમણે દ્રાવકને આઠ જૂથોમાં વિભાજિત કર્યા.
બ્રેનસ્ટેડ વર્ગીકરણના માળખામાં વિવિધ જૂથોના દ્રાવકના ઉદાહરણોમાં નીચેનાનો સમાવેશ થાય છે: I - પાણી; II - સલ્ફ્યુરિક એસિડ, ફોર્મિક એસિડ; III - હાઇડ્રેજિન, DMSO; IV - પ્રોપીલીન કાર્બોનેટ, નાઇટ્રોબેન્ઝીન, એસેટોનાઇટ્રાઇલ, નાઇટ્રોમેથેન; V - બ્યુટેનોલ; VI - પ્રવાહી બ્રોમો- અને હાઇડ્રોજન આયોડાઇડ; VII - ટ્રાયથિલામાઇન, પાયરિડિન; VIII - હેક્સેન, ક્લોરોબેન્ઝીન.
Brønsted વર્ગીકરણ દરેક જૂથના દ્રાવકોમાં ઓગળેલા સંયોજનોના એસિડ-બેઝ ગુણધર્મોની આગાહી કરવાની મંજૂરી આપે છે. આમ, જૂથ II ના દ્રાવકમાં, પાયાની મજબૂતાઈ જૂથ III ના દ્રાવક કરતાં નોંધપાત્ર રીતે વધારે છે; જૂથ III સોલવન્ટ્સમાં એસિડની મજબૂતાઈ સામાન્ય રીતે જૂથ VII સોલવન્ટ્સ વગેરે કરતાં વધુ હોય છે.
કોષ્ટક 4
Brønsted અનુસાર દ્રાવક વર્ગીકરણ.
| મિલકત | દ્રાવક પ્રકાર |
|||||||
| આઈ | II | III | IV | વી | VI | VII | VIII |
|
| ડીપી | + | + | + | + | - | - | - | - |
| પ્રોટોજેનિસિટી | + | + | - | - | + | + | - | - |
| પ્રોટોફિલાલિટી | + | - | + | - | + | - | + | - |
* પ્રથમ લાઇનમાં + અને – ચિહ્નો ઉચ્ચ અને નીચા ડીપીને અનુરૂપ છે, બાકીની રેખાઓમાં - આ ગુણધર્મની હાજરી અથવા ગેરહાજરી સાથે.
આઠ ભૌતિક લાક્ષણિકતાઓના આધારે દ્રાવકનું વર્ગીકરણ પણ પ્રસ્તાવિત કરવામાં આવ્યું છે: કિર્કવુડ ફંક્શન, મોલર રીફ્રેક્શન, હિલ્ડેબ્રાન્ડ સોલ્યુબિલિટી પેરામીટર, રીફ્રેક્ટિવ ઈન્ડેક્સ, ઉત્કલન બિંદુ, દ્વિધ્રુવીય ક્ષણ, તેમજ સૌથી વધુ ભરેલા અને સૌથી ઓછા ભરાયેલા મોલેક્યુલર ઓર્બિટલ્સની ઊર્જા. આ ગુણધર્મોના સંયોજનના આધારે, સોલવન્ટને નવ જૂથોમાં વિભાજિત કરવાની દરખાસ્ત છે:
1) એપ્રોટિક ડીપોલર (ઉદાહરણ તરીકે, એસેટોનાઈટ્રાઈલ, નાઈટ્રોમેથેન, એસીટોન, 1,2-ડીક્લોરોઈથેન);
2) એપ્રોટિક અત્યંત દ્વિધ્રુવીય (DMSO, DMF, DMAA, પ્રોપીલીન કાર્બોનેટ, નાઈટ્રોબેન્ઝીન);
3) એપ્રોટિક, અત્યંત દ્વિધ્રુવીય અને અત્યંત ધ્રુવીયક્ષમ (સલ્ફોલેન, HMPTA);
4) સુગંધિત બિન-ધ્રુવીય (બેન્ઝીન, ટોલ્યુએન);
સુગંધિત પ્રમાણમાં ધ્રુવીય (ક્લોરોબેન્ઝીન, ઓ-ડિક્લોરોબેન્ઝીન, એસેટોફેનોન);
ઇલેક્ટ્રોન દાતા (ટ્રાઇથિલામાઇન, ઇથર્સ, ડાયોક્સેન);
એચ-બોન્ડ્સ (આલ્કોહોલ, કાર્બોક્સિલિક એસિડ્સ) સાથે દ્રાવક;
એચ-બોન્ડિંગ સાથે મજબૂત રીતે સંકળાયેલ સોલવન્ટ્સ (ફોર્મામાઇડ,
ડાયેથિલિન ગ્લાયકોલ, પાણી);
અનિશ્ચિત કાર્ય સાથેના દ્રાવકો (કાર્બન ડિસલ્ફાઇડ, ક્લોરોફોર્મ).
1.7 ઘન પદાર્થોની દ્રાવ્યતા નક્કી કરવા માટેની પદ્ધતિઓની સમીક્ષા
1.7.1 દ્રાવ્યતાનું ગ્રેવિમેટ્રિક નિર્ધારણ
પદ્ધતિમાં દ્રાવકના ચોક્કસ સમૂહ (વિશિષ્ટ દ્રાવ્યતા P ` ) અને આપેલ દ્રાવકના 100 ગ્રામમાં ઓગળવામાં સક્ષમ પદાર્થના સમૂહ તરીકે દ્રાવ્યતાની ગણતરી કરવી. પદ્ધતિ મૂલ્યાંકનકારી છે.ટેક્નોકેમિકલ બેલેન્સ (જી 1.) પર પરીક્ષણ પદાર્થના નમૂનાનું વજન કરવામાં આવે છે ` ). દ્રાવકના નમૂનાનું વજન કરો (g p). શુષ્ક ફિલ્ટર (જી 2) ના સમૂહ નક્કી કરો. દ્રાવકમાં પદાર્થનો એક નમૂનો રેડો; જો પદાર્થ સંપૂર્ણપણે ઓગળી ગયો હોય, તો વિસર્જન બંધ ન થાય ત્યાં સુધી તેને ઉમેરવું જરૂરી છે, દ્રાવકમાં રેડવામાં આવેલા પદાર્થના સંપૂર્ણ નમૂનાની નોંધ લો (g 1). વણ ઓગળેલા પદાર્થને ફિલ્ટર દ્વારા ફિલ્ટર કરો અને બાકીના પદાર્થ (g 3) સાથે ભીના ફિલ્ટરનો સમૂહ નક્કી કરો. ફિલ્ટરને બાકીના પદાર્થ સાથે સતત વજન (g 4) સુધી સુકાવો. સૂત્રનો ઉપયોગ કરીને ચોક્કસ દ્રાવ્યતાની ગણતરી કરો:
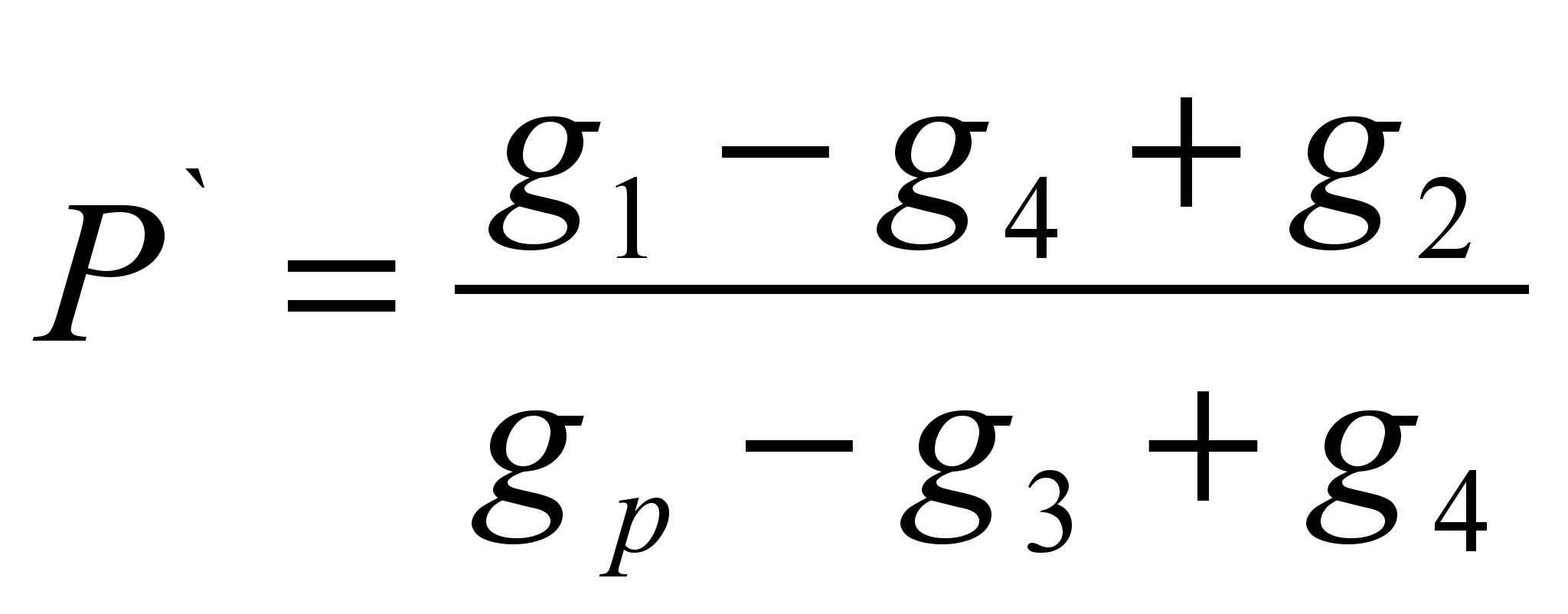
P = P` 100 (g/100 ગ્રામ)
કોષ્ટક 5
કેટલાક દ્રાવકોમાં ફિનોલ્ફથાલિનની દ્રાવ્યતા
| દ્રાવક | દ્રાવ્યતા | આર |
| મજબૂત રીતે ધ્રુવીય |
||
| પાણી | 0,0002 | 78,30 |
| મિથાઈલ આલ્કોહોલ | 19,42 | 52,66 |
| નબળું ધ્રુવીય |
||
| ઇથેનોલ | 17,29 | 24,55 |
| એસીટોન | 16,98 | 20,70 |
| ક્લોરોફોર્મ | 2,97 | 4,81 |
| ધ્રુવીય નથી |
||
| ઝાયલીન | 0,19 | 2,43 |
| ટોલ્યુએન | 0,17 | 2,38 |
| બેન્ઝીન | 0,16 | 2,27 |
1.7.2 ઇલેક્ટ્રોકેમિકલ પદ્ધતિ.
1. ડાયાગ્રામ અનુસાર ઇલેક્ટ્રોલાઇટ સોલ્યુશનના વોલ્યુમના પ્રતિકારને નિર્ધારિત કરવા માટે ઇન્સ્ટોલેશનને એસેમ્બલ કરો (ફિગ 3 જુઓ).
2. ચોક્કસ સાંદ્રતાના પોટેશિયમ ક્લોરાઇડના જલીય દ્રાવણને માપન પાત્રમાં ચિહ્નિત કરવા માટે રેડવામાં આવે છે અને ઇલેક્ટ્રોડ સાથેના પાત્રને આપેલ તાપમાને થર્મોસ્ટેટમાં રાખવામાં આવે છે. 15-20 મિનિટ પછી, જહાજને બિંદુ B અને D પર ઇન્સ્ટોલેશન સાથે જોડો.
3. રેઝિસ્ટર મેગેઝિનનો ઉપયોગ કરીને અને સંપર્ક C ને ખસેડીને, બ્રિજ સંતુલિત છે, ફોનમાં ઓછામાં ઓછો અવાજ અથવા એસિલોગ્રાફ સ્ક્રીન પર સાઇનસૉઇડનું ન્યૂનતમ કંપનવિસ્તાર હાંસલ કરે છે. વળતર બિંદુ કાં તો રિઓકોર્ડના એક છેડાથી અથવા બીજાથી સંપર્ક કરવામાં આવે છે. R x નું માપન અને અનુગામી ગણતરી:
R x = R 1 
વિવિધ પ્રતિકાર R 1 પર 3-4 વખત પુનરાવર્તન કરો. આ કિસ્સામાં, ફરતા સંપર્કે રિઓકોર્ડના છેડા સુધી પહોંચવું જોઈએ નહીં. જો માપમાં વિચલનો 0.5% કરતા ઓછા હોય, તો પરિણામો સંતોષકારક માનવામાં આવે છે અને સૂત્રનો ઉપયોગ કરીને જહાજની સ્થિરતાની ગણતરી કરવા આગળ વધો:
કે =  /
ડબલ્યુ =
આરએક્સ
/
ડબલ્યુ =
આરએક્સ
જ્યાં R x એ ઉકેલ પ્રતિકાર છે; -
ચોક્કસ વિદ્યુત વાહકતા.
4. થોડી માત્રામાં મીઠું 100 મિલી પાણીમાં રેડવામાં આવે છે અને, સ્ટોપર વડે ફ્લાસ્કને ચુસ્તપણે બંધ કરીને, તેને 20 મિનિટ સુધી સતત હલાવો. પરિણામી સસ્પેન્શનને ગ્લાસ ફિલ્ટર દ્વારા ચૂસવામાં આવે છે, અને અવક્ષેપનો ઉપયોગ સંતૃપ્ત ઉકેલ તૈયાર કરવા માટે થાય છે. વિદ્યુત વાહકતાને માપવા માટે પરિણામી સોલ્યુશનને વાસણમાં રેડવામાં આવે છે અને થર્મોસ્ટેટિંગ પછી, સોલ્યુશનનો પ્રતિકાર માપવામાં આવે છે.
=
k /
આરએક્સ  = /
સી
= /
સી
જ્યાં C એ દ્રાવણની સામાન્યતા છે, kg eq/m 3.
સંતૃપ્ત દ્રાવણમાં મીઠાની સાંદ્રતા ઓછી હોવાથી = . સમીકરણ પર આધારિત:
C = ( આર - વી ) /
જ્યાં આર- મીઠાના દ્રાવણની વિશિષ્ટ વિદ્યુત વાહકતા.
મોનોવેલેન્ટ ઇલેક્ટ્રોલાઇટ માટે દ્રાવ્યતા ઉત્પાદન:
![]() = ( C ) 2
= ( C ) 2
6. કોષ્ટકમાં પરિણામો દાખલ કરો:
| મીઠું | t, C 0 | , સેમી/મી | પ્રતિકાર, ઓહ્મ | કે | | | સી | એલ |
|||
| આર 1 | R2(AC) | R 3(CB) | આર એક્સ |
||||||||
કોષ્ટક 6
KCI સોલ્યુશનની ચોક્કસ વિદ્યુત વાહકતા
| t, C 0 | 1 N KCI | 0.1 એન | 0.02 એન | 0.01 એન |
| 10 4 , ઓહ્મ -1 સેમી -1 |
||||
| 0 | 654,1 | 71,5 | 15,21 | 7,76 |
| 10 | 831,9 | 93,3 | 19,94 | 10,20 |
| 14 | 906,3 | 102,5 | 21,93 | 11,21 |
| 16 | 944,1 | 107,2 | 22,94 | 11,73 |
| 18 | 982,2 | 111,9 | 23,97 | 12,25 |
| 20 | 1020,7 | 116,7 | 25,01 | 12,78 |
| 22 | 1055,4 | 121,5 | 26,06 | 13,32 |
| 24 | 1098,4 | 126,4 | 27,12 | 13,86 |
| 25 | 1118,0 | 128,8 | 27,65 | 14,13 |
| 26 | 1137,7 | 131,8 | 28,19 | 14,41 |
| 28 | 136,2 | 29,27 | 14,96 |
|
| 30 | 141,2 | 30,36 | 15,52 |
|
| 32 | 146,2 | 31,46 | 16,09 |
|
| 34 | 151,3 | 32,56 | 16,67 |
|
| 36 | 156,4 | 33,68 | ||
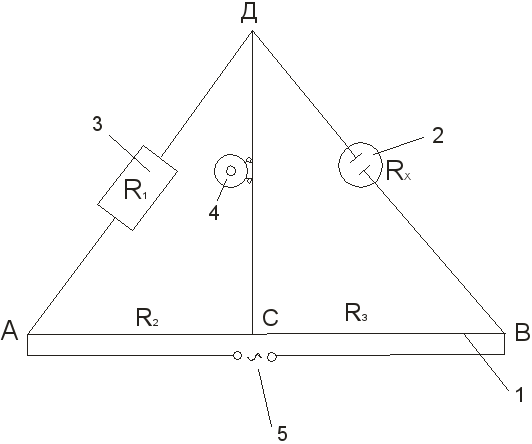
ફિગ.3વિદ્યુત વાહકતા નક્કી કરવા માટે સ્થાપન રેખાકૃતિ:
1 - શાસક પર ખેંચાયેલ વાયર; 2 - ઇલેક્ટ્રોડ્સ સાથે માપન જહાજ; 3 - રિઓસ્ટેટ; 4 - ઓછી અવબાધ ટેલિફોન; 5 - વર્તમાન સ્ત્રોત.
1.7.3
ફોટોઇલેક્ટ્રોકેલોમેટ્રિક પદ્ધતિ.
આ પદ્ધતિ પ્રકાશ શોષણના મૂળભૂત કાયદાનું અવલોકન કરતી વખતે ઓપ્ટિકલ ઘનતાના એડિટિવિટીના કાયદા પર આધારિત છે.
પ્રગતિ
1. શ્રેષ્ઠ પ્રકાશ ફિલ્ટર્સની પસંદગી.
1.1. 25 મિલી વોલ્યુમેટ્રિક ફ્લાસ્કમાં મૂકો:
ઉકેલોને મિક્સ કરો અને સૌથી યોગ્ય ક્યુવેટ્સમાં વિવિધ લાઇટ ફિલ્ટર્સનો ઉપયોગ કરીને પસંદ કરેલા દ્રાવકની તુલનામાં ઓપ્ટિકલ ઘનતા માપો. ક્યુવેટનું કદ સ્પષ્ટ કરો. FEC માટે ઓપરેટિંગ પ્રક્રિયા માટે ઉપકરણ ડેટા શીટ જુઓ.
1.2. મેળવેલ ડેટા કોષ્ટકમાં દાખલ કરો:
1.3. ગ્રાફ પેપર પર પ્રકાશ શોષણ વણાંકો A = f(, nm) દોરો અને ઓપરેશન દરમિયાન કયા તરંગલંબાઇ ફિલ્ટર્સનો શ્રેષ્ઠ ઉપયોગ થાય છે તે નિર્ધારિત કરો.
2. ગ્રાફનું બાંધકામ.
2.1. પ્રમાણભૂત ઉકેલોની શ્રેણી તૈયાર કરો. અગાઉ પસંદ કરેલા લાઇટ ફિલ્ટર્સનો ઉપયોગ કરીને પ્રમાણભૂત ઉકેલોની દરેક તૈયાર શ્રેણીની ઓપ્ટિકલ ઘનતાને માપો.
2.2. કોષ્ટકમાં પ્રાયોગિક ડેટા દાખલ કરો (નીચે જુઓ) ઉકેલોની દરેક શ્રેણી માટે અલગથી, અને પ્રાપ્ત પરિણામોની આંકડાકીય પ્રક્રિયા હાથ ધરો.
2.3. ગ્રાફ પેપર પર ટેબ્યુલર ડેટાનો ઉપયોગ કરીને, આલેખ A = f(પદાર્થનો C) બનાવો અને દ્રાવકમાં ફિનોલ્ફથાલિનની દ્રાવ્યતાની ગણતરી કરો.
ફિનોલ્ફથાલિન દ્રાવ્યતાના મુદ્દા પર સાહિત્યનો અભ્યાસ કર્યા પછી, ઉપર દર્શાવેલ પદ્ધતિઓ પસંદ કરવામાં આવી હતી. અને અમારી પ્રયોગશાળાની પરિસ્થિતિઓમાં, અવધિની દ્રષ્ટિએ અને અમલીકરણની સરળતાના સંદર્ભમાં તેનો ઉપયોગ કરવાની સંભાવના અનુસાર તેમની સરખામણી કરીને, દ્રાવ્યતા નક્કી કરવા માટે ગુરુત્વાકર્ષણ પદ્ધતિ પસંદ કરવામાં આવી હતી.
2. પ્રાયોગિક ભાગ
2.1 ફિનોલ્ફથાલિનનું સંશ્લેષણ
સાહિત્ય સમીક્ષામાં ઉલ્લેખિત પદ્ધતિ અનુસાર સંશ્લેષણ હાથ ધરવામાં આવ્યું હતું (કલમ 1.4.1).
| ક્રિયા | અવલોકન |
| 1.વજન: 5 ગ્રામ -પ્થાલિક એનહાઇડ્રાઇડ (રીએજન્ટ ગ્રેડ) | સફેદ સ્ફટિકીય પાવડર ગુલાબી, પ્રસરેલા સ્ફટિકો |
| 2. રીએજન્ટ્સને સપાટ તળિયાવાળા શંકુ આકારના ફ્લાસ્ક (100 મિલી) માં મૂક્યા, તેમાં થર્મોમીટર વડે હલાવો. | એક પોર્રીજ જેવો સમૂહ રચાયો છે, અને મિશ્રણ સહેજ ગરમ થાય છે (t ≈ 37 0 C). |
| 3. ફ્લાસ્ક મૂકો અને તેને રેતીના સ્નાનમાં ગરમ કરો (125 - 130 0 C ની અંદર તાપમાન). તેને 1.5 કલાક સુધી ગરમ કરો. | 45 0 સે.ના તાપમાને, ફિનોલ પીગળે છે, ફેથેલિક એનહાઇડ્રાઇડ (સફેદ ફ્લેક્સ) ભૂરા રંગના ઓગળે છે. 30 મિનિટ (t ≤ 130 0 C) સુધી ગરમ કર્યા પછી, એક સમાન બ્રાઉન-ક્રિમસન મેલ્ટ રચાય છે. ગરમ કર્યાના 1 કલાક પછી - લોહી-લાલ રંગનું સજાતીય પીગળવું. 1.5 કલાક પછી ગરમી બંધ થઈ ગઈ. |
| 4. તેણે ઉકળતા પાણી સાથે ફ્લાસ્કમાં ગરમ મેલ્ટ રેડ્યો અને પાણીની વરાળ સાથે બિનપ્રક્રિયા વગરના ફિનોલને નિસ્યંદિત કર્યું (સાહિત્ય સમીક્ષાના અનુરૂપ વિભાગમાં ઇન્સ્ટોલેશન ચિત્ર જુઓ). | ઉકળતા પાણી સાથેના ફ્લાસ્કમાં, ગરમ ઓગળ્યા પછી, ફિનોલ્ફથાલિનના આછા પીળા આકાર વગરના ટુકડાઓ તરતા લાગ્યા, પાણીની થોડી ગંદકી થઈ, ટી ? 99 0 C. વાદળછાયું નિસ્યંદન છોડવામાં આવે છે (V = 50 ml). નિસ્યંદનના 15 મિનિટ પછી, સ્પષ્ટ નિસ્યંદન ટપકવાનું શરૂ થયું. |
| 5. ફિલ્ટરમાં અવક્ષેપને સ્થાનાંતરિત કર્યા વિના બ્યુકનર ફનલ પર ફિનોલ્ફથાલિન સાથેના દ્રાવણને ડીકેંટ કરો. મેં કાંપને ઠંડા પાણીના ત્રણ ભાગ, દરેક 100 મિલીથી ધોઈ નાખ્યો. | સોલ્યુશનનું તાપમાન 26 0 સે છે, સોલ્યુશનમાં (V? 170 મિલી) ફિનોલ્ફથાલિનના દાણાના આકારના ટુકડાઓ હોય છે, જેનો રંગ થોડો પીળો હોય છે. |
| 6. ગરમ સોડિયમ હાઇડ્રોક્સાઇડ સોલ્યુશન (? = 5%) ના 15 મિલીલીટરમાં ફિલ્ટર કરેલ ફિનોલ્ફથાલિનને ઓગળવું. | T NaOH ?42 0 C, દ્રાવણ ઘેરો લાલ થઈ ગયો. |
| 7. મેં ઘેરા લાલ સોલ્યુશનને ફિલ્ટર કર્યું. | ઉકેલ તાપમાન? 35 0 C. ગાળણ સમાપ્ત થયા પછી, પદાર્થનો પાતળો, ગુલાબી-સફેદ, બારીક સ્ફટિકીય સ્તર ફિલ્ટર પર સ્થાયી થયો છે (મોટા ભાગે આ બિનપ્રક્રિયા વિનાનું phthalic anhydride છે). |
| 8. ગાળણમાં (V? 50 ml) 5 ml એસિટિક એસિડ (q.), 1 ml ભાગોમાં, હલાવતા ઉમેર્યું. | સોલ્યુશનના રંગમાં ઘેરા લાલથી ગ્રે-સફેદ, વાદળછાયું (ફ્લેકી) દ્રાવણમાં ફેરફાર થયો હતો. ઉકેલ ગરમ થયો નથી. ઉકેલ તાપમાન? 31 0 સે. |
| 9.હાઈડ્રોક્લોરિક એસિડના 2 ટીપાં ઉમેર્યા (k.) | વિઝ્યુઅલ ફેરફારોથયું નથી |
| 10. તેને 1 કલાક ઊભા રહેવા માટે છોડી દો. | ફ્લેક્સ કાચના તળિયે સ્થાયી થયા; કાંપની ઉપર એક પારદર્શક દ્રાવણ હતો, ફ્લેક્સ ગ્રેશ-સફેદ રંગના હતા. |
| 11. પરિણામી અવક્ષેપને ફિલ્ટર કરો. | ફિલ્ટર પર સફેદ-ગ્રેશ સ્લરી છે. એમ ઓવ? 5.07 |
કુલ 5.07 ગ્રામ ભીની તૈયારી મેળવી હતી.
2.2 ગરમ આલ્કોહોલમાંથી પુનઃસ્થાપન
સાહિત્ય સમીક્ષા (વિભાગ 1.4.4) માં ઉલ્લેખિત પદ્ધતિ અનુસાર પુનઃસ્થાપન હાથ ધરવામાં આવ્યું હતું. એક નકલ કરવામાં આવી હતી. ઉપકરણનું ચિત્ર સાહિત્ય સમીક્ષાના ફકરા 1.4.4 માં દર્શાવવામાં આવ્યું છે.
| ક્રિયા | અવલોકન |
| ફિનોલ્ફથાલિન (5.07 ગ્રામ) ના નમૂનાને ફ્લાસ્કમાં મૂકવામાં આવ્યું હતું અને 96% ઇથેનોલનું 50 મિલી ઉમેરવામાં આવ્યું હતું. | ફિઓલ્ફથાલિનનો એક નાનો ભાગ ઓગળી ગયો. દારૂ સહેજ વાદળછાયું બની ગયું છે. |
| ફ્લાસ્કને ધીમા તાપે ગરમ કરો. ફિનોલ્ફથાલિન સંપૂર્ણપણે ઓગળી ન જાય ત્યાં સુધી આલ્કોહોલ ઉમેરવામાં આવે છે (0.5 મિલી દરેક). V ETOH = 7 મિલી. | ફેનોલ્ફથાલિન સંપૂર્ણપણે ઓગળી ગયું હતું. દારૂ વાદળછાયું છે. t મિશ્રણ = 85 o C. |
| મિશ્રણ ધીમે ધીમે ઓરડાના તાપમાને ઠંડુ કરવામાં આવે છે. | t મિશ્રણ = 19 o C. ઘણા સફેદ સ્ફટિકો નાના સ્ફટિકોના રૂપમાં દ્રાવણમાંથી બહાર પડી ગયા. ઉકેલ પારદર્શક છે. |
| જે સ્ફટિકો પડી ગયા હતા તેને ચૂસવામાં આવ્યા હતા, બરફના પાણીથી ફિલ્ટર પર ધોવામાં આવ્યા હતા અને ફિલ્ટર પેપરની શીટ વચ્ચે સૂકવવામાં આવ્યા હતા. | હવાના સ્ફટિકોના રૂપમાં મેળવેલ ફેનોલ્ફથાલીન સફેદ-ગ્રે રંગ, બારીક. m(ફેનોલ્ફથાલીન) = 4.08 ગ્રામ. પુનઃસ્થાપન ઉપજ 83.5% હતી. |
પુનઃસ્થાપનની ગણતરી:
પુનઃસ્થાપન આઉટપુટ:
W,% = (m(ફેનોલ્ફથાલિન) ક્રોસ ડ્રાય 100%) / m(ફેનોલ્ફથાલિન) શુષ્ક
ડબલ્યુ,% =  % = 83,5 %
% = 83,5 %
સંશ્લેષણ ઉપજની ગણતરી:
ફિનોલ્ફથાલિન (સૈદ્ધાંતિક) અથવા m = 0.0338 mol 318 g/mol = 10.7 g મેળવવા માટે 0.0388 mol.
સૈદ્ધાંતિક માંથી આઉટપુટ:
W=  100 % = 40, 5 %
100 % = 40, 5 %
આમ, તે સિદ્ધાંતમાં પ્રાપ્ત થાય છે પર્યાપ્ત જથ્થોવધુ સંશોધન માટે phenolphthalein (લગભગ 4.08 ગ્રામ). સંશ્લેષણ સ્વીકાર્ય ઉત્પાદન ઉપજ સાથે હાથ ધરવામાં આવ્યું હતું.
2.3 દ્રાવ્યતાનું નિર્ધારણ
ફિનોલ્ફથાલિન દ્રાવ્યતાનું નિર્ધારણ ગુરુત્વાકર્ષણ દ્વારા હાથ ધરવામાં આવ્યું હતું (ફકરો 1.7.1 જુઓ).
ક્લોરોફોર્મ, બેન્ઝીન અને ઝાયલીનને દ્રાવક તરીકે પસંદ કરવામાં આવ્યા હતા. કારણ કે સાહિત્યના ડેટા અનુસાર (કોષ્ટક 5 જુઓ) તેમાંના ફિનોલ્ફથાલીન ઉપલબ્ધ સમૂહ માટે સ્વીકાર્ય દ્રાવ્યતા ધરાવે છે. મેં પાણીનો ઉપયોગ કર્યો નથી, કારણ કે ફેનોલ્ફથાલિનમાં ખૂબ ઓછી દ્રાવ્યતા છે (100 ગ્રામ દીઠ આશરે 10 -4 ગ્રામ). મેં ઇથેનોલનો ઉપયોગ પણ કર્યો ન હતો, કારણ કે ફિનોલ્ફથાલિન આલ્કોહોલમાં ખૂબ જ સારી દ્રાવ્યતા ધરાવે છે અને પદાર્થના મોટા પ્રમાણમાં વપરાશની જરૂર પડશે. નિર્ધારણ 21 ± 1 o C (પ્રવાહી તબક્કાનું તાપમાન) પર હાથ ધરવામાં આવ્યું હતું. પ્રેરણા 30 ± 1 મિનિટ સુધી ચાલતી હતી, જોરશોરથી હલાવીને.
ગણતરીના સૂત્રો:
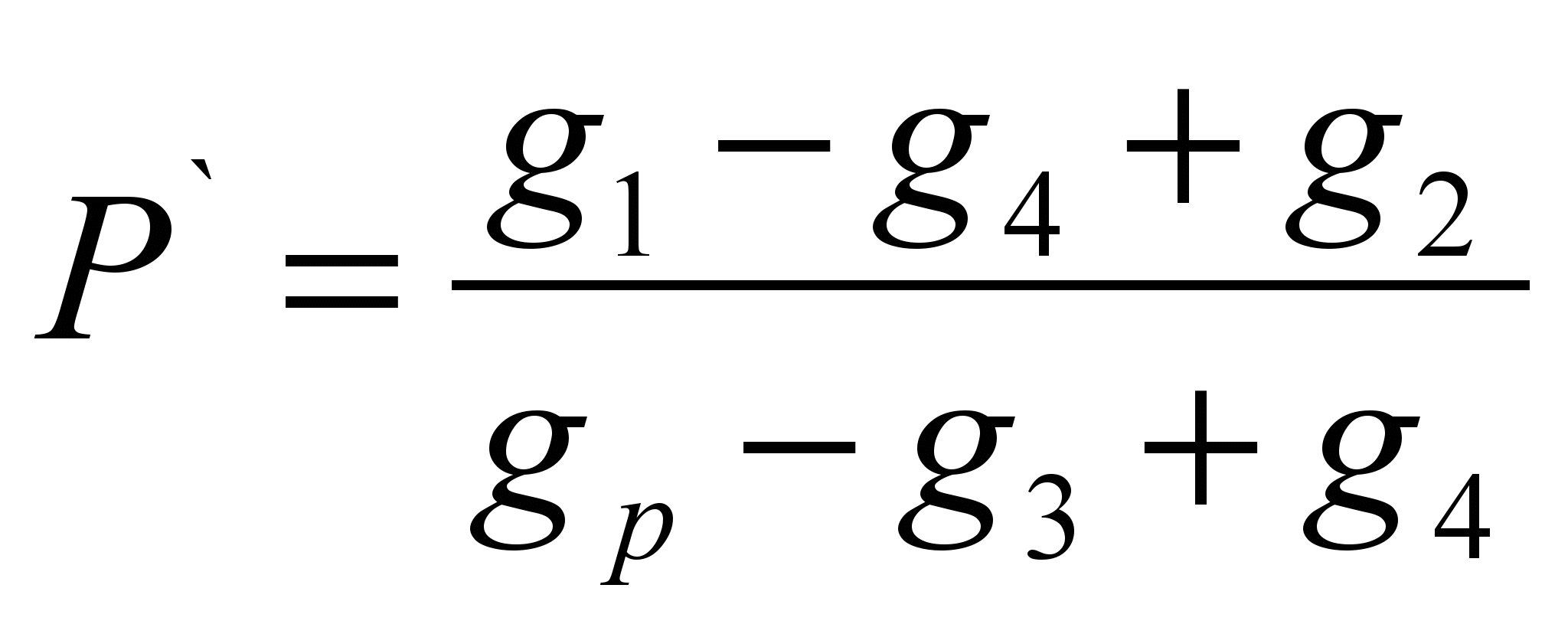 ; P = P` 100 (g/100 ગ્રામ)
; P = P` 100 (g/100 ગ્રામ)
જ્યાં, g 1 – ફિનોલ્ફથાલિનનો નમૂનો, g;
જી 2 - શુષ્ક ફિલ્ટરનો સમૂહ, જી;
G 3 - ફિનોલ્ફથાલિન અવશેષો સાથે ભીના ફિલ્ટરનો સમૂહ, g;
G 4 - ફિનોલ્ફથાલિન અવશેષો સાથે સૂકા ફિલ્ટરનો સમૂહ, g;
G p—દ્રાવક વજન, g;
પી - દ્રાવ્યતા, g/100 ગ્રામ દ્રાવણ;
Р` - ચોક્કસ દ્રાવ્યતા, દ્રાવણનો g/1 ગ્રામ.
નિર્ધારણ પરિણામો:
પી (ફેનોલ્ફથાલીન / ક્લોરોફોર્મ) = (3.0 ± 0.03) g/100 ગ્રામ ક્લોરોફોર્મ; ? = 1%.
પી (ફેનોલ્ફથાલીન / ઝાયલીન) = (0.22 ± 0.01) g/100 ગ્રામ xylene; ? = 6%.
પી (ફેનોલ્ફથાલીન / બેન્ઝીન) = (0.19 0.01) ગ્રામ / 100 ગ્રામ બેન્ઝીન; = 6%.
પ્રયોગના ડેટાના આધારે, સારાંશ કોષ્ટક અને ગ્રાફ બનાવવામાં આવ્યા હતા.
કોષ્ટક 7
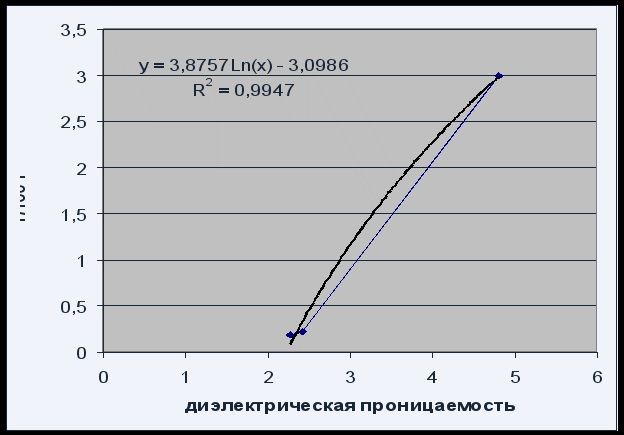
ફિગ.4દ્રાવકના ડાઇલેક્ટ્રિક સ્થિરાંક પર દ્રાવ્યતાની અવલંબન
દ્રાવકના ડાઇલેક્ટ્રિક સ્થિરાંક પર દ્રાવ્યતાની અવલંબન સંતોષકારક ગુણવત્તા R 2 = 0.995 સાથે લઘુગણક સમીકરણ P = 3.8757 Ln(x) – 3.0986 દ્વારા વર્ણવી શકાય છે.
દ્રાવકના વધતા ડાઇલેક્ટ્રિક સ્થિરાંક (તેની ધ્રુવીયતામાં વધારો) સાથે ફિનોલ્ફથાલિનની દ્રાવ્યતા વધે છે તે હકીકતને કારણે, આપણે કહી શકીએ કે ફેનોલ્ફથાલિન એ ધ્રુવીય સંયોજન છે.
નિષ્કર્ષ
કાર્ય દરમિયાન, 26 સાહિત્યિક સ્ત્રોતોનું વિશ્લેષણ કરવામાં આવ્યું હતું. વર્ણવેલ સામાન્ય સ્થિતિફિનોલ અને phthalic anhydride ની પ્રતિક્રિયા દ્વારા મેળવવામાં આવે છે. ફિનોલ્ફથાલિનની સંશ્લેષણ પદ્ધતિઓની સમીક્ષા હાથ ધરવામાં આવી હતી (એક પદ્ધતિ મળી આવી હતી, વિવિધ સાહિત્યના સ્ત્રોતોમાં પદ્ધતિ રીએજન્ટ લોડના વજનમાં અલગ હતી). આ પદ્ધતિનો ઉપયોગ કરીને સંશ્લેષણ હાથ ધરવું બાજુની પ્રક્રિયાઓ દ્વારા જટિલ નથી. ઉપયોગમાં લેવાતા પદાર્થોના સંશ્લેષણ અને સંચાલન દરમિયાન મુખ્ય જોખમો ઓળખવામાં આવે છે. દ્રાવ્યતા નક્કી કરવા માટેની પદ્ધતિઓ પસંદ કરવામાં આવી છે. દ્રાવ્યતા નક્કી કરવા માટે ક્લોરોફોર્મ, ઝાયલીન અને બેન્ઝીનને દ્રાવક તરીકે પસંદ કરવામાં આવ્યા હતા.
40.5% ની ઉપજ સાથે ફેનોલ્ફથાલિનનું સંશ્લેષણ કરવામાં આવ્યું હતું. સંશ્લેષણ, શુદ્ધિકરણ અને અલગતા માટેની શરતો પદ્ધતિના ડેટા અનુસાર સખત રીતે અવલોકન કરવામાં આવી હતી.
ફિનોલ્ફથાલિનની દ્રાવ્યતા (ગ્રેવિમેટ્રિક નિર્ધારણ અનુસાર) હતી: 3.00 ± 0.03 ગ્રામ/100 ગ્રામ ક્લોરોફોર્મ, 0.22 ± 0.01 ગ્રામ/100 ગ્રામ ઝાયલીન, 0.19 ± 0.01 ગ્રામ/100 ગ્રામ બેન્ઝીન.
દ્રાવકના ડાઇલેક્ટ્રિક સ્થિરાંકમાં વધારા સાથે ફિનોલ્ફથાલિનની દ્રાવ્યતામાં વધારો એ પુષ્ટિ કરે છે કે ફેનોલ્ફથાલિન એ આઇપોલર સંયોજન છે.
વપરાયેલ સાહિત્યની સૂચિ
1.એગ્રોનોમોવ એ.ઇ. કાર્બનિક રસાયણશાસ્ત્રમાં પ્રયોગશાળાનું કાર્ય. – એમ.: શિક્ષણ, 1977. 230 પૃષ્ઠ.2. અસ્તાખોવા એલ.આઈ., ક્રિવેન્કો એ.પી. કાર્બનિક રસાયણશાસ્ત્ર પર વર્કશોપ. – એમ.: મીર, 1990. 180 પૃષ્ઠ.
3.Bichot E. સૂચકાંકો. – એમ.: મીર, 1976. 356 પૃષ્ઠ.
4. બુહલર કે., પીયર્સન ડી. ઓર્ગેનિક સિન્થેસિસ. એમ.: ઉચ્ચ. Shk., 1973. 340 પૃષ્ઠ.
5. ગેરાસિમોવ Ya.I. ઉકેલોની થર્મોડાયનેમિક્સ. – એમ.: પબ્લિશિંગ હાઉસ – મોસ્કો સ્ટેટ યુનિવર્સિટી, 1980. 170 પૃષ્ઠ.
6.Gitis S.S. કાર્બનિક રસાયણશાસ્ત્ર પર વર્કશોપ /S. S. Gitis, A. I. Glaz, A. I. Ivanov. - એમ.: વીએસએચ, 1991.
7.ગોલોડનીકોવ જી.વી. કાર્બનિક રસાયણશાસ્ત્ર પર વર્કશોપ. – એમ.: રસાયણશાસ્ત્ર, 1978. 160 પૃષ્ઠ.
8. ગ્રાન્ડબર્ગ I. I. કાર્બનિક રસાયણશાસ્ત્રમાં પ્રાયોગિક કાર્ય અને સેમિનાર: વિદ્યાર્થીઓ માટે માર્ગદર્શિકા. યુનિવર્સિટીઓ - ચોથી આવૃત્તિ, સુધારેલ. અને વધારાના - એમ.: બસ્ટાર્ડ, 2001.
9. ઇવાનવ વી.જી. કાર્બનિક રસાયણશાસ્ત્ર પર વર્કશોપ: પાઠ્યપુસ્તક. વિદ્યાર્થીઓ માટે માર્ગદર્શિકા. ઉચ્ચ ped પાઠ્યપુસ્તક સંસ્થાઓ / વી. જી. ઇવાનવ, ઓ.એન. ગેવા, યુ.જી. ગેવેરોવા. - એમ.: પબ્લિશિંગ સેન્ટર "એકેડેમી", 2000.
10. કરાપેટીયન્ટ્સ M.Kh. રાસાયણિક પ્રક્રિયાઓના સિદ્ધાંતનો પરિચય. - એમ.: ઉચ્ચ. Shk., 1975. 280 પૃષ્ઠ.
11.કિરીલિન વી.એ. ઉકેલોની થર્મોડાયનેમિક્સ. – એમ.: એનર્જી, 1980. 80 પૃષ્ઠ.
12.કોગન વી.બી. દ્રાવ્યતા હેન્ડબુક. – એમ.: લેનિનગ્રાડ. પબ્લિશિંગ હાઉસ એકેડેમી ઓફ સાયન્સ, 1961. 300 પૃષ્ઠ.
13. લેવિના આર. યા. કાર્બનિક રસાયણશાસ્ત્ર પર પ્રાયોગિક કાર્ય. - એમ.: રસાયણશાસ્ત્ર, 1980.
14. ઓર્ગેનીકમ: કાર્બનિક રસાયણશાસ્ત્ર પર પ્રાયોગિક કાર્ય. – એમ.: મીર, 1979 – ટી.2.
15. પેટ્રોવ એ. એ. ઓર્ગેનિક કેમિસ્ટ્રી: યુનિવર્સિટીઓ માટે પાઠ્યપુસ્તક / એ. એ. પેટ્રોવ, એચ.વી. બાલ્યાન, એ.ટી. ટ્રોશચેન્કો. - 5મી આવૃત્તિ, સુધારેલ. અને વધારાના - સેન્ટ પીટર્સબર્ગ: ઇવાન ફેડોરોવ, 2002.
16. રીચાર્ડ કે. કાર્બનિક રસાયણશાસ્ત્રમાં સોલવન્ટ્સ અને પર્યાવરણીય અસરો. – એમ.: મીર, 1991. 182 પૃષ્ઠ.
17. કાર્બનિક રસાયણશાસ્ત્રમાં પ્રયોગશાળા વર્ગો માટે માર્ગદર્શિકા: યુનિવર્સિટીઓ માટે માર્ગદર્શિકા / એન. N. Artemyeva, V. L. Beloborodova, S. E. Zurabyan અને અન્ય; એડ. એન. એ. ટ્યુકાવકીના. - 2જી આવૃત્તિ., સુધારેલ. અને વધારાના - એમ.: બસ્ટાર્ડ, 2002.
18.ગુણધર્મો કાર્બનિક સંયોજનો: સંદર્ભ પુસ્તક /Ed. A. A. પોટેખીના. - એલ.: રસાયણશાસ્ત્ર, 1984.
19. સ્મોલિના ટી. એ. કાર્બનિક રસાયણશાસ્ત્રમાં પ્રાયોગિક કાર્ય: નાની વર્કશોપ /ટી. એ. સ્મોલિના, એન.વી. વાસિલીવા, એન.બી. કુપ્લેત્સ્કાયા. - 2જી આવૃત્તિ., સુધારેલ. - એમ.: શિક્ષણ, 1986.
20. કેમિસ્ટની હેન્ડબુક / એડ. બી.એન. નિકોલ્સ્કી અને અન્ય - એલ.: રસાયણશાસ્ત્ર, 1964.
21. સ્ટ્રોમબર્ગ એ.જી. ભૌતિક રસાયણશાસ્ત્ર: પાઠ્યપુસ્તક. રસાયણ માટે. નિષ્ણાત યુનિવર્સિટીઓ / એ. જી. સ્ટ્રોમબર્ગ, ડી.પી. સેમચેન્કો; એડ. એ.જી. સ્ટ્રોમબર્ગ. - 5મી આવૃત્તિ., રેવ. - એમ.: વીએસએચ, 2003.
22. ટ્રેવેન વી. એફ. ઓર્ગેનિક કેમિસ્ટ્રી: યુનિવર્સિટીઓ માટે પાઠ્યપુસ્તક. – M.: ICC “Akademkniga”, 2004. – T.1.
23.ભૌતિક રસાયણશાસ્ત્ર. 2 પુસ્તકોમાં. પુસ્તક 1. પદાર્થનું માળખું. થર્મોડાયનેમિક્સ: પાઠ્યપુસ્તક. યુનિવર્સિટીઓ માટે /કે. S. Krasnov, N.K. Vorobyov, I.I. Godnev અને અન્ય; એડ. કે.એસ. ક્રાસ્નોવા – ત્રીજી આવૃત્તિ, સુધારેલ. - એમ.: વીએસએચ, 2001.
24. ફિઆલ્કોવ યુ.એ. નિયંત્રણ એજન્ટ તરીકે દ્રાવક રાસાયણિક પ્રક્રિયા. - એલ.: રસાયણશાસ્ત્ર, 1990. 240 પૃષ્ઠ.
25.કેમિકલ જ્ઞાનકોશીય શબ્દકોશ/એડ. I. L. Knunyantsa અને અન્ય - M.: સોવિયેત જ્ઞાનકોશ, 1983.
26. ખ્રમકીના એમ.એન. કાર્બનિક સંશ્લેષણ પર વર્કશોપ. – એમ.: મોસ્કો સ્ટેટ યુનિવર્સિટી પબ્લિશિંગ હાઉસ, 1985. 473 પૃષ્ઠ.
ફેનોલ્ફથાલીનનું પ્રયોગમૂલક સૂત્ર: C20H14O4 .
ફેનોલ્ફથાલિન શું છે?
વિકિપીડિયા અનુસાર, 4,4′-ડાયોક્સીફ્થાલોફેનોન અથવા 3,3-bis-(4-હાઈડ્રોક્સિફેનાઈલ)ફથાલાઈડ રજૂ કરે છે એસિડ-બેઝ સૂચક .
પદાર્થો જેમ કે લિટમસ, ફિનોલ્ફથાલિન, મિથાઈલ નારંગી ઉકેલોની એસિડિટી નક્કી કરવા માટે રસાયણશાસ્ત્રમાં વ્યાપકપણે ઉપયોગમાં લેવાય છે.
તેના અપરિવર્તિત સ્વરૂપમાં, ઉત્પાદન પારદર્શક સ્ફટિકો છે જે પાણીમાં નબળી રીતે દ્રાવ્ય હોય છે, પરંતુ આલ્કોહોલમાં અત્યંત દ્રાવ્ય હોય છે અને ડાયથાઈલ ઈથર . પદાર્થમાંથી સંશ્લેષણ કરી શકાય છે ફિનોલ અને phthalic anhydride ઘનીકરણ પ્રતિક્રિયા દ્વારા, ઉપયોગ કરીને ઝીંક ક્લોરાઇડ કેવી રીતે ઉત્પ્રેરક (તમે એકાગ્રતાનો પણ ઉપયોગ કરી શકો છો સલ્ફ્યુરિક એસિડ ).
એસિડિક વાતાવરણમાં આ પદાર્થ ( pH 0 થી 3 સુધી) ઉચ્ચારણ નારંગી રંગ મેળવે છે. સહેજ એસિડિક અને તટસ્થ વાતાવરણમાં ( pH 4 થી 7 સુધી) સોલ્યુશન તેનો રંગ બદલશે નહીં. Phenolphthalein ની મદદથી તમે આલ્કલાઇન વાતાવરણને ઓળખી શકો છો. કારણ કે ઉત્પાદન સોલ્યુશનમાં કિરમજી રંગ લે છે, pH જે 8 થી 10 સુધી છે ( આલ્કલાઇન સોલ્યુશન). જો મૂલ્યો pH મૂલ્ય 11 થી 14 સુધી, પછી સૂચક દવાના રંગને કોઈપણ રીતે અસર કરશે નહીં. ફેનોલ્ફથાલિનનો ઉપયોગ થાય છે ટાઇટ્રેશન વિવિધ જલીય ઉકેલોવી વિશ્લેષણાત્મક રસાયણશાસ્ત્ર , દારૂમાં ઓગળેલા પદાર્થનો ઉપયોગ સામાન્ય રીતે થાય છે.
ફેનોલ્ફથાલીનનો દવામાં પણ વ્યાપકપણે ઉપયોગ થાય છે. શું થયું છે પુર્જન ? તે Phenolphthalein માટે સમાનાર્થી છે. છેલ્લી સદીમાં, પદાર્થનો સક્રિય રીતે રેચક તરીકે ઉપયોગ થતો હતો. દવા સક્રિયપણે આંતરડાની ગતિશીલતાને ઉત્તેજિત કરે છે. હવે પ્યુર્જેન રેચક શરીરમાં એકઠા થવાની ક્ષમતાને કારણે ભાગ્યે જ ઉપયોગમાં લેવાય છે અને કિડનીના કાર્યને પ્રતિકૂળ અસર કરે છે.
ફાર્માકોલોજિકલ અસર
રેચક.
ફાર્માકોડાયનેમિક્સ અને ફાર્માકોકીનેટિક્સ
ફેનોલ્ફથાલિન, તે શું છે?
પરજન એક શક્તિશાળી રેચક છે. તેની ક્રિયાની પદ્ધતિ ઉન્નતીકરણ પર આધારિત છે પેરીસ્ટાલિસિસ આંતરડા આ પદાર્થની ડિપ્રેસન કરવાની ક્ષમતાને કારણે થાય છે સોડિયમ-પોટેશિયમ ATPase , ઉત્તેજક એડેનાઇલ સાયકલેસ અને વધી રહી છે જૈવસંશ્લેષણ . આ પદાર્થ આંતરડાની દિવાલોના સિનેપ્સ અને ચેતા અંતને ઉત્તેજિત કરે છે, વિક્ષેપ પાડે છે. પાણી-ઇલેક્ટ્રોલાઇટ સંતુલન વી જઠરાંત્રિય માર્ગ , પ્રવાહી એકઠું થાય છે.
પ્રથમ ડોઝ પછી, ઉત્પાદનની અસર 24 કલાકની અંદર થાય છે. પદાર્થ શરીરમાં એકઠા થવાનું વલણ ધરાવે છે, કિડની પર બળતરા અસર કરે છે, અને પ્રોકાર્સિનોજેનિક ગુણધર્મો
ઉપયોગ માટે સંકેતો
આ પદાર્થ ધરાવતી તૈયારીઓનો ઉપયોગ ક્રોનિક માટે રેચક તરીકે થાય છે.
બિનસલાહભર્યું
રેચક પુર્જન બિનસલાહભર્યું છે:
- કિડની રોગો માટે;
- સાથે દર્દીઓ આંતરડાની અવરોધ ;
- જ્યારે Phenolphthalein પર;
- જ્યારે દર્દીમાં લક્ષણોનું સંકુલ જોવા મળે છે તીવ્ર પેટ ”.
લાંબા સમય સુધી દવાનો ઉપયોગ કરી શકાતો નથી. વૃદ્ધ લોકોની સારવાર કરતી વખતે ખાસ કાળજી લેવી જોઈએ.
આડઅસરો
પ્યુર્જન ગોળીઓ આનું કારણ બની શકે છે:
- અસાધારણતાને કારણે ઝડપી ધબકારા પાણી-ઇલેક્ટ્રોલાઇટ સંતુલન ;
- આલ્બ્યુમિન્યુરિયા ;
- પતન ;
- લોહીમાં પોટેશિયમના સ્તરમાં ઘટાડો;
- પેશાબના રંગમાં પીળાથી ગુલાબી અથવા ભૂરા રંગમાં ફેરફાર;
- ત્વચા પર ફોલ્લીઓ વગેરે.
પરજેન (પદ્ધતિ અને માત્રા) માટેની સૂચનાઓ
રેચક ગોળીઓ, વિવિધ ડોઝ અથવા મૌખિક વહીવટ માટે પાવડરના સ્વરૂપમાં ઉપલબ્ધ છે.
Phenolphthalein ના ઉપયોગ માટેની સૂચનાઓ
સરેરાશ, પુખ્ત વયના લોકો માટે દૈનિક માત્રા 100 મિલિગ્રામ છે.
બાળકોને તેમની ઉંમર અને વજનના આધારે દરરોજ 50-200 મિલિગ્રામ દવા સૂચવવામાં આવે છે.
24 કલાકની અંદર લઈ શકાય તેવા પદાર્થની મહત્તમ માત્રા 300 મિલિગ્રામ છે.
સારવારનો કોર્સ નિષ્ણાત દ્વારા સૂચવવામાં આવે છે. આ ઘટક ધરાવતી દવાઓ લાંબા સમય સુધી ન લેવી જોઈએ.
ઓવરડોઝ
દવા કારણ બની શકે છે હેમોરહોઇડલ રક્તસ્રાવ , નોંધપાત્ર ઘટાડો, સુધી પતન , પેશાબમાં પ્રોટીનનો દેખાવ. ઓવરડોઝના કિસ્સામાં, ડૉક્ટરની સલાહ લેવાની ભલામણ કરવામાં આવે છે.
ક્રિયાપ્રતિક્રિયા
જો ઉપચાર એકસાથે હાથ ધરવામાં આવે તો ફેનોલ્ફથાલિન શરીરમાં પોટેશિયમ રીટેન્શન તરફ દોરી શકે છે પોટેશિયમ-સ્પેરિંગ મૂત્રવર્ધક પદાર્થ .
વેચાણની શરતો
કોઈ પ્રિસ્ક્રિપ્શનની જરૂર નથી.
સંગ્રહ શરતો
ફેનોલ્ફથાલિન પર આધારિત તૈયારીઓને સૂકી, અંધારાવાળી જગ્યાએ, બાળકોથી સુરક્ષિત, ઓરડાના તાપમાને સ્ટોર કરો.
તારીખ પહેલાં શ્રેષ્ઠ
પાવડરની અમર્યાદિત શેલ્ફ લાઇફ છે; ગોળીઓ 10 વર્ષ સુધી સંગ્રહિત કરી શકાય છે (સિવાય કે પેકેજિંગ પર ઉત્પાદક દ્વારા સૂચવવામાં આવ્યું ન હોય).
ખાસ નિર્દેશો
આજકાલ, ફેનોલ્ફથાલીન ધરાવતી દવાઓનો દવામાં ભાગ્યે જ ઉપયોગ થાય છે. મોટેભાગે, અન્ય આધુનિક, સલામત રેચકને પ્રાધાન્ય આપવામાં આવે છે.
બાળકો માટે
પદાર્થ સાવધાની સાથે સૂચવવામાં આવે છે. બાળકની ઉંમર અને વજનના આધારે ડોઝ એડજસ્ટમેન્ટ જરૂરી છે.
વૃદ્ધ
વ્યક્તિઓમાં ઉંમર લાયકઆ દવા લેવાની અસર 24-72 કલાકની અંદર જોવા મળે છે.
વજન ઘટાડવા માટે
છેલ્લી સદીની શરૂઆતમાં, આ પદાર્થનો ઉપયોગ વજન ઘટાડવા માટે થતો હતો. હવે એવી અન્ય દવાઓ છે જે સમાન અસર ધરાવે છે. આદર્શ આકૃતિની શોધમાં ઘણી છોકરીઓ રેચકનો દુરુપયોગ કરે છે, જે ન કરવું જોઈએ. આ તમારા સ્વાસ્થ્ય માટે જોખમી હોઈ શકે છે.
દવાઓ ધરાવતી (એનાલોગ)
સ્તર 4 ATX કોડ મેળ ખાય છે:
Ex Lax, Purgen, Purgofen, Purgil, Phenaloin, Laxatol, Laxoil.
પુરજન કિંમત, ક્યાં ખરીદવી
જથ્થાબંધમાં ફેનોલ્ફથાલિન પાવડરના સ્વરૂપમાં રેચકની કિંમત 1 કિલો દીઠ આશરે 1,700 રુબેલ્સ છે.
મોસ્કોમાં ઉત્પાદન ખરીદવું લગભગ અશક્ય છે, કારણ કે તેના પર આધારિત દવાઓ લાંબા સમયથી ફાર્મસીઓને સપ્લાય કરવામાં આવી નથી.
ફેનોલ્ફથાલિનની કિંમત ઉત્પાદકના આધારે બદલાઈ શકે છે.
