Замерзание растворов. Растворы замерзают при более низкой температуре чем чистый растворитель
Растворы кипят при более высокой температуре чем чистый растворитель;
Следствия из закона Рауля
Растворы, которые строго подчиняются закону Рауля, являются идеальными. Для реальных растворов неэлектролитов закон Рауля соблюдается тем точнее, чем более разбавленным является этот раствор. По мере повышения концентрации растворенного вещества для большинства растворов наблюдаются отклонения от закона Рауля.
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Не подчиняются закону Рауля растворы электролитов (кислот, оснований, солей). Причем, даже в тех случаях, когда они являются разбавленными. Причина этого явления будет нами рассмотрена позже.
Из закона Рауля вытекают два важных следствия:
Рассмотрим их более подробно.
Кипение является физическим процессом перехода жидкости в газообразное состояние или пар, при котором пузырьки газа образуются по всему объему жидкости.
Жидкость закипает, когда давление ее насыщенного пара становится равным внешнему давлению. Если внешнее давление (например, атмосферное) не изменяется, а сама жидкость является индивидуальным и химически чистым веществом, то кипение ее в открытом подогреваемом сосуде происходит при постоянной температуре до тех пор, пока полностью не исчезнет жидкая фаза.
Так при атмосферном давлении равном 101,325 кПа температура кипения очищенной (дистиллированной) воды равна 100 о С или 373,16 K.
Если же в Н 2 О растворить какое-нибудь нелетучее вещество, то давление ее насыщенного пара понизится. Чтобы получившийся раствор закипел, необходимо нагреть его до температуры выше, чем 373,16 K, т.к., только при таких условиях давление насыщенного пара растворителя снова станет равным атмосферному.
Замерзание или кристаллизация представляет собой физическое явление, сопровождающееся превращением жидкости в твердое вещество. Причем кристаллические структуры образуются во всем объеме жидкости.
Процесс замерзания начинается, если давление насыщенного пара над жидкостью становится равным давлению насыщенного пара над ее твердыми кристалликами.
Если внешнее (атмосферное) давление остается постоянным, а жидкость не содержит посторонних примесей, то в процессе кристаллизации температура охлаждаемой жидкости будет оставаться постоянной до тех пор, пока жидкая фаза полностью не превратится в твердую.
При атмосферном давлении равном 101,325 кПа дистиллированная вода замерзает при 0 о С (273,16 K). Давление насыщенного пара воды надо льдом и жидкостью в этом случае равно 613,3 Па.
Для водного раствора давление насыщенного пара растворителя при 0 о С будет меньше чем 613,3 Па, а надо льдом остается неизменным. Опущенный в такой раствор лед будет быстро таять, вследствие конденсации над ним избыточного количества пара.
Лишь при понижении температуры снова можно уравнять давление насыщенного пара над жидкой и твердой фазой и вызвать процесс кристаллизации.
Опытным путем было установлено, что повышение температуры кипения (Dt кип.) и понижение температуры замерзания раствора (Dt зам.) по сравнению с чистым растворителем прямо пропорционально моляльной концентрации растворенного вещества. Математически это можно записать следующим образом:
t кип. р-ра – t кип. р-теля = Dt кип. = Em
t зам. р-теля – t зам. р-ра = Dt зам. = Km
где m – моляльная концентрация растворенного вещества; E и K – соответственно, эбуллиоскопическая (лат. ebbulio – выкипаю) и криоскопическая (греч. «криос» - холод) константы, значения которых зависят только от природы растворителя (табл. 7).
Таблица 7. Эбуллиоскопические E и криоскопические K константы некоторых растворителей (град/моль)
Рис. 7.12. Понижение давления пара воды над раствором
Сплошные линии выражают границы фазовых полей для чистой воды. Напомним, что линия 1 отображает равновесие “жидкость - пар”. После добавления к воде нелетучего растворённого вещества давление пара над раствором (пунктирная линия 2 ) понижается при любой температуре.
Любая жидкость будет замерзать (отвердевать) тогда, когда давление пара над ней сравнивается с давлением пара над твёрдой фазой (в случае воды - надо льдом). Поэтому и температура замерзания раствора Т зам будет меньше, чем температура замерзания Т о зам чистого растворителя - воды.
Ф.М.Рауль (1883) опытным путём установил, что понижение температуры замерзания (иначе - депрессия замерзания )
DT зам = Т о зам - Т зам ,
вызываемое разными растворёнными веществами, взятыми в одинаковых молярных количествах, одинаково для данного растворителя. Так, для 0,1m водных растворов некоторых веществ наблюдаются следующие температуры затвердевания:
Вещество T зам , o C
Пероксид водорода H 2 O 2 - 0,186
Метиловый спирт CH 3 OH - 0,181
Этиловый спирт C 2 H 5 OH - 0,183
Сахароза C 12 H 22 O 11 - 0,186
Декстроза C 6 H 12 O 6 - 0,188
При различных концентрациях растворённых веществ DT зам пропорционально их моляльной концентрации m :
DT зам = К кр m (7.1)
Коэффициент пропорциональности К кр в уравнении (7.1), называемый криоскопической константой , представляет собой молярное понижение температуры замерзания. Эта величина численно равна понижению температуры замерзания раствора, содержащего 1 моль растворённого вещества в 1 килограмме растворителя при условии, что раствор обладает свойствами идеального. Криоскопическая константа является характеристикой растворителя, её величина не зависит от природы растворённого вещества.
Моляльная концентрацияможет быть выражена через массы растворённого вещества (b) и растворителя (а) в граммах (см. п. 7.3):
где М - молярная масса растворённого вещества (г/моль). Подставляя это выражение в уравнение (7.1), получим
Из этого уравнения следует одно очень важное обстоятельство, а именно: зная точный состав разбавленного раствора и измеряя температуры замерзания чистого растворителя и раствора, можно рассчитать молярную массу растворённого вещества:
Уравнение (7.2) лежит в основе криоскопического (или криометрического )метода определения молярной массы веществ по понижению температуры замерзания их растворов.Криометрический метод находит широкое применение в лабораторной практике, в том числе и в фармации.
Принцип его заключается в следующем. Вначале измеряется температура плавления (или замерзания) точной навески а выбранного растворителя. Затем к растворителю добавляется точная навеска исследуемого вещества b и измеряется температура плавления полученной смеси (или температура замерзания, если вещество, выбранное в качестве растворителя, имеет низкую температуру плавления). Навеска растворённого вещества должна быть намного меньше, чем навеска растворителя, чтобы раствор получился разбавленным. Полученное значение DT зам подставляется в уравнение (7.2) и с его помощью вычисляется молярная масса исследуемого вещества. В простейшем случае в качестве растворителя может быть взята дистиллированная вода. Однако из-за малого значения криоскопической константы и низкой температуры замерзания, требующей применения криостатов или специальных охлаждающих смесей, вода применяется лишь для приблизительной оценки молярной массы веществ. Как правило, в особенности при изучении сложных органических веществ с большой молярной массой, в качестве растворителей выбираются другие вещества. При этом особое значение имеет камфора с её большой криоскопической константой. Главным условием для криометрического определения является полная растворимость исследуемого вещества в выбранном растворителе. Ниже приведены криоскопические константы некоторых веществ (при нормальном атмосферном давлении):
Вещество Т пл о С Криоскопическая
константа К кр
Бензол 5,5 5,12
Уксусная кислота 16,8 3,90
Циклогексан 6,5 20
Камфора 178,5 39,7
Криоскопический метод используется и для определения чистоты веществ. Это основано на том, что присутствие даже небольшой примеси снижает температуру плавления образца исследуемого вещества. Поэтому в химии (а также и в фармации) одним из критериев чистоты вещества является достижение максимальной температуры плавления, не возрастающей более после дополнительных операций очистки.
Ещё одно важное применение криоскопического эффекта - приготовление охлаждающих смесей. При определённом соотношении воды (или снега) и некоторых неорганических солей можно получить низкие температуры, удерживающиеся в течение достаточно длительного времени. Например, смесь, состоящая из 100 г снега и 143 г CaCl 2 ·6Н 2 О, позволяет получить температуру -55 о С.
В районах с холодным климатом в воду, используемую в автомобильных радиаторах, для предотвращения её замерзания зимой добавляются антифризы - такие вещества как спирт, глицерин или этиленгликоль. Лёд, намёрзший на проезжей части дорог и на тротуарах, легко плавится, когда его посыпают поваренной солью или золой, что тоже основано на криоскопическом эффекте. Следует только помнить, что неумеренное применение в этих целях соли может вызвать засоление близлежащих водоёмов и почв на их берегах и, как следствие, экологические нарушения.
Замерзание представляет собой фазовый переход, при котором происходит превращение жидкости в твердое вещество. Температурой замерзания 9кристаллизации) жидкости называют ту температуру, при которой давление насыщенного пара над жидкостью равно давлению насыщенного пара над выпадающими из нее кристаллами твердой фазы.
При этой температуре и соответствующем ей давлении насыщенного пара скорость кристаллизации равна скорости плавления и обе эти фазы могут сосуществовать в течение длительного времени.
Еще М.В. Ломоносов заметил, что разбавленный раствор замерзает при температуре более низкой, чем чистый растворитель. Так, морская вода замерзает не при 273 К, а при несколько более низкой температуре. Многочисленные эксперименты показали, что такое изменение температуры замерзания раствора можно рассматривать как общее правило.
Процессы замерзания и кипения были детально изучены Раулем и представлены в виде закона, который в последствии был назван вторым законом Рауля.
рассмотрим простейший вывод этого закона. На рис.2 показана диаграмма, выражающая зависимость давления насыщенног пара от температуры над чистым растворителем и над раствором.
Кривая 0А – зависимость давления насыщенного пара чистой воды от температуры.
Кривая ВС, ДЕ – зависимость давления насыщенного пара воды над растворами с различными концентрациями растворенного вещества
0Д – выражает температурную зависимость давления насыщенного пара воды над льдом.
Из рис.2 видно, что давление пара над раствором при 273 К ниже, чем над водой, но оно не равно давлению пара над льдом при той же температуре. Лишь при температуре ниже 273 К (Т’з) давление пара над раствором уменьшается настолько, что становится равным давлению пара над льдом. Этому соответствует точка В. При более высоких концентрациях раствора кривые, выражающие зависимость давления пара воды над раствором от температуры, располагаются ниже кривой ВС, но параллельно ей.
Введем следующий обозначения:
Р 0 А – давление пара над чистым растворителем при 273 К
Р А – давление пара над раствором при температуре его замерзания Т’ з
Из прямоугольного треугольника ВОК определяем
Из рисунка 2 видно, что , где - понижение температуры замерзания раствора.
Подставляя эти значения в выше записанное уравнение, получим

 (3)
(3)
Из первого закона Рауля для сильно разбавленных растворов имеем
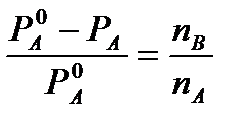
 и
и  (4)
(4)
где n А, n В, m А сохраняют ранее присвоенные обозначения (см. выше). Если через М 0 А обозначить молярную массу растворителя, то

При подстановке этого выражения в уравнение (4) получим

Умножим и разделим правую часть этого выражения на 1000, тогда
 (5)
(5)
Объединим все постоянные величины в уравнении (5) в одну постоянную К ( ), получим следующее выражение
), получим следующее выражение
 (6)
(6)
Выражение  представляет собой моляльность раствора Св.
представляет собой моляльность раствора Св.
Подставив это выражение в уравнение (6), получим окончательное уравнение.
 (7)
(7)
Это и есть математическое выражение второго закона Рауля: понижение температуры замерзания или повышение температуры кипения растворов прямо пропорционально его моляльной концентрации.
Коэффициент К в уравнении (7) носит название криоскопической постоянной, показывает молярное понижение температуры замерзания раствора, является индивидуальной характеристикой растворителя (К Н2О =1,86º) и имеет ту же размерность, что и Е (Кº·кг·моль -1)
Метод исследования, основанный на измерении понижения температуры замерзания растворов, называется криоскопическим. Он также, как и эбуллиоскопический позволяет вычислить молярную массу растворенного вещества

На рис.3 изображен прибор, предназначенный для измерения температуры замерзания растворов.
 |
ОСМОС И ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ .
Весьма важным в биологическом отношении свойством растворов является осмос.
В природе часто растворы отделяются от растворителя мембранами, проницаемыми лишь дл я частиц растворителя. В этом случае растворенное вещество диффундировать в растворитель не может, и будет наблюдаться только переход растворителя в в раствор, т.е. растворитель будет перемещаться в обоих направлениях, но все же в раствор его будет переходить немного больше, чем в обратном направлении.
Механизм осмоса легко представить на основе изотермической перегонки. Пусть полупроницаемая мембрана, имеющая микропоры, разделяет растворитель и раствор с концентрацией С в (рис.4)

В пору, ограниченную с одной стороны растворителем, а с другой раствором, идет испарение. Вследствие повышения по закону Рауля упругости насыщенного пара со стороны растворителя из парообразной фазы концентрируется, переходя в раствор.
В результате осмоса увеличивается объем раствора, и его концентрация постепенно снижается; проникающий через мембрану в раствор растворитель увеличивает столб жидкости h и, следовательно, повышает гидростатическое давление (см. рис.5). Одновременно будет возрастать число молекул растворителя, перемещающихся через мембрану в обратном направлении, т.е. из раствора в растворитель. постепенно гидростатическое давление и разбавление раствора достигнут величин, при которых количество молекул растворителя, перемещающихся в обоих направлениях, уравняется и наступит осмотическое равновесие. Развившееся в результате осмоса избыточное гидростатичекое давление, измеряемое столбом раствора высотой h, при котором устанавливается осмотическое равновесие, называют осмотическим давлением.
![]() рис. 5
рис. 5
Полупроницаемыми для многих растворов являются мембраны из коллодия, целлофана, железистосинеродистой меди и др.
ЗАКОНЫ ОСМОТИЧЕСКОГО ДАВЛЕНИЯ .
Изучение законов осмотического давления выявило их полную аналогию с газовыми законами. Для разбавленных растворов неэлектролитов их можно сформулировать так:
при постоянной температуре осмотическое давление прямо пропорционально молярной концентрации растворенного вещества (аналогия с законом Бойля-Мариотта):

при постоянной молярной концентрации осмотическое давление прямо пропорционально абсолютной температуре (аналогия с законом Гей-Люссака):

Из двух этих законов следует, что при одинаковых молярных концентрациях и температуре растворы разных неэлектролитов создают одинаковое осмотическое давление, т.е. эквимолярные растворы неэлектролитов изотоничны (аналогия с законом Авогадро).
Вант-Гоффом был предложен объединенный закон для осмотического давления в растворах (аналогично объединенного газовому закону Менделеева-Клайперона): Осмотическое давление разбавленных растворов неэлектролитов прямо пропорционально молярной концентрации, коэффициенту пропорциональности и абсолютной температуре:
так как с=n/V, где n – число молей неэлектролита, а V – объем раствора, то  или
или ![]()
Разбавленные растворы неэлектролитов.
Коллигативные свойства расвторов
Давление насыщенного пара
Равновесие “индивидуальная жидкость-пар” описывается константой равновесия
K p =p о нас. пара /a о ж (1)
Отсюда, поскольку активность индивидуальной жидкости а о ж =1, то давление насыщенного пара равно
p о пара = K p (2)
и зависит только от температуры.
Поскольку активность растворителя равна произведению a о ж на его молярную долю N 1 или же на (1 - N 2), где N 2 – молярная доля растворённого вещества, то константа равновесия равна:
K p =p 1 о =(p 1 /a о ж N 1)=(p 1 /1-N 2) (3)
Отсюда получаем закон Рауля (1886):
p 1 =p 1 о (1-N 2)=p 1 о N 1 (4)
(p 1 о -p 1)/p 1 о)=N 2 (5)
Давление насыщенного пара раствора равно его давлению над чистым растворителем, умноженному на мольную долю растворителя.
Относительное понижение давления насыщенного пара растворителя над чистым раствором равно мольной доле растворённого вещества.
Таким образом, давление пара уже зависит от содержания растворенного вещества. Закон Рауля можно использовать для определения молярной массы растворённого вещества:
Dp/p 1 ° =N 2 =n 2 /n 1 +n 2 ≈m 2 M 1 /m 1 M 2 (6)
Температура кипения растворов
Жидкость кипит, когда давление насыщенного пара становится равным внешнему давлению. Так как, по закону Рауля, давление пара над раствором меньше давления пара над чистым растворителем, то температура кипения раствора выше температуры кипения чистого растворителя.
Эксперименты показали, что для разбавленных растворов неэлектролитов:
где DТ - повышение температуры кипения раствора по сравнению с чистым растворителем, b - моляльность ([E]=К. Кг/моль) E- эбулиоскопическая постоянная (от ebbulio (лат.)- выкипать), зависящая только от свойств растворителя (его температуры кипения T о и удельная теплота испарения L 1):
E=RT о 2 /1000L 1 (8)
Температура кипения чистого растворителя имеет определённое значение при фиксированном внешнем давлении. Температура кипения раствора не постоянна - она растёт по мере кипения, так как за счёт испарения растворителя концентрация раствора увеличивается. При этом давление насыщенного пара всё время уменьшается. Поэтому температурой кипения раствора принято считать температуру, отвечающую появлению в нём первого пузырька пара.
Температура замерзания растворов
Над раствором давление пара растворителя ниже, чем давление пара над чистым растворителем. Давление пара над твёрдой и жидкой фазами тоже будет меньше. Это может быть только при более низкой температуре замерзания раствора по сравнению с чистым растворителем. Понижение температуры замерзания растворов неэлектролитов по отношению к температуре замерзания чистого растворителя пропорционально моляльности раствора:
где К- криоскопическая постоянная (от греч. “криос”- холод), зависящая только от свойств растворителя:
К=RT о 2 /1000L 1 , (10)
где T о, L * 1 - температура замерзания и удельная теплота плавления чистого растворителя.
Поскольку с затвердеванием растворителя возрастает концентрация растворённого вещества, то температура замерзания раствора непостоянна и уменьшается в ходе процесса. Поэтому за температуру замерзания раствора принимают температуру образования первого кристаллика.
В таблице 2 приведены значения Е и К для некоторых растворителей.
Таблица 2.
Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давление насыщенного пара над кристаллами и над раствором одинаково. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, температура, отвечающая этому условию, всегда будет более низкой, чем температура замерзания чистого растворителя. При этом понижение температуры замерзания раствора ΔT зам не зависит от природы растворенного вещества и определяется лишь соотношением числа частиц растворителя и растворенного вещества.
Можно показать, что понижение температуры замерзания раствора ΔT зам прямо пропорционально моляльной концентрации раствора:
Второй закон Рауля : Повышение Ткип и понижение Тзам р-ра пропорциональны числу частиц растворенного вещества и не зависят от его природы.
Конец работы -
Эта тема принадлежит разделу:
Лекция № 5. Фазовые равновесия. Растворы неэлектролитов
Газообразное состояние вещества характеризуется слабым взаимодействием между частицами и большими расстояниями между ними Поэтому газы смешиваются... Общее давление газовой смеси равно сумме парциальных давлений всех входящих в...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Все темы данного раздела:
Лекция № 5. Фазовые равновесия. Растворы неэлектролитов.
Фазовые равновесия.
На прошлой лекции мы рассмотрели химическое равновесие, константу равновесия, ее связь с т.д. величинами и факторы, влияющие на сдвиг равновесия.
Двухкомпонентные системы.
Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойс
Образование раствора
Образование раствора является сложным физико-химическим процессом. Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо
Растворимость
Процесс растворения связан с диффузией, т. е. с самопроизвольным распределением частиц одного вещества между частицами другого. При внесении растворяемого вещества в растворитель процесс растворени
Растворимость газов в жидкостях
Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов
Растворы неэлектролитов.
Свойства растворов рассматривают на примере разбавленных растворов, при образовании которых тепловой и объемный эффекты равны 0 (идеальные растворы). В таких растворах частица находятся на большом
Относительное понижение давления насыщенного пара над раствором равно мольной доле растворенного вещества.
Любая жидкость начинает кипеть при температуре, при которой давление ее насыщенного пара достигает величины внешнего давления. Т кип – Т, при которой давление пара= 101,3 кПа.Вода кипит при 100 С,
Осмотическое давление
Если разделить два раствора с различной концентрацией полупроницаемой перегородкой, пропускающей молекулы растворителя, но препятствующей переходу частиц растворённого вещества, будет наблюдаться я
