Quels systèmes sont appelés solutions. Sujet : La doctrine des solutions. Classement des solutions
Solutions- une forme galénique liquide obtenue par dissolution de substances liquides, solides ou gazeuses dans un solvant approprié. Selon la classification dispersologique, les solutions sont des systèmes librement dispersés avec un milieu de dispersion liquide.
Dans la pratique pharmaceutique, les solutions représentent en moyenne jusqu'à 30 % de la formulation pharmaceutique totale. Grand densité spécifique Les solutions, comme toutes les formes galéniques liquides, s'expliquent par un certain nombre de leurs avantages par rapport aux autres formes galéniques.
Avantages des solutions par rapport aux formes galéniques solides :
Haute biodisponibilité ;
Propriétés irritantes réduites ;
Début rapide de l'effet thérapeutique ;
Possibilité de correction gustative ;
Simplicité et facilité d'utilisation.
Inconvénients des solutions par rapport aux formes galéniques solides :
Durée de conservation courte ;
La nécessité de faire évoluer la composition des excipients. Les inconvénients inhérents aux solutions n’affectent pas leur utilisation généralisée.
Classement des solutions présenté dans le schéma.
Les propriétés des solutions sont présentées dans le tableau. 12.1.
Tableau 12.1.Propriétés des solutions
Nom des solutions | Phase dispersée | Taille des particules | Exemples de SDF | Propriétés |
Véritables solutions de substances de faible poids moléculaire | Molécules d'ions | 1 nm | Solutions de glucose, chlorure de sodium | Ils passent à travers le filtre, à travers la membrane de dialyse, et ne changent pas leurs propriétés lorsqu'ils sont centrifugés ou chauffés. Une précipitation (relargage) avec de l'alcool, de l'acétone, des électrolytes saturés est possible |
Vrai solutions Marine | Molécules | 1-100 nm | Solution pepsine, gélatine | Ils traversent le filtre, ne traversent pas la membrane de dialyse et changent de propriétés lorsqu'ils sont centrifugés ou chauffés. Relargage possible (coacervation) avec alcool, acétone, électrolytes saturés |
Solutions colloïdales | Micelles | 1-100 nm | Solutions de colgol |
12.1. SOLVANTS
Pour préparer la solution, des substances médicinales et des solvants sont nécessaires.
Solvants- composés chimiques individuels ou mélanges de ceux-ci capables de se dissoudre diverses substances, c'est-à-dire former avec eux systèmes homogènes- des solutions.
Les solvants sont divisés en 2 classes :
Eau (purifiée ou pour injection);
Solvants organiques (alcool éthylique, glycérine, chloroforme, éther, etc.).
Exigences de base pour les solvants :
Pouvoir solvant ;
Indifférence chimique et innocuité biologique ;
Aucun goût ni odeur désagréable ;
Pureté microbiologique ;
Prix bas et disponibilité.
12.1.1. Eau
En pharmacie, les principaux solvants entrant dans la fabrication des formes galéniques sont l’eau purifiée et l’eau pour préparations injectables.
12.1.2. Eau purifiée
Auparavant, on utilisait le terme « eau distillée », c'est-à-dire eau obtenue par distillation. Actuellement, de nouvelles technologies ont été développées qui permettent d'obtenir de l'eau de la qualité requise en filtrant les ions à travers une membrane. Donc GF X ! le terme « eau distillée » a été remplacé par le terme plus général « eau purifiée ». Ce terme exclut la définition
méthode d'obtention de l'eau et établit exigences généralesà sa qualité.
Il existe 2 manières d'obtenir de l'eau purifiée :
Distillation;
Osmose inverse. Équipement pour la production d'eau
purifié
Distillateurs d'eau Les distillateurs d'eau DE (Fig. 12.1) sont conçus pour produire de l'eau purifiée. Le corps et les parties principales sont en acier inoxydable. Les caractéristiques techniques sont présentées dans le tableau. 12.2.
Le distillateur se compose des blocs principaux suivants (Fig. 12.2) : refroidisseur (condenseur), égaliseur, chambre d'évaporation (évaporateur), radiateurs électriques, capteur de niveau, unité de commande.
Pour la production de petits volumes d'eau purifiée, il est recommandé

Riz. 12.1.Apparition des distillateurs d’eau DE
Tableau 12.2.Basique spécifications techniques Distillateurs DE

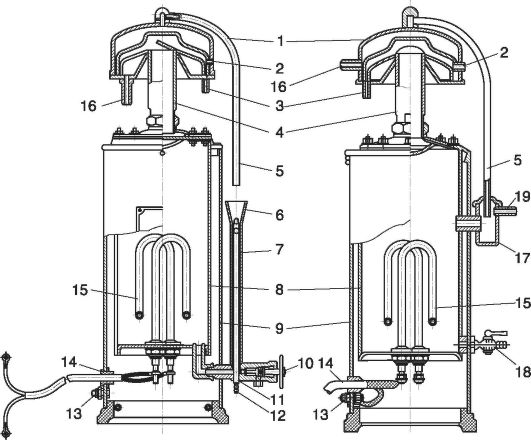
Riz. 12.2. Distillateur:
1 - condensateur ; 2 - trou; 3 - mamelon; 4 - tuyau; 5 - tube de vidange ; 6 - entonnoir ; 7 - égaliseur ; 8 - évaporateur ; 9 - boîtier; 10 - appuyez sur ; 11 - croix; 12 - trou dans le mamelon ; 13 - boulon de mise à la terre ; 14 - fil; 15 - élément chauffant; 16 - mamelon; 17 - réservoir égaliseur ; 18 - robinet de vidange ; 19 - raccord d'évacuation d'eau

Riz. 12.3.Distillateur d'eau de table
Vous utilisez des distillateurs de comptoir tels que MELAdest ? 65 de MELAG (Fig. 12.3). Le distillateur permet d'obtenir une eau purifiée répondant aux exigences de la pharmacopée. Productivité - 0,7 l/heure. Tailles - 23. 38 cm. Puissance - 500 W. Les principaux avantages sont une faible consommation d'énergie et une productivité qui permet d'utiliser le distillateur pour réaliser seulement quelques recettes.
Règles d'obtention d'eau purifiée par distillation
1. La réception et le stockage de l'eau purifiée doivent être effectués dans des locaux spéciaux
dans un local spécialement aménagé à cet effet en utilisant des distillateurs d'eau ou d'autres installations autorisées à cet effet.
2. Lorsque vous recevez de l'eau à l'aide d'un distillateur aquatique, chaque jour avant de commencer le travail :
Le distillateur et les pipelines sont cuits à la vapeur pendant 10 à 15 minutes à vannes fermées fournir de l'eau au condenseur ;
En 15 à 20 minutes, les premières portions d'eau sont jetées.
3. L'eau obtenue, purifiée et destinée à l'injection, est collectée dans des collecteurs industriels propres, stérilisés ou traités à la vapeur, fabriqués à partir de matériaux qui ne modifient pas les propriétés de l'eau et la protègent des particules étrangères et des contaminants microbiologiques (à titre exceptionnel - en verre cylindres). Les collections doivent porter une inscription claire : « Eau purifiée », « Eau pour injection ». Une étiquette indiquant la date de réception, le numéro d'analyse et la signature de la personne effectuant le contrôle est apposée sur la collecte d'eau. Si plusieurs collections sont utilisées simultanément, elles sont numérotées. L'étiquette des récipients de collecte et de stockage d'eau pour préparations injectables doit indiquer que leur contenu n'est pas stérilisé.
4. Les collections en verre sont hermétiquement fermées par des bouchons à 2 trous : un pour le tube dans lequel s'écoule l'eau, l'autre pour le tube en verre dans lequel est inséré un coton-tige stérile (changé quotidiennement).
5. L'eau purifiée est utilisée fraîchement préparée ou conservée dans des récipients fermés pendant 3 jours maximum.
Exigences du Fonds d'État pour la qualité de l'eau purifiée
L'eau purifiée de chaque cylindre est analysée quotidiennement pour vérifier l'absence de chlorures, de sulfates et de sels de calcium. Trimestriellement, l'eau purifiée est envoyée au laboratoire territorial de contrôle et d'analyse pour une analyse chimique complète.
L'eau purifiée doit être incolore, transparente, inodore et insipide. La valeur du pH peut fluctuer entre 5,0 et 6,8. Le résidu sec ne doit pas dépasser 0,001 % (soit 1 mg dans 100 ml d'eau). L'eau ne doit pas contenir de substances réductrices (en faisant bouillir 100 ml d'eau pendant 10 minutes avec 2 ml d'acide sulfurique dilué et 1 ml de solution de permanganate de potassium 0,01 M, l'eau doit rester colorée rose), nitrates, nitrites, chlorures, sulfates, calcium, métaux lourds, dioxyde de carbone. Seules des traces d'ammoniac sont autorisées (pas plus de 0,00002 %).
La pureté microbiologique de l'eau purifiée doit répondre aux exigences de l'eau potable. Il est permis de ne pas contenir plus de 100 micro-organismes par ml en l'absence de bactéries de la famille. Enterobacteriaceae, P. aeruginosa, S. aureus.
12.1.3. Eau pour préparations injectables
Pour la fabrication de solutions injectables, on utilise de l'eau pour préparations injectables, qui doit réussir le test de l'eau purifiée et doit également être stérile et apyrogène.
L'eau pour préparations injectables est-elle obtenue dans des conditions aseptiques sur la base d'un arrêté du ministère de la Santé ? 309. La préparation de l'eau pour préparations injectables s'effectue dans la salle de distillation de l'unité aseptique, où il est strictement interdit d'effectuer tout travail non lié à la distillation de l'eau.
L'eau pour préparations injectables est obtenue à l'aide de distillateurs d'eau ou d'unités d'osmose inverse conformément aux instructions qui y sont jointes.
On sait que les substances pyrogènes ne sont pas volatiles et ne peuvent pas être distillées avec de la vapeur d'eau. La contamination du distillat par des substances pyrogènes se produit par le transfert de minuscules gouttes d'eau ou leur élimination par un courant de vapeur dans le condenseur. Par conséquent, la tâche principale pour obtenir de l’eau pour injection est de séparer les gouttelettes d’eau de la phase vapeur. À cet effet, les distillateurs d'eau AA-1 (Fig. 12.4) disposent de séparateurs (8), où la vapeur parcourt un long chemin sinueux et perd progressivement la phase gouttelette-liquide sur le chemin du condenseur.
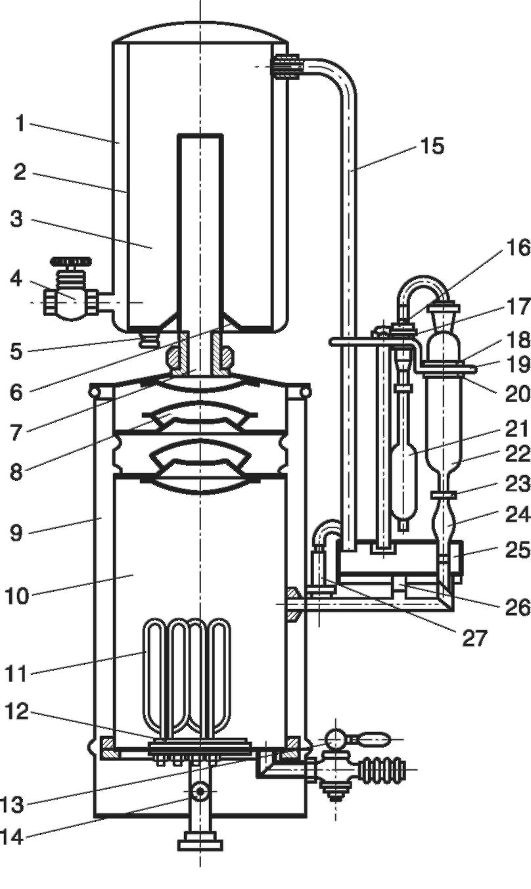
Riz. 12.4.Distillateur d'eau AA-1
Les parties principales du distillateur d'eau AA-1 sont la chambre d'évaporation (10 ) avec séparateur (8), condenseur (1-6 ), collecteur égaliseur (25) et tableau électrique. La chambre d'évaporation (10) est protégée de l'extérieur par une enveloppe en acier (9), conçue pour réduire les pertes de chaleur et protéger le personnel d'exploitation des brûlures. Vers le bas (12 ) la chambre est équipée de quatre radiateurs électriques (11) et de bords de réarmement (B). Dans la chambre d'évaporation (10) eau (avec produits chimiques ajoutés) (14 ), chauffé par des radiateurs électriques (11), se transforme en vapeur qui, à travers les séparateurs (8) et le tube de vapeur (7) entre dans la chambre de condensation (3), refroidi

Riz. 12.5.Alambics en verre
tirer eau froide (15), et, en se condensant, se transforme en eau apyrogène.
Pour obtenir de l'eau apyrogène du plus haut degré de déminéralisation, des distillateurs en verre Sanyo sont utilisés (Fig. 12.5). Le distillateur est doté d'un piège à vapeur breveté, fournissant un distillat apyrogène de la plus haute pureté ; pH 5,6-6,0. Productivité - 8 l/h.
Eau purifiée pour préparations injectables (déminéralisée)
Eau déminéralisée (Aqua déminéralisée) dans la pratique médicale, il est utilisé avec de l'eau pour préparations injectables pour produire des solutions injectables.
L’eau déminéralisée pour solutions injectables est obtenue en faisant passer l’eau de source à travers une unité d’osmose inverse et un filtre stérilisant. Au stade osmose inverse l'eau est débarrassée composés organiques et des sels. L'élimination des impuretés se produit en faisant passer de l'eau à travers une membrane semi-perméable à une pression supérieure à la pression osmotique. Pour augmenter l'efficacité du processus, un apport tangentiel d'eau à la surface de la membrane lors de la recirculation est utilisé. L'équipement est constitué de colonnes connectées en série (Fig. 12.6), constituées d'un système de filtres à membrane enroulés d'une certaine manière. Les membranes ont des pores de 0,0005 à 0,001 mm. Les systèmes d'osmose inverse sont surveillés en mesurant la conductivité électrique spécifique de l'eau quittant le système.
Stockage de l'eau pour préparations injectables
L'eau injectable obtenue est collectée dans des récipients en verre propres, stérilisés ou traités à la vapeur ou dans des récipients spéciaux (Fig. 12.7). Les contenants doivent être clairement étiquetés « Eau pour injection ». Le récipient de stockage de l'eau pour préparations injectables doit être équipé de :
Agitateur ;
Veste pour fournir de la vapeur et de l'eau de refroidissement ;
Un système de douche pour assurer un mouillage continu de toute la surface intérieure de la cuve ;
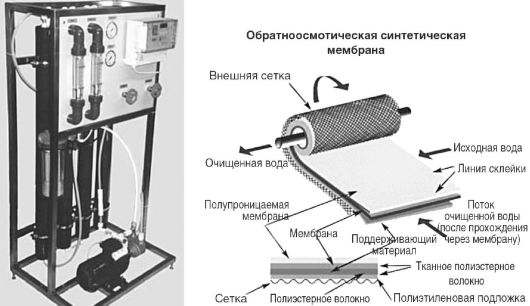
Riz. 12.6.Unités d'osmose inverse "Apyrogen-20" et membrane d'osmose inverse

Riz. 12.7.Réservoir de stockage d'injection d'eau à circulation continue pour la production industrielle
Système de thermostat ;
Filtre à air hydrophobe ;
Membrane explosive ;
Manomètre ;
Système de contrôle de niveau. De l'eau pour injection est utilisée
fraîchement préparé ou conservé à une température de 5 à 10 °C ou de 80 à 95 °C dans des récipients fermés constitués de matériaux qui ne modifient pas les propriétés de l'eau, la protégeant des impuretés mécaniques et des contaminants microbiologiques, pendant 24 heures maximum . Si nécessaire Pour le stockage à long terme de l'eau injectable, il est nécessaire d'organiser sa circulation à une température comprise entre 85 et 90 C.
Exigences relatives à la qualité de l'eau pour préparations injectables A. Absence de substances pyrogènes
Substances pyrogènes (grec. pyr- feu, lat. génération- naissance) sont appelés produits de l'activité vitale et de la décomposition des micro-organismes, cellules microbiennes mortes. En termes de composition chimique, les substances pyrogènes sont des composés de haut poids moléculaire de nature lipopolysaccharide avec des tailles de particules allant de 50 nm à 1 micron. Il a été établi que les substances pyrogènes sont formées principalement par des bactéries à Gram négatif.
L'injection d'une solution contenant des substances pyrogènes provoque un effet pyrogène (augmentation de la température corporelle, fièvre). Les réactions pyrogènes les plus graves sont observées lors d'injections intravasculaires, rachidiennes et intracrâniennes.
Les substances pyrogènes sont des substances thermostables ; ils ne sont détruits que lorsqu'ils sont chauffés dans des stérilisateurs à air sec à une température de 250 C pendant 30 minutes. En raison du danger d'un éventuel effet pyrogène, les solutions administrées par voie intraveineuse dans des volumes de 10 ml ou plus (GF) sont testées pour leur pyrogénicité. Une solution de glucose à 5 %, du chlorure de sodium isotonique et une solution de gélatine doivent être vérifiées. Une fois par trimestre, un test de pyrogénicité des solutions et de l'eau injectable sous forme de solution isotonique est réalisé selon la méthode biologique (MF).
Méthode biologique. La solution à tester est administrée à 3 lapins en bonne santé pesant 1,5 à 2,5 kg dans la veine de l'oreille à raison de 10 ml pour 1 kg de poids corporel de lapin. Une solution d'une substance médicinale ou d'eau est considérée comme apyrogène si, après administration, chez aucun des 3 lapins expérimentaux dans 1 des 3 mesures, il n'y a eu une augmentation de la température corporelle de plus de 0,6 °C par rapport à la température corporelle initiale, et au total l'augmentation de température des 3 lapins n'a pas dépassé 1,4°C.
Test Limulus.Outre la méthode biologique officielle de test de pyrogénicité, le test limulus (LALtest), basé sur la formation d'un gel lors de l'interaction de pyrogènes bactériens avec le lysat d'amibocytes, est largement utilisé. Limulus polyphème. Le test LAL est basé sur la capacité du lysat d'amibocytes (cellules hémolymphales d'animaux reliques - limules) à réagir spécifiquement avec les endotoxines des bactéries à Gram négatif. Actuellement
Le test LAL est légalisé par les pharmacopées de nombreux pays et depuis 2009, il a été proposé pour être inclus dans la pharmacopée de la Fédération de Russie comme méthode alternative d'identification des substances pyrogènes. Méthodes de dépyrogénation :
Chimique;
Physico-chimique ;
Enzymatique.
Méthodes chimiques de dépyrogénation :
Décomposition pyrolytique de substances pyrogènes en substances thermostables (dépyrogénation du chlorure de sodium à
180-200 C );
Chauffage dans une solution de peroxyde d'hydrogène à 6% à 100 ? C pendant 1 heure ;
Conserver dans une solution à 0,5-1% de permanganate de potassium acidifiée avec de l'acide sulfurique pendant 25-30 minutes. Pour préparer la solution, ajoutez 6 parties d'une solution d'acide sulfurique à 1,5 % à 10 parties d'une solution à 1 % de permanganate de potassium. Après traitement, les récipients et les tubes sont soigneusement lavés avec de l'eau fraîchement préparée pour préparations injectables.
Méthodes physico-chimiques :
Passage des solutions dans des colonnes avec charbon actif et cellulose ;
Utilisation d'ultrafiltres à membrane à potentiel zêta négatif. Cette méthode pratique pour la production industrielle de solutions d’injection.
B. Contrôle de la qualité de l'eau pour préparations injectables
Sur la base d'un arrêté du ministère de la Santé de la Fédération de Russie ? 309 et MU-78-113 « Préparation, stockage et distribution d'eau purifiée et d'eau pour préparations injectables » du 22 mai 1998, l'eau pour préparations injectables est surveillée quotidiennement conformément aux articles du Fonds d'État « Eau purifiée » et « Eau pour préparations injectables ». Injection » selon la monographie de la pharmacopée (tableau 12.3).
Si la pharmacie dispose d'un système de distribution d'eau par canalisations, l'eau pour injection est soumise à un contrôle supplémentaire dans les canalisations. Dans un système de distribution d'eau purifiée, le débit (pour les systèmes en boucle), la température (pour les systèmes chauds) et la conductivité électrique de l'eau sont soumis à une surveillance continue. De plus, un contrôle de la teneur en carbone organique est souhaitable.
Tableau 12.3. Indicateurs de qualité de l'eau purifiée et de l'eau pour injection selon FS-2619 et FS-2620
Indicateurs | Unités de mesure | Eau purifiée | Eau pour préparations injectables |
Apparence | Liquide transparent incolore, inodore et insipide |
||
pH | 5,0-7,0 | 5,0-7,0 |
|
Résidu sec | <0,001 | <0,001 |
|
Agents réducteurs | Selon la méthode FS | Selon la méthode FS |
|
Dioxyde de carbone | Selon la méthode FS | Selon la méthode FS |
|
Nitrates et nitrites | mg/ml | <0,0002 | <0,0002 |
Ammoniac | mg/ml | <0,0002 | <0,0002 |
Chlorures | mg/ml | <0,0001 | <0,0001 |
Sulfates | mg/ml | <0,003 | <0,003 |
Calcium | mg/ml | <0,0035 | <0,0035 |
Métaux lourds | mg/ml | <0,0005 | <0,0005 |
Microorganismes | unités/ml | <100 при отсутствии бактерий семейства Enterobacteriacea, Staphylococcus aureus, Pseudomonas aeruginosa. | Aucun |
Pyrogénicité | Apyrogène |
12.2. SOLUBILITÉ DES SUBSTANCES PAR GF
La technologie de fabrication des solutions dépend non seulement des propriétés du solvant, mais également de la solubilité de la substance médicamenteuse.
Solubilité- la concentration maximale d'une substance qui peut être complètement dissoute dans un solvant donné à une température et une pression données. Une substance médicamenteuse est considérée comme dissoute si ses particules ne sont pas détectées dans la solution lorsqu'elles sont observées en lumière transmise.
Selon le Fonds mondial, 7 termes ont été établis pour caractériser la solubilité des médicaments (tableau 12.4).
Tableau 12.4.Caractéristiques de solubilité selon GF
12.2.1. Facteurs affectant la solubilité
A. Température
La solubilité de toute substance dépend de la température. La plupart des substances sont endothermiques et absorbent la chaleur lorsqu'elles se dissolvent. Pour ces substances, chauffer la solution augmente la solubilité. Certaines substances (hydroxyde ou glycérophosphate de calcium et carbénicilline de sodium) génèrent de la chaleur lors du processus de dissolution. La solubilité de ces substances diminue avec l'augmentation de la température.
B. Présence d'autres ions
La solubilité diminue presque toujours lorsque des substances ou des ions supplémentaires sont introduits dans la solution (relargage). Cependant, il existe une relation inverse entre l'augmentation de la solubilité lorsque des ions sont introduits dans la solution :
- augmenter la solubilité des protéines globulines, qui sont mieux solubles dans une solution de chlorure de sodium que dans l'eau ;
- dissoudre l'iode dans une solution saturée d'iodure de potassium pour former le complexe KJ 3 ;
- dissoudre du chlorure mercurique dans une solution de chlorure de sodium pour former le composé complexe Na 2 HgCl 4 .


Il en résulte que le phénobarbital de sodium est à l'état dissous à un pH supérieur à 8,3. Une diminution du pH entraînera la précipitation du phénobarbital.
D. Polarité du solvant
La solubilité d’un médicament dans un solvant donné dépend en grande partie de la polarité du solvant. Sur la base de la constante diélectrique, les solvants sont classés comme polaires (e > 50), semi-polaires (e = 20-50) ou non polaires (e = 1-20) (tableau 12.5).
Tableau 12.5.Constante diélectrique des solvants
Solvant | Constante diélectrique, e, 20 ?C |
N-méthylformamide | |
Eau | |
Solution de sorbitol (70%) | |
Sirop (64%) | |
Glycérol | |
Propylène glycol | 32,1 |
Éthanol | |
Polyéthylèneglycol 400 | 12,4 |
Chloroforme | |
Huile de ricin | |
Éther | |
Huile d'olive |
Les solvants polaires dissolvent les sels ou les molécules hautement polaires (dipolaires). Les solvants non polaires dissolvent les molécules non polaires. Les solvants semi-polaires (alcools et cétones) peuvent dissoudre les deux en fonction de leurs propriétés. Ainsi, en pharmacie il existe une règle universelle pour choisir un solvant : "Le semblable se dissout dans le semblable."
Il existe 2 façons d'augmenter la solubilité des substances dans les solvants semi-polaires :
1. En modifiant le pH pour changer la polarité d'une substance (sel ou base). Une augmentation de la concentration en sel entraîne une augmentation
solubilité des sels dans les solvants polaires, des bases dans les solvants non polaires.
2. Mélanger des solvants de différentes polarités pour changer la polarité du solvant.

Exemple 2
Remplacez l'alcool par de la glycérine dans la solution de furatsiline 1:1500. Pour déterminer la constante diélectrique du solvant, des mélanges d'éthanol et d'eau sont préparés. Puis des solutions sont préparées dans ces mélanges, laissées toute la nuit, en observant la précipitation (Tableau 12.6).
Par exemple, aucune précipitation de furatsiline n'a été observée dans un mélange à 60/40 ou plus ; les résultats des expérimentations sont présentés ci-dessous : + (oui), - (non).
Tableau 12.6.L'effet de l'alcool sur la précipitation de la furatsiline
% v/v d'alcool | |||||||||||
Précipitation |


Questions de sécurité
1. Définir des solutions du point de vue de la classification dispersologique.
2. Quelles méthodes existent pour obtenir de l’eau purifiée ?
3. Quelles sont les exigences relatives à la qualité de l’eau purifiée ?
4. Quelles sont les exigences relatives à la qualité de l’eau pour préparations injectables ?
5. Quelles méthodes existent pour obtenir de l’eau pour préparations injectables ?
6. Comment l’eau purifiée et l’eau pour préparations injectables sont-elles conservées ?
Essais
1. Solutions - une forme galénique liquide obtenue en dissolvant :
1. Liquide.
2. Solide.
3. Substances gazeuses dans un solvant approprié
2. Véritables solutions de substances de faible poids moléculaire :
1. Passez à travers le filtre.
2. Passer à travers la membrane de dialyse.
3. Ne modifiez pas les propriétés pendant la centrifugation.
4. Ils chauffent.
3.Méthodes d'obtention de l'eau purifiée :
1. Distillation.
2. Osmose inverse.
3. Échange d'ions.
4. Le distillateur se compose des blocs principaux suivants :
1. Refroidisseur (condenseur).
2. Égaliseur.
3. Remplisseur.
4. Chambre d'évaporation (évaporateur).
5. Radiateurs électriques.
6. Capteur de niveau.
7. Unité de commande.
5. Chaque jour, avant de commencer les travaux, le distillateur et les canalisations sont cuits à la vapeur avec les vannes d'alimentation en eau du condenseur fermées pour :
1,5 minutes.
2. 10 minutes.
3. 15 minutes.
4. 20 minutes.
5. Ensuite, les premières portions d'eau sont jetées pendant 15 à 20 minutes.
6. Les distillateurs d'eau pour la production d'eau apyrogène AA-1 disposent de séparateurs pour :
1. Département des inclusions mécaniques.
2. Retirer la phase gouttelette-liquide de la vapeur.
3. Pour éliminer les micro-organismes.
7. Ce qui est correct :
1. Utilisez de l’eau fraîchement préparée pour injection ;
2. Conserver à une température de 5 à 10 ?
3. Conserver à une température de 80 à 95 C.
8. Les produits suivants sont appelés substances pyrogènes :
1. Activité vitale des micro-organismes.
2. Dégradation des micro-organismes.
3. Cellules microbiennes mortes.
4. Microorganismes viables.
9. Les substances pyrogènes sont détruites par :
1. Faire bouillir pendant 6 heures.
2. Stérilisation à une température de 132°C pendant 30 minutes.
3. Chauffage dans des stérilisateurs à air sec à une température de 250°C pendant 30 minutes.
10. L’eau pour préparations injectables doit être :
1 Stérile. 2. Apyrogène.
9. Solutions. Classement des solutions
Selon leur état d'agrégation, les solutions peuvent être gazeuses, liquides et solides.
Toute solution est constituée de substances dissoutes et d'un solvant, bien que ces concepts soient dans une certaine mesure arbitraires. Par exemple, selon le rapport alcool/eau, ce système peut être une solution d'alcool dans l'eau ou d'eau dans l'alcool.
En règle générale, un solvant est considéré comme le composant qui, en solution, est dans le même état d'agrégation qu'avant la dissolution.
L'étude des solutions présente un intérêt particulier pour les médecins car les fluides biologiques les plus importants - sang, lymphe, urine, salive, sueur - sont des solutions de sels, protéines, glucides, lipides dans l'eau.
Les fluides biologiques participent au transport des nutriments (graisses, acides aminés, oxygène), des médicaments vers les organes et tissus, ainsi qu'à l'excrétion des métabolites (urée, bilirubine, dioxyde de carbone, etc.) de l'organisme. Le plasma sanguin est un milieu pour les cellules - lymphocytes, érythrocytes, plaquettes.
Dans les milieux liquides du corps, une acidité, une concentration en sels et en substances organiques constantes sont maintenues. Cette constance est appelée homéostasie de concentration.
Classement des solutions
Les solutions de substances ayant une masse molaire inférieure à 5 000 g/mol sont appelées solutions de composés de faible poids moléculaire (LMC), et les solutions de substances ayant une masse molaire supérieure à 5 000 g/mol sont appelées solutions de composés de haut poids moléculaire ( HMC).
En fonction de la présence ou de l'absence de dissociation électrolytique, les solutions NMS sont divisées en deux classes : les solutions d'électrolytes et de non-électrolytes.
Les solutions électrolytiques sont des solutions de sels, d'acides, de bases et d'ampholytes qui se dissocient en ions. Par exemple, des solutions de KNO 3, HCl, KOH, Al(OH) 3, glycine.
La conductivité électrique des solutions électrolytiques est supérieure à celle du solvant.
Les solutions de non-électrolytes sont des solutions de substances qui ne se dissocient pratiquement pas dans l'eau. Par exemple, des solutions de saccharose, glucose, urée. La conductivité électrique des solutions non électrolytiques diffère peu de celle du solvant.
Les solutions de NMS (électrolytes et non-électrolytes) sont dites vraies contrairement aux solutions colloïdales. Les vraies solutions se caractérisent par l’homogénéité de leur composition et l’absence d’interface entre le soluté et le solvant. La taille des particules dissoutes (ions et molécules) est inférieure à 10 -9 m.
La plupart des BMC sont des polymères dont les molécules (macromolécules) sont constituées d'un grand nombre de groupes répétitifs ou d'unités monomères interconnectées par des liaisons chimiques. Les solutions de DIU sont appelées solutions polyélectrolytiques.
Les polyélectrolytes comprennent les polyacides (héparine, acide polyadénylique, acide polyaspartique, etc.), les polybases (polylysine), les polyampholytes (protéines, acides nucléiques).
Les propriétés des solutions DIU diffèrent considérablement de celles des solutions NMS. Ils seront donc examinés dans une section distincte. Ce chapitre est consacré aux solutions d'électrolytes, d'ampholytes et de non-électrolytes de faible poids moléculaire.
10. L'eau comme solvant
Le solvant le plus répandu sur notre planète est l’eau. Le corps d'une personne moyenne pesant 70 kg contient environ 40 kg d'eau. Dans ce cas, environ 25 kg d'eau correspondent au liquide contenu dans les cellules et 15 kg correspondent au liquide extracellulaire, qui comprend le plasma sanguin, le liquide intercellulaire, le liquide céphalo-rachidien, le liquide intraoculaire et le contenu liquide du tractus gastro-intestinal. Dans les organismes animaux et végétaux, l'eau représente généralement plus de 50 % et, dans certains cas, la teneur en eau atteint 90 à 95 %.
En raison de ses propriétés anormales, l’eau est un solvant unique, parfaitement adapté à la vie.
Tout d'abord, l'eau dissout bien les composés ioniques et de nombreux composés polaires. Cette propriété de l'eau est due en grande partie à sa constante diélectrique élevée (78,5).
Une autre grande classe de substances facilement solubles dans l’eau comprend les composés organiques polaires tels que les sucres, les aldéhydes, les cétones et les alcools. Leur solubilité dans l'eau s'explique par la tendance des molécules d'eau à former des liaisons polaires avec les groupes fonctionnels polaires de ces substances, par exemple avec les groupes hydroxyles des alcools et des sucres ou avec l'atome d'oxygène du groupe carbonyle des aldéhydes et des cétones. Vous trouverez ci-dessous des exemples de liaisons hydrogène importantes pour la solubilité des substances dans les systèmes biologiques. En raison de sa polarité élevée, l’eau provoque l’hydrolyse des substances.
L’eau constituant la majeure partie de l’environnement interne du corps, elle assure les processus d’absorption, de mouvement des nutriments et des produits métaboliques dans le corps.
Il convient de noter que l'eau est le produit final de l'oxydation biologique de substances, en particulier du glucose. La formation d’eau résultant de ces processus s’accompagne de la libération d’une grande quantité d’énergie – environ 29 kJ/mol.
D'autres propriétés anormales de l'eau sont également importantes : une tension superficielle élevée, une faible viscosité, des points de fusion et d'ébullition élevés et une densité plus élevée à l'état liquide qu'à l'état solide.
L'eau est caractérisée par la présence d'associés - des groupes de molécules reliées par des liaisons hydrogène.
En fonction de l'affinité pour l'eau, les groupes fonctionnels des particules solubles sont divisés en hydrophiles (attirant l'eau), facilement solvatés par l'eau, hydrophobes (repoussant l'eau) et diphiles.
Les groupes hydrophiles comprennent les groupes fonctionnels polaires : hydroxyle -OH, amino -NH 2, thiol -SH, carboxyle -COOH. Les groupes hydrophobes comprennent les groupes apolaires, par exemple les radicaux hydrocarbonés : CH3-(CH2)p-, C6H5-. Les hyphiles comprennent les substances (acides aminés, protéines) dont les molécules contiennent à la fois des groupes hydrophiles (-OH, -NH 2, -SH, -COOH) et des groupes hydrophobes : (CH 3 - (CH 2) p, - C6H5-).
Lorsque les substances diphiles se dissolvent, la structure de l'eau change en raison de l'interaction avec des groupes hydrophobes. Le degré d'ordonnancement des molécules d'eau situées à proximité des groupes hydrophobes augmente et le contact des molécules d'eau avec les groupes hydrophobes est réduit au minimum. Les groupes hydrophobes, lorsqu’ils sont associés, repoussent les molécules d’eau hors de leur emplacement.
11. Concentration de la solution et méthodes d'expression
Solution On appelle un système homogène de composition variable composé de deux ou plusieurs substances en état d'équilibre. Les substances qui composent une solution sont appelées composants de la solution.
Une caractéristique importante d’une solution est sa concentration. Cette valeur détermine de nombreuses propriétés de la solution.
Concentration de substances(composant de la solution) est une quantité mesurée par la quantité de substance dissoute contenue dans une certaine masse ou volume d'une solution ou d'un solvant.
Les moyens les plus couramment utilisés pour exprimer la concentration sont : la fraction massique, la concentration molaire, la concentration équivalente molaire, la fraction molaire, la fraction volumique et le titre.
Fraction massique W(X) sont exprimés en parties d'unité, en pourcentage (%), en ppm (millième de pour cent) et en parties par million (ppm). La fraction massique est calculée à l'aide des formules :
W (X) = m (X) / m (taille),
W (X) = m (X) / m (taille) × 100 %,
où m (X) est la masse d'un composant donné X (substance dissoute), kg (g) ;
m (solution) – masse de solution, kg (g).
La concentration molaire est exprimée en mol/m3, mol/dm3, mol/cm3, mol/l, mol/ml. En médecine, l’utilisation d’unités mol/l est préférable. La concentration molaire est calculée à l'aide de la formule :
C(X) = n (X) /V(p-p) = m (X) /M(X) × V(rr) ,
où n (X) est la quantité de substance dissoute dans le système, mol ;
M.(X) – masse molaire de la substance dissoute, kg/mol ou g/mol ;
m (X) – masse de la substance dissoute, respectivement kg ou g ;
V(solution) – volume de solution, l. Concentration molaire
b (X) est exprimé en unités mol/kg.
Forme d'enregistrement, par exemple : b(HCl) = 0,1 mol/kg. Calculez la concentration molaire à l'aide de la formule :
b (X) = n (X) / m (r-l) = m (X) /M(X) × m (dimension)
où m (solution) est la masse du solvant, en kg.
En chimie, la notion d'équivalent et de facteur d'équivalence est largement utilisée.
Équivalent est appelée une particule réelle ou conditionnelle de la substance X, qui dans une réaction acido-basique donnée est équivalente à un ion hydrogène ou dans une réaction redox donnée - un électron, ou dans une réaction d'échange donnée entre sels - une unité de charge.
Fraction volumique f ( X) est exprimé en fractions d'unité ou en pourcentage, il est calculé selon la formule :
F (X) = V(X) /V(rr)
Où V(X) est le volume d'un composant X donné de la solution ;
V(р-р) – volume total de solvant.
Le titre de la solution est noté T (X), l'unité de mesure est kg/cm3, g/cm3, g/ml. Le titre de la solution peut être calculé à l'aide de la formule :
T (X) = m (X) /V(rr)
où m (X) est la masse de la substance, généralement g ;
V(solution) – volume de solution, ml.
12. Processus de dissolution
La nature du processus de dissolution est complexe. Naturellement, la question se pose de savoir pourquoi certaines substances sont facilement solubles dans certains solvants et peu solubles ou pratiquement insolubles dans d'autres.
La formation de solutions est toujours associée à certains processus physiques. L'un de ces processus est la diffusion d'un soluté et d'un solvant. Grâce à la diffusion, les particules (molécules, ions) sont éliminées de la surface de la substance dissolvante et sont réparties uniformément dans tout le volume du solvant. C'est pourquoi, en l'absence d'agitation, la vitesse de dissolution dépend de la vitesse de diffusion. Cependant, les processus physiques ne peuvent à eux seuls expliquer la solubilité inégale des substances dans différents solvants.
Le grand chimiste russe D.I. Mendeleïev (1834-1907) croyait que les processus chimiques jouaient un rôle important dans la dissolution. Il a prouvé l'existence d'hydrates d'acide sulfurique
H 2 SO 4 H 2 O, H 2 SO 4 2H 2 O, H 2 SO 4 4H 2 O et certaines autres substances, par exemple C 2 H 5 OH3H 2 O. Dans ces cas, la dissolution s'accompagne de la formation de liaisons chimiques entre les particules de la substance dissoute et le solvant. Ce processus est appelé solvatation ; dans le cas particulier où le solvant est de l’eau, on l’appelle hydratation.
Comme cela a été établi, selon la nature de la substance dissoute, des solvates (hydrates) peuvent se former à la suite d'interactions physiques : interaction ion-dipôle (par exemple, lors de la dissolution de substances à structure ionique (NaCI, etc. ); interaction dipôle-dipôle – lors de la dissolution de substances ayant une structure moléculaire (substances organiques)).
Les interactions chimiques s'effectuent via des liaisons donneur-accepteur. Ici, les ions de la substance dissoute sont des accepteurs d'électrons et les solvants (H 2 O, NH 3) sont des donneurs d'électrons (par exemple, la formation de complexes aquatiques), ainsi qu'en raison de la formation de liaisons hydrogène (pour exemple, la dissolution de l'alcool dans l'eau).
La preuve de l'interaction chimique d'une substance dissoute avec un solvant réside dans les effets thermiques et les changements de couleur qui accompagnent la dissolution.
Par exemple, lorsque l’hydroxyde de potassium est dissous dans l’eau, de la chaleur est libérée :
KOH + xH 2 O = KOH (H 2 O) x; ΔН° sol = –55 kJ/mol.
Et lorsque le chlorure de sodium se dissout, la chaleur est absorbée :
NaCI + xH 2 O = NaCI (H 2 O) x; ΔН° sol = +3,8 kJ/mol.
La chaleur dégagée ou absorbée lorsqu'une mole d'une substance est dissoute est appelée chaleur de la solution Q solution
Selon la première loi de la thermodynamique
Q solution = ΔН solution ,
où ΔН dissolution est le changement d'enthalpie lors de la dissolution d'une quantité donnée de substance.
La dissolution du sulfate de cuivre anhydre blanc dans l'eau conduit à l'apparition d'une couleur bleue intense. La formation de solvates, les changements de couleur, les effets thermiques, ainsi qu'un certain nombre d'autres facteurs, indiquent un changement dans la nature chimique des composants de la solution au cours de sa formation.
Ainsi, conformément aux concepts modernes, la dissolution est un processus physico-chimique dans lequel les interactions physiques et chimiques jouent un rôle.
13. Thermodynamique du processus de dissolution
Selon la deuxième loi de la thermodynamique, à p, T = const, les substances peuvent se dissoudre spontanément dans n'importe quel solvant si, à la suite de ce processus, l'énergie de Gibbs du système diminue, c'est-à-dire
ΔG = (ΔН – TΔS)< 0.
La valeur ΔH est appelée facteur d’enthalpie et la valeur TΔS est appelée facteur d’entropie de dissolution.
Lorsque des substances liquides et solides sont dissoutes, l'entropie du système augmente généralement (ΔS > 0), puisque les substances dissoutes passent d'un état plus ordonné à un état moins ordonné. La contribution du facteur d'entropie, qui contribue à une augmentation de la solubilité, est particulièrement visible à des températures élevées, car dans ce cas le facteur T est grand et la valeur absolue du produit TΔS est également grande, et la diminution de l'énergie de Gibbs augmente en conséquence.
Lorsque des gaz sont dissous dans un liquide, l'entropie du système diminue généralement (ΔS< 0), так как растворяемое вещество из менее упорядоченного состояния (боль–шого объема) переходит в более упорядоченное (ма–лый объем). Снижение температуры благоприятствует растворению газов, потому что в этом случае множи–тель Т мал и абсолютное значение произведения TΔS будет тем меньше, а убыль энергии Гиббса тем больше, чем ниже значение Т.
Lors de la formation d'une solution, l'enthalpie du système peut également augmenter (NaCI) ou diminuer (KOH). Le changement d’enthalpie du processus de dissolution doit être considéré conformément à la loi de Hess comme la somme algébrique des contributions endothermiques et exothermiques de tous les processus accompagnant le processus de dissolution. Il s'agit d'effets endothermiques de destruction du réseau cristallin des substances, de rupture des liaisons moléculaires, de destruction de la structure initiale du solvant et d'effets exothermiques de formation de divers produits d'interaction, dont des solvates.
Pour simplifier la présentation, l'incrément de l'enthalpie de dissolution ΔH d'une solution peut être représenté comme la différence entre l'énergie E cr dépensée pour la destruction du réseau cristallin du soluté et l'énergie E sol libérée lors de la solvatation des particules de le soluté par des molécules de solvant. En d'autres termes, le changement d'enthalpie est la somme algébrique du changement d'enthalpie ΔН cr résultant de la destruction du réseau cristallin et du changement d'enthalpie ΔН sol dû à la solvatation par les particules de solvant :
ΔН sol = ΔН cr + ΔН sol,
où ΔН dist est le changement d'enthalpie lors de la dissolution.
Cependant, la dissolution des gaz rares dans les solvants organiques s'accompagne souvent d'une absorption de chaleur, par exemple l'hélium et le néon dans l'acétone, le benzène, l'éthanol et le cyclohexane.
Lors de la dissolution de solides à structure cristalline moléculaire et de liquides, les liaisons moléculaires ne sont pas très fortes et donc généralement ΔH sol > ΔH cr Cela conduit au fait que la dissolution, par exemple, des alcools et des sucres est un processus exothermique (ΔH sol< 0).
Lors de la dissolution de substances solides avec un réseau ionique, le rapport énergétique E cr et E sol peut être différent. Cependant, dans la plupart des cas, l'énergie libérée lors de la solvatation des ions ne compense pas l'énergie dépensée pour détruire le réseau cristallin. Le processus de dissolution est donc endothermique.
Ainsi, les données thermodynamiques permettent de prédire la dissolution spontanée de diverses substances sur la base des première et deuxième lois de la thermodynamique.
14. Solubilité
Si une substance soluble entre en contact avec un solvant, le processus de formation de solution se produit dans de nombreux cas spontanément jusqu'à ce qu'une certaine concentration limite soit atteinte (saturation). Cela se produit lorsque l'équilibre est atteint, lorsque les facteurs d'enthalpie et d'entropie deviennent égaux, c'est-à-dire ΔН = TΔS.
Par exemple, lorsque des cristaux sont introduits dans un liquide, des molécules ou des ions passent de la surface du cristal à la solution. Grâce à la diffusion, les particules sont réparties uniformément dans tout le volume du solvant. La dissolution se poursuit jusqu'à saturation.
Une solution sursaturée est une solution dont la concentration est plus élevée que dans une solution saturée.
Une solution dont la concentration est inférieure à celle saturée est dite insaturée.
La capacité d’une substance à se dissoudre dans un solvant particulier est appelée solubilité. Numériquement, la solubilité d’une substance est égale à la concentration de sa solution saturée.
La solubilité peut être exprimée dans les mêmes unités que la concentration, par exemple en termes de quantité de soluté contenue dans 1 litre de solution saturée, mol/l, ou en termes de masse de soluté dans 100 g de solution saturée. L'unité de solubilité est le gramme pour 100 g de solvant. La valeur correspondante est appelée coefficient de solubilité.
La solubilité dépend de la nature du soluté et du solvant, de la température, de la pression et de la présence d'autres substances dans la solution.
14b Influence sur la solubilité de la nature des composants
La capacité des substances à se dissoudre est déterminée par la nature des forces d'interaction entre les molécules des composants de la solution X 1 et X 2 : solvant - solvant (X 1 - X 1), soluté - soluté (X 2 - X 2), solvant - soluté ( X 1 – X 2) (les points indiquent les liaisons moléculaires).
La solubilité des substances varie dans de larges limites. Les exemples montrent la solubilité de différents sels dans le même solvant (eau) et la solubilité de la même substance (AgNO 3) dans différents solvants.
Les substances ayant une liaison de type ionique et les substances constituées de molécules polaires se dissolvent mieux dans les solvants polaires tels que l'eau et les alcools. Ces solvants se caractérisent par une constante diélectrique élevée.
La haute solubilité des substances est assez souvent due à la formation de liaisons intermoléculaires, notamment hydrogène. Ainsi, la solubilité mutuelle illimitée de l'eau et de l'alcool s'explique par la formation de liaisons hydrogène entre les molécules d'eau et d'alcool, et la dissolution des cristaux AgcI dans une solution aqueuse d'ammoniac s'explique par la formation d'une liaison chimique donneur-accepteur du ion argent avec des molécules d'ammoniac (AgCI dans l'eau pratiquement insoluble). Pour la même raison, la pyridine, solvant à faible constante diélectrique, présente une très grande solubilité.
Puisque la solubilité caractérise le véritable équilibre, l’influence des conditions extérieures sur cet état (pression, température) peut être évaluée qualitativement à l’aide du principe de Le Chatelier. De telles évaluations sont nécessaires dans la pratique de la plongée sous-marine, lors du travail dans des ateliers chauds, etc.
15. Solubilité des gaz dans les liquides. Lois Henry-Dalton et Sechenov
La dissolution des gaz dans les liquides s'accompagne presque toujours d'un dégagement de chaleur. Par conséquent, la solubilité des gaz diminue avec l’augmentation de la température selon le principe de Le Chatelier. Ce modèle est souvent utilisé pour éliminer les gaz dissous de l'eau (par exemple, le C0 2 ) par ébullition. Parfois, la dissolution d'un gaz s'accompagne d'une absorption de chaleur (par exemple, la dissolution de gaz rares dans certains solvants organiques). Dans ce cas, une augmentation de la température augmente la solubilité du gaz.
Le gaz ne se dissout pas indéfiniment dans un liquide. A une certaine concentration de gaz X, l'équilibre s'établit :
Lorsqu'un gaz se dissout dans un liquide, il se produit une diminution significative du volume du système. Par conséquent, une augmentation de la pression, selon le principe de Le Chatelier, devrait conduire à un déplacement de l’équilibre vers la droite, c’est-à-dire à une augmentation de la solubilité du gaz. Si un gaz est légèrement soluble dans un liquide donné et que la pression est faible, alors la solubilité du gaz est proportionnelle à sa pression. Cette dépendance est exprimée par la loi de Henry (1803) : la quantité de gaz dissoute à une température donnée dans un certain volume de liquide, à l'équilibre, est directement proportionnelle à la pression du gaz.
La loi de Henry peut s'écrire sous la forme suivante :
Avec(X) = K r(X) × P(X)
où est la concentration de gaz dans une solution saturée, mol/l ;
P (X) – pression du gaz X au-dessus de la solution, Pa ;
K r(X) – Constante de Henry pour le gaz X, mol×l-1 × Pa -1.
La constante de Henry dépend de la nature du gaz, du solvant et de la température.
La loi de Henry n'est valable que pour des solutions relativement diluées, à basses pressions et en l'absence d'interaction chimique entre les molécules du gaz dissous et le solvant.
La loi de Henry est un cas particulier de la loi générale de Dalton. Si l'on parle de dissolution non pas d'une substance gazeuse, mais d'un mélange de gaz, alors la solubilité de chaque composant obéit à la loi de Dalton : la solubilité de chacun des composants du mélange gazeux à température constante est proportionnelle à la pression partielle du composant au-dessus du liquide et ne dépend pas de la pression totale du mélange et de l'individualité des autres composants.
Autrement dit, dans le cas de dissolution d'un mélange de gaz dans un liquide, la pression partielle p se substitue à l'expression mathématique de la loi de Henry ! de ce composant.
La pression partielle d'un composant s'entend comme la fraction de la pression du composant par rapport à la pression totale du mélange gazeux :
P i / P total
La pression partielle d'un composant est calculée à l'aide de la formule
En étudiant la solubilité des gaz dans les liquides en présence d'électrolytes, le médecin-physiologiste russe I.M. Sechenov (1829-1905) a établi le schéma suivant (loi de Sechenov) : la solubilité des gaz dans les liquides en présence d'électrolytes diminue ; des gaz sont libérés.
Р je = Р total ×(X je)
où p i est la pression partielle du composant X i ;
Ptot – pression totale du mélange gazeux ;
x(X i) – fraction molaire du i-ème composant.
En étudiant la solubilité des gaz dans les liquides en présence d'électrolytes, le médecin et physiologiste russe I.M. Sechenov (1829-1905) a établi le schéma suivant (loi de Sechenov) : la solubilité des gaz dans les liquides en présence d'électrolytes diminue ; des gaz sont libérés.
Selon leur état d'agrégation, les solutions peuvent être gazeuses, liquides et solides.
Toute solution est constituée de substances dissoutes et d'un solvant, bien que ces concepts soient dans une certaine mesure arbitraires. Par exemple, selon le rapport alcool/eau, ce système peut être une solution d'alcool dans l'eau ou d'eau dans l'alcool.
En règle générale, un solvant est considéré comme le composant qui, en solution, est dans le même état d'agrégation qu'avant la dissolution.
L'étude des solutions présente un intérêt particulier pour les médecins car les fluides biologiques les plus importants - sang, lymphe, urine, salive, sueur - sont des solutions de sels, protéines, glucides, lipides dans l'eau.
Les fluides biologiques participent au transport des nutriments (graisses, acides aminés, oxygène), des médicaments vers les organes et tissus, ainsi qu'à l'excrétion des métabolites (urée, bilirubine, dioxyde de carbone, etc.) de l'organisme. Le plasma sanguin est un milieu pour les cellules - lymphocytes, érythrocytes, plaquettes.
Dans les milieux liquides du corps, une acidité, une concentration en sels et en substances organiques constantes sont maintenues. Cette constance est appelée homéostasie de concentration.
Classement des solutions
Les solutions de substances ayant une masse molaire inférieure à 5 000 g/mol sont appelées solutions de composés de faible poids moléculaire (LMC), et les solutions de substances ayant une masse molaire supérieure à 5 000 g/mol sont appelées solutions de composés de haut poids moléculaire ( HMC).
En fonction de la présence ou de l'absence de dissociation électrolytique, les solutions NMS sont divisées en deux classes : les solutions d'électrolytes et de non-électrolytes.
Les solutions électrolytiques sont des solutions de sels, d'acides, de bases et d'ampholytes qui se dissocient en ions. Par exemple, des solutions de KNO 3, HCl, KOH, Al(OH) 3, glycine.
La conductivité électrique des solutions électrolytiques est supérieure à celle du solvant.
Les solutions de non-électrolytes sont des solutions de substances qui ne se dissocient pratiquement pas dans l'eau. Par exemple, des solutions de saccharose, glucose, urée. La conductivité électrique des solutions non électrolytiques diffère peu de celle du solvant.
Les solutions de NMS (électrolytes et non-électrolytes) sont dites vraies contrairement aux solutions colloïdales. Les vraies solutions se caractérisent par l’homogénéité de leur composition et l’absence d’interface entre le soluté et le solvant. La taille des particules dissoutes (ions et molécules) est inférieure à 10 -9 m.
La plupart des BMC sont des polymères dont les molécules (macromolécules) sont constituées d'un grand nombre de groupes répétitifs ou d'unités monomères interconnectées par des liaisons chimiques. Les solutions de DIU sont appelées solutions polyélectrolytiques.
Les polyélectrolytes comprennent les polyacides (héparine, acide polyadénylique, acide polyaspartique, etc.), les polybases (polylysine), les polyampholytes (protéines, acides nucléiques).
Les propriétés des solutions DIU diffèrent considérablement de celles des solutions NMS. Ils seront donc examinés dans une section distincte. Ce chapitre est consacré aux solutions d'électrolytes, d'ampholytes et de non-électrolytes de faible poids moléculaire.
Des solutions peuvent être liquide, solide et gazeux .
Solvant peut être solide, liquide et gazeux.
Presque tous les gaz se dissolvent les uns dans les autres. Les liquides, les gaz et les solides se dissolvent dans les liquides. Seuls les solides se dissolvent dans les solides. Dans les solutions solides, un système homogène de composants solides se forme.
Solutions gaz sont des solutions de gaz, de liquides et de solides dans des gaz. A la limite à pression nulle, tout gaz réel représente un système de particules indépendantes les unes des autres, c'est-à-dire présente les caractéristiques d’un système idéal. Un mélange de ces gaz, appelé gaz parfait, obéit la loi de Dalton:(Où R.– pression totale ; R. je– pression partielle jeème composant). Avec l'augmentation de la pression, une interaction entre les particules apparaît, puis un mélange de gaz réels, de vapeurs liquides et de solides est considéré comme une solution gazeuse.
Le plus répandu liquide, en particulier, solutions aqueuses. Dans le cas des solutions « liquide-gaz » et « liquide-solide », le solvant est généralement considéré comme le liquide. Dans les solutions liquide-liquide, le solvant est le composant en excès par rapport aux autres composants, appelés solutés.
Selon les propriétés du soluté, il existe solutions liquidespas d'électrolytes, d'électrolytes et de composés de poids moléculaire élevé(Marine). Ces derniers font l’objet de considérations en chimie des colloïdes.
La quantité de substance dissoute dans un volume donné de solvant est appelée concentration.
Façons d’exprimer les concentrations :
1) Concentration molaire M(ou molarité) – le nombre de moles d'une substance dissoute dans 1 m 3 (ou litre) de solution :
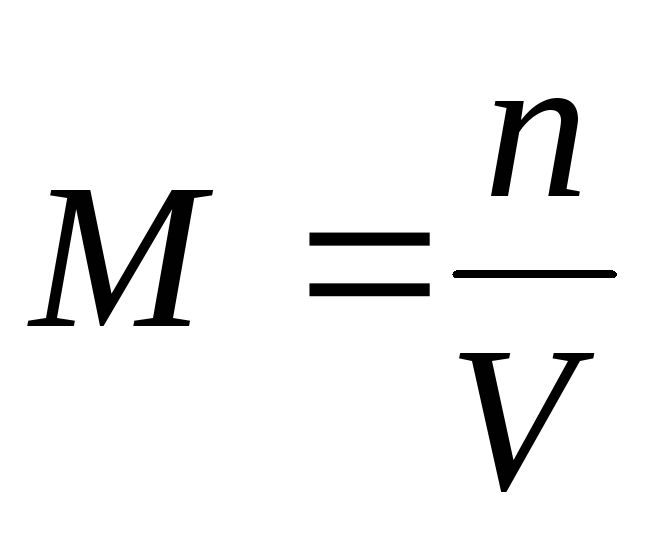
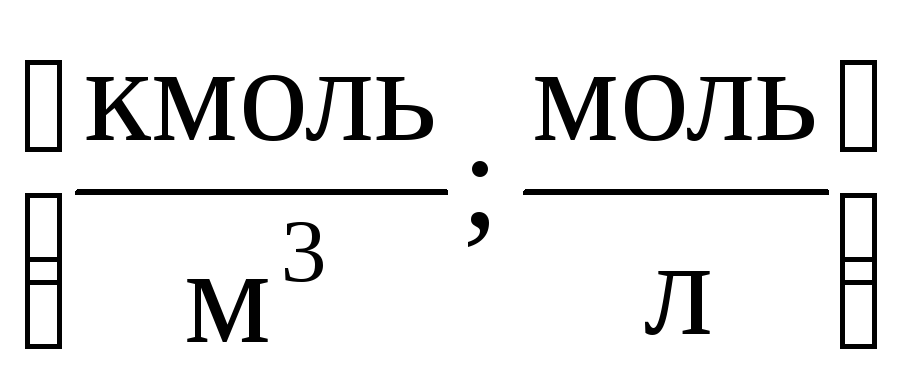
2) Concentration molaireT (ou molalité) – le nombre de moles de substance dissoute dans 1 kg ou 1 000 g de solvant :
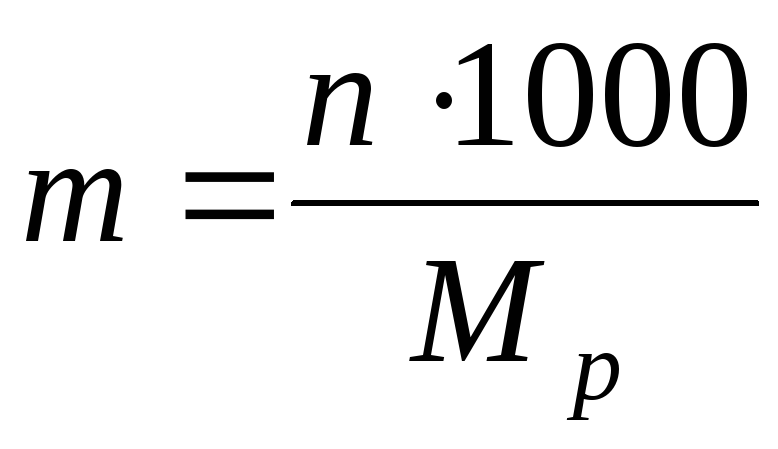

Où M. p – masse de solvant.
3) Pourcentage de concentration ω déterminé par le nombre de grammes de substance dans 100 g (en poids) ou 100 ml (en volume) de solution :
 ou
ou 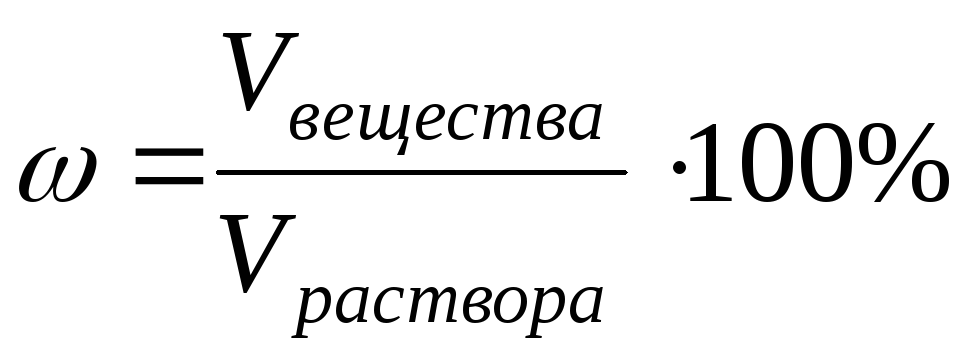
4) Fraction taupeN– le rapport du nombre de moles n d'un composant au nombre total de moles n de tous les composants de la solution :
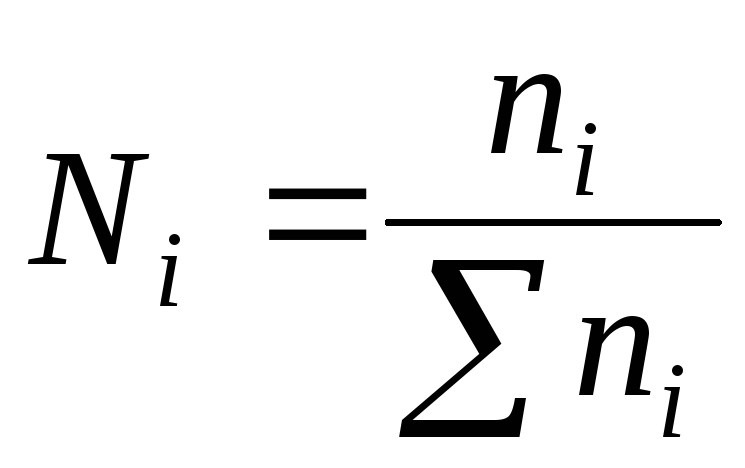
La somme des fractions molaires de tous les composants de la solution est égale à l'unité :
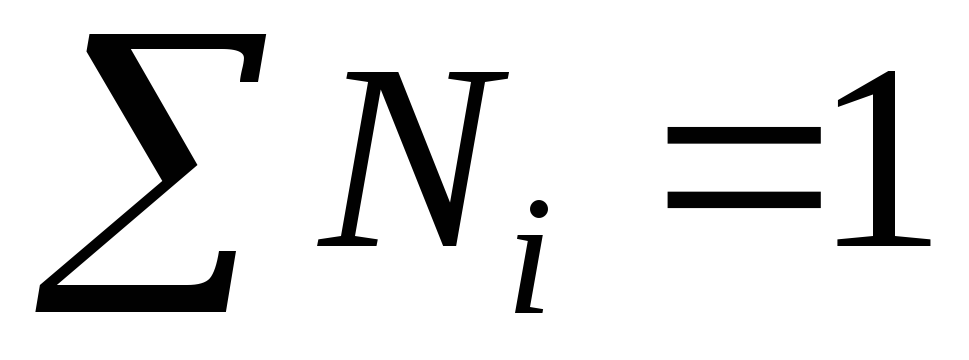
Exemple. Calculons M, m et N sur la base de la concentration massique connue d'acide sulfurique ω = 98 %, la densité de la solution est de 1,84 g/l ; les masses molaires des composants de la solution sont égales 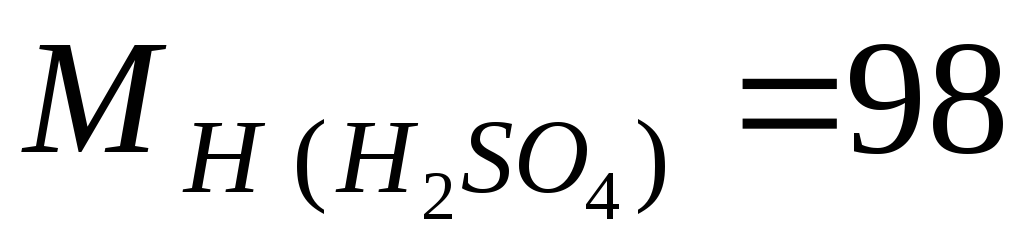 g/mole ;
g/mole ; 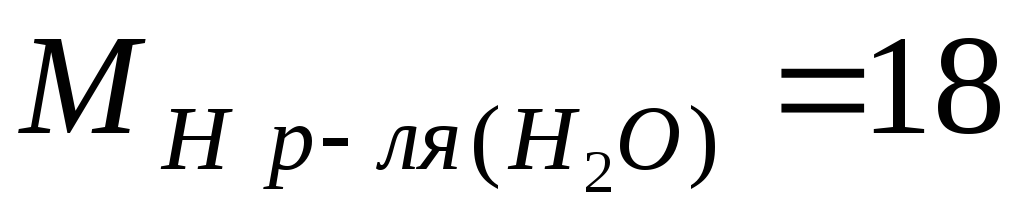 g/mol.
g/mol.
La molarité de la solution est :
La molalité de la solution est :
La fraction molaire de l’acide sulfurique est :
II. Les solutions sont également divisées en fonction du degré d'interaction entre le solvant et le soluté.
Solutions idéales Ce sont des solutions dans lesquelles la force d’interaction entre des molécules similaires et différentes est la même.
A – substance dissoute, f UN - UN
B – solvant, f V-V
Solution AB f UN - UN = f V-V = f UN -DANS
Dans les solutions idéales, l'énergie d'interaction entre les molécules de différents composants est la même ; toutes les molécules de la solution (solutés et solvant) ont le même champ de force et les volumes des molécules de tous les composants sont égaux. Dans une solution liquide idéale, contrairement à un gaz parfait, il y a une interaction entre les molécules. La même énergie d'interaction de toutes les molécules d'une solution conduit à leur répartition uniforme dans le volume. Par conséquent, l’entropie du mélange des composants d’une solution idéale est ΔSégale à l'entropie de mélange d'un gaz parfait ΔS i.e. .
Le volume égal de toutes les molécules garantit que le volume du système reste constant pendant la formation d'une solution idéale. L'effet thermique lors de cette formation d'une solution idéale est nul. À cet égard, nous pouvons donner une autre définition des solutions liquides idéales. Idéal Il y aura de telles solutions dont la formation à partir de composants pris dans le même état d'agrégation et dans aucun rapport ne s'accompagne d'un changement de volume et d'effet thermique, et le changement d'entropie est égal au changement d'entropie lors du mélange idéal. des gaz, c'est-à-dire
Δ V=0; ΔH=0; ΔS= ΔS i.e.
Le volume et l'enthalpie des solutions idéales sont additifs et dépendent de la composition de la solution.
Il convient de garder à l'esprit que les solutions peuvent être considérées comme idéales lorsque toutes les conditions ci-dessus sont remplies et, de plus, les pressions partielles des composants doivent être égales, ils doivent avoir la même température et le même état d'agrégation.
Les solutions idéales sont dites idéales car elles n’existent pas dans la réalité. Il existe cependant un nombre important de solutions présentant des propriétés proches des solutions idéales. Ceux-ci incluent des solutions diluées.
L'énergie de Gibbs jeème Le composant d’une solution idéale est numériquement égal au potentiel chimique et peut être représenté comme suit :
Quand ∆ H je =0, potentiel chimique jeème Le composant dans une solution idéale est égal à :
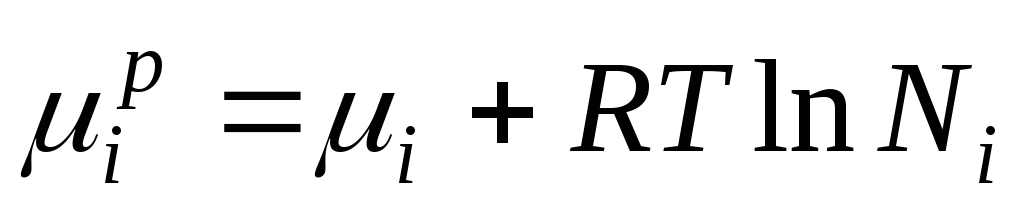 , Où
, Où
µ je , µ je p–potentiels chimiques je le composant individuel de la solution ; N je –fraction molaire jeème composant.
Dérivons cette équation et obtenons :
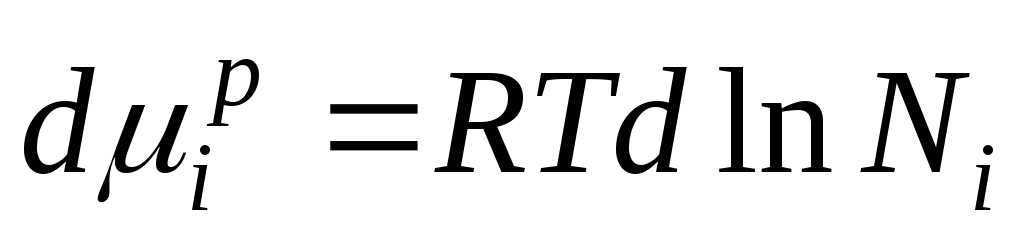
Du fait que 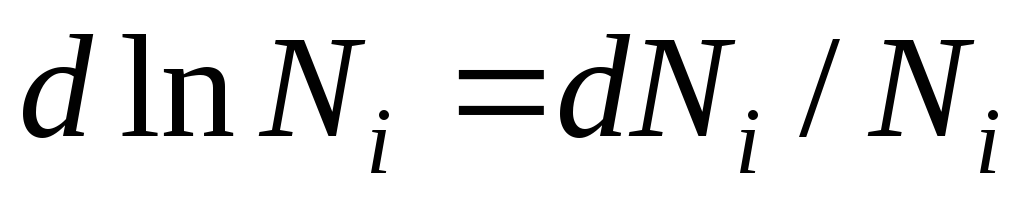 on obtient :
on obtient :
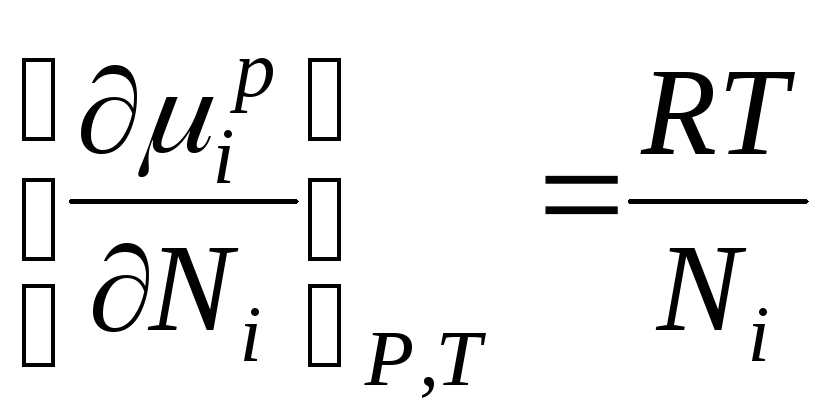
Cette équation montre la relation entre le potentiel chimique des composants d'une solution idéale et sa composition, déterminée par la fraction molaire des composants de la solution.
Considérons solutions extrêmement diluées, qui sont souvent appelés simplement dilués. Solutions extrêmement diluées Ce sont des solutions dans lesquelles le solvant obéit à la loi des solutions idéales et la substance soluble obéit aux lois des solutions réelles.
La concentration d'un soluté dans une solution diluée est infinitésimale, donc l'interaction entre ses molécules peut être négligée. Les solutions extrêmement diluées peuvent alors être décrites par des lois et des équations valables pour des solutions idéales.
Solutions non idéales (réelles) Ce sont des solutions dans lesquelles les forces d’interaction entre molécules similaires et différentes sont différentes.
Solution AB f UN - UN ≠ f V-V ≠ f UN -DANS
Les solutions réelles n'obéissent pas aux lois des solutions idéales et extrêmement diluées. Cependant, en introduisant des quantités auxiliaires, les propriétés des solutions non idéales peuvent également être exprimées à travers les lois des solutions idéales.
Solubilité. Méthodes d'expression de la concentration des solutions. Dissolution en tant que processus physique et chimique.
Objectifs:
Pédagogique:
− Comprendre les notions : « solution », « dissolution », « solubilité », « concentration ».
− Considérez la théorie physique, chimique et moderne des solutions.
− Montrer l'importance des solutions dans la vie humaine.
Pédagogique:
− Consolider les connaissances, les compétences et les capacités des étudiants à résoudre des problèmes sur le thème des solutions.
Éducateurs :
− Développement des capacités d'observation des élèves, de leur pensée logique, de leur capacité à tirer des conclusions et des conclusions.
Déroulement de la conférence
I. Moment organisationnel. Tester les connaissances sur la vitesse d’une réaction chimique.
II. Explication du nouveau matériel.
Professeur: Les solutions jouent un rôle important dans la nature, la technologie et la science.
Où sont utilisées les solutions ? (réponses des élèves)
Professeur: Le rôle des solutions dans l’émergence et le développement de la vie sur Terre est immense. L'une des théories sur l'origine des organismes est la théorie de l'origine de la vie dans l'océan primaire, qui était de l'eau contenant des substances dissoutes. De cette solution, les organismes recevaient les ions et les molécules nécessaires à leur croissance et à leur développement.
Le corps humain contient des solutions physiologiquement importantes. Lequel? (sang, suc gastrique, etc.)
Solution est un système homogène composé de deux ou plusieurs composants, dont le contenu peut être modifié dans certaines limites sans perturber l'homogénéité.
Une solution est un système homogène (homogène) constitué de particules d'une substance dissoute, d'un solvant et des produits de leur interaction.
Classement des solutions
selon l'état d'agrégation : gaz (air), liquide (eau de mer), solide (alliages)
par composition de solvant(eau, ammoniaque, benzène, etc.)
Par granulométrie ou degré de broyage (dispersité) :
Suspendre(systèmes grossiers) - granulométrie 10-3 -10-5 cm Les suspensions sont des systèmes très fragiles et hétérogènes. Les systèmes grossièrement dispersés sont généralement
sous forme de suspensions, émulsions, aérosols.
Donnez des exemples de systèmes naturels grossiers ?
Solutions colloïdales- taille des particules
10-5 - 10-7 cm. Des exemples de DS colloïdaux sont des solutions de colle et de gélatine.
Les solutions colloïdales se distinguent par le fait que leurs particules diffusent fortement la lumière qui les traverse et rendent perceptible le trajet du faisceau lumineux transmis (effet Tyndall).
De vraies solutions - la taille des particules est de 10-7 à 10-8 cm, ce sont des DS homogènes et stables.
La concentration de la solution saturée est appelée solubilité indiquant la température à laquelle elle est déterminée.
n Solubilité - nombre de moles de substance dissoute dans un litre de solution (en état de saturation)
Solubilité- la capacité d'une substance à former des systèmes homogènes avec d'autres substances - des solutions dans lesquelles la substance se présente sous la forme d'atomes, d'ions, de molécules ou de particules individuels. La solubilité est exprimée comme la concentration d'un soluté dans sa solution saturée, soit en pourcentage, soit en unités de poids ou de volume. La solubilité des gaz dans un liquide dépend de la température et de la pression. La solubilité des substances liquides et solides dépend presque entièrement de la température.
n Coeff. solubilité- masse du composant de la solution dans 100 g de solution
Les vraies solutions sont des systèmes thermodynamiquement stables qui sont indéfiniment stables dans le temps.
Les forces motrices pour la formation de solutions sont les facteurs d’entropie et d’enthalpie. Lorsque les gaz sont dissous dans un liquide, l'entropie diminue toujours ΔS< 0, а при растворении кристаллов возрастает (ΔS >0). Plus l'interaction entre le soluté et le solvant est forte, plus le facteur enthalpie joue un rôle important dans la formation des solutions. Le signe de la variation de l'enthalpie de dissolution est déterminé par le signe de la somme de tous les effets thermiques des processus accompagnant la dissolution, dont la contribution principale est apportée par la destruction du réseau cristallin en ions libres (ΔH > 0). et l'interaction des ions résultants avec les molécules de solvant (soltivation, ΔH< 0). При этом независимо от знака энтальпии при растворении (абсолютно нерастворимых веществ нет) всегда ΔG = ΔH – T·ΔS < 0, т. к. переход вещества в раствор сопровождается значительным возрастанием энтропии вследствие стремления системы к разупорядочиванию. Для жидких растворов (расплавов) процесс растворения идет самопроизвольно (ΔG < 0) до установления динамического равновесия между раствором и твердой фазой.
