به چه سیستم هایی راه حل می گویند. موضوع: دکترین راه حل ها. طبقه بندی راه حل ها
راه حل ها- یک شکل دوز مایع که از حل کردن مواد مایع، جامد یا گاز در یک حلال مناسب به دست میآید. با توجه به طبقه بندی پراکندگی، محلول ها سیستم های آزادانه پراکنده با یک محیط پخش مایع هستند.
در عمل داروسازی، محلول ها به طور متوسط تا 30 درصد از کل فرمولاسیون داروخانه را تشکیل می دهند. بزرگ وزن مخصوصمحلول ها، مانند همه اشکال دوز مایع، با تعدادی از مزایای آنها نسبت به سایر اشکال دارویی توضیح داده می شود.
مزایای محلول ها در مقایسه با فرم های دوز جامد:
فراهمی زیستی بالا؛
کاهش خواص محرک؛
شروع سریع اثر درمانی؛
امکان اصلاح طعم;
سادگی و سهولت استفاده.
معایب محلول ها در مقایسه با فرم های دوز جامد:
ماندگاری کوتاه؛
نیاز به توسعه ترکیب مواد کمکی. معایب ذاتی راه حل ها بر استفاده گسترده آنها تأثیر نمی گذارد.
طبقه بندی راه حل ها در نمودار ارائه شده است.
خواص محلول ها در جدول ارائه شده است. 12.1.
جدول 12.1.خواص راه حل ها
نام راه حل ها | فاز پراکنده | اندازه ذرات | نمونه هایی از SDF | خواص |
محلول های واقعی مواد با وزن مولکولی کم | مولکول های یون | 1 نانومتر | محلول های گلوکز، کلرید سدیم | آنها از فیلتر عبور می کنند و از غشای دیالیز می گذرند و وقتی سانتریفیوژ یا گرم می شوند خواص خود را تغییر نمی دهند. بارش (نمک کردن) با الکل، استون، الکترولیت های اشباع امکان پذیر است |
درست است راه حل ها نیروی دریایی | مولکول ها | 1-100 نانومتر | راه حل پپسین، ژلاتین | آنها از فیلتر عبور می کنند، از غشای دیالیز عبور نمی کنند، و هنگامی که سانتریفیوژ یا گرم می شوند، خواص خود را تغییر می دهند. نمک زدایی احتمالی (کواسرویشن) با الکل، استون، الکترولیت های اشباع |
محلول های کلوئیدی | میسل | 1-100 نانومتر | محلول های کولارگول |
12.1. حلال ها
برای ساخت محلول به مواد دارویی و حلال نیاز است.
حلال ها- ترکیبات شیمیایی منفرد یا مخلوط آنها که قابلیت حل شدن دارند مواد مختلف، یعنی با آنها تشکیل شود سیستم های همگن- راه حل ها
حلال ها به 2 دسته تقسیم می شوند:
آب (تصفیه شده یا برای تزریق)؛
حلال های آلی (اتیل الکل، گلیسیرین، کلروفرم، اتر و غیره).
الزامات اساسی برای حلال ها:
قدرت حلال؛
بی تفاوتی شیمیایی و بی ضرری بیولوژیکی؛
بدون طعم و بوی نامطبوع؛
خلوص میکروبیولوژیکی؛
قیمت پایین و در دسترس بودن.
12.1.1. آب
در داروسازی، حلال های اصلی در ساخت اشکال دارویی، آب تصفیه شده و آب تزریقی است.
12.1.2. آب تصفیه شده
قبلاً از اصطلاح "آب مقطر" استفاده می شد. آب به دست آمده از تقطیر در حال حاضر فناوریهای جدیدی توسعه یافتهاند که با فیلتر کردن یونها از طریق یک غشاء، آب با کیفیت مورد نیاز را به دست میآورند. بنابراین GF X! اصطلاح «آب مقطر» با عبارت عمومی تر «آب تصفیه شده» جایگزین شد. این اصطلاح از تعریف خارج می شود
روش به دست آوردن آب و ایجاد الزامات عمومیبه کیفیت آن
2 راه برای به دست آوردن آب تصفیه شده وجود دارد:
تقطیر؛
اسمز معکوس تجهیزات تولید آب
خالص شده
دستگاه های تقطیر آب دستگاه های تقطیر آب DE (شکل 12.1) برای تولید آب تصفیه شده طراحی شده اند. بدنه و قسمت های اصلی از فولاد ضد زنگ. مشخصات فنی در جدول ارائه شده است. 12.2.
دستگاه تقطیر از بلوک های اصلی زیر تشکیل شده است (شکل 12.2): خنک کننده (کندانسور)، اکولایزر، محفظه تبخیر (اواپراتور)، بخاری برقی، سنسور سطح، واحد کنترل.
برای تولید حجم کم آب تصفیه شده توصیه می شود

برنج. 12.1.ظاهر دستگاه های تقطیر آب DE
جدول 12.2.اساسی مشخصات فنیتقطیر کننده های DE

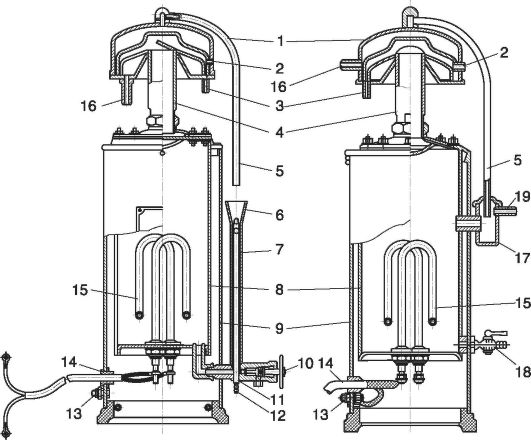
برنج. 12.2.تقطیر کننده:
1 - خازن؛ 2 - سوراخ؛ 3 - نوک پستان؛ 4 - لوله; 5 - لوله تخلیه; 6 - قیف; 7 - اکولایزر; 8 - اواپراتور; 9 - پوشش; 10 - ضربه بزنید؛ 11 - صلیب؛ 12 - سوراخ در نوک پستان؛ 13 - پیچ زمین؛ 14 - سیم؛ 15 - عنصر گرمایش؛ 16 - نوک پستان؛ 17 - مخزن اکولایزر; 18 - شیر تخلیه؛ 19 - اتصالات تخلیه آب

برنج. 12.3.دستگاه تقطیر آب رومیزی
با استفاده از تقطیرهای پیشخوان مانند MELAdest؟ 65 از MELAG (شکل 12.3). دستگاه تقطیر به شما این امکان را می دهد که آب تصفیه شده ای را بدست آورید که مطابق با الزامات فارمکوپه باشد. بهره وری - 0.7 لیتر در ساعت. سایز - 23. قدرت 38 سانتی متر - 500 وات. مزایای اصلی مصرف انرژی و بهره وری کم است که به دستگاه تقطیر اجازه می دهد فقط برای تهیه چند دستور غذا استفاده شود.
قوانین به دست آوردن آب تصفیه شده با تقطیر
1. دریافت و ذخیره آب تصفیه شده باید به صورت ویژه انجام شود
در اتاقی که مخصوص این منظور مجهز شده است با استفاده از دستگاه تقطیر آب یا سایر تاسیسات مجاز برای این منظور.
2. هنگام دریافت آب با استفاده از تقطیر آب، هر روز قبل از شروع کار:
دستگاه تقطیر و خطوط لوله به مدت 10-15 دقیقه بخارپز می شوند دریچه های بستهتامین آب به کندانسور؛
در عرض 15-20 دقیقه، اولین قسمت های آب دور ریخته می شود.
3. آب حاصل، تصفیه شده و برای تزریق، در کلکتورهای صنعتی تمیز، استریل شده یا بخار ساخته شده از موادی که خواص آب را تغییر نمی دهند و از آن در برابر ذرات خارجی و آلاینده های میکروبیولوژیکی محافظت نمی کنند (به عنوان استثنا در شیشه جمع آوری می شود). سیلندر). مجموعه ها باید دارای یک نوشته واضح باشند: "آب تصفیه شده"، "آب برای تزریق". برچسبی که تاریخ دریافت آن، شماره آنالیز و امضای بازرس را نشان می دهد به مجموعه آب ضمیمه شده است. اگر چندین مجموعه به طور همزمان استفاده شوند، شماره گذاری می شوند. برچسب ظروف جمع آوری و نگهداری آب تزریقی باید نشان دهد که محتویات آنها استریل نشده است.
4. مجموعه های شیشه ای با درپوش هایی با 2 سوراخ محکم بسته می شوند: یکی برای لوله ای که آب از آن جریان می یابد، دیگری برای لوله شیشه ای که یک سواب پنبه ای استریل در آن قرار می گیرد (روزانه تعویض می شود).
5. آب تصفیه شده به صورت تازه تهیه شده استفاده می شود و یا در ظروف در بسته به مدت حداکثر 3 روز نگهداری می شود.
الزامات صندوق دولتی برای کیفیت آب تصفیه شده
آب تصفیه شده از هر سیلندر روزانه از نظر عدم وجود کلرید، سولفات و نمک های کلسیم مورد تجزیه و تحلیل قرار می گیرد. هر فصل، آب تصفیه شده برای تجزیه و تحلیل شیمیایی کامل به آزمایشگاه کنترل سرزمینی و تجزیه و تحلیل ارسال می شود.
آب تصفیه شده باید بی رنگ، شفاف، بی بو و بی مزه باشد. مقدار pH می تواند بین 5.0-6.8 در نوسان باشد. باقیمانده خشک نباید از 0.001٪ تجاوز کند (یعنی 1 میلی گرم در 100 میلی لیتر آب). آب نباید حاوی مواد کاهنده باشد (هنگام جوشاندن 100 میلی لیتر آب به مدت 10 دقیقه با 2 میلی لیتر اسید سولفوریک رقیق شده و 1 میلی لیتر محلول پرمنگنات پتاسیم 0.01 مولار، آب باید رنگی بماند. صورتی)، نیترات ها، نیتریت ها، کلریدها، سولفات ها، کلسیم، فلزات سنگین، دی اکسید کربن. فقط اثری از آمونیاک مجاز است (بیش از 0.00002٪).
خلوص میکروبیولوژیکی آب تصفیه شده باید الزامات آب آشامیدنی را برآورده کند. در غیاب باکتری های خانواده مجاز است بیش از 100 میکروارگانیسم در میلی لیتر داشته باشد. انتروباکتریاسه، P. aeruginosa، S. aureus.
12.1.3. آب برای تزریق
برای ساخت محلول های تزریقی از آب تزریقی استفاده می شود که باید تست آب تصفیه شده را پشت سر بگذارد و همچنین باید استریل و عاری از پیروژن باشد.
آیا آب تزریقی در شرایط آسپتیک بر اساس دستور وزارت بهداشت تهیه می شود؟ 309. آماده سازی آب برای تزریق در اتاق تقطیر واحد آسپتیک انجام می شود که در آنجا انجام هرگونه کار غیر مرتبط با تقطیر آب اکیداً ممنوع است.
آب برای تزریق با استفاده از دستگاه های تقطیر آب یا دستگاه های اسمز معکوس مطابق با دستورالعمل های پیوست شده به آنها به دست می آید.
مشخص است که مواد تب زا غیرفرار هستند و نمی توان آنها را با بخار آب تقطیر کرد. آلودگی تقطیر با مواد تب زا از طریق انتقال قطرات ریز آب یا وارد شدن آنها توسط یک جت بخار به داخل کندانسور اتفاق می افتد. بنابراین، وظیفه اصلی در به دست آوردن آب برای تزریق، جداسازی قطرات آب از فاز بخار است. برای این منظور، دستگاه های تقطیر آب AA-1 (شکل 12.4) دارای جداکننده (8) هستند، جایی که بخار از یک مسیر پیچ در پیچ طولانی عبور می کند و به تدریج فاز قطره- مایع را در راه رسیدن به کندانسور از دست می دهد.
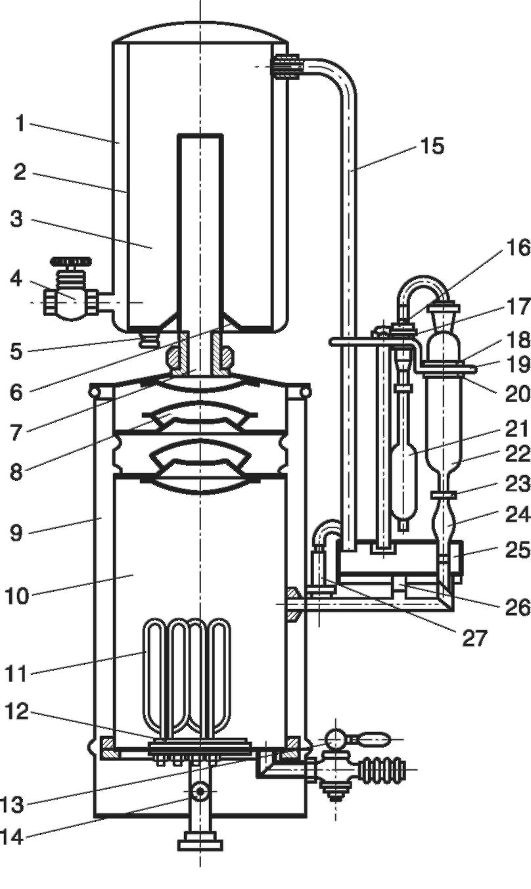
برنج. 12.4.دستگاه تقطیر آب AA-1
قسمت اصلی دستگاه تقطیر آب AA-1 محفظه تبخیر است (10 ) دارای جداکننده (8)، کندانسور (1-6 ، کلکتور اکولایزر (25) و تابلو برق. محفظه تبخیر (10) از بیرون توسط یک محفظه فولادی (9) محافظت می شود که برای کاهش تلفات حرارتی و محافظت از پرسنل عملیاتی در برابر سوختگی طراحی شده است. به پایین (12 ) محفظه مجهز به چهار بخاری برقی (11) و ریست لبه ها (B) است. در محفظه تبخیر (10) آب (با مواد شیمیایی اضافه شده) (14 ) که توسط بخاری های برقی (11) گرم می شود، به بخار تبدیل می شود که از طریق جداکننده ها تبدیل می شود (8) و لوله بخار (7) سرد شده وارد محفظه تراکم (3) می شود

برنج. 12.5.عکس های شیشه ای
شلیک کنید آب سرد (15), و با متراکم شدن به آب عاری از پیروژن تبدیل می شود.
برای به دست آوردن آب بدون پیروژن با بالاترین درجه دمینرالیزاسیون، از تقطیرهای شیشه ای Sanyo استفاده می شود (شکل 12.5). دستگاه تقطیر دارای یک تله بخار ثبت شده است که تقطیر عاری از پیروژن با بالاترین خلوص را ارائه می دهد. pH 5.6-6.0. بهره وری - 8 لیتر در ساعت.
آب تصفیه شده برای تزریق (غیر معدنی)
آب غیر معدنی (آکوا دمینرالیسایتا)در عمل پزشکی همراه با آب برای تزریق برای تولید محلول های تزریقی استفاده می شود.
آب غیر معدنی برای محلول های تزریقی با عبور آب منبع از واحد اسمز معکوس و فیلتر استریل کننده به دست می آید. در صحنه اسمز معکوسآب پاک می شود ترکیبات آلیو نمک ها حذف ناخالصی ها با عبور آب از یک غشای نیمه تراوا با فشاری بیش از فشار اسمزی اتفاق می افتد. برای افزایش راندمان فرآیند، از یک منبع مماس آب به سطح غشا در حین گردش مجدد استفاده می شود. تجهیزات متشکل از ستون هایی است که به صورت سری به هم متصل شده اند (شکل 12.6)، که از یک سیستم فیلترهای غشایی تشکیل شده است که به روشی خاص رول شده اند. اندازه منافذ غشاها 0.0005-0.001 میلی متر است. سیستمهای اسمز معکوس با اندازهگیری رسانایی الکتریکی ویژه آب خروجی از سیستم نظارت میشوند.
ذخیره سازی آب برای تزریق
آب حاصله برای تزریق در ظروف شیشه ای تمیز، استریل شده یا با بخار آب یا در ظروف مخصوص جمع آوری می شود (شکل 12.7). ظروف باید به وضوح دارای برچسب "آب برای تزریق" باشند. ظرف نگهداری آب برای تزریق باید مجهز به موارد زیر باشد:
همزن؛
ژاکت برای تامین بخار و آب خنک کننده؛
یک سیستم حمام برای اطمینان از خیس شدن مداوم کل سطح داخلی کشتی.
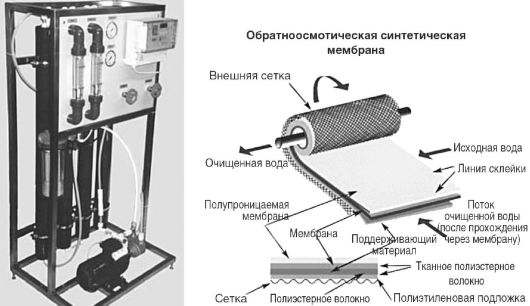
برنج. 12.6.واحدهای اسمز معکوس "Apyrogen-20" و غشای اسمز معکوس

برنج. 12.7.مخزن ذخیره تزریق آب با گردش مداوم برای تولید صنعتی
سیستم ترموستات؛
فیلتر هوای آبگریز؛
غشای انفجاری؛
فشار سنج؛
سیستم کنترل سطح آب برای تزریق استفاده می شود
تازه تهیه شده یا در دمای 5 تا 10 درجه سانتیگراد یا از 80 تا 95 درجه سانتیگراد در ظروف دربسته ساخته شده از موادی که خواص آب را تغییر نمی دهند و آن را از ناخالصی های مکانیکی و آلودگی های میکروبی محافظت می کند، به مدت حداکثر 24 ساعت نگهداری می شود؟ در صورت لزوم برای ذخیره سازی طولانی مدت آب برای تزریق، لازم است گردش آن در دمای 85-90 درجه سانتیگراد سازماندهی شود.
الزامات کیفیت آب تزریقی الف. عدم وجود مواد تب زا
مواد تب زا (یونانی. پیر- آتش، لات. نسل- تولد) محصولات فعالیت حیاتی و پوسیدگی میکروارگانیسم ها، سلول های میکروبی مرده نامیده می شوند. از نظر ترکیب شیمیایی، مواد تب زا، ترکیبات مولکولی بالا با ماهیت لیپوپلی ساکارید با اندازه ذرات از 50 نانومتر تا 1 میکرون هستند. مشخص شده است که مواد تب زا عمدتا توسط باکتری های گرم منفی تشکیل می شوند.
تزریق محلول حاوی مواد تب زا باعث اثر تب زایی (افزایش دمای بدن، تب) می شود. شدیدترین واکنش های تب زایی با تزریق داخل عروقی، نخاعی و داخل جمجمه ای مشاهده می شود.
مواد تب زا مواد مقاوم در برابر حرارت هستند. آنها تنها زمانی از بین می روند که در دستگاه های ضدعفونی کننده هوای خشک در دمای 250 درجه سانتیگراد به مدت 30 دقیقه گرم شوند. به دلیل خطر یک اثر تب زایی احتمالی، محلول هایی که به صورت داخل وریدی در حجم های 10 میلی لیتر یا بیشتر (GF) تجویز می شوند، از نظر تب زایی آزمایش می شوند. محلول گلوکز 5 درصد، کلرید سدیم ایزوتونیک و محلول ژلاتین باید بررسی شود. یک بار در سه ماهه، آزمایش تب زایی محلول ها و آب برای تزریق به شکل محلول ایزوتونیک با استفاده از روش بیولوژیکی (MF) انجام می شود.
روش بیولوژیکی محلول آزمایش به 3 خرگوش سالم با وزن 1.5-2.5 کیلوگرم در رگ گوش به میزان 10 میلی لیتر به ازای هر 1 کیلوگرم وزن بدن خرگوش تزریق می شود. محلول یک ماده دارویی یا آب در صورتی که پس از تجویز، هیچ یک از 3 خرگوش تجربی افزایش دمای بدن را بیش از 0.6 درجه سانتیگراد در مقایسه با دمای اولیه بدن طی 1 از 3 اندازه گیری تجربه نکردند، بدون تب زایی در نظر گرفته می شود. در مجموع افزایش دما در 3 خرگوش از 1.4 درجه سانتیگراد تجاوز نکرد.
تست لیمولوسعلاوه بر روش بیولوژیکی رسمی برای آزمایش تب زایی، آزمایش لیمولوس (LALtest)، بر اساس تشکیل ژل در طول برهمکنش پیروژن های باکتریایی با لیز آمیبوسیت، به طور گسترده ای مورد استفاده قرار می گیرد. لیمولوس پلیفموس.آزمایش LAL بر اساس توانایی لیزات آمبوسیت (سلول های همولنف حیوانات باقی مانده - خرچنگ نعل اسبی) برای واکنش خاص با اندوتوکسین های باکتری های گرم منفی است. در حال حاضر
آزمایش LAL توسط فارماکوپه های بسیاری از کشورها قانونی شده است و از سال 2009 برای گنجاندن در فارماکوپه فدراسیون روسیه به عنوان یک روش جایگزین برای شناسایی مواد تب زا پیشنهاد شده است. روش های دپیروژناسیون:
شیمیایی؛
فیزیکوشیمیایی؛
آنزیمی.
روش های شیمیایی دپیروژناسیون:
تجزیه پیرولیتیک مواد تب زا در مواد مقاوم در برابر حرارت (بیرون زدایی از کلرید سدیم در
180-200 C)؛
حرارت دادن در محلول پراکسید هیدروژن 6 درصد در 100؟ C به مدت 1 ساعت؛
نگهداری در محلول 0.5-1٪ پرمنگنات پتاسیم اسیدی شده با اسید سولفوریک به مدت 25-30 دقیقه. برای تهیه محلول، 6 قسمت از محلول اسید سولفوریک 1.5% را به 10 قسمت از محلول 1% پرمنگنات پتاسیم اضافه کنید. پس از درمان، عروق و لوله ها به طور کامل با آب تازه آماده برای تزریق شسته می شوند.
روشهای فیزیکوشیمیایی:
عبور محلول ها از ستون هایی با کربن فعال و سلولز.
استفاده از اولترافیلترهای غشایی با پتانسیل زتا منفی. این روشمناسب برای تولید صنعتی محلول های تزریقی.
ب. کنترل کیفیت آب تزریقی
بر اساس دستور وزارت بهداشت فدراسیون روسیه؟ 309 و MU-78-113 "تهیه، ذخیره و توزیع آب تصفیه شده و آب برای تزریق" مورخ 22 مه 1998، آب برای تزریق روزانه مطابق با مواد صندوق دولتی "آب تصفیه شده" و "آب برای تزریق" نظارت می شود. تزریق» طبق مونوگراف داروسازی (جدول 12.3).
اگر داروخانه دارای سیستم توزیع آب از طریق خطوط لوله باشد، آب برای تزریق تحت کنترل اضافی در خطوط لوله است. در یک سیستم توزیع آب تصفیه شده، نرخ جریان (برای سیستم های حلقه)، دما (برای سیستم های گرم) و هدایت الکتریکی آب تحت نظارت مداوم هستند. علاوه بر این، کنترل محتوای کربن آلی مطلوب است.
جدول 12.3. شاخص های کیفیت آب تصفیه شده و آب برای تزریق مطابق با FS-2619 و FS-2620
شاخص ها | واحدهای اندازه گیری | آب تصفیه شده | آب برای تزریق |
ظاهر | مایع شفاف بی رنگ، بی بو و بی مزه |
||
pH | 5,0-7,0 | 5,0-7,0 |
|
باقی مانده خشک | <0,001 | <0,001 |
|
عوامل کاهنده | طبق روش FS | طبق روش FS |
|
دی اکسید کربن | طبق روش FS | طبق روش FS |
|
نیترات ها و نیتریت ها | mg/ml | <0,0002 | <0,0002 |
آمونیاک | mg/ml | <0,0002 | <0,0002 |
کلریدها | mg/ml | <0,0001 | <0,0001 |
سولفات ها | mg/ml | <0,003 | <0,003 |
کلسیم | mg/ml | <0,0035 | <0,0035 |
فلزات سنگین | mg/ml | <0,0005 | <0,0005 |
میکروارگانیسم ها | واحد در میلی لیتر | <100 при отсутствии бактерий семейства انتروباکتریاسه، استافیلوکوکوس اورئوس، سودوموناس آئروژینوزا. | هیچ کدام |
تب زایی | غیر تب زا |
12.2. حلالیت مواد توسط GF
تکنولوژی ساخت محلول ها نه تنها به خواص حلال، بلکه به حلالیت ماده دارویی نیز بستگی دارد.
حلالیت- حداکثر غلظت ماده ای که می تواند به طور کامل در یک حلال معین در دما و فشار معین حل شود. یک ماده دارویی در صورتی محلول در نظر گرفته می شود که ذرات آن در محلول در نور عبوری مشاهده نشود.
طبق گزارش صندوق جهانی، 7 اصطلاح مشخص شده است که حلالیت داروها را مشخص می کند (جدول 12.4).
جدول 12.4.ویژگی های حلالیت بر اساس GF
12.2.1. عوامل موثر بر حلالیت
الف. دما
حلالیت هر ماده به دما بستگی دارد. بیشتر مواد گرماگیر هستند و در حین حل شدن، گرما را جذب می کنند. برای این مواد، حرارت دادن محلول حلالیت را افزایش می دهد. برخی از مواد (هیدرات اکسید یا گلیسروفسفات کلسیم و سدیم کاربنی سیلین) در طول فرآیند انحلال گرما تولید می کنند. حلالیت چنین موادی با افزایش دما کاهش می یابد.
ب- وجود یون های دیگر
حلالیت تقریباً همیشه زمانی کاهش می یابد که مواد یا یون های اضافی به محلول وارد شوند (نمک کردن). با این حال، یک رابطه معکوس بین افزایش حلالیت زمانی که یون ها وارد محلول می شوند وجود دارد:
- افزایش حلالیت پروتئین های گلوبولین که در محلول کلرید سدیم بهتر از آب حل می شوند.
- حل کردن ید در محلول اشباع یدید پتاسیم برای تشکیل کمپلکس KJ 3.
- حل کردن کلرید جیوه در محلول کلرید سدیم برای تشکیل ترکیب پیچیده Na 2 HgCl 4 .


از این نتیجه می شود که سدیم فنوباربیتال در حالت محلول در pH بیشتر از 8.3 است. کاهش pH باعث رسوب فنوباربیتال می شود.
د. قطبیت حلال
حلالیت یک دارو در یک حلال معین تا حد زیادی به قطبیت حلال بستگی دارد. بر اساس ثابت دی الکتریک، حلال ها به عنوان قطبی (e > 50)، نیمه قطبی (e = 20-50) یا غیر قطبی (e = 1-20) طبقه بندی می شوند (جدول 12.5).
جدول 12.5.ثابت دی الکتریک حلال ها
حلال | ثابت دی الکتریک، e، 20 ?C |
N-متیل فرمامید | |
آب | |
محلول سوربیتول (70%) | |
شربت (64%) | |
گلیسرول | |
پروپیلن گلیکول | 32,1 |
اتانول | |
پلی اتیلن گلیکول 400 | 12,4 |
کلروفرم | |
روغن کرچک | |
اتر | |
روغن زیتون |
حلال های قطبی نمک ها یا مولکول های بسیار قطبی (دوقطبی) را حل می کنند. حلال های غیر قطبی مولکول های غیر قطبی را حل می کنند. حلال های نیمه قطبی (الکل ها و کتون ها) بسته به خواص آنها می توانند هر دو را حل کنند. بنابراین، در داروخانه یک قانون جهانی برای انتخاب یک حلال وجود دارد: "مثل به شبیه حل می شود."
2 راه برای افزایش حلالیت مواد در حلال های نیمه قطبی وجود دارد:
1. با تغییر pH برای تغییر قطبیت یک ماده (نمک یا پایه). افزایش غلظت نمک منجر به افزایش می شود
حلالیت نمک ها در حلال های قطبی، بازها در حلال های غیر قطبی.
2. مخلوط کردن حلال هایی با قطبیت های مختلف برای تغییر قطبیت حلال.

مثال 2
الکل را با گلیسیرین در محلول فوراتسیلین 1:1500 جایگزین کنید. برای تعیین ثابت دی الکتریک حلال، مخلوطی از اتانول و آب تهیه می شود. سپس محلولهایی در این مخلوطها آماده میشوند و یک شب با مشاهده بارش رها میشوند (جدول 12.6).
به عنوان مثال، بارش فوراتسیلین در مخلوطی از 60/40 یا بیشتر مشاهده نشد. نتایج آزمایش ها در زیر ارائه شده است: + (بله)، - (خیر).
جدول 12.6.تأثیر الکل بر رسوب فوراتسیلین
% v/v الکل | |||||||||||
بارش |


سوالات امنیتی
1. راه حل ها را از دیدگاه طبقه بندی پراکندگی تعریف کنید.
2. چه روش هایی برای به دست آوردن آب تصفیه شده وجود دارد؟
3. الزامات کیفیت آب تصفیه شده چیست؟
4. الزامات کیفیت آب تزریقی چیست؟
5. چه روش هایی برای تهیه آب تزریقی وجود دارد؟
6. آب تصفیه شده و آب تزریقی چگونه ذخیره می شود؟
تست ها
1. محلول ها - یک شکل دوز مایع که با حل کردن به دست می آید:
1. مایع.
2. جامد.
3. مواد گازی در یک حلال مناسب
2. محلول های واقعی مواد با وزن مولکولی کم:
1. از فیلتر عبور کنید.
2. از غشای دیالیز عبور کنید.
3. در طول سانتریفیوژ، خواص را تغییر ندهید.
4. گرم می شوند.
3-روشهای بدست آوردن آب تصفیه شده:
1. تقطیر.
2. اسمز معکوس.
3. تبادل یونی.
4. دستگاه تقطیر از بلوک های اصلی زیر تشکیل شده است:
1. کولر (کندانسور).
2. اکولایزر.
3. پرکننده.
4. محفظه تبخیر (اواپراتور).
5. بخاری برقی.
6. سنسور سطح.
7. واحد کنترل.
5. هر روز، قبل از شروع کار، دستگاه تقطیر و خطوط لوله با دریچه های آبرسانی به کندانسور بسته می شوند تا برای:
1.5 دقیقه
2. 10 دقیقه
3. 15 دقیقه
4. 20 دقیقه
5. سپس اولین قسمت های آب به مدت 15-20 دقیقه دور ریخته می شود.
6. دستگاه های تقطیر آب برای تولید آب بدون پیروژن AA-1 دارای جداکننده هایی برای موارد زیر هستند:
1. بخش اجزاء مکانیکی.
2. برای حذف فاز قطره مایع از بخار.
3. برای حذف میکروارگانیسم ها.
7. چه چیزی درست است:
1. از آب تازه آماده برای تزریق استفاده کنید.
2. در دمای 5 تا 10 درجه سانتیگراد نگهداری شود.
3. در دمای 80 تا 95 درجه سانتیگراد نگهداری شود.
8. محصولاتی به نام مواد تب زا:
1. فعالیت حیاتی میکروارگانیسم ها.
2. پوسیدگی میکروارگانیسم ها.
3. سلول های میکروبی مرده.
4. میکروارگانیسم های زنده.
9. مواد تب زا توسط:
1. به مدت 6 ساعت بجوشانید.
2. استریل کردن در دمای 132 درجه سانتیگراد به مدت 30 دقیقه.
3. حرارت دادن در دستگاه های ضدعفونی کننده هوای خشک در دمای 250 درجه سانتیگراد به مدت 30 دقیقه.
10. آب برای تزریق باید:
1 استریل. 2. غیر تب زا.
9. راه حل ها. طبقه بندی راه حل ها
با توجه به حالت تجمع آنها، محلول ها می توانند گاز، مایع و جامد باشند.
هر محلولی از مواد محلول و یک حلال تشکیل شده است، اگرچه این مفاهیم تا حدی دلبخواه هستند. به عنوان مثال، بسته به نسبت الکل و آب، این سیستم می تواند محلولی از الکل در آب یا آب در الکل باشد.
به طور معمول، یک حلال به آن جزء در نظر گرفته می شود که در محلول در همان حالت تجمعی مانند قبل از انحلال است.
مطالعه محلول ها مورد توجه خاص پزشکان است زیرا مهمترین مایعات بیولوژیکی - خون، لنف، ادرار، بزاق، عرق - محلول های نمک ها، پروتئین ها، کربوهیدرات ها، لیپیدها در آب هستند.
مایعات بیولوژیکی در انتقال مواد مغذی (چربی ها، اسیدهای آمینه، اکسیژن)، داروها به اندام ها و بافت ها و همچنین در دفع متابولیت ها (اوره، بی لیروبین، دی اکسید کربن و غیره) از بدن نقش دارند. پلاسمای خون یک محیط برای سلول ها - لنفوسیت ها، گلبول های قرمز، پلاکت ها است.
در محیط مایع بدن، اسیدیته ثابت، غلظت نمک ها و مواد آلی حفظ می شود. به این ثبات هموستاز غلظت می گویند.
طبقه بندی راه حل ها
محلول های مواد با جرم مولی کمتر از 5000 گرم در مول را محلول های ترکیبات با وزن مولکولی کم (LMC) و محلول های مواد با جرم مولی بیشتر از 5000 گرم در مول را محلول های ترکیبات با وزن مولکولی بالا می نامند. HMC).
بر اساس وجود یا عدم وجود تفکیک الکترولیتی، محلول های NMS به دو دسته تقسیم می شوند - محلول های الکترولیت ها و غیر الکترولیت ها.
محلول های الکترولیت محلول هایی از نمک ها، اسیدها، بازها و آمفولیت ها هستند که به یون ها تجزیه می شوند. به عنوان مثال، محلول های KNO 3، HCl، KOH، Al(OH) 3، گلیسین.
رسانایی الکتریکی محلول های الکترولیت بیشتر از حلال است.
محلول های غیر الکترولیت ها محلول هایی از موادی هستند که عملاً در آب تجزیه نمی شوند. به عنوان مثال، محلول های ساکارز، گلوکز، اوره. رسانایی الکتریکی محلول های غیر الکترولیت کمی با حلال متفاوت است.
محلول های NMS (الکترولیت ها و غیر الکترولیت ها) برخلاف محلول های کلوئیدی درست نامیده می شوند. محلول های واقعی با همگنی ترکیب و عدم وجود رابط بین املاح و حلال مشخص می شوند. اندازه ذرات محلول (یون ها و مولکول ها) کمتر از 9-10 متر است.
بیشتر BMC ها پلیمرهایی هستند که مولکول های آنها (درشت مولکول ها) از تعداد زیادی گروه تکرار شونده یا واحدهای مونومر تشکیل شده است که توسط پیوندهای شیمیایی به هم متصل شده اند. محلول های IUD محلول های پلی الکترولیت نامیده می شوند.
پلی الکترولیت ها شامل پلی اسیدها (هپارین، پلی آدنیلیک اسید، پلی آسپارتیک اسید و غیره)، پلی بازها (پلی لیزین)، پلی آمفولیت ها (پروتئین ها، اسیدهای نوکلئیک) می باشند.
خواص محلول های IUD به طور قابل توجهی با خواص محلول های NMS متفاوت است. بنابراین در بخش جداگانه ای بررسی خواهند شد. این فصل به محلول های الکترولیت های با وزن مولکولی کم، آمفولیت ها و غیر الکترولیت ها اختصاص دارد.
10. آب به عنوان یک حلال
رایج ترین حلال در سیاره ما آب است. بدن یک فرد متوسط با وزن 70 کیلوگرم تقریباً 40 کیلوگرم آب دارد. در این حالت حدود 25 کیلوگرم آب مایع داخل سلول ها و 15 کیلوگرم مایع خارج سلولی است که شامل پلاسمای خون، مایع بین سلولی، مایع مغزی نخاعی، مایع داخل چشمی و محتویات مایع دستگاه گوارش است. در موجودات جانوری و گیاهی، آب معمولاً بیش از 50٪ را تشکیل می دهد و در برخی موارد محتوای آب به 90-95٪ می رسد.
آب به دلیل خواص غیرعادی خود یک حلال منحصر به فرد است که کاملاً برای زندگی سازگار است.
اول از همه، آب بسیاری از ترکیبات یونی و قطبی را به خوبی حل می کند. این خاصیت آب تا حد زیادی به دلیل ثابت دی الکتریک بالای آن (78.5) است.
دسته بزرگ دیگری از موادی که به آسانی در آب حل می شوند شامل ترکیبات آلی قطبی مانند قندها، آلدئیدها، کتون ها و الکل ها هستند. حلالیت آنها در آب با تمایل مولکول های آب به تشکیل پیوندهای قطبی با گروه های عاملی قطبی این مواد، به عنوان مثال با گروه های هیدروکسیل الکل ها و قندها یا با اتم اکسیژن گروه کربونیل آلدئیدها و کتون ها توضیح داده می شود. در زیر نمونه هایی از پیوندهای هیدروژنی وجود دارد که برای حلالیت مواد در سیستم های بیولوژیکی مهم هستند. آب به دلیل قطبیت زیاد خود باعث هیدرولیز مواد می شود.
از آنجایی که آب قسمت اصلی محیط داخلی بدن را تشکیل می دهد، فرآیندهای جذب، حرکت مواد مغذی و محصولات متابولیک را در بدن تضمین می کند.
لازم به ذکر است که آب محصول نهایی اکسیداسیون بیولوژیکی مواد به ویژه گلوکز است. تشکیل آب در نتیجه این فرآیندها با آزاد شدن مقدار زیادی انرژی - تقریباً 29 کیلوژول بر مول - همراه است.
سایر خواص غیرعادی آب نیز مهم هستند: کشش سطحی بالا، ویسکوزیته کم، نقطه ذوب و جوش بالا و چگالی بالاتر در حالت مایع نسبت به حالت جامد.
آب با حضور پیوندهایی مشخص می شود - گروه هایی از مولکول ها که با پیوندهای هیدروژنی به هم متصل شده اند.
بسته به تمایل به آب، گروه های عاملی ذرات محلول به آبدوست (جذب آب)، به راحتی توسط آب حل می شوند، آبگریز (آب دفع کننده) و دودوست تقسیم می شوند.
گروه های هیدروفیل شامل گروه های عاملی قطبی هستند: هیدروکسیل -OH، آمینو -NH 2، تیول -SH، کربوکسیل -COOH. گروه های آبگریز شامل گروه های غیر قطبی، به عنوان مثال رادیکال های هیدروکربنی: CH3-(CH2) p -، C6H5-. هیفیلیک شامل موادی (اسیدهای آمینه، پروتئین ها) است که مولکول های آنها دارای هر دو گروه آبدوست (-OH، -NH 2، -SH، -COOH) و گروه های آبگریز هستند: (CH 3 - (CH 2) p. - C 6 H 5 -).
هنگامی که مواد دودوست حل می شوند، ساختار آب در نتیجه برهمکنش با گروه های آبگریز تغییر می کند. درجه ترتیب مولکول های آب واقع در نزدیکی گروه های آبگریز افزایش می یابد و تماس مولکول های آب با گروه های آبگریز به حداقل می رسد. گروه های آبگریز، زمانی که با هم مرتبط شوند، مولکول های آب را از محل خود بیرون می راند.
11. غلظت محلول و روش های بیان آن
راه حلیک سیستم همگن از ترکیب متغیر متشکل از دو یا چند ماده که در حالت تعادل است نامیده می شود. مواد تشکیل دهنده محلول را اجزای محلول می نامند.
یکی از ویژگی های مهم یک محلول غلظت آن است. این مقدار بسیاری از خواص محلول را تعیین می کند.
غلظت مواد(جزء محلول) کمیتی است که با مقدار ماده محلول موجود در جرم یا حجم معینی از محلول یا حلال اندازه گیری می شود.
متداول ترین روش های مورد استفاده برای بیان غلظت عبارتند از: کسر جرمی، غلظت مولی، غلظت معادل مولی، کسر مولی، کسر حجمی، تیتر.
کسر جرمی دبلیو(X) در بخشهای واحد، درصد (%)، ppm (هزارم درصد) و قسمت در میلیون (ppm) بیان میشود. کسر جرمی با استفاده از فرمول های زیر محاسبه می شود:
W (X) = m (X) / m (اندازه)،
W (X) = متر (X) / متر (اندازه) × 100٪
که در آن m (X) جرم یک جزء معین X (ماده محلول)، کیلوگرم (g) است.
متر (محلول) - جرم محلول، کیلوگرم (گرم).
غلظت مولی بر حسب mol/m3، mol/dm3، mol/cm3، mol/l، mol/ml بیان میشود. در پزشکی استفاده از واحدهای mol/l ارجحیت دارد. غلظت مولی با استفاده از فرمول محاسبه می شود:
سی(X) = n (X) /V(p-p) = m (X) / م(X)× V(rr) ،
که در آن n (X) مقدار ماده محلول در سیستم، مول است.
م(X) - جرم مولی ماده محلول، کیلوگرم بر مول یا گرم بر مول؛
m (X) - جرم ماده محلول، کیلوگرم یا گرم، به ترتیب.
V(محلول) – حجم محلول، l. غلظت مولی
b (X) بر حسب مول بر کیلوگرم بیان می شود.
فرم ضبط، برای مثال: b(HCl) = 0.1 mol/kg. غلظت مولی را با استفاده از فرمول محاسبه کنید:
b (X) = n (X) / m (r-l) = m (X) / م(X) × m (بعد)
که در آن m (محلول) جرم حلال، کیلوگرم است.
در شیمی از مفهوم معادل و ضریب هم ارزی بسیار استفاده می شود.
معادلذره ای واقعی یا شرطی از ماده X نامیده می شود که در یک واکنش اسید-باز معین معادل یک یون هیدروژن یا در یک واکنش ردوکس معین - یک الکترون یا در یک واکنش تبادل معین بین نمک ها - یک واحد بار است.
کسر حجمی f ( X) به کسری از واحد یا به صورت درصد بیان می شود، با استفاده از فرمول محاسبه می شود:
F (X) = V(X) /V(rr)
کجا V(X) حجم یک جزء معین X از محلول است.
V(р-р) - حجم کل حلال.
تیتر محلول با T (X) نشان داده می شود، واحد اندازه گیری kg/cm3، g/cm3، g/ml است. تیتر محلول را می توان با استفاده از فرمول محاسبه کرد:
T (X) = m (X) /V(rr)
که در آن m (X) جرم ماده است، معمولاً g.
V(محلول) - حجم محلول، میلی لیتر.
12. فرآیند انحلال
ماهیت فرآیند انحلال پیچیده است. طبیعتاً این سؤال مطرح می شود که چرا برخی از مواد در برخی از حلال ها به راحتی حل می شوند و در برخی دیگر ضعیف یا عملاً نامحلول هستند.
تشکیل محلول ها همیشه با فرآیندهای فیزیکی خاصی همراه است. یکی از این فرآیندها انتشار یک املاح و یک حلال است. به لطف انتشار، ذرات (مولکول ها، یون ها) از سطح ماده حل کننده حذف می شوند و به طور مساوی در کل حجم حلال توزیع می شوند. به همین دلیل است که در غیاب هم زدن، سرعت انحلال به سرعت انتشار بستگی دارد. با این حال، فرآیندهای فیزیکی به تنهایی نمی توانند حلالیت نابرابر مواد در حلال های مختلف را توضیح دهند.
شیمیدان بزرگ روسی D.I. مندلیف (1834-1907) معتقد بود که فرآیندهای شیمیایی نقش مهمی در انحلال دارند. او وجود هیدرات های اسید سولفوریک را ثابت کرد
H 2 SO 4 H 2 O، H 2 SO 4 2H 2 O، H 2 SO 4 4H 2 O و برخی مواد دیگر، به عنوان مثال، C 2 H 5 OH3H 2 O. در این موارد، انحلال با تشکیل پیوندهای شیمیایی بین ذرات ماده محلول و حلال. به این فرآیند حلالیت می گویند.
همانطور که مشخص شد، بسته به ماهیت ماده محلول، حلال ها (هیدرات ها) می توانند در نتیجه فعل و انفعالات فیزیکی تشکیل شوند: برهمکنش یون-دو قطبی (به عنوان مثال، در حین انحلال مواد با ساختار یونی (NaCI و غیره). برهمکنش دوقطبی - دوقطبی - هنگام حل کردن مواد با ساختار مولکولی (مواد آلی)).
فعل و انفعالات شیمیایی از طریق پیوندهای دهنده-پذیرنده انجام می شود. در اینجا، یونهای ماده محلول گیرنده الکترون هستند و حلالها (H 2 O، NH 3) اهداکننده الکترون هستند (به عنوان مثال، تشکیل کمپلکس های آبی)، و همچنین در نتیجه تشکیل پیوندهای هیدروژنی (برای به عنوان مثال، حل شدن الکل در آب).
شاهد برهمکنش شیمیایی یک ماده محلول با یک حلال، اثرات حرارتی و تغییرات رنگی است که با انحلال همراه است.
به عنوان مثال، هنگامی که هیدروکسید پتاسیم در آب حل می شود، گرما آزاد می شود:
KOH + xH 2 O = KOH (H 2 O) x; ΔН° سل = -55 کیلوژول بر مول.
و هنگامی که کلرید سدیم حل می شود، گرما جذب می شود:
NaCI + xH 2 O = NaCI (H 2 O) x; ΔН° سل = +3.8 kJ/mol.
گرمای آزاد شده یا جذب شده با حل شدن 1 مول از یک ماده نامیده می شود گرمای محلول محلول Q
طبق قانون اول ترمودینامیک
محلول Q = محلول ΔН ,
که در آن انحلال ΔΝ تغییر در آنتالپی در هنگام حل مقدار معینی از ماده است.
حل کردن سولفات مس بی آب سفید در آب منجر به ظاهر شدن رنگ آبی شدید می شود. تشکیل محلولها، تغییر رنگ، اثرات حرارتی و همچنین تعدادی از عوامل دیگر نشاندهنده تغییر ماهیت شیمیایی اجزای محلول در طول تشکیل آن است.
بنابراین، مطابق با مفاهیم مدرن، انحلال یک فرآیند فیزیکوشیمیایی است که در آن هر دو نوع تعامل فیزیکی و شیمیایی نقش دارند.
13. ترمودینامیک فرآیند انحلال
طبق قانون دوم ترمودینامیک، در p، T = const، اگر در نتیجه این فرآیند، انرژی گیبس سیستم کاهش یابد، مواد می توانند به طور خود به خود در هر حلالی حل شوند.
ΔG = (ΔΝ – TΔS)< 0.
مقدار ΔH را ضریب آنتالپی و مقدار TΔS را ضریب آنتروپی انحلال می نامند.
وقتی مواد مایع و جامد حل میشوند، آنتروپی سیستم معمولاً افزایش مییابد (ΔS > 0)، زیرا مواد محلول از حالت مرتبتری به حالت کمتر میروند. سهم ضریب آنتروپی، که به افزایش حلالیت کمک می کند، به ویژه در دماهای بالا قابل توجه است، زیرا در این حالت ضریب T بزرگ است و قدر مطلق محصول TΔS نیز زیاد است و انرژی گیبس کاهش می یابد. بر این اساس افزایش می یابد.
هنگامی که گازها در یک مایع حل می شوند، آنتروپی سیستم معمولا کاهش می یابد (ΔS< 0), так как растворяемое вещество из менее упорядоченного состояния (боль–шого объема) переходит в более упорядоченное (ма–лый объем). Снижение температуры благоприятствует растворению газов, потому что в этом случае множи–тель Т мал и абсолютное значение произведения TΔS будет тем меньше, а убыль энергии Гиббса тем больше, чем ниже значение Т.
در طول تشکیل یک محلول، آنتالپی سیستم نیز می تواند افزایش یابد (NaCI) یا کاهش (KOH). تغییر در آنتالپی فرآیند انحلال باید مطابق با قانون هس به عنوان مجموع جبری سهم گرماگیر و گرمازا همه فرآیندهای همراه با فرآیند انحلال در نظر گرفته شود. اینها اثرات گرمازایی تخریب شبکه کریستالی مواد، شکستن پیوندهای مولکولها، تخریب ساختار اولیه حلال و اثرات گرمازا ناشی از تشکیل محصولات متقابل مختلف، از جمله حلالها است.
برای سادگی ارائه، افزایش آنتالپی انحلال ΔH یک محلول را می توان به عنوان تفاوت بین انرژی Ecr که برای تخریب شبکه کریستالی ماده حل شونده صرف می شود و انرژی E sol آزاد شده در طول حلال شدن ذرات نشان داد. املاح توسط مولکول های حلال به عبارت دیگر، تغییر در آنتالپی مجموع جبری تغییر در آنتالپی ΔΝ cr در نتیجه تخریب شبکه بلوری و تغییر در آنتالپی ΔΝ سل در اثر حل شدن توسط ذرات حلال است:
دН sol = ΔН cr + ΔН سل،
جایی که ΔΝ dist تغییر در آنتالپی در طول انحلال است.
با این حال، انحلال گازهای نجیب در حلال های آلی اغلب با جذب گرما همراه است، به عنوان مثال، هلیوم و نئون در استون، بنزن، اتانول و سیکلوهگزان.
هنگام حل کردن جامدات با ساختار کریستالی مولکولی و مایعات، پیوندهای مولکولی خیلی قوی نیستند، و بنابراین معمولا ΔH sol > ΔH cr این منجر به این واقعیت می شود که انحلال، به عنوان مثال، الکل ها و قندها یک فرآیند گرمازا است (ΔH sol< 0).
هنگام حل کردن مواد جامد با یک شبکه یونی، نسبت انرژی Ecr و E sol می تواند متفاوت باشد. با این حال، در بیشتر موارد، انرژی آزاد شده در حین حلال شدن یون ها، انرژی صرف شده برای تخریب شبکه کریستالی را جبران نمی کند، بنابراین، فرآیند انحلال گرماگیر است.
بنابراین، داده های ترمودینامیکی امکان پیش بینی انحلال خود به خودی مواد مختلف را بر اساس قوانین اول و دوم ترمودینامیک فراهم می کند.
14. حلالیت
اگر یک ماده محلول با یک حلال تماس پیدا کند، فرآیند تشکیل محلول در بسیاری از موارد خود به خود اتفاق می افتد تا زمانی که غلظت محدود کننده مشخصی حاصل شود (اشباع رخ می دهد). این زمانی اتفاق میافتد که به تعادل برسد، زمانی که عوامل آنتالپی و آنتروپی برابر میشوند، یعنی ΔΝ = TΔS.
به عنوان مثال، هنگامی که کریستال ها به یک مایع وارد می شوند، مولکول ها یا یون ها از سطح کریستال به محلول عبور می کنند. به دلیل انتشار، ذرات به طور مساوی در کل حجم حلال توزیع می شوند. انحلال تا اشباع ادامه دارد.
محلول فوق اشباع محلولی است که غلظت آن بیشتر از محلول اشباع شده باشد.
محلولی که غلظت آن کمتر از محلول اشباع باشد غیراشباع نامیده می شود.
توانایی یک ماده برای حل شدن در یک حلال خاص را حلالیت می گویند. از نظر عددی، حلالیت یک ماده برابر با غلظت محلول اشباع آن است.
حلالیت را می توان بر حسب واحدهای غلظت بیان کرد، برای مثال بر حسب مقدار املاح موجود در 1 لیتر محلول اشباع، مول در لیتر، یا بر حسب جرم املاح در 100 گرم محلول اشباع. واحد حلالیت گرم در 100 گرم حلال است. مقدار مربوطه را ضریب حلالیت می نامند.
حلالیت به ماهیت املاح و حلال، دما، فشار و وجود مواد دیگر در محلول بستگی دارد.
14ب تأثیر بر حلالیت ماهیت اجزاء
توانایی مواد برای انحلال با ماهیت نیروهای برهمکنش بین مولکول های اجزای محلول X 1 و X 2 تعیین می شود: حلال - حلال (X 1 - X 1)، املاح - املاح (X 2 - X 2)، حلال - املاح (X 1 - X 2) (نقاط نشان دهنده پیوندهای مولکولی است).
حلالیت مواد در محدوده وسیعی متفاوت است. مثال ها حلالیت نمک های مختلف در یک حلال (آب) و حلالیت یک ماده (AgNO 3) در حلال های مختلف را نشان می دهد.
مواد با نوع پیوند یونی و مواد متشکل از مولکول های قطبی در حلال های قطبی مانند آب و الکل ها بهتر حل می شوند. این حلال ها با ثابت دی الکتریک بالا مشخص می شوند.
حلالیت بالای مواد اغلب به دلیل تشکیل پیوندهای بین مولکولی، به ویژه هیدروژن است. بنابراین، حلالیت نامحدود متقابل آب و الکل با تشکیل پیوندهای هیدروژنی بین مولکولهای آب و الکل توضیح داده میشود، و انحلال بلورهای AgcI در محلول آبی آمونیاک با تشکیل یک پیوند دهنده و گیرنده شیمیایی توضیح داده میشود. یون نقره با مولکول های آمونیاک (AgCI در آب عملا نامحلول). به همین دلیل، پیریدین، حلالی با ثابت دی الکتریک پایین، حلالیت بسیار بالایی از خود نشان می دهد.
از آنجایی که حلالیت مشخص کننده تعادل واقعی است، تأثیر شرایط خارجی بر این حالت (فشار، دما) را می توان با استفاده از اصل Le Chatelier به صورت کیفی ارزیابی کرد. چنین ارزیابی هایی در تمرین غواصی در اعماق دریا، هنگام کار در فروشگاه های داغ و غیره ضروری است.
15. حلالیت گازها در مایعات. قوانین هنری دالتون و سچنوف
انحلال گازها در مایعات تقریباً همیشه با آزاد شدن گرما همراه است. بنابراین حلالیت گازها با افزایش دما طبق اصل Le Chatelier کاهش می یابد. این الگو اغلب برای حذف گازهای محلول از آب استفاده می شود (به عنوان مثال، C0 2 ) با جوشاندن. گاهی انحلال گاز با جذب گرما همراه است (مثلاً انحلال گازهای نجیب در برخی از حلال های آلی). در این حالت افزایش دما حلالیت گاز را افزایش می دهد.
گاز به طور نامحدود در مایع حل نمی شود. در غلظت گاز معین X، تعادل برقرار می شود:
هنگامی که یک گاز در یک مایع حل می شود، کاهش قابل توجهی در حجم سیستم رخ می دهد. بنابراین، افزایش فشار، طبق اصل لو شاتلیه، باید به تغییر تعادل به سمت راست، یعنی افزایش حلالیت گاز منجر شود. اگر گازی در مایع معین کمی محلول باشد و فشار آن کم باشد، حلالیت گاز متناسب با فشار آن است. این وابستگی با قانون هنری (1803) بیان می شود: مقدار گاز حل شده در دمای معین در حجم معینی از مایع، در حالت تعادل، با فشار گاز نسبت مستقیم دارد.
قانون هنری را می توان به شکل زیر نوشت:
با(X) = ک r(X) × P(X)
غلظت گاز در محلول اشباع کجاست، mol/l.
P (X) - فشار گاز X بالای محلول، Pa.
ک r(X) – ثابت هنری برای گاز X، mol×l-1×Pa-1.
ثابت هانری به ماهیت گاز، حلال و دما بستگی دارد.
قانون هنری فقط برای محلول های نسبتا رقیق، در فشارهای کم و عدم وجود برهمکنش شیمیایی بین مولکول های گاز محلول و حلال معتبر است.
قانون هنری یک مورد خاص از قانون کلی دالتون است. اگر در مورد انحلال یک ماده گازی، بلکه مخلوطی از گازها صحبت می کنیم، حلالیت هر جزء از قانون دالتون پیروی می کند: حلالیت هر یک از اجزای مخلوط گاز در دمای ثابت متناسب با فشار جزئی است. جزء بالای مایع است و به فشار کل مخلوط و فردیت سایر اجزا بستگی ندارد.
به عبارت دیگر، در صورت حل شدن مخلوط گازها در مایع، فشار جزئی p جایگزین بیان ریاضی قانون هنری می شود! از این جزء
فشار جزئی یک جزء به عنوان کسر فشار جزء از فشار کل مخلوط گاز درک می شود:
P i / P کل
فشار جزئی یک جزء با استفاده از فرمول محاسبه می شود
با مطالعه حلالیت گازها در مایعات در حضور الکترولیت ها، پزشک فیزیولوژیست روسی I.M. Sechenov (1829-1905) الگوی زیر را ایجاد کرد (قانون Sechenov): حلالیت گازها در مایعات در حضور الکترولیت ها کاهش می یابد. گازها آزاد می شوند.
Р i = Р کل ×(X i)
که در آن p i فشار جزئی جزء X i است.
ptot - فشار کل مخلوط گاز؛
x(X i) – کسر مولی جزء i ام.
با مطالعه حلالیت گازها در مایعات در حضور الکترولیت ها، پزشک و فیزیولوژیست روسی I.M. Sechenov (1829-1905) الگوی زیر را ایجاد کرد (قانون Sechenov): حلالیت گازها در مایعات در حضور الکترولیت ها کاهش می یابد. گازها آزاد می شوند.
با توجه به حالت تجمع آنها، محلول ها می توانند گاز، مایع و جامد باشند.
هر محلولی از مواد محلول و یک حلال تشکیل شده است، اگرچه این مفاهیم تا حدی دلبخواه هستند. به عنوان مثال، بسته به نسبت الکل و آب، این سیستم می تواند محلولی از الکل در آب یا آب در الکل باشد.
به طور معمول، یک حلال به آن جزء در نظر گرفته می شود که در محلول در همان حالت تجمعی مانند قبل از انحلال است.
مطالعه محلول ها مورد توجه خاص پزشکان است زیرا مهمترین مایعات بیولوژیکی - خون، لنف، ادرار، بزاق، عرق - محلول های نمک ها، پروتئین ها، کربوهیدرات ها، لیپیدها در آب هستند.
مایعات بیولوژیکی در انتقال مواد مغذی (چربی ها، اسیدهای آمینه، اکسیژن)، داروها به اندام ها و بافت ها و همچنین در دفع متابولیت ها (اوره، بی لیروبین، دی اکسید کربن و غیره) از بدن نقش دارند. پلاسمای خون یک محیط برای سلول ها - لنفوسیت ها، گلبول های قرمز، پلاکت ها است.
در محیط مایع بدن، اسیدیته ثابت، غلظت نمک ها و مواد آلی حفظ می شود. به این ثبات هموستاز غلظت می گویند.
طبقه بندی راه حل ها
محلول های مواد با جرم مولی کمتر از 5000 گرم در مول را محلول های ترکیبات با وزن مولکولی کم (LMC) و محلول های مواد با جرم مولی بیشتر از 5000 گرم در مول را محلول های ترکیبات با وزن مولکولی بالا می نامند. HMC).
بر اساس وجود یا عدم وجود تفکیک الکترولیتی، محلول های NMS به دو دسته تقسیم می شوند - محلول های الکترولیت ها و غیر الکترولیت ها.
محلول های الکترولیت محلول هایی از نمک ها، اسیدها، بازها و آمفولیت ها هستند که به یون ها تجزیه می شوند. به عنوان مثال، محلول های KNO 3، HCl، KOH، Al(OH) 3، گلیسین.
رسانایی الکتریکی محلول های الکترولیت بیشتر از حلال است.
محلول های غیر الکترولیت ها محلول هایی از موادی هستند که عملاً در آب تجزیه نمی شوند. به عنوان مثال، محلول های ساکارز، گلوکز، اوره. رسانایی الکتریکی محلول های غیر الکترولیت کمی با حلال متفاوت است.
محلول های NMS (الکترولیت ها و غیر الکترولیت ها) برخلاف محلول های کلوئیدی درست نامیده می شوند. محلول های واقعی با همگنی ترکیب و عدم وجود رابط بین املاح و حلال مشخص می شوند. اندازه ذرات محلول (یون ها و مولکول ها) کمتر از 9-10 متر است.
بیشتر BMC ها پلیمرهایی هستند که مولکول های آنها (درشت مولکول ها) از تعداد زیادی گروه تکرار شونده یا واحدهای مونومر تشکیل شده است که توسط پیوندهای شیمیایی به هم متصل شده اند. محلول های IUD محلول های پلی الکترولیت نامیده می شوند.
پلی الکترولیت ها شامل پلی اسیدها (هپارین، پلی آدنیلیک اسید، پلی آسپارتیک اسید و غیره)، پلی بازها (پلی لیزین)، پلی آمفولیت ها (پروتئین ها، اسیدهای نوکلئیک) می باشند.
خواص محلول های IUD به طور قابل توجهی با خواص محلول های NMS متفاوت است. بنابراین در بخش جداگانه ای بررسی خواهند شد. این فصل به محلول های الکترولیت های با وزن مولکولی کم، آمفولیت ها و غیر الکترولیت ها اختصاص دارد.
راه حل ها می تواند باشد مایع، جامد و گاز .
حلالمی تواند جامد، مایع و گاز باشد.
تقریباً همه گازها در یکدیگر حل می شوند. مایعات، گازها و جامدات در مایعات حل می شوند. فقط جامدات در جامدات حل می شوند. در محلول های جامد، یک سیستم همگن از اجزای جامد تشکیل می شود.
محلول های گازیمحلول گازها، مایعات و جامدات در گازها هستند. در حد فشار صفر، هر گاز واقعی نشان دهنده سیستمی از ذرات مستقل از یکدیگر است، به عنوان مثال. ویژگی های یک سیستم ایده آل را دارد. مخلوطی از این گازها به نام گاز ایده آل، اطاعت می کند قانون دالتون:(کجا آر- فشار کل؛ آر من- فشار جزئی منجزء ام). با افزایش فشار، برهمکنش بین ذرات ظاهر می شود، سپس مخلوطی از گازهای واقعی، بخار مایع و جامدات به عنوان محلول گاز در نظر گرفته می شود.
گسترده ترین مایعبه ویژه، محلول های آبی. در مورد محلول های "مایع-گاز" و "مایع-جامد"، حلال معمولاً مایع در نظر گرفته می شود. در محلول های مایع-مایع، حلال جزئی است که در مقایسه با سایر اجزاء که املاح نامیده می شوند، بیش از حد است.
بسته به خواص املاح، وجود دارد محلول های مایعنه الکترولیت، الکترولیت و ترکیبات با وزن مولکولی بالا(نیروی دریایی). مورد دوم در شیمی کلوئید مورد توجه قرار می گیرد.
مقدار ماده حل شده در حجم معینی از حلال نامیده می شود تمرکز
روش های بیان غلظت:
1) غلظت مولی M(یا مولاریته) - تعداد مول های یک ماده حل شده در 1 متر مکعب (یا لیتر) محلول:
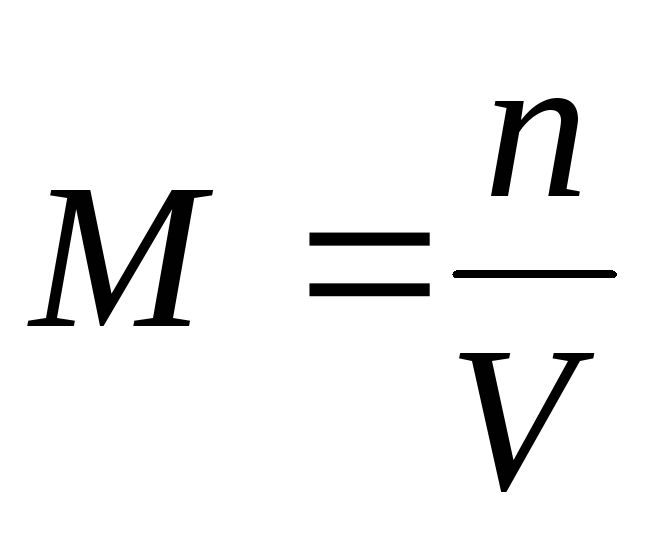
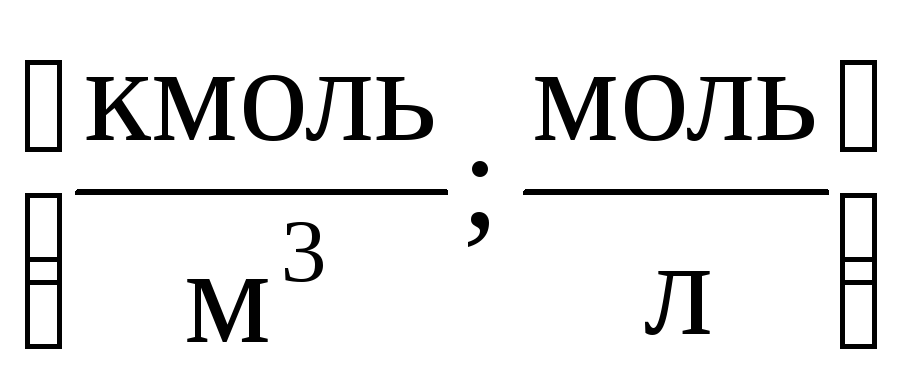
2) غلظت مولیتی (یا مولالیته) - تعداد مولهای ماده محلول در 1 کیلوگرم یا 1000 گرم حلال:
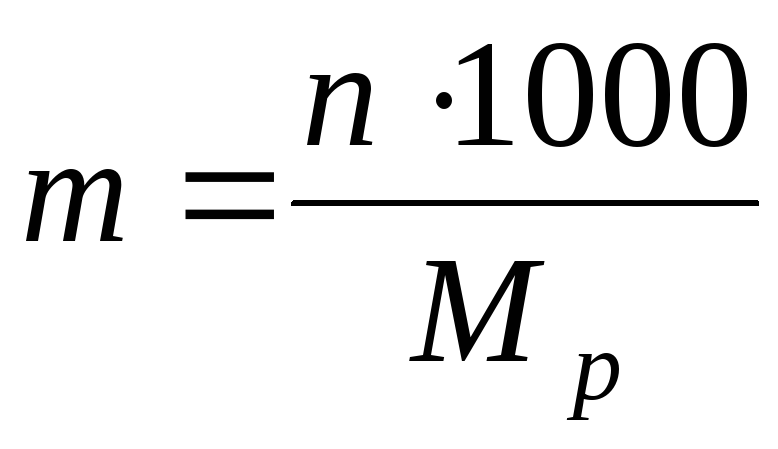

کجا م ص - جرم حلال
3) درصد غلظت ω با تعداد گرم ماده در 100 گرم (وزنی) یا 100 میلی لیتر (حجمی) محلول تعیین می شود:
 یا
یا 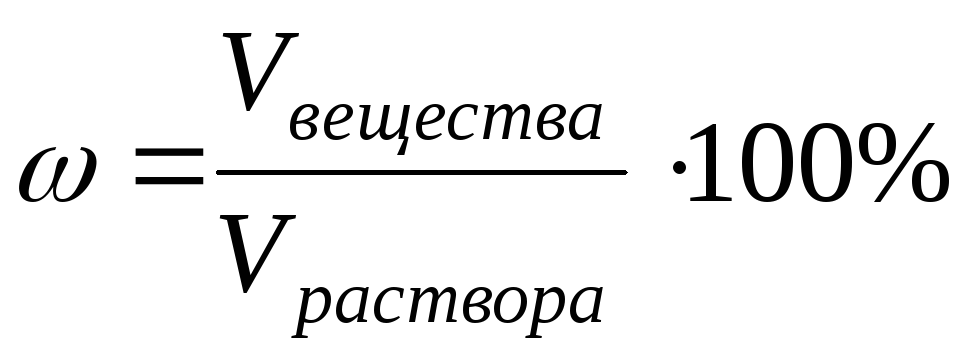
4) کسر مولن- نسبت تعداد مول n یک جزء به تعداد کل مول n تمام اجزای محلول:
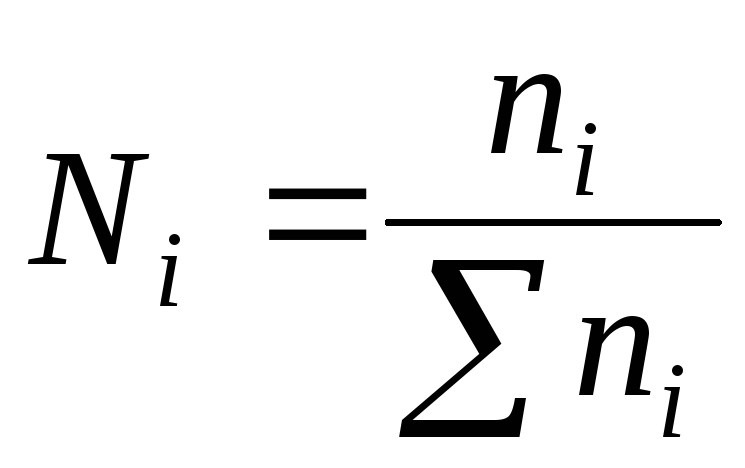
مجموع کسرهای مولی همه اجزای محلول برابر با واحد است:
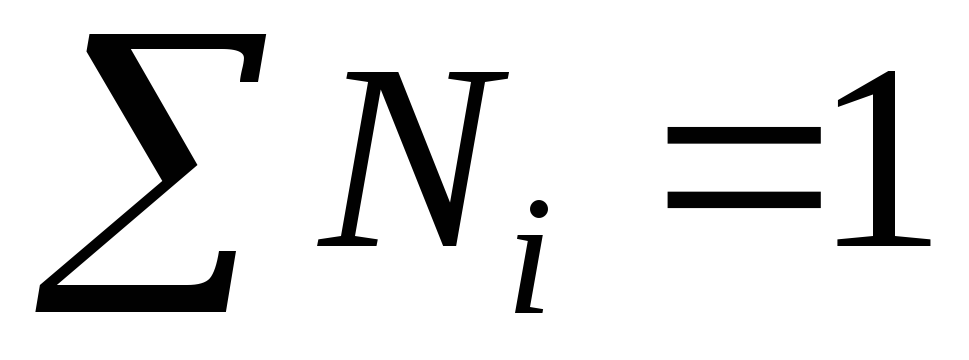
مثال.بیایید M، m و N را بر اساس غلظت جرمی شناخته شده اسید سولفوریک ω = 98٪ محاسبه کنیم، چگالی محلول 1.84 گرم در لیتر است. جرم مولی اجزای محلول برابر است 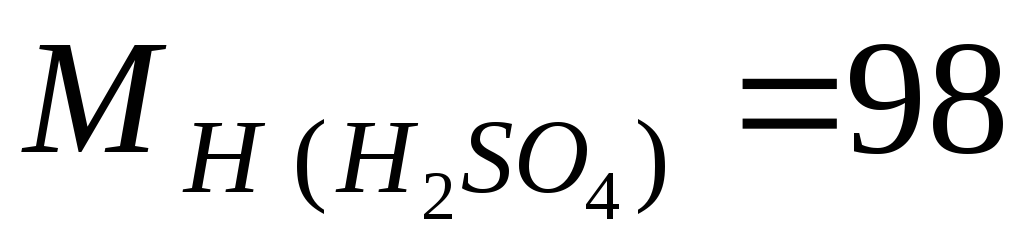 گرم در مول؛
گرم در مول؛ 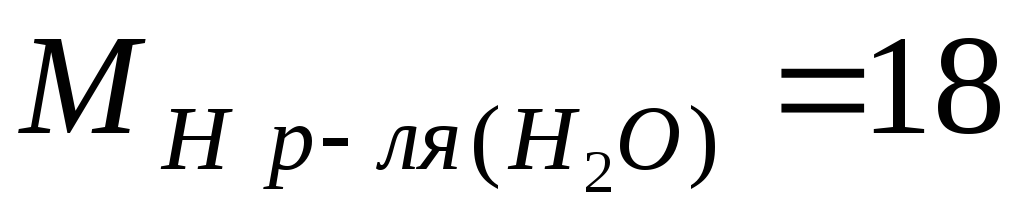 g/mol.
g/mol.
مولاریته محلول:
مولالیته محلول عبارت است از:
کسر مولی اسید سولفوریک عبارت است از:
II محلول ها نیز بر اساس میزان برهمکنش بین حلال و املاح تقسیم می شوند.
راه حل های ایده آل اینها محلولهایی هستند که در آنها قدرت برهمکنش بین مولکولهای مشابه و غیر مشابه یکسان است.
الف – ماده محلول f الف - الف
ب – حلال f V-V
محلول AB f الف - الف = f V-V = f الف -IN
در محلول های ایده آل، انرژی برهمکنش بین مولکول های اجزای مختلف یکسان است. همه مولکول های محلول (املاح و حلال) میدان نیروی یکسانی دارند و حجم مولکول های همه اجزاء برابر است. در یک محلول مایع ایده آل، بر خلاف گاز ایده آل، برهمکنش بین مولکول ها وجود دارد. انرژی برهمکنش یکسان همه مولکول ها در یک محلول منجر به توزیع یکنواخت آنها در حجم می شود. بنابراین، آنتروپی اختلاط اجزای یک محلول ایده آل است ΔSبرابر با آنتروپی اختلاط یک گاز ایده آل است ΔS به عنوان مثال .
حجم مساوی همه مولکول ها تضمین می کند که حجم سیستم در طول تشکیل یک محلول ایده آل ثابت می ماند. اثر حرارتی در طول این تشکیل یک محلول ایده آل صفر است. در این رابطه می توان تعریف دیگری از محلول های مایع ایده آل ارائه داد. ایده آل چنین محلول هایی وجود خواهد داشت که تشکیل آنها از اجزای گرفته شده در همان حالت تجمع و در هیچ نسبتی با تغییر حجم و اثر حرارتی همراه نیست و تغییر در آنتروپی برابر با تغییر آنتروپی هنگام مخلوط کردن ایده آل است. گازها، یعنی
Δ V=0; ΔH=0; ΔS= ΔS به عنوان مثال
حجم و آنتالپی محلول های ایده آل افزودنی بوده و به ترکیب محلول بستگی دارد.
باید در نظر داشت که محلول ها را زمانی می توان ایده آل در نظر گرفت که تمام شرایط فوق رعایت شده باشد و علاوه بر این، فشار جزئی اجزاء باید برابر باشد، آنها باید دمای یکسان و حالت تجمع یکسان داشته باشند.
راه حل های ایده آل را ایده آل می نامند زیرا در واقعیت وجود ندارند. با این حال، تعداد قابل توجهی از راه حل ها با خواص نزدیک به راه حل های ایده آل وجود دارد. این شامل محلول های رقیق شده است.
انرژی گیبس منهفتم جزء یک محلول ایده آل از نظر عددی برابر با پتانسیل شیمیایی است و می تواند به صورت زیر نمایش داده شود:
وقتی ∆ اچ من = 0، پتانسیل شیمیایی منهفتم جزء در یک راه حل ایده آل برابر است با:
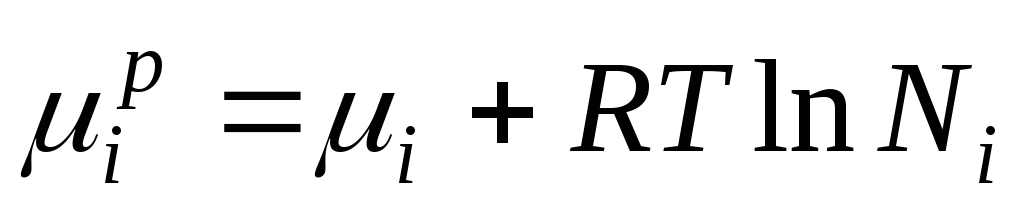 ، کجا
، کجا
µ من , µ من ص- پتانسیل های شیمیایی منجزء منفرد در محلول؛ ن من – کسر مول منجزء ام
بیایید این معادله را متمایز کنیم و بدست آوریم:
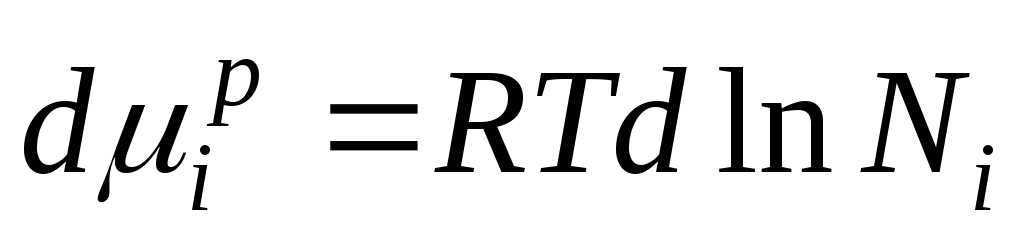
با توجه به اینکه 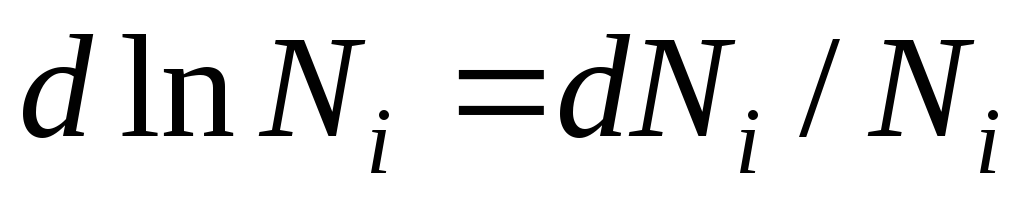 دریافت می کنیم:
دریافت می کنیم:
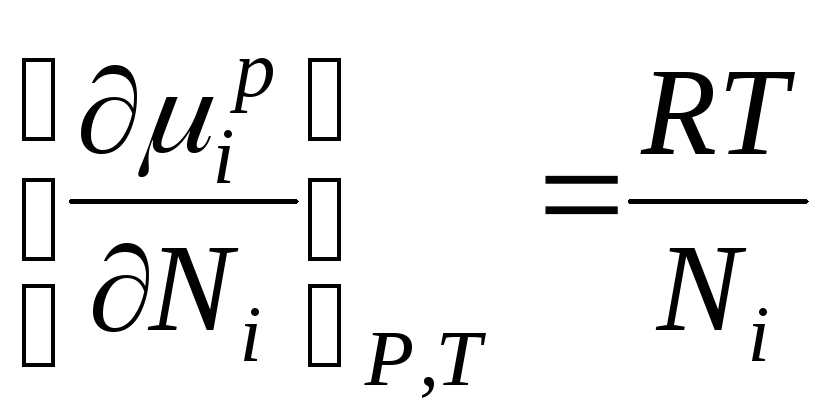
این معادله رابطه بین پتانسیل شیمیایی اجزای یک محلول ایده آل و ترکیب آن را نشان می دهد که توسط کسر مولی اجزای محلول تعیین می شود.
در نظر بگیریم محلول های بسیار رقیق شده، که اغلب به آنها به سادگی رقیق می گویند. محلول های بسیار رقیق شده اینها محلولهایی هستند که در آنها حلال از قانون محلولهای ایده آل و ماده محلول از قوانین محلولهای واقعی پیروی می کند.
غلظت یک املاح در محلول رقیق بی نهایت کوچک است، بنابراین می توان از تعامل بین مولکول های آن غفلت کرد. سپس راه حل های بسیار رقیق را می توان با قوانین و معادلاتی توصیف کرد که برای راه حل های ایده آل معتبر هستند.
راه حل های غیر ایده آل (واقعی). اینها محلولهایی هستند که در آنها نیروهای برهمکنش بین مولکولهای مشابه و غیرمشابه متفاوت است.
محلول AB f الف - الف ≠ f V-V ≠ f الف -IN
راه حل های واقعی از قوانین راه حل های ایده آل و بسیار رقیق تبعیت نمی کنند. با این حال، با معرفی کمیت های کمکی، می توان خواص راه حل های غیر ایده آل را از طریق قوانین راه حل های ایده آل نیز بیان کرد.
حلالیت روشهای بیان غلظت محلولها انحلال به عنوان یک فرآیند فیزیکی و شیمیایی.
اهداف:
آموزشی:
- ایجاد درک درستی از مفاهیم: "حلول"، "انحلال"، "حلالیت"، "غلظت".
- نظریه فیزیکی، شیمیایی و مدرن محلول ها را در نظر بگیرید.
- اهمیت راه حل ها را در زندگی انسان نشان دهید.
آموزشی:
- تحکیم دانش، مهارت ها و توانایی های دانش آموزان در حل مسائل در موضوع راه حل.
مربیان:
- توسعه مهارت های مشاهده، تفکر منطقی، توانایی نتیجه گیری و نتیجه گیری دانش آموزان.
پیشرفت سخنرانی
I. لحظه سازمانی. آزمایش دانش در مورد سرعت یک واکنش شیمیایی.
II. توضیح مطالب جدید
معلم:راه حل ها نقش مهمی در طبیعت، فناوری و علم دارند.
محلول ها کجا استفاده می شود؟ (پاسخ دانش آموزان)
معلم:نقش راه حل ها در پیدایش و توسعه حیات روی زمین بسیار زیاد است. یکی از نظریه های پیدایش موجودات، نظریه پیدایش حیات در اقیانوس اولیه است که آب با مواد حل شده در آن بود. از این محلول، موجودات یون ها و مولکول های لازم برای رشد و نمو را دریافت کردند.
بدن انسان حاوی محلول های مهم فیزیولوژیکی است. کدام؟ (خون، شیره معده و غیره)
راه حلیک سیستم همگن متشکل از دو یا چند جزء است که محتوای آن را می توان در محدوده های معینی تغییر داد بدون اینکه همگنی را مختل کند.
محلول یک سیستم همگن (همگن) است که از ذرات یک ماده محلول، یک حلال و محصولات برهمکنش آنها تشکیل شده است.
طبقه بندی راه حل ها
با توجه به وضعیت تجمع:گاز (هوا)، مایع (آب دریا)، جامد (آلیاژ)
با ترکیب حلال(آب، آمونیاک، بنزن و غیره)
بر اساس اندازه ذرات یا درجه آسیاب (پراکندگی):
تعلیق کند(سیستم های درشت) - اندازه ذرات 10-3 -10-5 سانتی متر سیستم های تعلیق بسیار شکننده و ناهمگن هستند. معمولا سیستم های پراکنده درشت هستند
به شکل سوسپانسیون، امولسیون، آئروسل.
نمونه هایی از سیستم های درشت طبیعی را ذکر کنید؟
محلول های کلوئیدی- اندازه ذرات
10-5 - 10-7 سانتی متر نمونه هایی از DS کلوئیدی محلول های چسب و ژلاتین هستند.
محلول های کلوئیدی با این واقعیت متمایز می شوند که ذرات آنها نور عبوری از خود را به شدت پراکنده می کنند و مسیر پرتو نور عبوری را قابل توجه می کنند (اثر Tyndall).
راه حل های واقعی -اندازه ذرات 10-7 - 10-8 سانتی متر است، اینها DS همگن و پایدار هستند.
غلظت محلول اشباع نامیده می شود حلالیت نشان دهنده دمایی است که در آن تعیین می شود.
n حلالیت - تعداد مول ماده محلول در یک لیتر محلول (در حالت اشباع)
حلالیت- توانایی یک ماده برای تشکیل سیستم های همگن با سایر مواد - محلول هایی که در آنها ماده به شکل اتم ها، یون ها، مولکول ها یا ذرات منفرد است. حلالیت به صورت غلظت یک املاح در محلول اشباع آن، به صورت درصد یا بر حسب واحد وزن یا حجم بیان می شود. حلالیت گازها در مایع به دما و فشار بستگی دارد. حلالیت مواد مایع و جامد تقریباً به طور کامل به دما بستگی دارد.
n Coef. حلالیت- جرم جزء محلول در 100 گرم محلول
راه حل های واقعی سیستم های ترمودینامیکی پایدار هستند که به طور نامحدود در زمان پایدار هستند.
نیروهای محرک برای تشکیل محلول ها عوامل آنتروپی و آنتالپی هستند. هنگامی که گازها در یک مایع حل می شوند، آنتروپی همیشه ΔS کاهش می یابد< 0, а при растворении кристаллов возрастает (ΔS >0). هر چه برهمکنش بین املاح و حلال قوی تر باشد، نقش عامل آنتالپی در تشکیل محلول ها بیشتر می شود. علامت تغییر در آنتالپی انحلال با علامت مجموع تمام اثرات حرارتی فرآیندهای همراه با انحلال تعیین می شود، که سهم اصلی آن با تخریب شبکه کریستالی به یون های آزاد است (ΔH > 0) و برهمکنش یونهای حاصل با مولکولهای حلال (حلول زایی، ΔH< 0). При этом независимо от знака энтальпии при растворении (абсолютно нерастворимых веществ нет) всегда ΔG = ΔH – T·ΔS < 0, т. к. переход вещества в раствор сопровождается значительным возрастанием энтропии вследствие стремления системы к разупорядочиванию. Для жидких растворов (расплавов) процесс растворения идет самопроизвольно (ΔG < 0) до установления динамического равновесия между раствором и твердой фазой.
