فنل فتالئین چیست؟ خطرات اصلی تقطیر با بخار آب
(سند)
n2.doc
آژانس فدرال آموزش
آزمایش عمومی 1: تیتراسیون
چرا هنگام اضافه کردن چند قطره آخر آب باید مطمئن شوید که چشمانتان یکنواخت است؟
- غلظت این محلول استاندارد چقدر است؟
- هدف از شستشوی لیوان و قیف با آب چیست؟
- هدف از شستشوی داخل فلاسک حجمی با آب چیست؟
روش تبلور مجدد از الکل داغ
از جدول، میانگین حجم تیتراسیون این آزمایش را تعیین کنید و از این مقدار در بقیه محاسبات خود استفاده کنید. با استفاده از مثال های قبلی، غلظت اسید استیک را در نمونه سرکه تعیین کنید. به یاد داشته باشید که اطلاعات زیر را دارید: حجم حجم انگور محلول هیدروکسید سدیم، غلظت محلول هیدروکسید سدیم. غلظت محلول هیدروکسید سدیم با غلظت نامعلوم را تعیین کنید.
دولت موسسه تحصیلیآموزش عالی حرفه ای
پامرانیان دانشگاه دولتیبه نام M.V. Lomonosov
گروه شیمی
کار دوره
سنتز فنل فتالئین
بررسی انحلال پذیری در حلال هایی با ضریب دی الکتریک متفاوت
تکمیل شد:
اسیدها و بازهای غلیظ می توانند باعث سوختگی شدید شوند. پیشنهاد می کنیم هنگام کار با اسید یا باز از دستکش و عینک استفاده کنید. با اطمینان از بسته بودن بورت، محلول استاندارد اگزالیک اسید را به دقت به بورت اضافه کنید تا بورت پر شود. یک لیوان تمیز را زیر بورت قرار دهید و مقداری از محلول اسید اگزالیک را با احتیاط داخل آن قرار دهید. این اطمینان حاصل می کند که هیچ حباب هوا در بورت وجود ندارد. قسمت بالای محلول باید بین علامت های 0 و 1 سانتی متر مکعب باشد.مقدار را تا رقم دوم اعشار ثبت کنید. از یک پیپت برای اندازه گیری 20 سانتی متر مکعب محلول در یک فلاسک مخروطی استفاده کنید. 3-4 قطره نشانگر فنل فتالئین را به فلاسک مخروطی اضافه کنید. با افزودن سریع اسید اگزالیک به فلاسک مخروطی و چرخاندن مداوم فلاسک مخروطی، آزمایش تیتراسیون خشن را انجام دهید. به محض تغییر رنگ محلول متوقف شده و پس از چرخش تغییر می کند. اگر هنگام چرخاندن فلاسک تغییر رنگ باقی نماند، اسید اگزالیک بیشتری اضافه کنید تا رنگی باقی نماند. مراحل 4-7 را با فلاسک دوم مخروطی تکرار کنید. اسید اگزالیک را به سرعت به فلاسک مخروطی اضافه کنید تا زمانی که 2 سانتی متر مکعب کمتر از حجم تیتراسیون ناخالص خود اضافه کنید. بر این لحظهتغییر رنگ دائمی نباید وجود داشته باشد. اسید اگزالیک را به تدریج اضافه کنید. بین هر قطره گرداب بزنید و در صورت لزوم کناره های فلاسک را با آب بشویید. هنگامی که محلول تغییر رنگ داد و رنگ جدید باقی می ماند، حجم روی بوته را یادداشت کنید. به یاد داشته باشید که حجم تیتر شده: -. برای دقت، مراحل 9-11 را تکرار کنید تا زمانی که سه عدد با اختلاف بیش از 0.1 سانتی متر مکعب نداشته باشید.
- یکی از عینک ها را علامت گذاری کنید \\.
- از یک پیپت برای اندازه گیری 100 سانتی متر مکعب آب در یک بشر استفاده کنید.
- تقریباً 4 گرم به یک لیوان اضافه کنید و هم بزنید.
- بورت را به پایه پشتی وصل کنید و قیف کوچک را روی آن قرار دهید.
- هنگام افزودن فنل فتالئین محلول هیدروکسید سدیم چه رنگی بود؟
- وقتی اسید کافی اضافه شد چه رنگی بود؟
دانشجوی سال 3
گروه های شیمی
آلفروف ولادیمیر ایوانوویچ
بررسی شد:
دانشیار، Cand. شیمی علوم
Levandovskaya T.V.
دانشیار، Cand. فن آوری علوم
چاگینا N. B.
آرخانگلسک
1. مروری بر ادبیات………………………………………………………..5
مشخصات ظاهری و فیزیکی فنل فتالئین………….5
کاربرد فنل فتالئین……………………………………………
خواص شیمیایی…………………………………………………………………………………………
به دست آوردن فنل فتالئین………………………………………………………
1.4.2 مشخصات فیزیکیمواد مورد استفاده در سنتز ... .15
با استفاده از مثال های قبلی، غلظت محلول هیدروکسید سدیم را تعیین کنید. به یاد داشته باشید که اطلاعات زیر را دارید: حجم محلول هیدروکسید سدیم در حجم محلول اسید اگزالیک غلظت محلول اسید اگزالیک. معادله شیمیایی متعادل برای این واکنش.
جرم اسید اگزالیک را که دانش آموز باید حل کند تا محلول استاندارد مورد نیاز تشکیل شود را محاسبه کنید. او معتقد است که 40 سانتی متر مکعب از محلول اسید اگزالیک، 35 سانتی متر مکعب از محلول هیدروکسید سدیم را به طور کامل خنثی می کند.
- ما به یک توده اسید اگزالیک نیاز داریم.
- با این حال، ما هنوز تعداد خال ها را نمی دانیم.
1.4.3 روش تقطیر با بخار………………………….16
1.4.4 روش تبلور مجدد از الکل داغ…………….18
1.5 اقدامات احتیاطی ایمنی……………………………………………………………………………………………………
1.5.1 خطرات اصلی هنگام کار با اسیدهای غلیظ………………………………………………………………………………………………………………………………………
1.5.2 خطرات اصلی در تقطیر با بخار ……..21
- یک معادله شیمیایی متعادل برای واکنش بنویسید.
- غلظت اسید را محاسبه کنید.
این باران غالباً اسیدی برای اولین بار در قرن نوزدهم مورد توجه قرار گرفت، اما تا قرن بیستم بود که این اسیدیته در سطوح خطرناکی که ما با اصطلاح "باران اسیدی" میشناسیم، گسترده شد. مقصر اصلی زغال سنگ حاوی گوگرد به عنوان ناخالصی بود. هنگامی که در یک نیروگاه سوزانده می شود، این گوگرد با اکسیژن ترکیب می شود و دی اکسید گوگرد را تشکیل می دهد که از طریق دودکش بالا می رود و در جو پراکنده می شود.
1.5.3 خطرات اصلی در حین تبلور مجدد از الکل داغ…………………………………………………………………………………………………………………………………….
22
1.6 خصوصیات حلال ها………………………………………………………………………….
1.6.1 طبقه بندی حلال ها بر اساس خواص فیزیکی … 25
اسید سولفوریک اسید بسیار قوی است و هنگامی که آب از هوا متراکم می شود و قطرات باران را تشکیل می دهد، اسید در آب حل می شود. سپس باران می بارد و در بدن ها جمع می شود آب شیرینافزایش اسیدیته آنها شمال شرقی ایالات متحده بیشترین آسیب را از این امر متحمل شده است زیرا دره اوهایو، از جمله مناطق اوهایو و پنسیلوانیا، مکان هایی هستند که بیشترین استخراج زغال سنگ در یک قرن و نیم گذشته را داشته اند. به دلیل شرایط آب و هوایی غالب، این گازهای دودکش وارد جو در دره اوهایو می شوند، اما باران در شمال نیویورک و نیوانگلند می بارد.
1.6.2 سیستم های طبقه بندی حلال بر اساس آنها خواص شیمیایی………………………………………………..30
1.7 مروری بر روشهای تعیین حلالیت جامدات ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
1.7.1 روش ثقلی………………………………………………………….35
1.7.2 روش الکتروشیمیایی…………………………………………37
1.7.3 روش فوتوالکتروکالریمتری………………………..41
افزایش اسیدیته باران می تواند مخرب باشد. ناخالصی های فلزی موجود در خاک، که معمولاً به طور محکم به ترکیبات دیگر متصل می شوند، می توانند توسط باران اسیدی به دریاچه ها و نهرها شسته شوند. در یک زمان، بسیاری از حوضچه ها در نیوانگلند به همین دلیل قادر به حمایت از ماهی قزل آلا نیستند. گیاهان به pH خاک نیز بسیار حساس هستند. مواد مغذی مفید نیز می توانند از خاک شسته شوند و گیاهان قادر به ادامه حیات در آن نباشند. همانطور که در بالا نشان داده شده است، در مناطقی که به شدت آسیب دیده اند، ده ها درخت مرده را می توان یافت.
2. بخش تجربی……………………………………………………………………………
2.1 سنتز فنل فتالئین……………………………………………………………………………
2.2 تبلور مجدد از الکل داغ…………………………..45
2.3 تعیین حلالیت……………………………………………….47
نتیجه گیری…………………………………………………………
فهرست کتابشناختی………………………………………….51
ساختمانها و مجسمهها نیز در اثر باران اسیدی آسیب دیدهاند که سنگها، بهویژه سنگهای آهکی را میخورد. افزایش فرسایش مجسمه ها، سنگ قبرها و حتی برخی از ساختمان ها منجر به خسارات زیادی شد - برخی از آثار هنری به طور کامل نابود شدند.
از آن زمان انتشار گازهای گلخانه ای به میزان قابل توجهی کاهش یافته است و بنابراین باران اسیدی نیز پایین آمده است. با این حال، این مشکل هنوز برطرف نشده است و کارهای زیادی برای انجام این مشکل جدی زیست محیطی باقی مانده است. بیایید به اسید کلریدریک که جزء اصلی اسید معده است و هیدروکسید سدیم که اغلب به آن «لی» می گویند و در صابون استفاده می شود نگاهی بیندازیم. با این حال، تقریباً تمام هیدرونیون و هیدروکسید با هم ترکیب میشوند تا مولکولهای آب را بسازند و تنها یونهای کلرید و سدیم را باقی میگذارند.
مقدمه
فنل فتالئین یکی از پرکاربردترین شاخص های اسید-باز در شیمی است. متعلق به رنگهای تری آریل متان به نام فتالئین است.
هدف از این کار سنتز فنل فتالئین و بررسی حلالیت آن در حلال هایی با ثابت های دی الکتریک مختلف است. برای رسیدن به این هدف، حل وظایف زیر ضروری است:
اگر مقدار اسید کلریدریک دقیقاً با مقدار هیدروکسید سدیم در مول برابر باشد، هر هیدرونیوم باید یک هیدروکسید داشته باشد تا بتواند واکنش نشان دهد و محلولی که در حال حاضر خنثی است باقی بماند. حالا باید یک لیوان آب خالص با PH 7 و نمک معمولی حل شده در آن باشد. ما با دو ماده بسیار سوزاننده شروع می کنیم و با محصولات خوش خیم پایان می دهیم.
به طور کلی، هنگامی که اسیدها و بازها با یکدیگر برهمکنش می کنند، یکدیگر را خنثی می کنند و pH محلول به این نزدیک می شود. به آن «.» می گویند. تنها زمانی که مقدار مساوی یک اسید قوی و یک باز قوی با هم جمع شوند، pH دقیق خواهد بود. اما در بسیاری از موارد اسیدهای ضعیف و بازهای ضعیف با هم ترکیب می شوند. با این حال، pH به 7 نزدیک می شود، اما محلول خنثی نخواهد بود. در مورد باران اسیدی، سنگ ها و خاک اغلب سنگ های اصلی هستند، به ویژه سنگ های کربناتی که در بخش هایی از کشور یافت می شوند.
1. تحلیل ادبیات مربوط به این موضوع؛
2. روش های سنتز را انتخاب کنید و مناسب ترین آنها را انتخاب کنید.
3. برای انجام سنتز، جداسازی و خالص سازی محصول؛
4. بررسی حلالیت در حلال های با ثابت دی الکتریک مختلف، مقایسه نتایج به دست آمده با داده های ادبیات.
همانطور که اسیدهای ضعیف در باران اسیدی روی سنگ می ریزند، آنها توسط بازهای روی برگ، گل و سنگ خنثی می شوند. با این حال، بسیاری از این پایهها، مانند آنهایی که در سنگها هستند، تجدیدپذیر نیستند. پس از یک قرن باران اسیدی، سنگ ها تمام پایه های موجود در سنگ ها را خنثی می کنند، باران اسیدی فقط وارد اکوسیستم می شود و هیچ چیز آن را خنثی نمی کند.
فنل فتالئین: شاخص عمومی آزمایشگاهی
مولکول فنل فتالئین در حضور اسید شفاف و در حضور باز صورتی است. این یک شاخص عالی برای یافتن نقطه هم ارزی در تیتراسیون اسید-باز برای اسیدهای ساده است. در بخش 5 از بخش 8، تیتراسیون به عنوان روشی برای ترکیب دو محلول با هم به منظور داشتن یک واکنش استوکیومتری کنترل شده معرفی شد. نیاز به محلولی با غلظت مشخص دارد، معمولاً در یک بورت، که با محلولی با غلظت نامعلوم در یک فنجان زیر واکنش می دهد. هر واکنشی برای تیتراسیون کار خواهد کرد، اما برای اینکه بتوانیم بگوییم چه زمانی واکنش انجام شده است، باید یک نقطه پایان قابل مشاهده وجود داشته باشد.
5.
در مورد کار انجام شده نتیجه گیری کنید.
1. بررسی ادبیات
1.1 ظاهر و خواص فیزیکی فنل فتالئین
فنل فتالئین (Di-n-dioxydiphenylphthalide، 2،2-bis(n-hydroxyphenyl)phthalide) یک پودر کریستالی سفید یا کمی زرد است. هنگام تبلور مجدد از اتانول رقیق، سوزن های بی رنگ و لوزی شکل ایجاد می شود. فنل فتالئین بی بو است و در هوا پایدار نیست. وزن مولکولی 318.3 گرم بر مول است. فنل فتالئین در دمای 250 درجه سانتیگراد (258 درجه سانتیگراد) و در دمای بیشتر ذوب می شود. دمای بالامتعالی می کند.
فنل فتالئین برای کاهش وزن
برای واکنشهای باز اسیدی، نشانگرها میتوانند فقط این نوع اطلاعات را با تغییر رنگ برای نشان دادن نقطه پایان ارائه دهند. بنابراین، واکنشهای خنثیسازی اسید باز یکی از رایجترین انواع واکنشهای مورد استفاده در سنجش تیتراسیون هستند. بنابراین می توان از تیتراسیون برای تعیین مقدار اسید یا باز در محلول ناشناخته استفاده کرد.
هنگام تیتراسیون اسیدهای قوی با بازهای قوی، نقطه پایانی زمانی حاصل می شود که PH دقیقاً 7 باشد زیرا محلول باید فقط یک محلول آبی خالص با الکترولیت های خنثی در آن باشد. پس از از بین رفتن اسید، هر پایه ای که به فلاسک اضافه می کنیم خنثی نمی شود و pH محلول شروع به افزایش می کند. با این حال، حتی یک قطره کوچک از یک بورت باز قوی اضافی، pH را تغییر می دهد. یکی از این شاخص ها، فنل فتالئین، در محلول های اسیدی شفاف و بی رنگ است، اما اگر pH بالاتر از 2 باشد، در محلول های بازی به رنگ صورتی تیره می شود.
فنل فتالئین در اتانول، دی اتیل اتر، کلروفرم، استون، اتر نفتی، بنزن، تولوئن محلول و در آب ضعیف است.
1.2 استفاده از فنل فتالئین
فنل فتالئین یکی از پرکاربردترین شاخص ها به ویژه در تعیین حجمی اسیدهای ضعیف است.
چندین مزیت دارد: به دماهای بالا حساس نیست، خطای وجود مواد پروتئینی و کلوئیدی ناچیز است. حتی در محلول های حاوی الکل می توان از آن به طور گسترده استفاده کرد، فقط رنگ محلول قلیایی با رنگ بنفش مشخصه محلول آبی متفاوت است. در محلول های الکل غلیظ شکل اصلی دارای رنگ آبی-بنفش است. فنل فتالئین را می توان در تیتراسیون اسیدهای آلی در محلول های الکلی یا تعیین اسیدیته الکل ها و استرها استفاده کرد. هیورت و هام استفاده از پلی سدیم گلیکولات را برای تعیین تیتر پایه در حضور فنل فتالئین پیشنهاد کردند. نتایج رضایت بخشی با تیتراسیون 2 •10 -6 - 30 •10 -6 گرم اسیدهای آلی در حجم 2.7 •10 -6 - 40 •10 -6 لیتر در حضور فنل فتالئین بدست می آید. طبق تحقیقات میک، غلظت اندیکاتور نقش بسیار مهمی در میکرواسیدیمتری دارد. فنل فتالئین جزء بسیاری از شاخص های ترکیبی است. با توجه به خواصی که دارد برای تعیین کالری سنجی pH با استفاده از محلول های بافر یا روش Michaelis بدون محلول بافر مناسب است. شکل رنگی در طیف وسیعی از غلظت ها از قانون بیر پیروی می کند.
نشانگرهای اسید انواع مختلفی دارند
این واقعیت که فنل فتالئین کمی بالاتر از 0 تغییر رنگ می دهد معمولاً باعث خطای بسیار کمی در آزمایش می شود. علاوه بر فنل فتالئین، شاخص های دیگر شامل بروموتیمول بلو و متیل اورنج می باشد. برای محلول هایی که فقط با نقطه پایانی خود تفاوت جزئی دارند، بروموتیمول بلو نشانه خوبی است. درست زیر PH 7، محلول دارای رنگ زرد است که کمی بالاتر از pH آبی می شود. هنگامی که نقطه پایان تیتراسیون نسبتا اسیدی است، متیل اورانژ استفاده می شود.
فنل فتالئین همچنین می تواند به عنوان یک معرف در تجزیه و تحلیل کیفی استفاده شود. به گفته ساکس، برخی از هیدروکسیدهای نامحلول فلزات مانند سرب، کادمیوم، روی، منیزیم و غیره هنگام پاشش با فنل فتالئین رنگ می دهند که با جذب نشانگر توضیح داده می شود. گروه دیگری از واکنش ها بر این واقعیت استوار است که در یک محیط قلیایی، فنل فتالئین توسط روی به فنل فتالئین بی رنگ کاهش می یابد. این ترکیب لوکو توسط مواد خاصی اکسید می شود و سپس رنگ قرمز فنل فتالئین دوباره ظاهر می شود. اثر مشابهی با مقادیر بسیار کم یون سیانید (0.01-0.05 میلی گرم در لیتر) در حضور آثار سولفات مس مشاهده می شود. در مقادیر بسیار کم مس (10-4 - 10-5%)، ورود پراکسید هیدروژن به سیستم منجر به افزایش سرعت فرآیند اکسیداسیون ترکیب لوکو می شود.
یکی از مشتقات فنل فتالئین - فنل فتالئین فسفات - در تعیین فعالیت آنزیم فسفاتاز استفاده می شود. فنل فتالئین فسفات خود خواص یک شاخص را ندارد، اما با عمل آنزیم از بین می رود. گروه های فسفات تحت تاثیر بستر جدا می شوند و رنگ قرمز فنل فتالئین ظاهر می شود.
در پزشکی از فنل فتالئین به عنوان ملین استفاده می شود و دارو را پرگن می نامند.
1.3 خواص شیمیایی
فاصله انتقال رنگ فنل فتالئین از PH 8.2 (بی رنگ) تا PH 9.8 (سرخابی) متغیر است. برای تعیین فاصله انتقال، یک سری محلول بافر با مقادیر pH زیر استفاده می شود: 7.8-8.0-8.2-8.4-9.0-9.6-9.8-10.0-10.2. مقدار pH که در آن اولین رنگ صورتی ظاهر می شود به غلظت نشانگر بستگی دارد. شدت رنگ بنفش به تدریج تا pH 9.8 افزایش می یابد: pH 1/2 9.53.
فرآیند تشکیل یک دیانیون رنگی از ساختار کینوئید (III) که در نتیجه برهمکنش فنل فتالئین با محلول قلیایی رقیق (pH 8.5) ایجاد میشود، میتواند به صورت زیر نمایش داده شود:
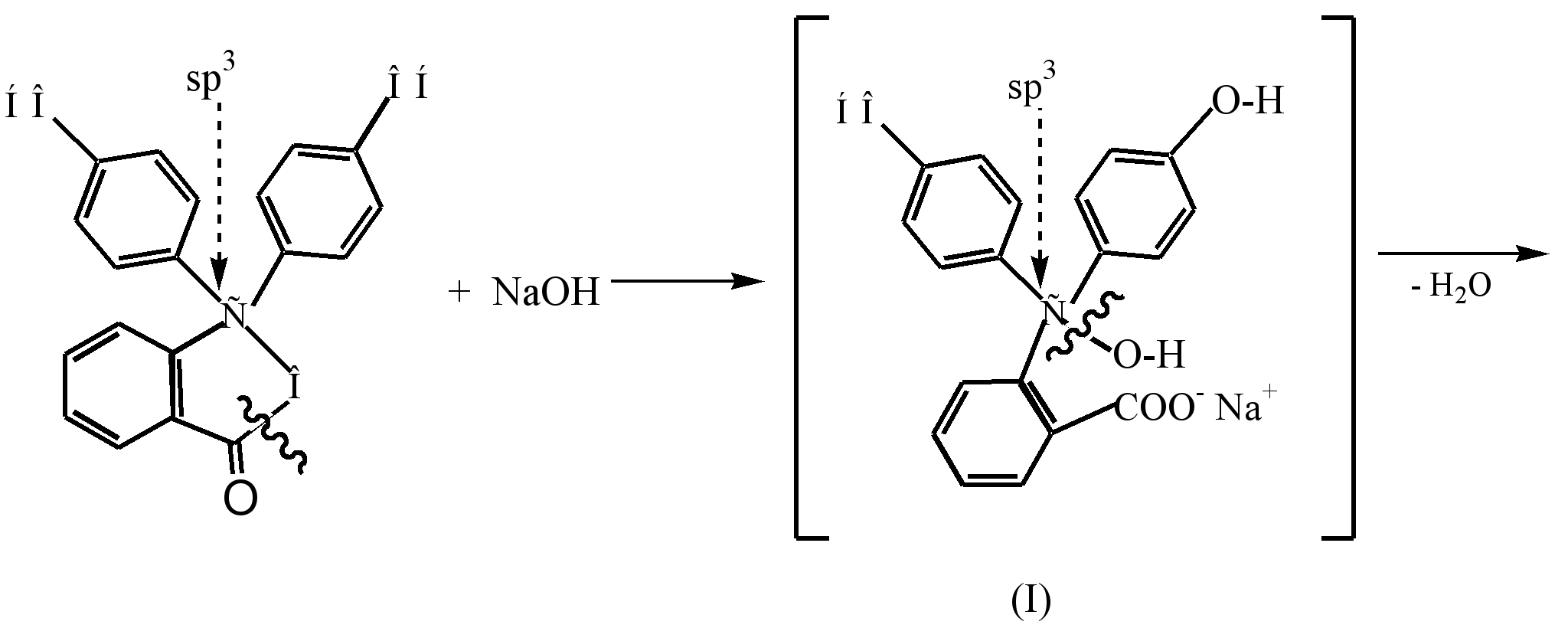

تحت تأثیر قلیایی در فنل فتالئین بی رنگ، حلقه بتا لاکتون باز می شود (هیدرولیز) و الکل بی رنگ حاصل (I) به طور خود به خود از یک مولکول آب جدا می شود و نمک مونوسدیم (II) را تشکیل می دهد. رنگ زرد. برهمکنش بیشتر با قلیایی منجر به تشکیل نمک دی سدیم (III) و عمیق شدن رنگ به تمشک می شود که به دلیل طویل شدن زنجیره مزدوج است.
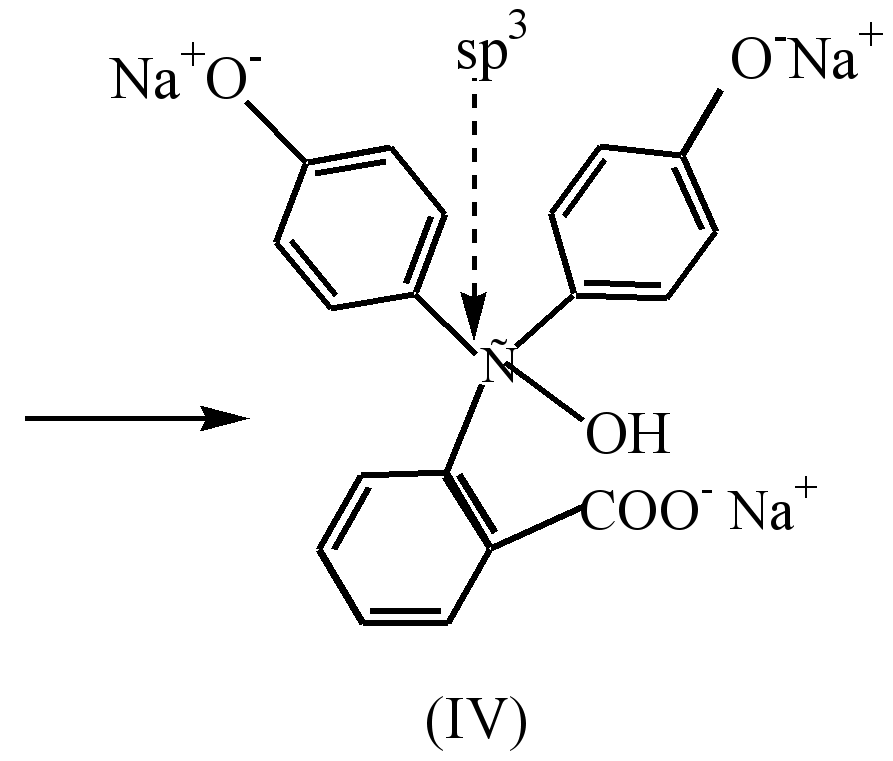
در یک محیط قوی قلیایی (рН10) تغییر رنگ محلول در نتیجه انتقال نمک دی سدیم (III) به نمک تری سدیم (IV)، که در آن حلقهها مزدوج نشدهاند، مشاهده میشود.
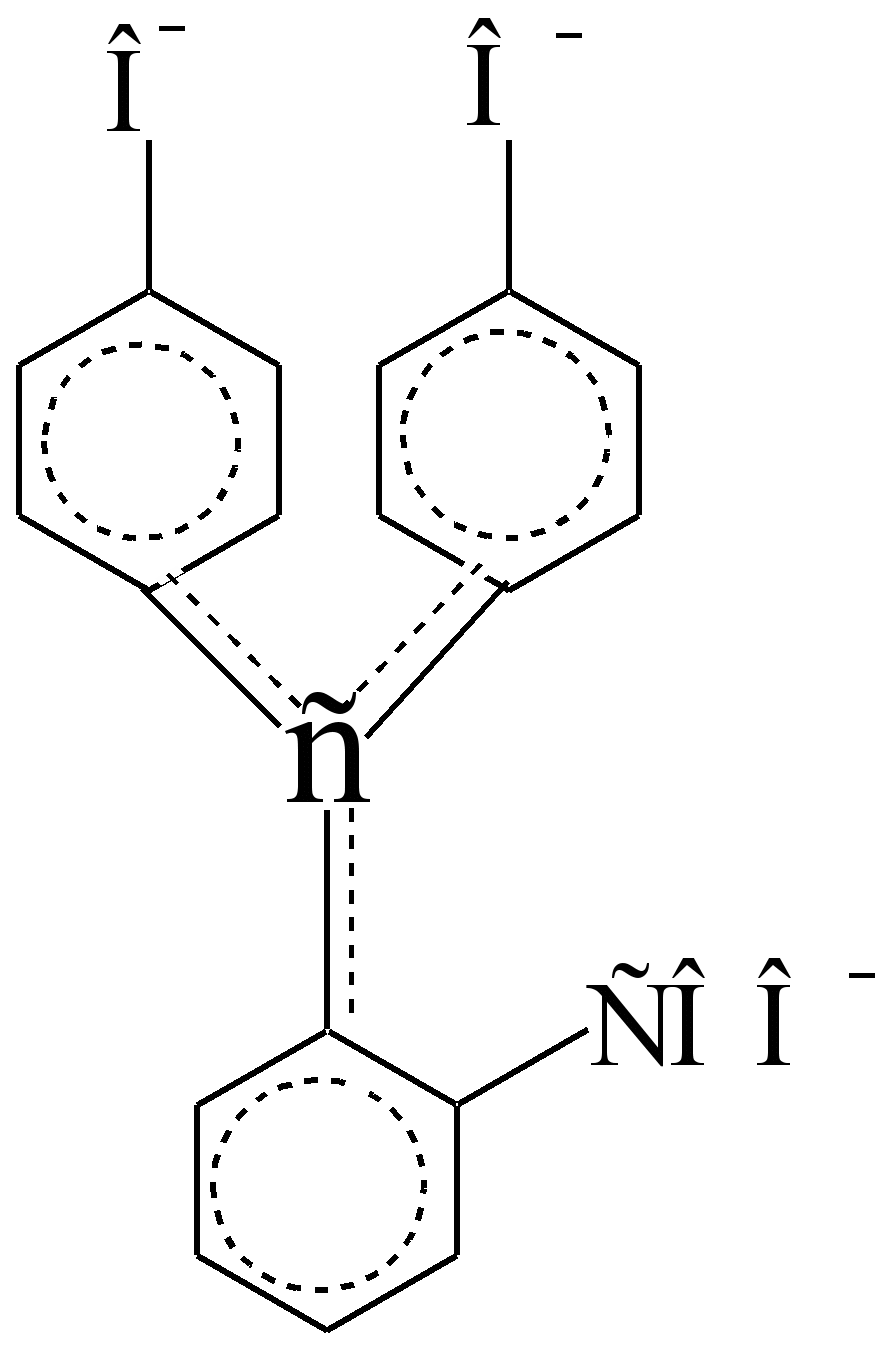
در یک محیط اسیدی، بی رنگ است، زیرا کروموفورهای بنزن ضعیف ایزوله، مستقل و در ?,? - تعامل (جفت شدن) با یکدیگر وارد نمی شود:
آیا آنها توسط C sp 3 - یک اتم کربن، که یک عایق است، نه یک رسانا، از هم جدا می شوند؟ – الکترون ها در یک محیط قلیایی، چرخه لاکتون شکسته می شود، یکی از هیدروکسیل های فنلی یونیزه می شود و اتم C sp 3 - پیکربندی C sp 2 را به دست می آورد و تبدیل به یک رسانا می شود؟ - الکترونهای بین کروموفورهای بنزن، علاوه بر این، اکسوکرومهای قطبی هنوز - COO - و -O -. در اسید سولفوریک غلیظ، نشانگر می چرخد رنگ نارنجی. شدت رنگ محلولهای قلیایی بنفش در حالت ایستاده کاهش مییابد، تا حدی به دلیل تشکیل یک پایه کربوکسیل بیرنگ (این یک تبدیل برگشتپذیر است)، تا حدی به دلیل اکسیداسیون برگشتناپذیر توسط هوا.
کروموفور فنل فتالئین
(شکل قلیایی، 1 = 553 نانومتر، 1 = 9000)
1.4 به دست آوردن فنل فتالئین
روش اصلی برای به دست آوردن فنل فتالئین، تراکم فنل با انیدرید فتالیک است. این واکنش یک مورد خاص از آسیلاسیون فریدل کرافت است. واکنش زمانی ادامه می یابد که با یک کاتالیزور اسیدی (اسید سولفوریک غلیظ یا کلرید روی) حرارت داده شود:
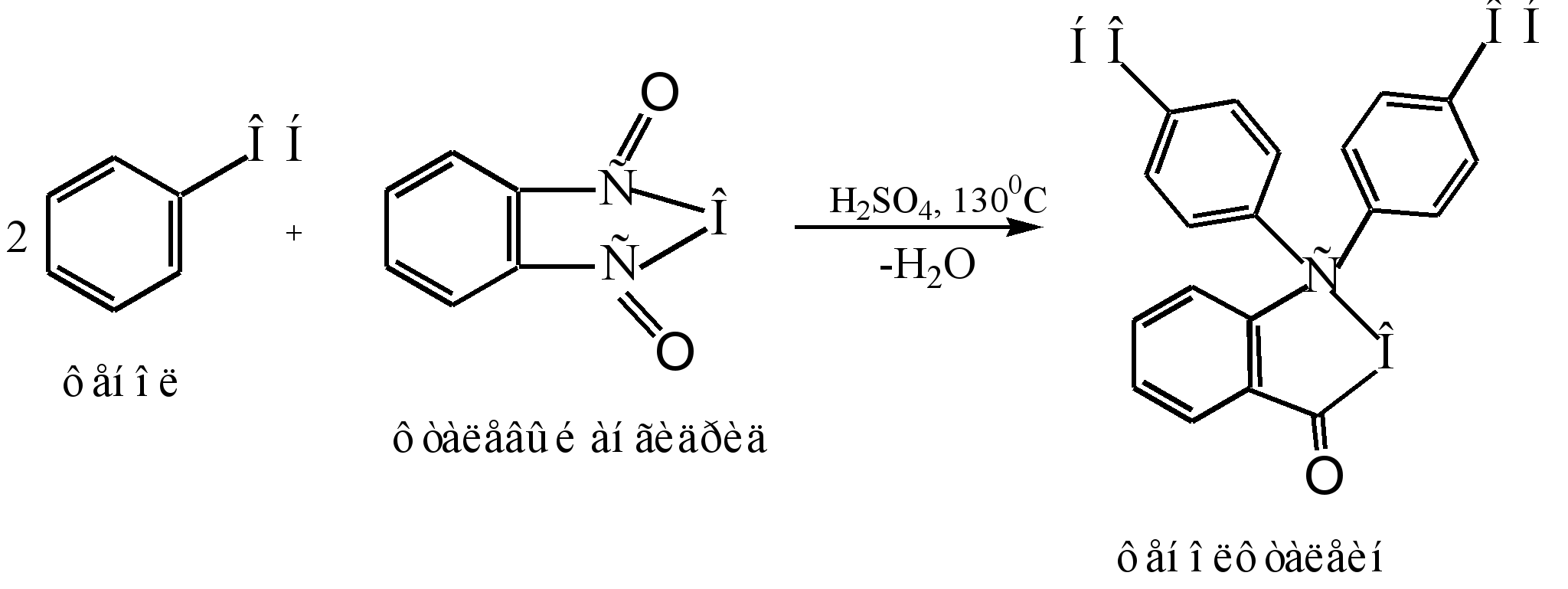
مکانیسم واکنش را می توان به صورت زیر نشان داد:

سیگما - مجتمع
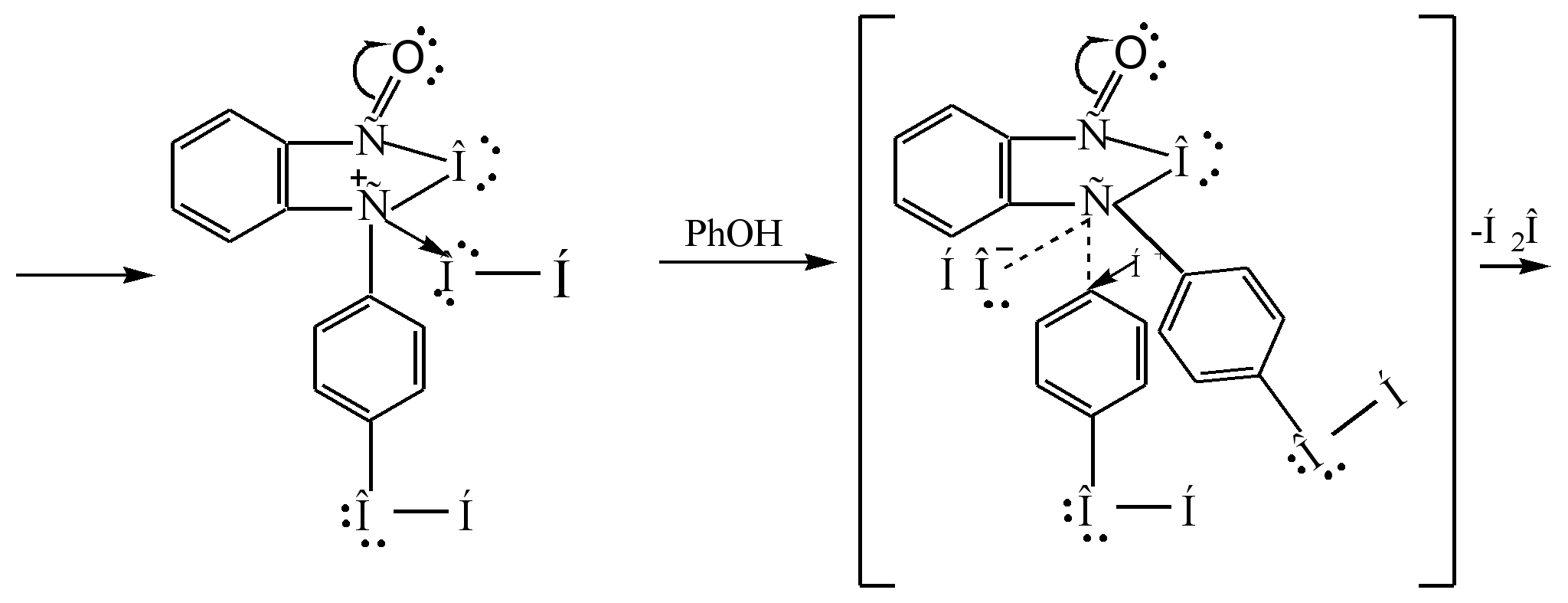
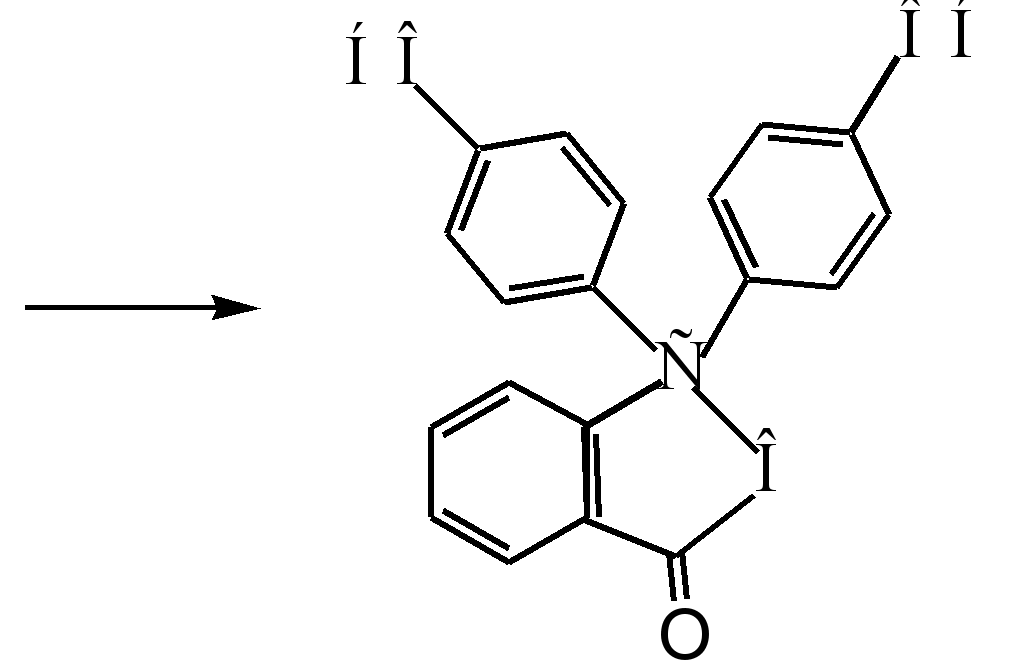
فنل فتالئین
1.4.1 روشهای بدست آوردن فنل فتالئین
پس از تجزیه و تحلیل ادبیات در مورد این موضوع، مشخص شد که در تمام کتابچه های روش شناسی، روش یکسانی برای به دست آوردن فنل فتالئین ارائه شده است. این بر اساس واکنش ارائه شده در بالا است. این تکنیک کاملاً با شرایط آزمایشگاهی ما سازگار است.
برای سنتز، به معرف ها، ظروف و تجهیزات زیر نیاز دارید:
انیدرید فتالیک - 5 گرم؛ فنل - 10 گرم؛ اسید سولفوریک - 2 میلی لیتر؛ هیدروکسید سدیم - 4-5٪؛ اسید استیک (غلیظ)؛ اسید هیدروکلریک (غلیظ)؛ اتیل الکل (مطلق).
فلاسک ته گرد (50 میلی لیتر) - 1 عدد؛ شیشه (100 میلی لیتر) - 1 عدد؛ فنجان چینی - 1 عدد؛ فلاسک های مخروطی (250 میلی لیتر) - 2 عدد؛ دماسنج؛ دستگاه تقطیر بخار؛ حمام شن و ماسه
سنتز پیشرفت:
مخلوطی از 5 گرم انیدرید فتالیک، 10 گرم فنل و 2 میلی لیتر اسید سولفوریک در یک فلاسک قرار داده می شود و به مدت 1.5 ساعت روی یک حمام ماسه گرم می شود و دمای 125 - 130 درجه سانتیگراد را کاملاً رعایت می کند (دما سنج در مذاب و به صورت دوره ای محتویات را هم بزنید). مخلوط داغ در یک فلاسک با 100 میلی لیتر آب جوش ریخته می شود، فنل واکنش نداده با بخار تقطیر می شود. برای جلوگیری از پاشیده شدن و از دست دادن مواد، مایع باید همیشه هم زده شود. پایان تقطیر را می توان با تغییر در کدورت تقطیر مشاهده کرد: اگر تقطیر کدر شد، باید تقطیر را ادامه داد، اگر تقطیر شفاف بود، می توان تقطیر را متوقف کرد. محلول اجازه داده می شود تا خنک شود، پس از آن روی قیف بوخنر ریخته می شود و تا آنجا که ممکن است سعی می شود رسوب به فیلتر منتقل نشود. سپس محصول در دو قسمت کوچک با تخلیه شسته می شود. آب سرد، آنچه هنوز روی فیلتر است را به قسمت عمده جامد در یک لیوان اضافه کنید، در آن حل کنید مقدار کمیهیدروکسید سدیم 4-5% گرم شده و انیدرید فتالیک واکنش نداده با فیلتراسیون جدا می شود. اسید استیک به فیلتر قرمز تیره اضافه می شود تا فنل فتالئین به طور کامل رسوب کند، سپس 1-2 قطره اسید کلریدریک اضافه می شود و به مدت 1 ساعت می ماند.
فنل فتالئین آزاد شده به شکل ماسه مایل به زرد روی قیف بوشنر مکیده می شود. محصول خام به یک لیوان منتقل شده و با حرارت دادن در حدود 10 میلی لیتر الکل حل می شود. محلول داغ مکیده شده و کیک فیلتر با الکل داغ شسته می شود. از طریق یک فیلتر مرطوب شده با الکل از قطرات جدا شده روغن فیلتر می شود. فیلتر به یک ظرف چینی منتقل می شود و در یک حمام ماسه داغ گرم می شود تا مقدار زیادی الکل از بین برود. مخلوط در فنجان به مدت 30 دقیقه بماند. کریستال های بی رنگ یا زرد روشن جدا شده مکیده شده و در هوا بین صفحات کاغذ صافی خشک می شوند.
1.4.2 خواص فیزیکی مواد مورد استفاده در سنتز
میز 1
خواص فیزیکی مواد مورد استفاده در سنتز
| نام | فرمول | ظاهر | T pl، 0 C | بیل تی، 0 С | انحلال پذیری |
|
| در آب | در متفاوت |
|||||
| فنل فتالئین | C 20 H 14 O 4 | سوزن های لوزی شکل بی رنگ یا شنی، بی بو، هوا پایدار نیست | 261 | هوا nyatsya | کم محلول (0.0002 گرم در 100 گرم آب) | خوب در اتانول، به مقدار کم در دی اتیل اتر، همچنین محلول در محلول های قلیایی. |
| فنل | C 6 H 5 OH | سوزن های لوزی بی رنگ یا صورتی | 41-43 | 182 | در سرما - متوسط داغ - خوب | دارای اتانول، اتر، کلروفرم، گلیسیرین، دی سولفید کربن است |
| انیدرید فتالیک | C 8 H 4 O 3 | سوزن های لوزی سفید | 130,8 | Vozg 284.3 | بد | در اتانول، در اتر، کلروفرم |
| اسید سولفوریک | H2SO4 | مایع بی رنگ و چسبناک با بوی نامطبوع | 10,37 | 330 | | واکنش نشان می دهد |
| هیدروکسید سدیم | NaOH | کریستال های لطیف سفید، لوزی شکل | 320 | 1378 | با حرارت قابل حل است | در الکل، گلیسیرین، فنل، اتر، استون |
| استیک اسید | CH 3 COOH | مایع بی رنگ با بوی تند | 16,6 | 118,1 | | در اتانول، اتر |
| اسید هیدروکلریک | HCI | مایع مایل به زرد، بخار در هوا، با بوی نامطبوع | -15,35 | - | خوب | در الکل |
1.4.3 روش تقطیر با بخار
از آنجایی که در طول سنتز لازم است که فنل واکنش نداده را با استفاده از تقطیر با بخار تقطیر کنیم، لازم است روش اجرای آن را در نظر بگیریم.
تقطیر در دستگاهی متشکل از یک مولد بخار با یک لوله ایمنی، یک فلاسک تقطیر Claisen (250 میلی لیتر)، یک دماسنج، یک کندانسور مستقیم Liebig، یک آلونژ و یک گیرنده انجام می شود. مولد بخار و فلاسک تقطیر که از طریق یک سه راهی به یکی از شاخه های آن متصل می شوند که یک لوله لاستیکی با یک گیره هافمن روی آن قرار داده شده است، در یک حمام ماسه گرم می شوند.
پیشرفت تقطیر (تقطیر): مذاب داغ در یک فلاسک تقطیر با 100 میلی لیتر آب جوش قرار می گیرد. با حرارت دادن مولد بخار و فلاسک تقطیر، یک تقطیر حاوی فنل واکنش نداده جمع آوری می شود. وجود آن با کدورت تقطیر مشهود است. تقطیر در پایان رواناب تقطیر کدر متوقف می شود، یعنی تا زمانی که یک تقطیر شفاف ظاهر شود. 
عکس. 1دستگاه تقطیر بخار
1- لوله ایمنی; 2 - لوله تامین بخار; 3 - سه راهی؛ 4 - گیره؛ 5 - مولد بخار; 6 - فلاسک کلایزن; 7 - دماسنج; 8 – یخچال لیبیگ; 9 - النگه; 10 - گیرنده؛ 11 - مانتو گرمکن; 12 - کاشی.
1.4.4 روش تبلور مجدد از الکل داغ
به طور تجربی، تبلور مجدد به شرح زیر انجام می شود: ماده را در یک فلاسک ته گرد قرار داده و کمی حلال به آن اضافه می شود. مخلوط تحت رفلاکس در یک حمام آب گرم گرم می شود.
بیشتر مایعات تمایل به گرم شدن بیش از حد دارند و بنابراین با ضربه های قوی می جوشند. برای جلوگیری از این امر، قبل از شروع گرمایش، آب جوش وارد فلاسک می شود.از طریق یک کندانسور رفلاکس، حلال به تدریج در قسمت های کوچک اضافه می شود تا زمانی که ماده کاملاً حل شود.
پس از حل شدن کامل ماده، حرارت دادن متوقف می شود و مخلوط با آب در حمام خنک می شود. ماده ته نشین شده فیلتر می شود.
در بیشتر موارد، تبلور مجدد دو مرحله ای است به روشی قابل اعتمادتصفیه مواد 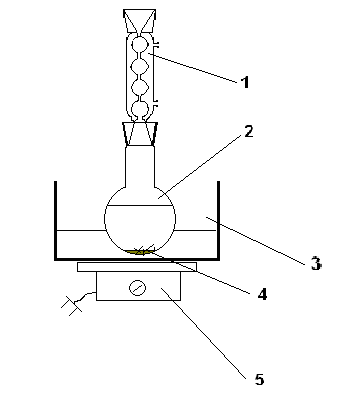
شکل 2تبلور مجدد
1- یخچال معکوس; 2 - فلاسک ته گرد؛ 3- حمام آب; 4 - آب جوش؛ 5 - کاشی.
1.5 ایمنی سنتز
1.5.1 خطرات اصلی هنگام کار با اسیدهای غلیظ
1. اسیدهای معدنی قوی در صورت تماس با پوست باعث سوختگی شیمیایی می شوند.برای سوختگی های شیمیایی ناشی از تماس پوستی اسیدهای غلیظمحل سوخته را با جریان قوی آب و سپس با محلول 1 درصد بی کربنات سدیم (که در جعبه کمک های اولیه موجود است) بشویید. اگر اسید وارد چشم شد، باید بلافاصله با محلول بی کربنات سدیم 1 درصد و آب مقطر در دمای اتاق شسته شود. از پزشک کمک بگیرید.
2. با توجه به این که اسید کلریدریک غلیظ با کلرید هیدروژن تبخیر می شود، لازم است با آن تحت یک پیش نویس خوب کار کنید و یک پرده پیش نویس پایین آورده شود. در صورت مسمومیت با بخارات هیدروژن کلرید فوراً به هوای تازه بروید.
3. اسید ریخته شده باید با ماسه پوشانده شود و با کربنات سدیم جامد خنثی شود تا تکامل گاز متوقف شود. شن و ماسه را پس از خنثی شدن کامل با حجم زیادی از آب لوله کشی بشویید، کامل بودن شستشو را بررسی کنید (آزمایش کلر را انجام دهید - با استفاده از AgNO 3) و پس از خشک شدن در کوره، در جعبه حاوی ماسه برگردانید.
1.5.2 خطرات اصلی در تقطیر با بخار آب
خطرات اصلی در هنگام تقطیر مربوط به استفاده از وسایل گرمایش الکتریکی (اجاق های برقی، بخاری های گوشته) است.1. سیم (از کاشی با سیم در سیم پیچ پارچه ای استفاده نکنید)، دوشاخه و بدنه اجاق گاز نباید آسیب قابل مشاهده ای داشته باشد.
2. بررسی دمای سطح تابش گرما با دست غیرقابل قبول است.
3. اجاق گاز برقی را با قرار دادن و خارج کردن دوشاخه و گرفتن پریز با یک دست و دوشاخه با دست دیگر از شبکه روشن و خاموش کنید. برای تنظیم حرارت از کلید استفاده کنید.
4. در صورت سوختگی حرارتی لازم است محل سوختگی را با محلول 5/0 درصد پرمنگنات پتاسیم لوسیون های طولانی مدت از محل سوخته تهیه کرد سپس با باند استریل پوشانده و با پزشک مشورت کرد. برای سوختگی های 3 و 4 درجه بلافاصله باند استریل بزنید و با پزشک مشورت کنید.
1.5.3 خطرات اصلی در هنگام تبلور مجدد از الکل داغ
1. حجم کل الکل اضافه شده نباید بیش از 200 میلی لیتر باشد و نباید بیش از 1/3 حجم فلاسک را اشغال کند.2. اندازه حمام آب باید باشد بیش از اندازهسطح کاشی تابش گرما
1.5.4 ویژگی های کار با مواد مورد استفاده در سنتز
اکثریت مواد شیمیاییتا حدی سمی اقدامات احتیاطی هنگام کار با آنها با هدف جلوگیری از موارد نفوذ این مواد به بدن از طریق دهان، ریه ها و پوست است.در طول سنتز، از مواد بالقوه خطرناک استفاده خواهد شد: فنل، اسید سولفوریک، اسید استیک و اسید هیدروکلریک.
فنل یک ماده بی رنگ (صورتی) کریستالی با بوی مشخص است. MPC در هوای محل کار 0.3 mg/m 3 است. کلاس خطر II. تمام کار با فنل در یک هود بخار انجام می شود. اثر سمی: سم عصبی، دارای اثر تحریک کننده و سوزاننده موضعی قوی است، باعث مسمومیت شدید عمومی می شود. عواقب مرگبار احتمالی وضعیت با این واقعیت پیچیده است که این ماده باعث بی حسی موضعی می شود. کمک های اولیه: در صورت تماس با لباس فوراً آن را تعویض کنید، در صورت تماس با پوست آن را بشویید روغن سبزیجاتیا محلولی با کسر جرمی اتانول 10-40٪.
اسید کلریدریک به کلاس خطر دوم تعلق دارد (حداکثر غلظت در هوای محل کار 5 میلی گرم بر متر مکعب بر حسب HCl است)، کلیه کارها با اسید کلریدریک غلیظ نیز باید در هود بخار انجام شود. که بخار هیدروژن کلرید ساطع می کند. در صورت مسمومیت با بخارات هیدروژن کلرید، انتقال به هوای تازه ضروری است، سایر خطرات در بالا ذکر شده است.
اسید سولفوریک ( \u003d 1.84 g / cm 3) - MAC pz \u003d 1 mg / m 3. کلاس خطر II. پس از حدود 5 ثانیه، کم آبی شدید بافت ها شروع می شود، جایی که قطره سقوط کرده است. کمک های اولیه: شستن پوست آب جاریبه دنبال خنثی سازی
اسید استیک - MPC pz = 5 mg / m 3. کلاس خطر 37. بخارات دستگاه تنفس فوقانی را تحریک می کند، محلول هایی با کسر جرمی بیش از 30٪ روی پوست، بیش از 2٪ روی چشم ها تأثیر می گذارد. کمک های اولیه: (رجوع کنید به اسید سولفوریک و اسید کلریدریک).
1.6 خصوصیات حلال ها
گذردهی دی الکتریک جایگاه ویژه ای در ویژگی های حلال ها دارد. مزیت دومی نسبت به سایر معیارها به دلیل سادگی مدلهای حلالپذیری الکترواستاتیک است و بنابراین گذردهی به معیاری مفید برای قطبیت حلال تبدیل شده است. در این رابطه، مهم است که به وضوح بدانیم دقیقاً چه چیزی گذردهی ماکروسکوپی حلال را که گذردهی نسبی نیز نامیده می شود منعکس می کند:
r = 0 /
0 - گذردهی خلاء.
گذردهی با قرار دادن یک حلال بین دو صفحه خازن باردار تعیین می شود. در حضور یک حلال، کشش میدان الکتریکیبین صفحات E در مقایسه با کشش E 0 اندازه گیری شده در خلاء کاهش می یابد و نسبت E 0 / گذردهی حلال است. اگر مولکول های حلال گشتاور دوقطبی دائمی خود را نداشته باشند، تحت تأثیر یک میدان خارجی، بارهای درون مولکولی از هم جدا می شوند و یک دوقطبی را القا می کنند.
AT میدان الکتریکیمولکول های دارای دوقطبی دائمی یا القایی به روش خاصی جهت گیری می کنند. این پدیده قطبی شدن نامیده می شود. هر چه درجه پلاریزاسیون بیشتر باشد، افت قدرت میدان الکتریکی قوی تر است. بنابراین، گذردهی مستقیماً با توانایی حلال در جداسازی بارها و جهت دهی دوقطبی های خود مرتبط است.
1.6.1 طبقه بندی حلال ها بر اساس خواص فیزیکی.
ثابت دی الکتریک (DP) محلول e یکی از مهمترین عوامل در بین آنهایی است که بیشترین مقدار را دارند نفوذ قویدر مورد ویژگی های فرآیندی که در محلول رخ می دهد.
مقادیر DP حلال های منفرد در محدوده بسیار گسترده ای متفاوت است - از 1.8 (آلکان) تا 170-180 (N-آلکیل آمیدهای اسیدهای کربوکسیلیک آلیفاتیک). اصطلاحات زیربنایی درجه بندی حلال ها بر اساس DP کاملاً تعریف شده و سازگار نیست. حلال هایی با DP بالا قطبی نامیده می شوند و حتی بالا قطبی، اگرچه، به بیان دقیق، اصطلاح "قطبی" به گشتاور دوقطبی µ مولکول حلال اشاره دارد، یعنی ویژگیهای ماکرو بلکه ویژگیهای خرد حلال را مشخص نمیکند.
با این حال، همانطور که از نظریه مربوط به به μ بر می آید، در حالت کلی، یک تغییر نمادین در این کمیت ها وجود دارد. علاوه بر این، برای مشخص کردن حلال ها با وجود یا عدم وجود یک گشتاور دوقطبی در مولکول های آنها، اصطلاح "دوقطبی" (μ0) است. و حلال های "آپولار" (µ = 0).
حلال های کم قطب شامل حلال هایی هستند که DP آنها در محدوده = l.8h12 است، حلال های قطبی متوسط با = 12h50، حلال های با قطبیت بالا با > 50. نسبیت این تقسیم نه تنها و حتی نه چندان در این فواصل نسبتاً دلخواه انتخاب شده، اما همچنین در شرایطی بسیار ضروری تر.
علیرغم ارتباط بین DP و گشتاور دوقطبی یک مایع منفرد، که کاملاً توسط تئوری مشخص شده است، باید نسبت به موازی بودن کاملاً واضح بین مقادیر و μ هشدار داد. . نکته این است که ارتباط ضد موازی (اما نه زنجیره ای) دوقطبی ها منجر به کاهش گشتاور دوقطبی پیوندها نسبت به ممان دوقطبی یک مولکول منفرد و در نتیجه کاهش گذردهی مایع می شود. به همین دلیل است که DP مایعات تشکیل شده توسط مولکول هایی با گشتاور دوقطبی نسبتاً بزرگ می تواند بسیار کم باشد.
ویژگی های ساختاری حلال تأثیر قابل توجهی بر قطبیت حلال دارد. حلال های ساختاریافته، به عنوان یک قاعده، دارای DP بالایی هستند.
گذردهی، همراه با تشکیل پیوندهای شیمیایی هم مولکولی، یکی از مهم ترین عوامل تعیین کننده خواص هر مایع است که به انرژی برهمکنش بین مولکولی بستگی دارد. دومی توسط برهمکنش واکنشی تعیین می شود که انرژی آن به DP ساکن ()، DP بستگی دارد که به طول موج بی نهایت بلند ( ) برون یابی شده و برابر است؟ 1.1 n D و همچنین گشتاور دوقطبی µ و حجم مولی؟:
E R = 
مقادیر انرژی های برهمکنش واکنشی مولکول های دوقطبی تعدادی حلال در جدول 1 آورده شده است.
همانطور که M. I. Shakhparonov تأکید می کند، میدان واکنشی مولکول های قطبی منجر به تشکیل ساختارهای شیمیایی (همبستگان هممولکولی) نمی شود که وجود آنها توسط فعل و انفعالات شیمیایی تعیین می شود. پایداری دومی با افزایش انرژی میدان راکتیو کاهش می یابد.
انرژی میدان واکنشی تعدادی از ویژگیهای فیزیکی حلالها را توضیح میدهد و بنابراین ممکن است طبقهبندی حلالها بر اساس مقدار مفید باشد. - ایا .
بدیهی است که تمام حلال هایی که مولکول های آنها دارای گشتاور دوقطبی نیستند، یک کلاس غیر واکنشی را تشکیل می دهند. مایعات حلال هایی با انرژی میدان راکتیو در بازه - ایا = 0h5 kJmol -1 کلاس کم راکتیو را تشکیل می دهد، در محدوده - Er = 5h15 kJ mol -1 - واکنش متوسط و در نهایت حلال هایی با - E R 25 kJ mol -1 کلاس را تشکیل می دهند. حلال های بسیار واکنش پذیر
به عنوان یک قاعده، مایعات بسیار واکنش پذیر هم غیرالکترولیت ها و هم الکترولیت ها را به خوبی حل می کنند و دومی در مقایسه با سایر کلاس ها (طبق این سیستم طبقه بندی) حلال ها در آنها بهتر تفکیک می شوند. این با این واقعیت توضیح داده می شود که حلال های بسیار واکنش پذیر مقادیر بالایی از DP و ممان دوقطبی را ترکیب می کنند.
جدول 2
انرژی میدان راکتیو برخی از حلالها در 298.15 K.
| حلال | -E R، kJ mol -1 | حلال | -E R، kJ mol -1 |
| آنیلین | 2,9 | متیل اتیل کتون | 3,4 |
| استون | 9,1 | اسید فرمیک | 5,2 |
| استونیتریل | 20,9 | نیتروبنزن | 17,1 |
| بوتیل الکل | 2,9 | نیترومتان | 17,5 |
| اب | 18,6 | پیریدین | 5,7 |
| Hexen-1 | 0,15 | کربنات پروپیلن | 43,8 |
| N، N-دی متیل استامید | 15,8 | پروپیل الکل | 3,6 |
| دی متیل سولفوکسید | 6,4 | تولوئن | 0,05 |
| دی متیل فرمامید | 19,5 | استیک اسید | 3,7 |
| دی اکسان | 0,07 | تتراهیدروفوران | 2,9 |
| 1،2 - دی کلرو اتان | 4,2 | کلروبنزن | 1,8 |
| o - زایلن | 0,12 | اتیل استات | 2,45 |
| n - زایلن | 0,05 | اتیلن گلیکول | 8,9 |
| N-متیل استامید | 24,1 | اتانول | 4,7 |
| متیل فرمت | 4,0 |
بر اساس ویسکوزیته (به طور دقیق تر، با ضریب ویسکوزیته ) مایعات به مایعات کم ویسکوزیته با 10-2 Pa s تقسیم می شوند.
با توجه به رسانایی الکتریکی خاص مایعات به مایعات "رسانا" با تقسیم می شوند. حدود 10 2 - 10 -1 سانتی متر · m -1 و بالاتر. "رسانا متوسط" - با حدود 10 -1 - 10 -4 و با 10 -4 Sm -1 به عنوان "غیر رسانا" نامیده می شود.
همچنین به طبقه بندی حلال ها بر اساس نقطه جوش اشاره شده است که در آن حلال ها به حلال های کم جوش (150 0 C) تقسیم می شوند.
برای طبقه بندی حلال ها بر اساس توانایی آنها در تبخیر، یک مقیاس نسبی بر اساس گرمای تبخیر پیشنهاد شده است. بنابراین، حلال های فرار (فرار نسبی 35) متمایز می شوند. اگر مستقیماً روی گرمای تبخیر تمرکز کنیم، حلال های فرار باید به عنوان حلال هایی طبقه بندی شوند که با گرمای تبخیر استفاده از H مشخص می شود. جدول 3
طبقه بندی حلال ها بر اساس ثابت دی الکتریک
| بسیار قطبی |
|||
| حلال |  r r | حلال | r |
| اب | 78,30 | DMF | 36,71 |
| اتیلن گلیکول | 37,7 | بنزونیتریل | 26,20 |
| متانول | 32,66 | نیتروبنزن | 34,78 |
| DMSO | 46,45 | گلیسرول | 51,7 |
| قطب پایین |
|||
| THF | 7,58 | انیدرید استیک | 20,7 |
| دی اتیل اتر | 4,20 | بوتانون - 2 | 18,51 |
| استون | 20,70 | پنتانون - 2 | 15,38 |
| اتانول | 24,55 | پیریدین | 12,91 |
| استیک اسید | 6,17 | متیل استات | 6,68 |
| پروپانول - 1 | 20,45 | سیکلوهگزانون | 16,10 |
| بوتانول - 1 | 17,51 | کوینالین | 8,95 |
| ایزوآمیل الکل | 15,19 | کلروفرم | 4,81 |
| آنیلین | 6,71 | آمیل الکل | 13,9 |
| غیر قطبی |
|||
| 1،4 - دی اکسان | 2,21 | سیکلوهگزان | 2,02 |
| تری کلرواتیلن | 3,42 | H - پنتان | 1,84 |
| بنزن | 2,27 | دی سولفید کربن | 2,64 |
| تولوئن | 2,38 | دی اتیل آمین | 3,78 |
| تتراکلرید کربن | 2,23 | دی اتیل کربنات | 2,82 |
| تری اتیلامین | 2,42 | ||
| n-هپتان | 1,92 | ||
| n-هگزان | 1,88 | ||
1.6.2 سیستم های طبقه بندی حلال ها بر اساس خواص شیمیایی آنها
اکثر سیستمهای طبقهبندی حلالها بر اساس ویژگیهای شیمیایی، به طور صریح یا ضمنی، ویژگیهای اسید-باز آنها را در نظر میگیرند. بنابراین، بیشترین سیستم عمومیطبقه بندی حلال ها امکان تقسیم آنها را به دو دسته بزرگ - اهدا کننده فراهم می کند
(اساسی) و پذیرنده (اسید) که مشخصاً تعریف آنها جداسازی دسته دیگری از حلالهای بی تفاوت را از پیش تعیین می کند. مشروط بودن اختصاص دادن هر حلال خاص به هر یک از این طبقات، اگر فقط به این دلیل باشد که توانایی یک مولکول حلال برای اهدا یا پذیرش یک جفت الکترون از یک شریک به خواص حلال و ترکیب محلول بستگی دارد. به همین دلیل است که این طبقهبندی رفتار مشخصه حلال را در واکنشها یا فرآیندهای حلپذیری ارائه میکند.
ویژگی مشترک حلال های دهنده حلالیت غالب کاتیون ها به عنوان ذرات است که با کمبود الکترون مشخص می شود. به طور مشابه، حلال های پذیرنده ترجیحاً آنیون ها را به عنوان گونه هایی با الکترون اضافی حل می کنند.
تنوع حلال های دهنده توسط تعداد نسبتاً زیاد عناصری که اتم های آنها می توانند به عنوان دهنده جفت الکترون عمل کنند و تنوع ترکیبات شیمیایی این عناصر تعیین می شود. بنابراین نمایندگان این دسته از حلال ها به N-بازها (آمین ها یا آمیدهای انواع مختلف)، 0-باز (اترها و استرها، الکل ها، کتون ها، کمتر آلدئیدها)، پایه های S (تیواترها، تیوالکل ها، سولفوکسیدها) تقسیم می شوند. بازهای P (تری آلکیل، تری آریل یا آلکیلاریل فسفین) و موارد مشابه.
حلال های گیرنده به پروتیک تقسیم می شوند و آپروتیک.
حلالهایی که بسته به عملکردی که از خود نشان میدهند، قادر به مشارکت در تعادل اولیه هستند، اغلب پروتوفیل (اساسی) و پیشساز نیز نامیده میشوند. (اسید). حلال هایی که به طور مساوی هر دو عملکرد را نشان می دهند (الکل ها، کتون ها) آمفی پروتیک نامیده می شوند.
مولکول های بسیاری از حلال ها از طریق تشکیل پیوند هیدروژنی (H-) در حلالیت شرکت می کنند. مطابق با این، طبقهبندی حلالها بر اساس توانایی آنها در تشکیل پیوند H پیشنهاد شده است.
اولین کلاس در این سیستم طبقه بندی از مایعاتی تشکیل شده است که در آنها یک شبکه سه بعدی از پیوندهای H وجود دارد. حلال های این کلاس (آب، اسید فرمیک، اسید سولفوریک، گلیکول ها) با DP بسیار بالا و ویسکوزیته نسبتا بالا و انرژی فعال سازی جریان ویسکوز مشخص می شوند. به عنوان یک قاعده، حلال های این کلاس به خوبی در یکدیگر حل می شوند و از طریق پیوند H پیوندهای هترومولکولی تشکیل می دهند.
دسته دوم مایعات با شبکه دو بعدی از پیوندهای H هستند. به عنوان یک قاعده، مولکول های حلال این کلاس حاوی یک گروه هیدروکسیل (الکل های مونو هیدریک، اسیدهای کربوکسیلیک مونوبازیک، فونول ها و غیره) هستند. تمایل به تشکیل پیوندهای هترومولکولی در این گروه از حلال ها به طور کلی کمتر از نمایندگان کلاس اول است.
دسته سوم شامل مایعاتی است که مولکول های آنها حاوی اتم های نیتروژن، اکسیژن، گوگرد، فلوئور و غیره است که قادر به ایجاد پیوند H با دهنده های پروتون هستند. این دسته شامل اترها، آمین ها، کتون ها، آلدئیدها و غیره است.
طبقه چهارم شامل مایعاتی است که مولکول های آنها می توانند دهنده پروتون باشند. اینها شامل کلروفرم، دی کلرو اتان و موارد مشابه است.
طبقه پنجم شامل مایعاتی است که مولکول های آنها در شرایط عادی قادر به شرکت در تشکیل پیوند H نیستند. این گروه شامل آلکان ها، تتراکلرید کربن، پرهالوآلکان ها و ... می باشد.
پارکر پیشنهاد کرد که حلال ها را بر اساس توانایی آنها در حلال کردن یون ها طبقه بندی کند. در این طبقه بندی، حلال ها به گروه هایی تقسیم می شوند.
آپروتیک آپولار - مایعات با DP پایین (
آپروتیک دوقطبی - مایعاتی با مقادیر نسبتاً بالای DP (> 15) و گشتاورهای دوقطبی (µ > 2D) ,
حاوی هیدروژنی نیست که بتواند پیوند H را تشکیل دهد. نمایندگان این گروه از حلال ها عبارتند از: دی اکسید گوگرد، نیتروبنزن، نیترومتان، استونیتریل، کربنات پروپیلن، DMSO و غیره.
پروتیک - مایعاتی که مولکول های آنها شامل گروه هایی است که اتم هیدروژن به یک اتم الکترونگاتیو متصل است. ترکیبات موجود در این گروه (اسیدهای کربوکسیلیک، الکلها، فنلها و غیره) با توانایی مشخص برای تشکیل پیوند H متمایز میشوند.
قدرت حلالیت حلال ها عموماً از گروه اول به گروه سوم افزایش می یابد.
برونستد پیشنهاد کرد که حلال ها را بر اساس ترکیبی از گذردهی و اولیه بودن طبقه بندی کند. او با توجه به این ویژگی ها، حلال ها را به هشت گروه تقسیم کرد.
نمونههایی از حلالهای گروههای مختلف در طبقهبندی برنستد عبارتند از: I - آب؛ II - اسید سولفوریک، اسید فرمیک؛ III - هیدرازین، DMSO؛ IV - پروپیلن کربنات، نیتروبنزن، استونیتریل، نیترومتان، V - بوتانول، VI - برمو مایع و ید هیدروژن؛ VII - تری اتیلامین، پیریدین؛ VIII - هگزان، کلروبنزن.
طبقه بندی برونستد امکان پیش بینی خواص اسید-باز ترکیبات محلول در حلال های هر گروه را فراهم می کند. بنابراین، در حلال گروه II، قدرت پایه ها به طور قابل توجهی بیشتر از حلال گروه III است. قدرت اسیدها در حلال های گروه III به طور کلی بیشتر از حلال های گروه VII و غیره است.
جدول 4
طبقه بندی حلال ها برونستد
| ویژگی | نوع حلال |
|||||||
| من | II | III | IV | V | VI | VII | هشتم |
|
| DP | + | + | + | + | - | - | - | - |
| پروتوژنیسیته | + | + | - | - | + | + | - | - |
| پروتکل | + | - | + | - | + | - | + | - |
* علائم + و - در خط اول مربوط به بالا و پایین DP، در خطوط دیگر - به وجود یا عدم وجود این ویژگی است.
طبقهبندی حلالها نیز بر اساس هشت ویژگی فیزیکی پیشنهاد شده است: تابع کرکوود، شکست مولی، پارامتر حلالیت هیلدبراند، ضریب شکست، نقطه جوش، گشتاور دوقطبی، و همچنین انرژیهای پر شدهترین و کمترین اوربیتالهای مولکولی پر نشده. با توجه به ترکیب این ویژگی ها، پیشنهاد می شود حلال ها را به 9 گروه تقسیم کنند:
1) دوقطبی آپروتیک (به عنوان مثال، استونیتریل، نیترومتان، استون، 1،2-دی کلرواتان).
2) آپروتیک بسیار دوقطبی (DMSO، DMF، DMAA، کربنات پروپیلن، نیتروبنزن).
3) آپروتیک بسیار دوقطبی و بسیار قطبی پذیر (سولفولان، HMFTA).
4) غیر قطبی معطر (بنزن، تولوئن)؛
معطر نسبتا قطبی (کلروبنزن، o-دی کلروبنزن، استوفنون)؛
دهنده الکترون (تری اتیلامین، اترها، دی اکسان)؛
حلال های با پیوند H (الکل ها، اسیدهای کربوکسیلیک)؛
حلال های قوی مرتبط با پیوند H (فرامید،
دی اتیلن گلیکول، آب)؛
حلال هایی با عملکرد نامشخص (دی سولفید کربن، کلروفرم).
1.7 مروری بر روش تعیین انحلال پذیری جامدات
1.7.1 تعیین وزن سنجی حلالیت
این روش شامل تعیین جرم یک ماده محلول در جرم معینی از حلال (حلالیت خاص P ` ) و محاسبه حلالیت به عنوان جرم ماده ای که می تواند در 100 گرم از یک حلال معین حل شود. روش برآورد شده است.روی ترازوهای تکنوشیمیایی، قسمتی از ماده مورد آزمایش را وزن کنید (گرم ۱ ` ). نمونه ای از حلال را وزن کنید (گرم p). وزن فیلتر خشک (g 2) را تعیین کنید. مقدار وزن شده از ماده را در حلال بریزید ، اگر ماده کاملاً حل شده است ، باید آن را اضافه کنید تا انحلال متوقف شود ، وزن کامل ماده ریخته شده در حلال را یادداشت کنید (g 1). ماده حل نشده را از طریق فیلتر فیلتر کنید و وزن فیلتر مرطوب را با باقیمانده ماده (g 3) تعیین کنید. فیلتر را با بقایای ماده تا وزن ثابت (گرم 4) خشک کنید. حلالیت ویژه را با استفاده از فرمول محاسبه کنید:
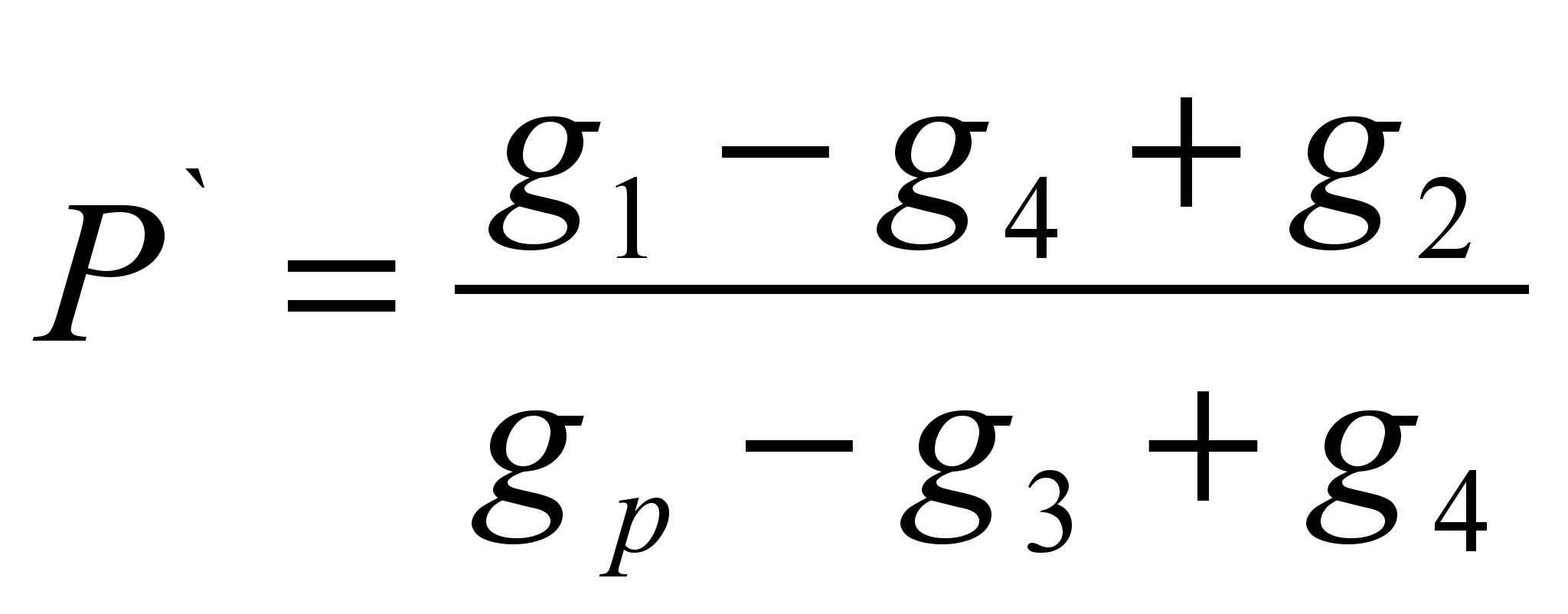
P \u003d P` 100 (گرم / 100 گرم)
جدول 5
حلالیت فنل فتالئین در برخی از حلال ها
| حلال | انحلال پذیری | r |
| به شدت قطبی |
||
| اب | 0,0002 | 78,30 |
| متیل الکل | 19,42 | 52,66 |
| قطبی ضعیف |
||
| اتانول | 17,29 | 24,55 |
| استون | 16,98 | 20,70 |
| کلروفرم | 2,97 | 4,81 |
| غیر قطبی |
||
| زایلن | 0,19 | 2,43 |
| تولوئن | 0,17 | 2,38 |
| بنزن | 0,16 | 2,27 |
1.7.2 روش الکتروشیمیایی.
1. نصب را برای تعیین مقاومت حجم محلول الکترولیت طبق طرح جمع کنید (شکل 3 را ببینید).
2. محلول آبی کلرید پتاسیم با غلظت معین در ظرف اندازه گیری تا علامت ریخته می شود و ظرف دارای الکترود در یک ترموستات در دمای معین نگهداری می شود. پس از 15-20 دقیقه، کشتی در نقاط B و D به نصب متصل می شود.
3. با کمک یک جعبه مقاومت و یک کنتاکت متحرک C، پل متعادل می شود و به کوچکترین صدا در تلفن یا حداقل دامنه سینوسی روی صفحه اسیلوسکوپ می رسد. نقطه جبران ابتدا از یک سر ریاکورد و سپس از سر دیگر نزدیک می شود. اندازه گیری و محاسبه بعدی Rx:
R x = R 1 
3-4 بار در مقاومت های مختلف R 1 تکرار کنید. در این حالت، کنتاکت متحرک نباید به انتهای ریاکورد نزدیک شود. اگر انحراف در اندازه گیری ها کمتر از 0.5٪ باشد، نتایج رضایت بخش در نظر گرفته می شود و با استفاده از فرمول به محاسبه ثابت ظرف ادامه می دهیم:
K=  /
w =
R x
/
w =
R x
جایی که Rx مقاومت محلول است. -
هدایت الکتریکی خاص
4. مقدار کمی نمک را در 100 میلی لیتر آب ریخته و با بسته شدن محکم در فلاسک را به مدت 20 دقیقه به طور مداوم تکان دهید. سوسپانسیون حاصل از طریق یک فیلتر شیشه ای مکیده می شود و از رسوب برای تهیه محلول اشباع استفاده می شود. محلول به دست آمده در ظرفی برای اندازه گیری هدایت الکتریکی ریخته می شود و پس از کنترل دما، مقاومت محلول اندازه گیری می شود.
=
ک /
R x  = /
سی
= /
سی
جایی که C نرمال بودن محلول است، kg equiv / m 3.
از آنجایی که غلظت نمک در محلول اشباع کم است، = . بر اساس معادله:
C = ( آر - که در ) /
جایی که آررسانایی الکتریکی محلول نمک است.
محصول حلالیت برای یک الکترولیت تک ظرفیتی:
![]() = (ج ) 2
= (ج ) 2
6. نتایج را در جدول وارد کنید:
| نمک | t، C0 | سانتی متر بر متر | مقاومت، اهم | ک | | | ج | L |
|||
| R1 | R2 (AC) | R3 (CB) | R X |
||||||||
جدول 6
هدایت ویژه محلول KCI
| t، C0 | 1 N KCI | 0.1 N | 0.02 N | 0.01 N |
| 10 4، اهم -1 cm -1 |
||||
| 0 | 654,1 | 71,5 | 15,21 | 7,76 |
| 10 | 831,9 | 93,3 | 19,94 | 10,20 |
| 14 | 906,3 | 102,5 | 21,93 | 11,21 |
| 16 | 944,1 | 107,2 | 22,94 | 11,73 |
| 18 | 982,2 | 111,9 | 23,97 | 12,25 |
| 20 | 1020,7 | 116,7 | 25,01 | 12,78 |
| 22 | 1055,4 | 121,5 | 26,06 | 13,32 |
| 24 | 1098,4 | 126,4 | 27,12 | 13,86 |
| 25 | 1118,0 | 128,8 | 27,65 | 14,13 |
| 26 | 1137,7 | 131,8 | 28,19 | 14,41 |
| 28 | 136,2 | 29,27 | 14,96 |
|
| 30 | 141,2 | 30,36 | 15,52 |
|
| 32 | 146,2 | 31,46 | 16,09 |
|
| 34 | 151,3 | 32,56 | 16,67 |
|
| 36 | 156,4 | 33,68 | ||
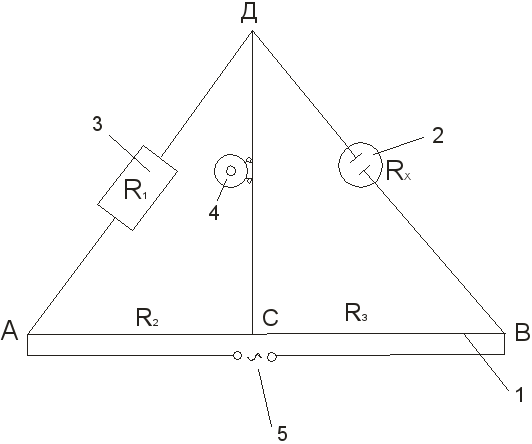
شکل 3طرح نصب برای تعیین هدایت الکتریکی:
1 - سیم کشیده شده روی خط کش; 2 - ظرف اندازه گیری با الکترود. 3 - رئوستات؛ 4 - تلفن کم مقاومت; 5 - منبع فعلی.
1.7.3
روش فوتوالکتروکالومتری
این روش بر اساس قانون افزایشی چگالی نوری، مشروط به قانون اساسی جذب نور است.
پیش رفتن
1. انتخاب فیلترهای نور بهینه.
1.1. در یک فلاسک حجمی 25 میلی لیتری قرار دهید:
محلول ها را مخلوط کرده و چگالی نوری را نسبت به حلال انتخابی با فیلترهای نوری مختلف در مناسب ترین کووت ها برای این کار اندازه گیری کنید. اندازه کووت را مشخص کنید. روش کار بر روی FEC را در گذرنامه ابزار ببینید.
1.2. داده های به دست آمده را در جدول وارد کنید:
1.3. روی کاغذ گراف، منحنی های جذب نور A \u003d f (، nm) را رسم کنید و تعیین کنید که کدام فیلترها با کدام طول موج بهترین استفاده را در هنگام کار می کنند.
2. نقشه کشیدن.
2.1. یک سری محلول استاندارد تهیه کنید. چگالی نوری هر سری از محلول های استاندارد آماده شده را با استفاده از فیلترهای انتخاب شده قبلی اندازه گیری کنید.
2.2. داده های آزمایشی را در جدول (در زیر ببینید) برای هر سری از راه حل ها به طور جداگانه وارد کنید، پردازش آماری نتایج را انجام دهید.
2.3. با استفاده از داده های جدولی روی کاغذ گراف، A = f (مواد C) را رسم کنید و حلالیت فنل فتالئین در حلال ها را محاسبه کنید.
پس از مطالعه ادبیات حلالیت فنل فتالئین، روش های ذکر شده در بالا انتخاب شدند. و پس از مقایسه آنها از نظر امکان کاربرد در شرایط آزمایشگاهی ما، از نظر مدت زمان، از نظر سهولت اجرا، روش تعیین گرانی سنجی حلالیت انتخاب شد.
2. بخش تجربی
2.1 سنتز فنل فتالئین
سنتز بر اساس روش مشخص شده در بررسی ادبیات (بند 1.4.1) انجام شد.
| عمل | مشاهده |
| 1. وزن شده: 5 گرم انیدرید فتالیک (از نظر شیمیایی خالص) | پودر کریستالی سفید کریستال های صورتی و لطیف |
| 2. من معرف ها را در یک فلاسک مخروطی ته صاف (در هر 100 میلی لیتر) قرار دادم و با دماسنج در آن هم زدم. | یک توده فرنی مانند تشکیل شده است و مخلوط کمی گرم می شود (t≥ 37 0 C). |
| 3. فلاسک را روی یک حمام ماسه قرار دادم (دمای آن در محدوده 125 - 130 0 C). به مدت 1.5 ساعت گرم می شود. | در دمای 45 درجه سانتیگراد، فنل ذوب می شود، انیدرید فتالیک (فلکه های سفید) در مذاب قهوه ای شناور می شود. پس از حرارت دادن به مدت 30 دقیقه (t ≥ 130 0 C)، مذاب قهوه ای زرشکی همگن تشکیل شد. پس از 1 ساعت حرارت دادن - یک ذوب همگن رنگ قرمز خون. گرمایش پس از 1.5 ساعت متوقف شد. |
| 4. او مذاب داغ را در یک فلاسک با آب جوش ریخت و فنل واکنش نداده را با بخار آب تقطیر کرد (نقشه نصب را در بخش مربوط به بررسی ادبیات ببینید). | در یک فلاسک با آب در حال جوش، پس از ریختن مذاب داغ، قطعات فنل فتالئین به رنگ زرد روشن شروع به شناور شدن کردند، کمی کدر شدن آب رخ می دهد، t ? 99 0 C. یک تقطیر کدر آزاد می شود (V = 50 ml). پس از 15 دقیقه تقطیر، یک تقطیر شفاف شروع به چکیدن کرد. |
| 5. محلول را با فنل فتالئین بر روی قیف بوشنر بدون انتقال رسوب به فیلتر ریخته کنید. رسوب را با سه قسمت آب سرد، هر کدام 100 میلی لیتر شستم. | دمای محلول 26 0 C، در محلول (V? 170 میلی لیتر) قطعات دانه مانند فنل فتالئین، کمی به رنگ زرد است. |
| 6. فنل فتالئین فیلتر شده را در 15 میلی لیتر محلول گرم هیدروکسید سدیم (? = 5٪) حل کنید. | T NaOH ~42 0 C، رنگ محلول رخ داد - قرمز تیره. |
| 7. محلول قرمز تیره را فیلتر کرد. | دمای محلول 35 0 C. پس از فیلتراسیون، یک لایه نازک، صورتی مایل به سفید و ریز کریستالی از یک ماده بر روی فیلتر نشسته است (به احتمال زیاد انیدرید فتالیک واکنش نداده است). |
| 8. به فیلتر (V? 50 میلی لیتر) 5 میلی لیتر اسید استیک (c.) در قسمت های 1 میلی لیتری با هم زدن اضافه شد. | تغییر رنگ محلول از قرمز تیره به محلول خاکستری مایل به سفید و کدر (پوسته پوسته) مشاهده شد. محلول گرم نشد. دمای محلول 31 0 C. |
| 9. اضافه کردن 2 قطره اسید کلریدریک (c.) | تغییرات بصریاتفاق نیفتاد |
| 10. بگذارید به مدت 1 ساعت بماند. | ته لیوان ته لیوان، محلول شفاف بالای رسوب، تکه هایی به رنگ سفید مایل به خاکستری بود. |
| 11. رسوب حاصل را فیلتر کرد. | یک دوغاب سفید مایل به خاکستری روی فیلتر وجود دارد. م اوه؟ 5.07 |
در مجموع 5.07 گرم آماده سازی مرطوب به دست آمد.
2.2 تبلور مجدد از الکل داغ
تبلور مجدد طبق روش مشخص شده در بررسی متون انجام شد (بند 1.4.4). یک تکرار انجام شد. نقشه دستگاه در پاراگراف 1.4.4 بررسی ادبیات نشان داده شده است.
| عمل | مشاهده |
| مقدار وزن شده فنل فتالئین (5.07 گرم) در یک فلاسک قرار داده شد و 50 میلی لیتر اتانول 96 درصد به آن اضافه شد. | بخش کوچکی از فئولفتالئین حل شد. الکل کمی کدر است. |
| فلاسک تا یک جوش ملایم گرم شد. الکل اضافه شد تا زمانی که فنل فتالئین به طور کامل حل شود (هر کدام 0.5 میلی لیتر). VETOH = 7 میلی لیتر. | فنل فتالئین به طور کامل حل می شود. الکل کدر است. t مخلوط = 85 o C. |
| مخلوط به آرامی تا دمای اتاق خنک شد. | t مخلوط = 19 o C. بسیاری از بلورهای سفید به شکل بلورهای کوچک از محلول بیرون ریختند. محلول شفاف است. |
| کریستالهای رسوبشده مکیده شدند و روی فیلتر با آب یخ شسته شدند و بین صفحات کاغذ صافی خشک شدند. | فنل فتالئین که به شکل کریستال های هوا بدست می آید سفید خاکستری، ریزدانه. m (فنول فتالئین) = 4.08 گرم. بازده تبلور مجدد 83.5٪ بود. |
محاسبه تبلور مجدد:
بازده تبلور مجدد:
W,% \u003d (m (فنول فتالئین) خشک 100%) / متر (فنول فتالئین) مرطوب
W,% =  % = 83,5 %
% = 83,5 %
محاسبه بازده سنتز:
برای به دست آوردن 0.0388 مول فنل فتالئین (تئوری) یا m = 0.0338 mol 318 g/mol = 10.7 گرم.
خروجی از نظری:
W=  100 % = 40, 5 %
100 % = 40, 5 %
بنابراین، در اصل کافیفنل فتالئین (حدود 4.08 گرم) برای تحقیقات بیشتر. سنتز با بازده قابل قبولی از محصول انجام شد.
2.3 تعیین حلالیت
تعیین حلالیت فنل فتالئین توسط وزن سنجی انجام شد (نقطه 1.7.1 را ببینید).
کلروفرم، بنزن و زایلن به عنوان حلال انتخاب شدند. از آنجایی که طبق داده های ادبیات (جدول 5 را ببینید)، فنل فتالئین موجود در آنها حلالیت قابل قبولی برای جرم موجود فنل فتالئین دارد. من از آب استفاده نکردم، زیرا فنل فتالئین حلالیت بسیار کمی دارد (حدود 10-4 گرم در 100 گرم). از اتانول هم استفاده نکردم چون فنل فتالئین حلالیت خیلی خوبی در الکل دارد و مصرف زیاد ماده لازم است. اندازه گیری در دمای 1 ± 21 درجه سانتی گراد (دمای فاز مایع) انجام شد. انفوزیون 1 ± 30 دقیقه با هم زدن شدید به طول انجامید.
فرمول های محاسبه:
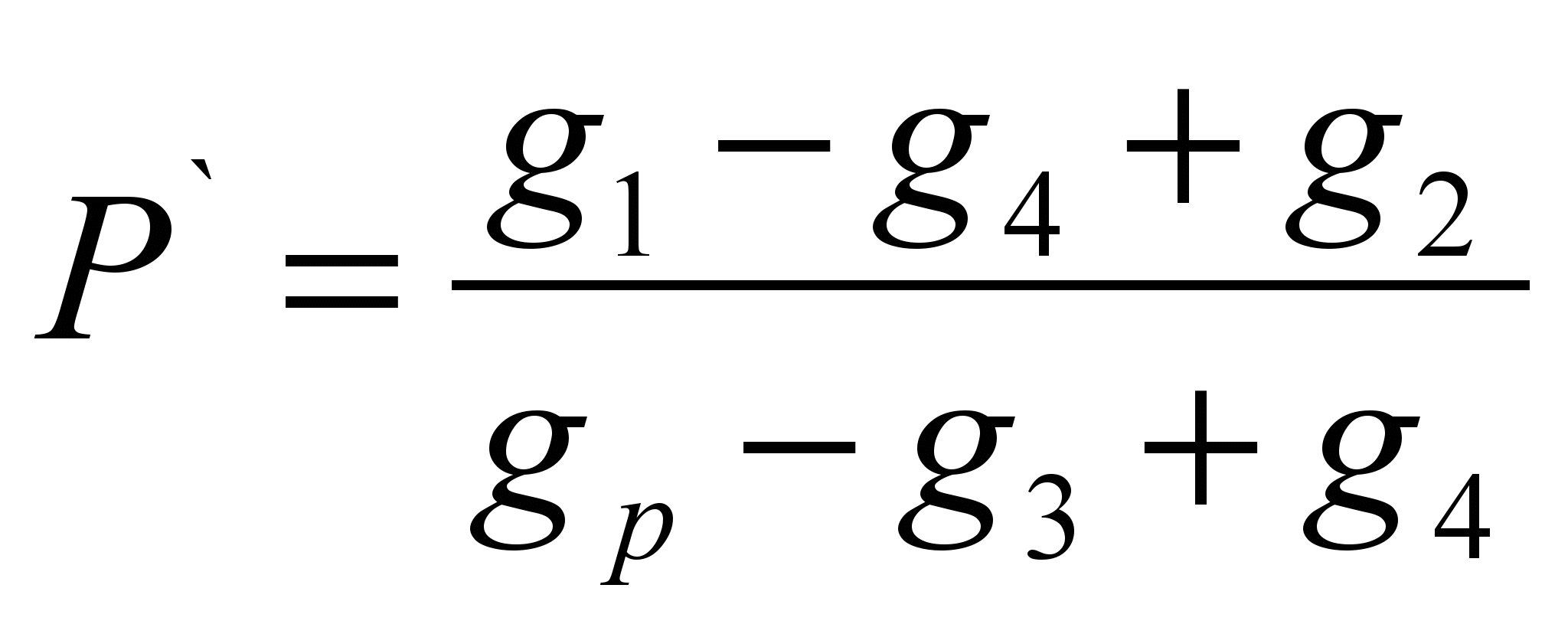 ; P \u003d P` 100 (گرم / 100 گرم)
; P \u003d P` 100 (گرم / 100 گرم)
جایی که، g 1 - نمونه ای از فنل فتالئین، g;
G 2 - وزن فیلتر خشک، گرم؛
G 3 - وزن فیلتر مرطوب با بقایای فنل فتالئین، گرم؛
G 4 - وزن فیلتر خشک با بقایای فنل فتالئین، g;
G p – نمونه حلال، g;
Р - حلالیت، محلول گرم در 100 گرم؛
Р`- حلالیت خاص، g/1 گرم sol.
نتایج تعریف:
P (فنول فتالئین / کلروفرم) = (0.03 ± 3.0) گرم / 100 گرم کلروفرم؛ ? = 1٪.
P (فنول فتالئین / زایلن) = (0.01 ± 0.22) گرم / 100 گرم زایلن. ? = 6 درصد
P (فنول فتالئین / بنزن) \u003d (0.19 0.01) گرم / 100 گرم بنزن؛ = 6٪.
طبق آزمایش، یک جدول محوری و یک نمودار ساخته شد.
جدول 7
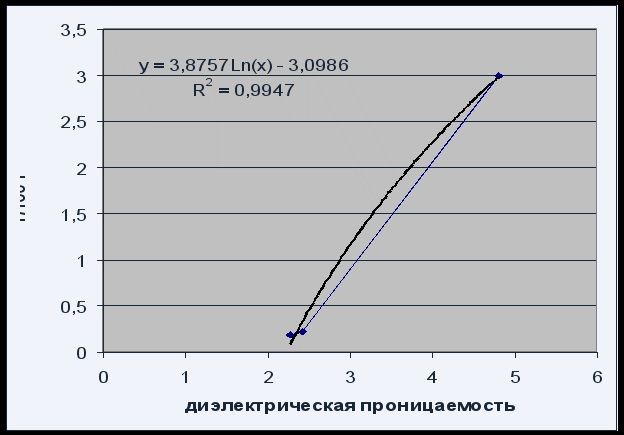
شکل 4وابستگی حلالیت به گذردهی حلال
وابستگی حلالیت به گذردهی حلال را می توان با معادله لگاریتمی P = 3.8757 Ln(x) - 3.0986 با کیفیت رضایت بخش R2 = 0.995 توصیف کرد.
با توجه به اینکه حلالیت فنل فتالئین با افزایش ثابت دی الکتریک حلال افزایش می یابد (افزایش قطبیت آن)، می توان گفت که فنل فتالئین یک ترکیب قطبی است.
نتیجه
در طول کار، 26 منبع ادبی مورد تجزیه و تحلیل قرار گرفت. شرح داده شده موقعیت عمومیبه دست آوردن با استفاده از واکنش برهمکنش فنل و انیدرید فتالیک. بررسی روشهای سنتز انجام شد (یک روش پیدا شد، در منابع مختلف ادبیات، روش در جرم بارگیری معرفها متفاوت بود) فنل فتالئین. انجام سنتز طبق این روش توسط فرآیندهای جانبی پیچیده نیست. خطرات اصلی در طول سنتز و جابجایی مواد مورد استفاده تعیین می شود. روشهایی برای تعیین حلالیت انتخاب شدند. کلروفرم، زایلن و بنزن به عنوان حلال برای تعیین حلالیت انتخاب شدند.
فنل فتالئین با عملکرد 40.5 درصد سنتز شد. شرایط سنتز، خالصسازی و جداسازی کاملاً مطابق با دادههای روش مشاهده شد.
حلالیت فنل فتالئین (بر اساس تعیین وزن سنجی) عبارت بود از: 0.03 ± 3.00 گرم در 100 گرم کلروفرم، 0.01 ± 0.22 گرم در 100 گرم زایلن، 0.19 ± 0.01 گرم در 100 گرم ben.
افزایش حلالیت فنل فتالئین با افزایش ثابت دی الکتریک حلال تایید می کند که فنل فتالئین یک ترکیب قطبی است.
فهرست ادبیات استفاده شده
1. آگرونوموف A.E. کار آزمایشگاهی در شیمی آلی – م.: روشنگری، 1977. 230 ص.2. Astakhova L.I., Krivenko A.P. کارگاه شیمی آلی – م.: میر، 1990. 180 ص.
3. Bishot E. اندیکاتورها. – م.: میر، 1355. 356 ص.
4. بولر ک.، پیرسون دی. سنتزهای آلی. م.: بالاتر. Shk., 1973. 340 p.
5. Gerasimov Ya.I. ترمودینامیک محلول ها – م.: Izd – v MGU, 1980. 170 p.
6. Gitis S. S. کارگاه شیمی آلی /S. S. Gitis، A. I. Glaz، A. I. Ivanov. - م.: وش، 1991.
7.Golodnikov G.V. کارگاه شیمی آلی - M.: شیمی، 1978. 160s.
8. گراندبرگ I. I. کار عملی و سمینارها در شیمی آلی: کتابچه راهنمای برای دانش آموزان. دانشگاه ها. – ویرایش چهارم، بازبینی شده. و اضافی - M.: Bustard، 2001.
9. Ivanov V. G. کارگاه شیمی آلی: Proc. کمک هزینه برای دانش آموزان. بالاتر Ped کتاب درسی مؤسسات / V. G. Ivanov، O. N. Geva، Yu. G. Gaverova. - م .: مرکز انتشارات "آکادمی"، 2000.
10. کاراپتیانس م.خ. مقدمه ای بر تئوری فرآیندهای شیمیایی. - م .: بالاتر. Shk., 1975. 280 p.
11. Kirilin V.A. ترمودینامیک محلول ها – م.: انرژی، 1980. 80 ص.
12. کوگان وی.بی. کتاب حلالیت. - م.: ل. انتشارات فرهنگستان علوم، 1961. 300 ص.
13. Levina R. Ya. کار عملی در شیمی آلی. - M.: شیمی، 1980.
14. Organicum: کار عملی در مورد شیمی آلی. - م.: میر، 1979 - V.2.
15. پتروف A. A. شیمی آلی: کتاب درسی برای دانشگاه ها / A. A. Petrov، H. V. Balyan، A. T. Troshchenko. – ویرایش پنجم، بازبینی شده. و اضافی - سن پترزبورگ: ایوان فدوروف، 2002.
16. Reichard K. حلالها و اثرات محیط در شیمی آلی. – م.: میر، 1370. 182 ص.
17. راهنمای مطالعات آزمایشگاهی در شیمی آلی: راهنمای دانشگاه ها /ن. N. Artemyeva، V. L. Beloborodova، S. E. Zurabyan و دیگران؛ اد. N. A. Tyukavkina. - ویرایش دوم، تجدید نظر شده. و اضافی - M.: Bustard، 2002.
18. خواص ترکیبات آلی: کتاب مرجع / ویرایش. A. A. Potekhina. - L.: شیمی، 1984.
19. Smolina T. A. کار عملی در شیمی آلی: یک کارگاه کوچک / T. A. Smolina، N. V. Vasilyeva، N. B. Kupletskaya. - ویرایش دوم، تجدید نظر شده. - م.: روشنگری، 1986.
20. کتاب راهنمای یک شیمیدان / ویرایش. B. N. Nikolsky و دیگران - L.: شیمی، 1964.
21. Stromberg A. G. Physical Chemistry: Proc. برای شیمی متخصص. دانشگاه ها /A. G. Stromberg، D. P. Semchenko; اد. A. G. Stromberg. - ویرایش پنجم، کشیش. - م.: وش، 2003.
22. Traven VF شیمی آلی: کتاب درسی برای دانشگاه ها. - M .: ICC "Akademkniga"، 2004. - T.1.
23. شیمی فیزیک. در 2 کتاب کتاب. 1. ساختار ماده. ترمودینامیک: Proc. برای دانشگاه ها / ک. S. Krasnov، N. K. Vorobyov، I. I. Godnev و دیگران؛ اد. K. S. Krasnova - ویرایش سوم، Rev. - م.: وش، 2001.
24. فیالکوف یو.آ. حلال به عنوان وسیله ای برای کنترل فرآیند شیمیایی. - ل.: شیمی، 1990. 240 ص.
25.شیمیایی فرهنگ لغت دایره المعارفی/ اد. I. L. Knunyants و دیگران - M .: دایره المعارف شوروی, 1983.
26. خرمکینا م.ن. کارگاه سنتز آلی - M.: انتشارات دانشگاه دولتی مسکو، 1985. 473 ص.
فرمول تجربی فنل فتالئین: C20H14O4 .
فنل فتالئین چیست؟
طبق ویکی پدیا، 4،4'-دیوکسیفتالوفنون یا 3،3-بیس-(4-هیدروکسی فنیل)فتالید نشان می دهد نشانگر اسید و باز .
موادی مانند تورنسل، فنل فتالئین، متیل اورانژ به طور گسترده ای در شیمی برای تعیین اسیدیته محلول ها استفاده می شود.
به شکل بدون تغییر، عامل یک کریستال شفاف است که در آب کمی حل می شود، اما در الکل ها و الکل ها بسیار حل می شود. دی اتیل اتر . امکان سنتز یک ماده از فنل و انیدرید فتالیک با استفاده از واکنش تراکم کلرید روی چگونه کاتالیزور (می توانید از غلیظ نیز استفاده کنید اسید سولفوریک ).
این ماده در محیط اسیدی ( pH از 0 تا 3) رنگ نارنجی مشخصی به دست می آورد. در محیط های کمی اسیدی و خنثی ( pH از 4 تا 7) رنگ محلول تغییر نمی کند. با کمک فنل فتالئین می توان یک محیط قلیایی را تشخیص داد. از آنجایی که محصول در محلول رنگ زرشکی به خود می گیرد، pH که از 8 تا 10 ( محلول قلیایی). اگر مقادیر pH از 11 تا 14، سپس نشانگر بر رنگ دارو تأثیر نمی گذارد. فنل فتالئین برای تیتراسیون مختلف محلول آبیکه در شیمی تجزیه ، معمولاً از ماده ای حل شده در الکل استفاده می شود.
فنل فتالئین نیز به طور گسترده در پزشکی استفاده می شود. چی پورگن ? این مترادف برای فنل فتالئین است. در قرن گذشته، این ماده به طور فعال به عنوان یک ملین استفاده می شد. این دارو به طور فعال تحرک روده را تحریک می کند. اکنون ملین Purgen به ندرت استفاده می شود، زیرا توانایی آن در تجمع در بدن و تأثیر نامطلوب بر عملکرد کلیه ها است.
اثر فارماکولوژیک
ملین.
فارماکودینامیک و فارماکوکینتیک
فنل فتالئین چیست؟
Purgen یک ملین قوی است. مکانیسم عمل آن بر اساس پریستالسیس روده ها این به دلیل توانایی ماده در مهار اتفاق می افتد سدیم پتاسیم ATPase ، تحریک کننده آدنیل سیکلاز و بالا بردن بیوسنتز . این ماده سیناپس ها و پایانه های عصبی دیواره روده را تحریک می کند، مختل می شود تعادل آب و الکترولیت که در دستگاه گوارش مایع جمع می شود.
پس از اولین دوز، اثر دارو در عرض یک روز ظاهر می شود. این ماده تمایل به تجمع در بدن دارد، بر کلیه ها اثر تحریک کننده دارد، دارد طرفدار سرطان خواص
موارد مصرف
فرآورده های حاوی این ماده به عنوان ملین برای مزمن استفاده می شود.
موارد منع مصرف
ملین Purgen منع مصرف دارد:
- با بیماری کلیوی؛
- بیماران با انسداد روده ;
- هنگام استفاده از فنولفتالئین
- هنگامی که یک بیمار دارای مجموعه ای از علائم است " شکم حاد ”.
دارو نباید برای مدت طولانی استفاده شود. هنگام درمان سالمندان با این دارو باید احتیاط خاصی صورت گیرد.
اثرات جانبی
قرص Purgen می تواند باعث شود:
- تپش قلب به دلیل تعادل آب و الکترولیت ;
- آلبومینوری ;
- سقوط - فروپاشی ;
- کاهش سطح پتاسیم در خون؛
- تغییر رنگ ادرار از زرد به صورتی یا قهوه ای؛
- بثورات پوستی و
دستورالعمل Purgen (روش و دوز)
این ملین به شکل قرص، دوزهای مختلف یا پودر برای مصرف خوراکی موجود است.
دستورالعمل استفاده از فنل فتالئین
به طور متوسط، دوز روزانه برای یک بزرگسال 100 میلی گرم است.
برای کودکان بسته به سن و وزن آنها 50-200 میلی گرم در روز تجویز می شود.
حداکثر مقدار ماده ای که می توان در عرض 24 ساعت مصرف کرد 300 میلی گرم است.
دوره درمان توسط یک متخصص تجویز می شود. آماده سازی حاوی این جزء نباید برای مدت طولانی مصرف شود.
مصرف بیش از حد
دارو ممکن است باعث شود خونریزی هموروئیدی ، کاهش قابل توجهی، تا سقوط - فروپاشی ظاهر پروتئین در ادرار در صورت مصرف بیش از حد، توصیه می شود با پزشک مشورت کنید.
اثر متقابل
اگر درمان به صورت موازی انجام شود، فنل فتالئین می تواند منجر به احتباس پتاسیم در بدن شود. دیورتیک های نگهدارنده پتاسیم .
شرایط فروش
بدون نیاز به نسخه
شرایط نگهداری
فرآوردههای مبتنی بر فنل فتالئین را در مکانی خشک و تاریک، محافظت شده از کودکان، در دمای اتاق نگهداری کنید.
ماندگاری
پودر ماندگاری نامحدودی دارد، قرص ها را می توان به مدت 10 سال نگهداری کرد (مگر اینکه در بسته بندی توسط سازنده غیر از این مشخص شده باشد).
دستورالعمل های ویژه
در حال حاضر داروهای حاوی فنل فتالئین به ندرت در پزشکی استفاده می شود. اغلب، سایر ملین های مدرن و ایمن ترجیح داده می شوند.
فرزندان
این ماده با احتیاط تجویز می شود. بسته به سن و وزن کودک تنظیم دوز مورد نیاز است.
مسن
افراد کهنسالاثر مصرف این دارو در عرض 24-72 ساعت رخ می دهد.
برای کاهش وزن
در آغاز قرن گذشته از این ماده برای کاهش وزن استفاده می شد. اکنون داروهای دیگری نیز وجود دارند که تأثیر مشابهی دارند. بسیاری از دختران در آب و هوا برای یک شکل کامل از ملین ها سوء استفاده می کنند، که نباید انجام شود. این ممکن است برای سلامتی شما خطرناک باشد.
آماده سازی حاوی (آنالوگ)
تصادف در کد ATX سطح 4:
Ex Lax، Purgen، Purgofen، Purgil، Phenaloin، Laxatol، Laxoil.
قیمت پرگن، از کجا بخریم
قیمت یک ملین به شکل پودر فنل فتالئین به صورت عمده حدود 1700 روبل در هر کیلوگرم است.
خرید دارو در مسکو تقریبا غیرممکن است، زیرا آماده سازی بر اساس آن مدت طولانی است که به داروخانه ها عرضه نمی شود.
قیمت فنل فتالئین ممکن است بسته به سازنده متفاوت باشد.
