Was ist Phenolphthalein? Die Hauptgefahren bei der Wasserdampfdestillation.
(Dokument)
n2.doc
Bundesamt für Unterricht
Allgemeines Experiment 1: Titration
Warum sollten Sie sicherstellen, dass Ihre Augen gleichmäßig sind, wenn Sie die letzten Tropfen Wasser hinzufügen?
- Wie hoch ist die Konzentration dieser Standardlösung?
- Was ist der Zweck des Waschens der Tasse und des Trichters mit Wasser?
- Was ist der Zweck, um das Innere des Messkolbens mit Wasser zu spülen?
Rekristallisationsmethode aus heißem Alkohol
Bestimmen Sie aus der Tabelle das durchschnittliche Titrationsvolumen für dieses Experiment und verwenden Sie diesen Wert in Ihren anderen Berechnungen. Bestimmen Sie anhand der obigen Beispiele die Essigsäurekonzentration in einer Essigprobe. Denken Sie daran, dass Sie folgende Informationen haben: das Volumen der Weinrebe der Natriumhydroxidlösung, die Konzentration der Natriumhydroxidlösung. Bestimmen Sie die Konzentration der Natronlauge mit unbekannter Konzentration.
Staatliche Hochschule für berufliche Bildung
Pomor State University benannt nach M.V. Lomonosov
Fachbereich Chemie
Kursarbeit
Synthese von Phenolphthalein.
Die Untersuchung der Löslichkeit in Lösungsmitteln mit unterschiedlicher Dielektrizitätskonstante
Hergestellt von:
Konzentrierte Säuren und Basen können schwere Verbrennungen verursachen. Wir empfehlen die Verwendung von Handschuhen und Schutzbrillen, wenn Sie mit Säure oder Base arbeiten. Nachdem Sie sichergestellt haben, dass die Bürette geschlossen ist, geben Sie vorsichtig die Standard-Oxalsäurelösung in die Bürette, bis die Bürette voll ist. Stellen Sie ein sauberes Glas unter die Bürette und geben Sie vorsichtig einen Teil der Oxalsäurelösung hinein. Dadurch wird sichergestellt, dass sich keine Luftblasen in der Bürette befinden. Der obere Teil der Lösung sollte jetzt zwischen den Markierungen 0 und 1 cm liegen. 3. Schreiben Sie den Wert auf die zweite Dezimalstelle. Verwenden Sie eine Pipette, um eine 20 cm 3 -Lösung in einem Erlenmeyerkolben zu messen. Geben Sie 3-4 Tropfen Phenolphthalein-Indikator in den Erlenmeyerkolben. Führen Sie ein Rohtitrationsexperiment durch, indem Sie schnell Oxalsäure in den Erlenmeyerkolben geben und den Erlenmeyerkolben ständig drehen. Stoppen Sie, sobald sich die Farbe der Lösung ändert und nachdem Sie sie verwirbelt haben. Wenn die Farbänderung beim Drehen des Kolbens nicht erhalten bleibt, fügen Sie mehr Oxalsäure hinzu, bis die Farbe erhalten bleibt. Wiederholen Sie die Schritte 4 bis 7 mit dem zweiten Erlenmeyerkolben. Geben Sie schnell Oxalsäure in den Erlenmeyerkolben, bis Sie 2 cm 3 weniger als Ihr Grobtitrationsvolumen zugeben. Im Moment sollte es keine dauerhafte Farbveränderung geben. Fügen Sie nach und nach Oxalsäure hinzu. Wirbel zwischen jedem Tropfen und spüle, falls nötig, die Seiten des Kolbens mit Wasser ab. Achten Sie auf das Volumen der Bürette, wenn sich die Farbe der Lösung ändert und die Farbe unverändert bleibt. Denken Sie daran, dass das titrierte Volumen: -. Wiederholen Sie die Schritte 9 bis 11, bis Sie drei Messwerte mit einem Unterschied von nicht mehr als 0,1 cm 3 erhalten.
- Markiere eine der Brillen \\\\.
- Mit einer Pipette 100 cm 3 Wasser in einem Glas messen.
- Ca. 4 g in ein Glas geben und mischen.
- Befestigen Sie die Bürette am Retortenständer und setzen Sie einen kleinen Trichter auf.
- Welche Farbe hatte die Natronlauge bei der Zugabe von Phenolphthalein?
- Was war die Farbe, als genug Säure hinzugefügt wurde?
3 jähriger Student
abteilungen für Chemie
Alferov Vladimir Ivanovich
Überprüft:
Assoziierter Professor Chem. der Wissenschaften
Lewandowska T.V.
Assoziierter Professor tech. der Wissenschaften
Chagina N. B.
ARCHANGELSK
1. Literaturübersicht ………………………………………………… ..5
Aussehen und physikalische Eigenschaften von Phenolphthalein ………… .5
Die Verwendung von Phenolphthalein ………………………………… ... 6
Chemische Eigenschaften ……………………………………………… ... 8
Phenolphthalein erhalten …………………………………… 11
1.4.2 Physikalische Eigenschaften von Stoffen, die bei der Synthese von ... .15 verwendet werden
Bestimmen Sie anhand der vorstehenden Beispiele die Konzentration der Natronlauge. Denken Sie daran, dass Sie die folgenden Informationen haben: Das Volumen einer Lösung von Natriumhydroxid im Volumen einer Lösung von Oxalsäure ist die Konzentration einer Lösung von Oxalsäure. Eine ausgewogene chemische Gleichung für diese Reaktion.
Berechnen Sie die Masse der Oxalsäure, die der Schüler auflösen muss, um die erforderliche Standardlösung zu erhalten. Er glaubt, dass 40 cm 3 Oxalsäurelösung 35 cm 3 Natriumhydroxidlösung vollständig neutralisieren.
- Wir brauchen viel Oxalsäure.
- Die Anzahl der Mole ist uns jedoch noch nicht bekannt.
1.4.3 Methoden der Wasserdampfdestillation …………………… .16
1.4.4 Verfahren zur Umkristallisation aus heißem Alkohol 18
1.5 Sicherheitsvorkehrungen …………………………………………… 20
1.5.1 Die Hauptgefahren beim Arbeiten mit konzentrierten Säuren
1.5.2 Hauptgefahren bei der Wasserdampfdestillation 21
- Schreiben Sie eine ausgewogene chemische Gleichung für die Reaktion.
- Berechnen Sie die Säurekonzentration.
Dieser oft saure Regen wurde zum ersten Mal im 19. Jahrhundert bemerkt, aber erst im 20. Jahrhundert breitete sich dieser Säuregehalt in gefährlichen Mengen aus, was wir mit dem Begriff „saurer Regen“ in Verbindung bringen. Der Hauptschuldige war Kohle, die Schwefel als Verunreinigung enthielt. Bei der Verbrennung in einem Kraftwerk bildet dieser Schwefel zusammen mit Sauerstoff Schwefeldioxid, das durch den Schornstein aufsteigt und sich in der Atmosphäre verteilt.
1.5.3 Hauptgefahren beim Umkristallisieren aus heißem Alkohol .......................................................................
1.5.4 Merkmale der Arbeit mit Stoffen, die bei der Synthese von ………………………………………………………………………… 22 verwendet werden
1.6 Charakterisierung von Lösungsmitteln …………………………… .24
1.6.1 Einstufung von Lösungsmitteln nach physikalischen Eigenschaften ... 25
Schwefelsäure ist eine sehr starke Säure. Wenn Wasser aus der Luft zu Regentropfen kondensiert, löst sich die Säure in Wasser auf. Dann fällt der Regen und sammelt sich in den Körpern des Süßwassers und erhöht deren Säure. Der Nordosten der Vereinigten Staaten ist am stärksten davon betroffen, da das Ohio Valley, einschließlich der Bezirke Ohio und Pennsylvania, Orte mit dem größten Teil des Steinkohlenbergbaus der letzten anderthalb Jahrhunderte sind. Aufgrund der vorherrschenden Wetterbedingungen gelangen diese Abgase im Ohio Valley in die Atmosphäre. Im Norden des Staates New York und in Neuengland fällt jedoch Regen.
1.6.2 Lösuauf der Grundlage ihrer chemischen Eigenschaften ………………………………………………… ..30
1.7 Übersicht der Methoden zur Bestimmung der Löslichkeit von Feststoffen
1.7.1 Gravimetrisches Verfahren …………………………………… .35
1.7.2 Elektrochemisches Verfahren 37
1.7.3 Photoelektrokalorimetrisches Verfahren …………………… ..41
Ein Anstieg der Regensäure kann verheerend sein. Metallverunreinigungen im Boden, die normalerweise fest an andere Verbindungen gebunden sind, können in Seen und Bächen mit saurem Regen gewaschen werden. Zu einer Zeit waren viele Teiche in Neuengland aus diesem Grund nicht in der Lage, Forellen zu halten. Pflanzen reagieren auch sehr empfindlich auf den pH-Wert des Bodens. Nützliche Nährstoffe können auch aus dem Boden ausgewaschen werden, sodass Pflanzen nicht in der Lage sind, darin zu überleben. In besonders stark betroffenen Gebieten sind Dutzende abgestorbener Bäume zu finden, wie oben gezeigt.
2. Der experimentelle Teil ………………………………………… 43
2.1 Synthese von Phenolphthalein ………………………………………… ... 43
2.2 Umkristallisation aus heißem Alkohol ……………………… ..45
2.3 Bestimmung der Löslichkeit ………………………………… .47
Fazit .............................................. 50
Bibliografische Liste ……………………………………… .51
Gebäude und Statuen wurden auch durch sauren Regen beschädigt, der Stein, insbesondere Kalkstein, auffrisst. Zunehmende Erosion von Skulpturen, Grabsteinen und sogar einigen Gebäuden führte zu enormen Verlusten - einige Kunstwerke wurden vollständig zerstört.
Seitdem sind die Emissionen erheblich gesunken, und daher ist auch der saure Regen zurückgegangen. Das Problem ist jedoch noch nicht gelöst, und es bleibt noch viel zu tun, um dieses schwerwiegende Umweltproblem zu lösen. Schauen wir uns Salzsäure an, die die Hauptkomponente der Magensäure ist, und Natriumhydroxid, das oft als „Alkali“ bezeichnet wird und in Seife verwendet wird. Fast alle Hydronionen und Hydroxide bilden zusammen Wassermoleküle, wobei nur die Chlorid- und Natriumionen zurückbleiben.
Einleitung
Phenolphthalein ist einer der am häufigsten verwendeten Säure-Base-Indikatoren in der Chemie. Es gehört zu den als Phthalsäure bezeichneten Triarylmethanfarbstoffen.
Ziel dieser Arbeit ist die Synthese von Phenolphthalein und die Untersuchung seiner Löslichkeit in Lösungsmitteln mit unterschiedlichen Dielektrizitätskonstanten. Um dieses Ziel zu erreichen, müssen folgende Aufgaben gelöst werden:
Wenn die Menge an Salzsäure genau der Menge an Natriumhydroxid in Mol entspricht, muss jedes Hydronium Hydroxid aufweisen, um mit einer Lösung zu reagieren, die gegenwärtig neutral ist. Es sollte jetzt ein Glas sauberes Wasser mit einem pH-Wert von 7 und normalem darin gelöstem Tafelsalz sein. Wir beginnen mit zwei extrem ätzenden Substanzen und enden mit gutartigen Produkten.
Im Allgemeinen neutralisieren sich Säuren und Basen gegenseitig, wenn sie miteinander interagieren, und der pH-Wert der Lösung nähert sich diesem Wert an. Das heißt ".". Nur wenn eine gleiche Menge an starker Säure und starker Base zusammengegeben wird, ist der pH-Wert genau. In vielen Fällen verbinden sich jedoch schwache Säuren und schwache Basen. Der pH-Wert wird sich jedoch 7 nähern, aber die Lösung wird nicht neutral sein. Bei saurem Regen sind Steine \u200b\u200bund Erde häufig die Hauptursache, insbesondere in Teilen des Landes vorkommende Karbonatgesteine.
1. Die Literatur zu diesem Thema zu analysieren;
2. Wählen Sie Synthesemethoden und wählen Sie die akzeptabelste von ihnen.
3. Um das Produkt zu synthetisieren, zu isolieren und zu reinigen;
4. Die Löslichkeit in Lösungsmitteln mit unterschiedlichen Dielektrizitätskonstanten untersuchen und die Ergebnisse mit Literaturdaten vergleichen.
Da die schwachen Säuren im sauren Regen auf das Gestein fallen, werden sie durch Basen auf den Blättern, im Schlamm und im Gestein neutralisiert. Viele dieser Basen, zum Beispiel in den Felsen, sind jedoch nicht erneuerbar. Nach einem Jahrhundert sauren Regens neutralisieren Gesteine \u200b\u200bdie gesamte Gesteinsbasis, saurer Regen gelangt einfach in das Ökosystem und nichts neutralisiert es.
Phenolphthalein: ein gängiger Laborindikator
Das Phenolphthaleinmolekül ist in Gegenwart von Säure transparent und in Gegenwart einer Base rosa. Dies ist ein ausgezeichneter Indikator, um den Äquivalenzpunkt bei der Säure-Base-Titration für einfache Säuren zu ermitteln. In Abschnitt 5 von Abschnitt 8 wurden Titrationen eingeführt, um die beiden Lösungen zu kombinieren und eine kontrollierte stöchiometrische Reaktion zu erhalten. Es erfordert eine Lösung bekannter Konzentration, normalerweise in einer Bürette, die mit einer Lösung unbekannter Konzentration in einem Glas darunter reagiert. Jede Reaktion funktioniert für die Titration. Um jedoch feststellen zu können, wann die Reaktion abgeschlossen ist, muss ein sichtbarer Endpunkt vorhanden sein.
5.
Machen Sie eine Schlussfolgerung über die geleistete Arbeit.
1. Literaturübersicht
1.1 Aussehen und physikalische Eigenschaften von Phenolphthalein
Phenolphthalein (Di-n-dioxidiphenylphthalid, 2,2-Bis (n-hydroxyphenyl) phthalid) ist ein weißes oder leicht gelbes kristallines Pulver; Beim Umkristallisieren aus verdünntem Ethylalkohol bilden sich farblose, rhombische Nadeln. Phenolphthalein ist geruchlos und an der Luft nicht stabil. Das Molekulargewicht beträgt 318,3 g / mol. Phenolphthalein schmilzt bei einer Temperatur von 250 ° C (258 ° C) und sublimiert bei höheren Temperaturen.
Phenolphthalein als Mittel zum Abnehmen
Bei Reaktionen mit einer Säure-Base können Indikatoren genau diese Art von Farbänderungsinformationen liefern, um den Endpunkt anzuzeigen. Daher sind Säure-Base-Neutralisationsreaktionen eine der häufigsten Arten von Reaktionen, die in Titrationstests verwendet werden. Somit kann durch Titration die Menge an Säure oder Base in einer unbekannten Lösung bestimmt werden.
Beim Titrieren von starken Säuren mit starken Basen wird der Endpunkt erreicht, wenn der pH-Wert genau 7 beträgt, da die Lösung nur eine reine wässrige Lösung mit neutralen Elektrolyten sein sollte. Nachdem die Säure verschwunden ist, wird jede Base, die wir in den Kolben geben, nicht neutralisiert, und der pH-Wert der Lösung beginnt zu steigen. Ein kleiner Teil eines Tropfens von der Bürette einer zu starken Base führt jedoch zu einer Änderung des pH-Werts. Ein oder ein solcher Indikator, Phenolphthalein, ist in sauren Lösungen transparent und farblos, in basischen Lösungen wird er jedoch dunkelrosa, wenn der pH-Wert über 2 liegt.
Phenolphthalein ist in Ethanol, Diethylether, Chloroform, Aceton, Petrolether, Benzol, Toluol und schlecht in Wasser löslich.
1.2 Verwendung von Phenolphthalein
Phenolphthalein ist einer der am häufigsten verwendeten Indikatoren, insbesondere bei der volumetrischen Bestimmung von schwachen Säuren.
Es hat mehrere Vorteile: Es ist unempfindlich gegen erhöhte Temperaturen, der Fehler durch die Anwesenheit von Eiweißstoffen und Kolloiden ist unerheblich. Es kann sogar in alkoholhaltigen Lösungen weit verbreitet verwendet werden, nur die Farbe der alkalischen Lösung unterscheidet sich von dem für eine wässrige Lösung charakteristischen violetten Ton. In konzentrierten Alkohollösungen hat die Hauptform eine blau-violette Farbe. Phenolphthalein kann zur Titration von organischen Säuren in Alkohollösungen oder zur Bestimmung des Säuregehalts von Alkoholen und Estern verwendet werden. Hayort und Ham schlagen vor, Dinatriumglykolat zu verwenden, um in Gegenwart von Phenolphthalein einen Basentiter zu bestimmen. Befriedigende Ergebnisse werden durch Titration von 2 · 10 -6 - 30 · 10 -6 g organischen Säuren in einem Volumen von 2,7 · 10 -6 - 40 · 10 -6 l in Gegenwart von Phenolphthalein erhalten. Laut Micks Studien spielt die Konzentration des Indikators eine sehr wichtige Rolle in der Mikroazimetrie. Phenolphthalein ist Teil vieler gemischter Indikatoren. Aufgrund seiner Eigenschaften eignet es sich zur kalorimetrischen Bestimmung des pH-Wertes mit Pufferlösungen oder nach der Michaelis-Methode ohne Pufferlösungen. Die gefärbte Form folgt dem Biergesetz in einer Vielzahl von Konzentrationen.
Säureindikatoren gibt es in vielen Arten
Die Tatsache, dass Phenolphthalein seine Farbe geringfügig über 0 ändert, führt normalerweise zu einem sehr kleinen Fehler im Experiment. Weitere Indikatoren sind neben Phenolphthalein Bromtimolblau und Methylorange. Für Lösungen, die sich nur geringfügig vom Endpunkt unterscheiden, ist Bromthymolblau ein guter Indikator. Unmittelbar unter pH 7 hat die Lösung eine gelbe Farbe, die sich unmittelbar oberhalb des pH-Werts blau färbt. Wenn der Titrationsendpunkt ziemlich sauer ist, wird Methylorange verwendet.
Phenolphthalein kann auch als Reagenz für eine qualitative Analyse verwendet werden. Laut Sachs ergeben einige unlösliche Metallhydroxide wie Blei, Cadmium, Zink, Magnesium usw. beim Besprühen mit Phenolphthalein eine Farbe, die durch die Adsorption des Indikators erklärt wird. Eine weitere Gruppe von Reaktionen beruht auf der Tatsache, dass Phenolphthalein im alkalischen Milieu durch Zink zu farblosem Phenolphthalein reduziert wird. Diese Leukoverbindung wird durch bestimmte Substanzen oxidiert, und dann erscheint wieder rotes Phenolphthalein. Ein ähnlicher Effekt wird bei sehr geringen Mengen an Cyanidionen (0,01-0,05 mg / l) in Gegenwart von Kupfersulfatspuren beobachtet. Bei sehr geringen Kupfermengen (10 -4 - 10 -5%) führt die Einführung von Wasserstoffperoxid in das System zu einer Erhöhung der Oxidationsrate der Leukoverbindung.
Eines der Phenolphthalinderivate - Phenolphthaleinphosphat - wird zur Bestimmung der Aktivität des Phosphataseenzyms verwendet. Phenolphthaleinphosphat allein hat nicht die Eigenschaften eines Indikators, sondern wird durch die Wirkung des Enzyms zerstört; Phosphatgruppen werden durch die Einwirkung des Substrats abgespalten und es erscheint eine rote Farbe von Phenolphthalein.
In der Medizin wird Phenolphthalein als Abführmittel verwendet und das Medikament heißt - Purgen.
1.3 Chemische Eigenschaften
Das Phenolphthalein-Farbübergangsintervall reicht von pH 8,2 (farblos) bis pH 9,8 (violett). Zur Bestimmung des Übergangsintervalls wird eine Reihe von Pufferlösungen mit folgenden pH-Werten verwendet: 7.8-8.0-8.2-8.4-9.0-9.6-9.8-10.0-10.2. Die pH-Werte, bei denen die erste rosa Farbe auftritt, hängen von der Konzentration des Indikators ab. Die Intensität der violetten Farbe steigt allmählich auf pH 9,8 an: pH 1/2 9,53.
Der Prozess der Bildung eines farbigen Dianions der Chinoidstruktur (III), das durch Wechselwirkung von Phenolphthalein mit einer verdünnten Alkalilösung (pH 8,5) entsteht, kann wie folgt dargestellt werden:
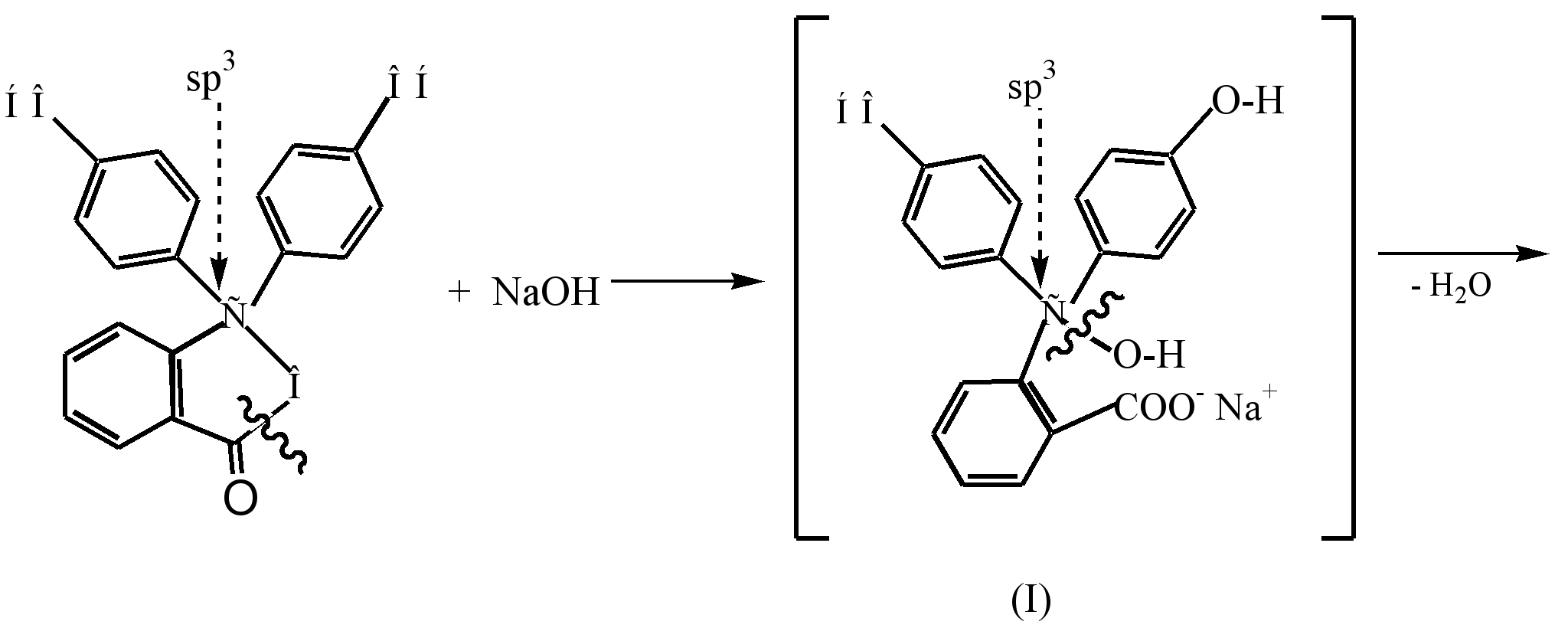

Unter der Einwirkung von Alkali im farblosen Phenolphthalein wird der β-Lactonring geöffnet (Hydrolyse) und der resultierende farblose Alkohol (I) spaltet spontan ein Wassermolekül unter Bildung eines gelben Mononatriumsalzes (II). Eine weitere Wechselwirkung mit Alkali führt zur Bildung von Dinatriumsalz (III) und zu einer Vertiefung der Himbeerfarbe, was auf die Verlängerung der Konjugationskette zurückzuführen ist.
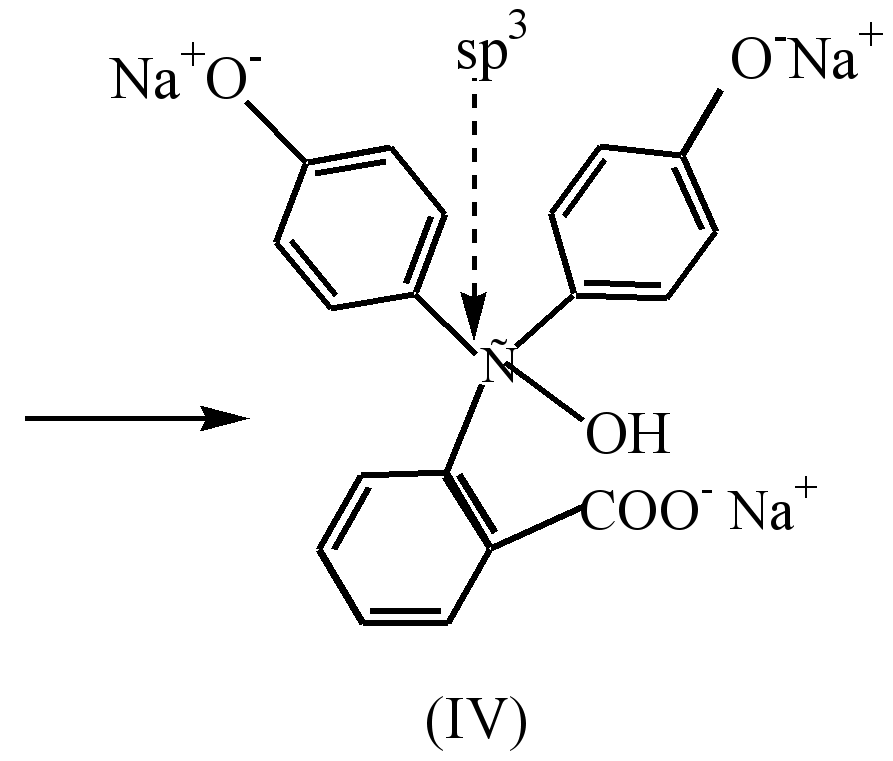
In einem stark alkalischen Medium (pH-10) wird eine Verfärbung der Lösung infolge des Übergangs des Dinatriumsalzes (III) zum Trinatriumsalz (IV) beobachtet, in dem die Ringe nicht konjugiert sind.
In einer sauren Umgebung ist es farblos, da schwache Benzolchromophore isoliert sind, autonom und - Interaktion (Paarung) miteinander nicht eingeben:
Sind sie durch sp 3 getrennt - ein Kohlenstoffatom, das ein Isolator ist, kein Leiter? - Elektronen. In einem alkalischen Medium bricht der Lactonzyklus, eine der phenolischen Hydroxylgruppen ionisiert und das C sp 3 -Atom nimmt die C sp 2 -Konfiguration an und wird zum Leiter? - Elektronen zwischen Benzolchromophoren, außerdem polarisierte Auxochrome - СОО - und –О -. In konzentrierter Schwefelsäure färbt sich der Indikator orange. Die Farbintensität purpurfarbener Laugen im Stehen nimmt zum Teil durch Bildung einer farblosen Carboxybase ab (dies ist eine reversible Umwandlung), zum Teil durch irreversible Oxidation durch Luft
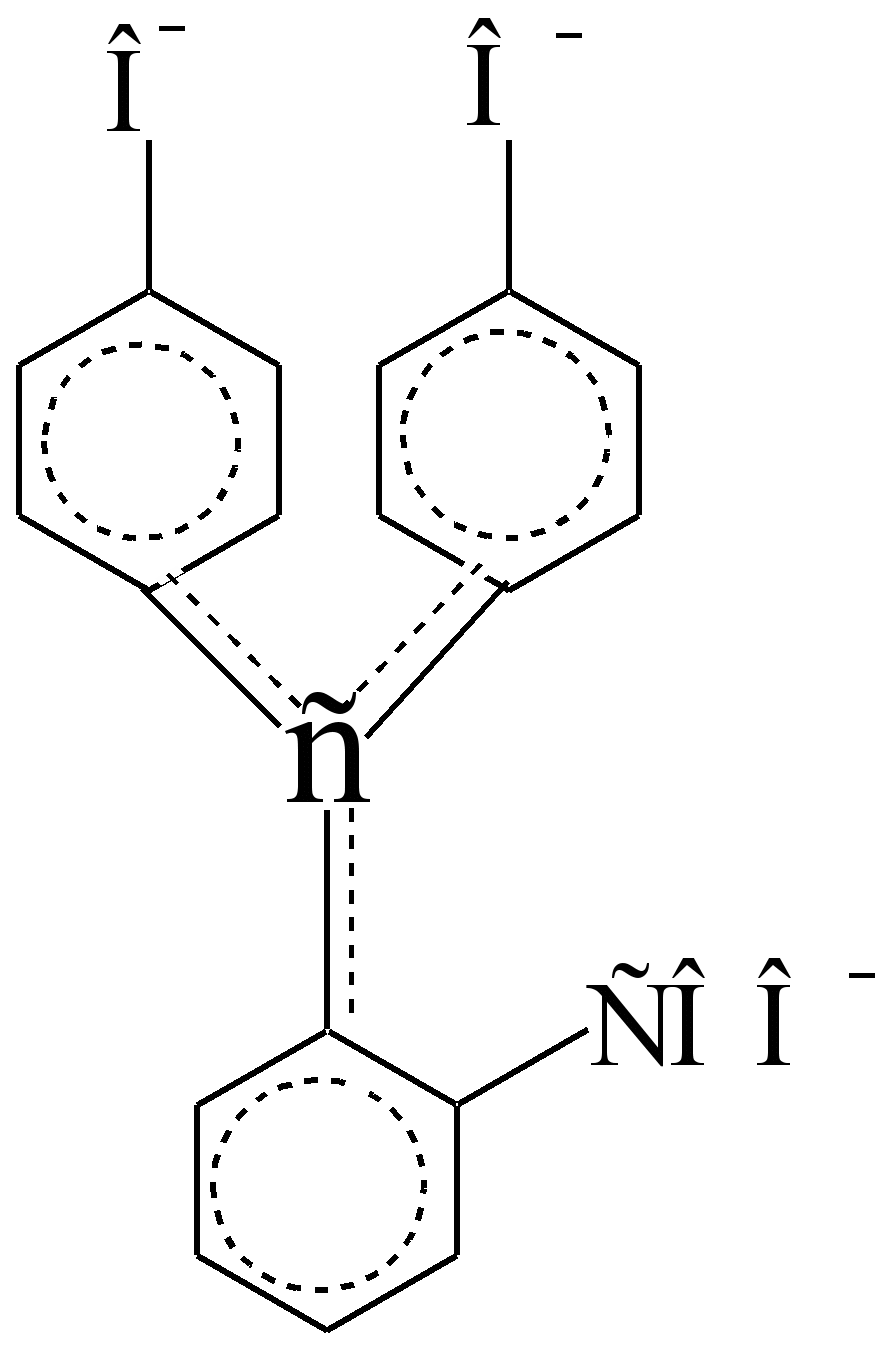
Phenolphthalein-Chromophor
(alkalische Form, ≤ 1 \u003d 553 nm, ≤ 1 \u003d 9000)
1.4 Gewinnung von Phenolphthalein
Das Hauptverfahren zur Herstellung von Phenolphthalein ist die Kondensation von Phenol mit Phthalsäureanhydrid. Diese Reaktion ist ein Sonderfall der Friedel-Crafts-Acylierung. Die Reaktion läuft beim Erhitzen mit einem sauren Katalysator (konzentrierte Schwefelsäure oder Zinkchlorid) ab:
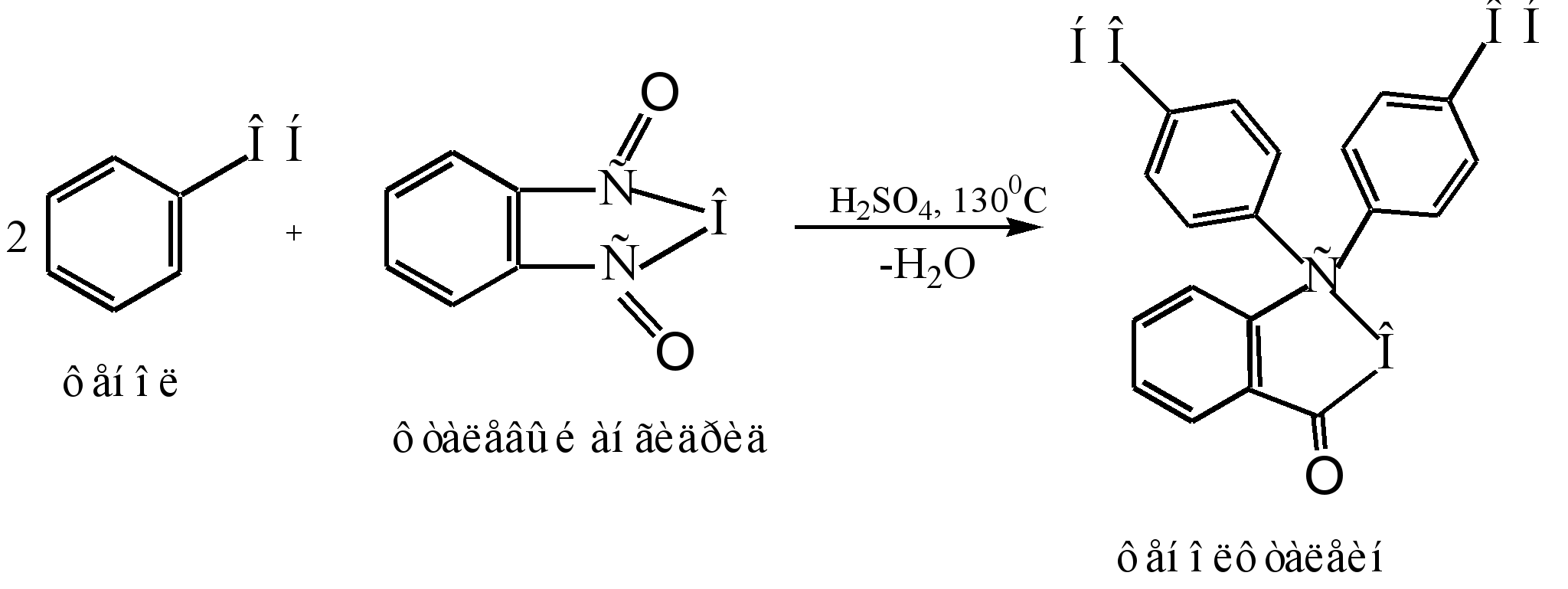
Der Reaktionsmechanismus kann wie folgt dargestellt werden:

Sigma - Komplex
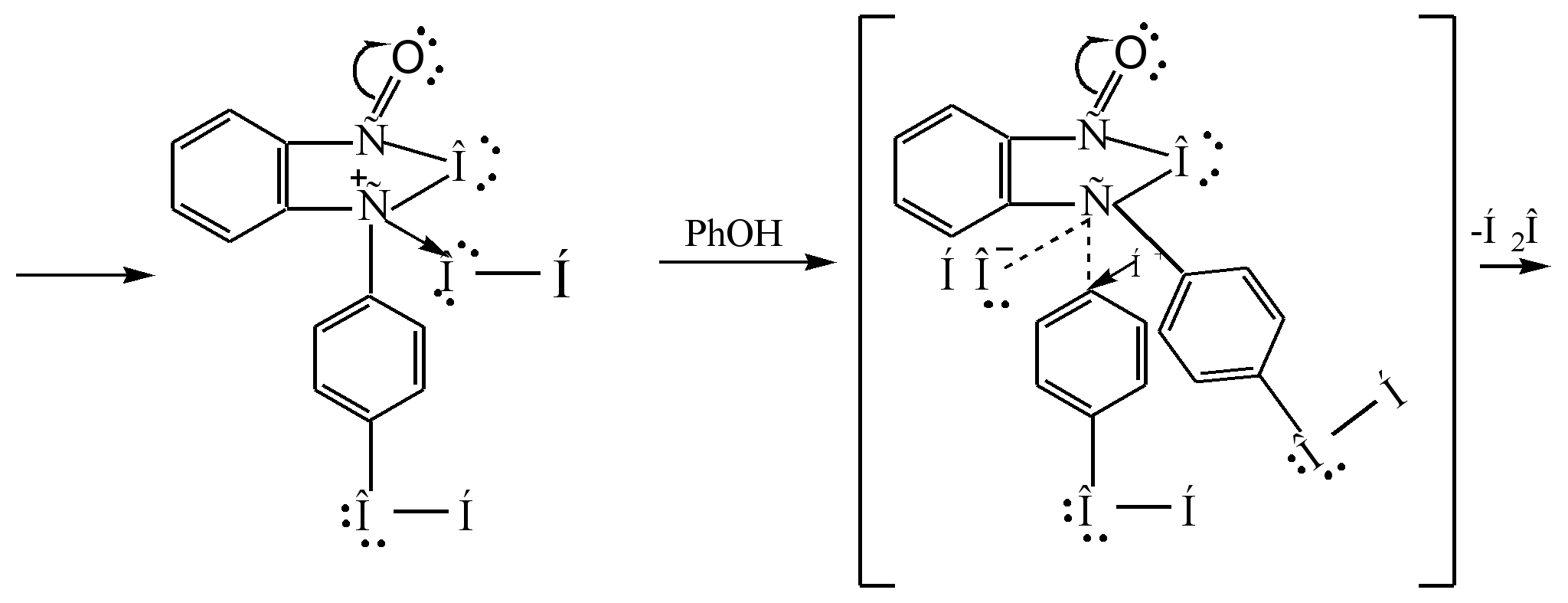
phenolphthalein
1.4.1 Methoden zur Herstellung von Phenolphthalein
Nach Analyse der Literatur zu diesem Thema wurde festgestellt, dass in allen methodischen Handbüchern die gleiche Methodik für die Herstellung von Phenolphthalein angegeben ist. Es basiert auf der oben dargestellten Reaktion. Die Technik ist voll auf unsere Laborbedingungen abgestimmt.
Für die Synthese benötigen Sie folgende Reagenzien, Geschirr und Geräte:
Phthalsäureanhydrid-5 g; Phenol-10 g; Schwefelsäure - 2 ml; Natriumhydroxid - 4-5%; Essigsäure (konzentriert); Salzsäure (konzentriert); Ethylalkohol (absolut).
Rundkolben (50 ml) - 1 Stück; Glas (100 ml) - 1 Stk .; Porzellantasse - 1 Stück; Erlenmeyerkolben (250 ml) - 2 Stk .; ein Thermometer; Vorrichtung zur Wasserdampfdestillation; Sandbad.
Strichsynthese:
Eine Mischung aus 5 g Phthalsäureanhydrid, 10 g Phenol und 2 ml Schwefelsäure wird in einen Kolben gegeben und 1,5 Stunden in einem Sandbad erhitzt, wobei eine Temperatur von 125-130ºC (ein Thermometer in der Schmelze und periodisches Mischen des Inhalts) genau eingehalten wird. Die heiße Mischung wird in einen Kolben mit 100 ml kochendem Wasser gegossen, mit Wasserdampf abdestilliert, nicht umgesetztes Phenol. Um ein Verspritzen und den damit verbundenen Substanzverlust zu vermeiden, muss die Flüssigkeit ständig gemischt werden. Das Ende der Destillation ist an der Änderung der Trübung des Destillats zu erkennen: Wenn die Destillation nicht klar verläuft, sollte die Destillation fortgesetzt werden. Wenn die Destillation transparent ist, kann die Destillation abgebrochen werden. Die Lösung wurde abkühlen gelassen, wonach sie auf einen Büchner-Trichter dekantiert wurde, wobei darauf geachtet wurde, den Niederschlag nicht auf den Filter zu übertragen. Dann wird das Produkt durch Dekantieren mit zwei kleinen Portionen kaltem Wasser gewaschen, das noch auf den Filter fallende auf die Masse des Feststoffs in einem Glas aufgeklebt, in einer kleinen Menge warmem 4-5% igem Natriumhydroxid gelöst und nicht umgesetztes Phthalsäureanhydrid durch Filtration abgetrennt. Das dunkelrote Filtrat wird mit Essigsäure versetzt, bis das Phenolphthalein vollständig ausgefällt ist, dann werden 1-2 Tropfen Salzsäure zugegeben und 1 Stunde stehen gelassen.
Das freigesetzte Phenolphthalein in Form von gelblichem Sand wird über einen Büchner-Trichter abgesaugt. Das Rohprodukt wird in ein Becherglas überführt und durch Erhitzen in ca. 10 ml Alkohol gelöst. Die heiße Lösung wird abgesaugt und der Filterkuchen mit heißem Alkohol gewaschen. Durch ein mit Alkohol angefeuchtetes Filter filtrieren, um Öltröpfchen zu entfernen. Das Filtrat wird in eine Porzellantasse überführt und in einem heißen Sandbad erhitzt, um einen wesentlichen Teil des Alkohols zu entfernen. Die Mischung in der Tasse wird 30 Minuten stehen gelassen. Die isolierten farblosen oder hellgelben Kristalle werden abgesaugt und zwischen Filterpapierbögen an der Luft getrocknet.
1.4.2 Physikalische Eigenschaften der bei der Synthese verwendeten Substanzen
Tabelle 1
Physikalische Eigenschaften der bei der Synthese verwendeten Substanzen
| Titel | Formula | aussehen | T pl, 0 ° C | T Ballen, 0 ° C | löslichkeit |
|
| Im Wasser | in einem anderen |
|||||
| Phenolphthalein | C 20 H 14 O 4 | Farblose oder sandfarbene Rhombennadeln, geruchlos, nicht luftbeständig | 261 | erhaben drängt sich zusammen | Schwer löslich (0,0002 g in 100 g Wasser) | Gutes Ethanol, mäßig in Diethylether, auch in alkalischen Lösungen löslich. |
| Phenol | C 6 H 5 OH | Farblose oder rosa rhombische Nadeln | 41-43 | 182 | Bei Kälte - mäßig In der heißen - gut | Gut in Ethanol, Ether, Chloroform, Glycerin, Schwefelkohlenstoff |
| Phthalsäureanhydrid | C 8 H 4 O 3 | Weiße rhombische Nadeln | 130,8 | Vozg 284.3 | schlecht | In Ethanol, Ether, Chloroform |
| Schwefelsäure | H 2 SO 4 | Farblose, viskose Flüssigkeit mit unangenehmem Geruch | 10,37 | 330 | | reagiert |
| Natriumhydroxid | NaOH | Weiße, verschwommene, rhombische Kristalle | 320 | 1378 | Mit Hitze löslich | In Alkohol, Glycerin, Phenol, Ether, Aceton |
| essigsäure | CH 3 COOH | Farblose Flüssigkeit mit stechendem unangenehmen Geruch | 16,6 | 118,1 | | In Ethanol Äther |
| Salzsäure | HCI | Gelbliche Flüssigkeit, raucht in der Luft, mit einem unangenehmen Geruch | -15,35 | - | ok | In Alkohol |
1.4.3 Methode der Wasserdampfdestillation
Da im Verlauf der Synthese nicht umgesetztes Phenol durch Wasserdampfdestillation abdestilliert werden muss, ist die Durchführung zu überlegen.
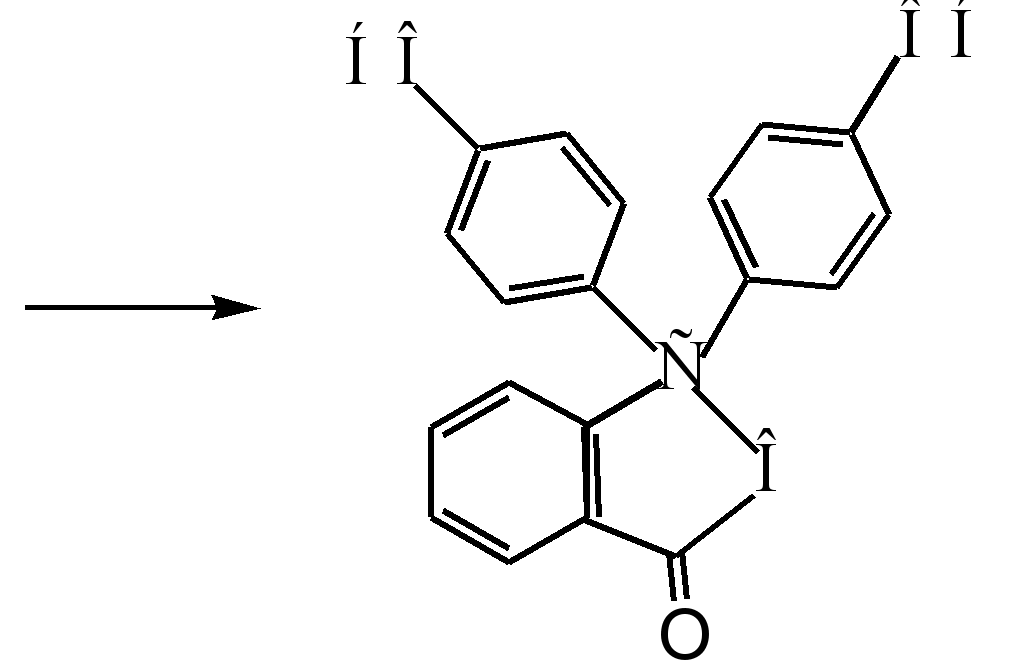
Die Destillation wird in einem Gerät durchgeführt, das aus einem Dampferzeuger mit Sicherheitsrohr, einem Kleisen-Destillationskolben (250 ml), einem Thermometer, einem Liebig-Direktkühlschrank, einem Allonge und einer Vorlage besteht. Ein Dampferzeuger und ein Destillationskolben, die durch ein T-Stück mit einem Verfahren verbunden sind, bei dem ein Gummischlauch mit einer Hoffman-Klammer angelegt wird, werden in einem Sandbad erhitzt.
Der Ablauf der Destillation (Destillation): Eine heiße Schmelze wird mit 100 ml kochendem Wasser in einen Destillationskolben gegeben. Durch Erhitzen eines Dampferzeugers und eines Destillationskolbens wird ein Destillat gesammelt, das nicht umgesetztes Phenol enthält. Die Trübung des Destillats zeigt seine Anwesenheit an. Die Destillation wird am Ende des Ablaufs der trüben Destillation gestoppt, dh bis eine transparente Destillation auftritt. 
1 Apparate zur Wasserdampfdestillation
1- Sicherheitsrohr; 2 - Dampfversorgungsleitung; 3 - tee; 4 - Klemme; 5 - Dampferzeuger; 6 - Kleisenflasche; 7 - Thermometer; 8 - Liebig Kühlschrank; 9 - allonge; 10 - Empfänger; 11 - Mantelheizung; 12 - Fliese.
1.4.4 Verfahren zur Umkristallisation aus heißem Alkohol
Die Umkristallisation wird experimentell wie folgt durchgeführt: Die Substanz wird in einen Rundkolben gegeben und mit etwas Lösungsmittel versetzt. Die Mischung wird in einem auf einer Fliese erhitzten heißen Wasserbad unter Rückfluß erhitzt.
Die meisten Flüssigkeiten neigen zur Überhitzung und kochen daher mit starken Stößen. Um dies zu vermeiden, werden vor dem Erhitzen Kessel in den Kolben eingeführt.Das Lösungsmittel wird allmählich in kleinen Portionen durch einen Rückflusskühler zugegeben, bis die Substanz vollständig gelöst ist.
Nach vollständiger Auflösung der Substanz wird die Erwärmung gestoppt und die Mischung zusammen mit Wasser im Bad abkühlen gelassen. Die ausgefallene Substanz wird abfiltriert.
In den meisten Fällen ist eine zweistufige Rekristallisation eine zuverlässige Methode zur Reinigung einer Substanz. 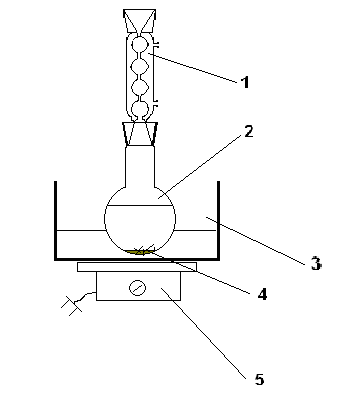
Abb.2 Rekristallisationsgerät
1-Rückflusskühler; 2 - Rundkolben; 3 - Wasserbad; 4 - Kessel; 5 - Fliese.
1.5 Synthesesicherheit
1.5.1 Allgemeine Gefahren beim Arbeiten mit konzentrierten Säuren
1. Starke anorganische Säuren verursachen bei Hautkontakt Verätzungen.Bei Verätzungen durch konzentrierte Säuren auf der Haut wird die verbrannte Stelle mit einem starken Wasserstrahl und anschließend mit einer 1% igen Natriumbicarbonatlösung (im Medizinschrank) gewaschen. Falls Säure in die Augen gelangt, sofort mit 1% iger Natriumhydrogencarbonatlösung und destilliertem Wasser bei Raumtemperatur ausspülen. Bitten Sie einen Arzt um Hilfe.
2. Angesichts der Tatsache, dass konzentrierte Salzsäure mit Chlorwasserstoff aufsteigt, ist es notwendig, mit dieser unter einem gut funktionierenden Zug und einem etwas tieferen Zugvorhang zu arbeiten. Bei Vergiftung mit Chlorwasserstoffdämpfen ist es notwendig, sofort an die frische Luft zu gehen.
3. Verschüttete Säure muss in Sand getaucht und mit festem Natriumcarbonat neutralisiert werden, bis die Gasentwicklung aufhört. Nach vollständiger Neutralisation den Sand mit viel Leitungswasser abspülen, auf Vollständigkeit prüfen (Cl - mit AgNO 3 testen) und nach dem Trocknen im Ofen wieder in den Sandkasten legen.
1.5.2 Hauptgefahren bei der Wasserdampfdestillation
Die Hauptrisiken während der Destillation sind mit der Verwendung von elektrischen Heizgeräten (Elektroherde, Mäntel) verbunden.1. Kabel (Fliesen mit einem Kabel dürfen nicht in Lappenwicklungen verwendet werden), der Stecker und der Ofenkörper dürfen keine sichtbaren Schäden aufweisen.
2. Verwenden Sie nicht Ihre Hände, um die Temperatur der wärmeabgebenden Oberfläche zu überprüfen.
3. Schalten Sie den Ofen aus dem Netzwerk ein und aus, indem Sie den Stecker einstecken und herausziehen, wobei eine Hand die Steckdose und die andere den Stecker hält. Verwenden Sie den Schalter, um die Heizung einzustellen.
4. Im Falle einer thermischen Verbrennung ist es notwendig, lange Lotionen der verbrannten Stelle mit einer 0,5% igen Lösung von Kaliumpermanganat herzustellen, diese dann mit einem sterilen Verband zu verschließen und einen Arzt aufzusuchen. Bei Verbrennungen von 3 und 4 Grad sofort einen sterilen Verband anlegen und einen Arzt aufsuchen.
1.5.3 Hauptgefahren bei der Umkristallisation aus heißem Alkohol
1. Das Gesamtvolumen des eingegossenen Alkohols sollte 200 ml nicht überschreiten und nicht mehr als 1/3 des Kolbenvolumens einnehmen.2. Das Wasserbad sollte größer sein als die wärmeabstrahlende Oberfläche der Fliese.
1.5.4 Merkmale der Arbeit mit in der Synthese verwendeten Substanzen
Die meisten Chemikalien sind mehr oder weniger giftig. Vorsichtsmaßnahmen bei der Arbeit mit ihnen sollen verhindern, dass diese Stoffe über Mund, Lunge und Haut in den Körper gelangen.Während der Synthese werden potenziell gefährliche Substanzen verwendet: Phenol, Schwefelsäure, Essigsäure und Salzsäure.
Phenol ist eine farblose (rosa), kristalline Substanz mit einem charakteristischen Geruch. MAC in der Luft der Arbeitszone 0,3 mg / m 3. Die Gefahrenklasse ist an zweiter Stelle. Alle Arbeiten mit Phenol werden in einem Abzug durchgeführt. Toxische Wirkung: Nervengift, hat eine starke lokale Reiz- und Ätzwirkung, die zu einer allgemeinen schweren Vergiftung führt. Mögliches tödliches Ergebnis. Die Situation wird dadurch erschwert, dass die Substanz eine Lokalanästhesie verursacht. Erste Hilfe: Wenn es mit Kleidung in Berührung kommt, wechseln Sie es sofort aus, wenn es mit der Haut in Berührung kommt, waschen Sie es mit Pflanzenöl oder einer Lösung mit einem Massenanteil an Ethanol von 10 - 40% ab.
Salzsäure gehört zur zweiten Gefahrenklasse (MPC in der Luft des Arbeitsbereichs 5 mg / m 3 in Bezug auf HCl), alle Arbeiten mit konzentrierter Salzsäure sollten auch im Abzug durchgeführt werden, da Chlorwasserstoffdampf freigesetzt wird. Bei Vergiftung mit Chlorwasserstoffdämpfen muss an die frische Luft gegangen werden, andere Gefahren sind oben angegeben.
Schwefelsäure ( \u003d 1,84 g / cm 3) - MPC pz \u003d 1 mg / m 3. Die Gefahrenklasse ist an zweiter Stelle. Nach ca. 5 Sekunden beginnt die energetische Dehydration des Gewebes, wobei der Tropfen abfällt. Erste Hilfe: Haut mit fließendem Wasser abspülen und anschließend neutralisieren.
Essigsäure - MPC rz \u003d 5 mg / m 3. Gefahrenklasse Drei 7. Dämpfe reizen die oberen Atemwege, Lösungen mit einem Massenanteil des Stoffes von über 30% wirken auf die Haut und über 2% auf die Augen. Erste Hilfe: (siehe Schwefelsäure und Salzsäure).
1.6 Charakterisierung von Lösungsmitteln
Einen besonderen Stellenwert bei der Charakterisierung von Lösungsmitteln nimmt die Dielektrizitätskonstante ein. Der Vorteil des letzteren gegenüber anderen Kriterien hängt mit der Einfachheit elektrostatischer Solvatisierungsmodelle zusammen, und daher ist die Dielektrizitätskonstante ein nützliches Maß für die Lösungsmittelpolarität geworden. In diesem Zusammenhang ist es wichtig zu wissen, was genau die makroskopische Permeabilität des Lösungsmittels, auch relative Permittivität genannt, widerspiegelt:
r = 0 /
0 ist die Dielektrizitätskonstante des Vakuums.
Die Dielektrizitätskonstante wird bestimmt, indem ein Lösungsmittel zwischen zwei geladene Platten des Kondensators gegeben wird. In Gegenwart eines Lösungsmittels nimmt das elektrische Feld zwischen den Platten E im Vergleich zu der im Vakuum gemessenen Spannung E 0 ab, und das Verhältnis E 0 / repräsentiert die Dielektrizitätskonstante des Lösungsmittels. Wenn die Lösungsmittelmoleküle kein eigenes konstantes Dipolmoment haben, trennen sich unter dem Einfluss eines externen Feldes die intramolekularen Ladungen und induzieren einen Dipol.
In einem elektrischen Feld sind Moleküle mit einem konstanten oder induzierten Dipol auf eine bestimmte Weise ausgerichtet; Dieses Phänomen nennt man Polarisation. Je höher der Polarisationsgrad ist, desto stärker nimmt die elektrische Feldstärke ab. Daher steht die Dielektrizitätskonstante in direktem Zusammenhang mit der Fähigkeit des Lösungsmittels, Ladungen abzutrennen und seine eigenen Dipole zu orientieren.
1.6.1 Einstufung von Lösungsmitteln nach physikalischen Eigenschaften.
Die Dielektrizitätskonstante (DP) der Lösung e ist einer der wichtigsten Faktoren, die die Eigenschaften eines Prozesses in einer Lösung am stärksten beeinflussen.
Die DP-Werte der einzelnen Lösungsmittel variieren in einem sehr signifikanten Bereich - von 1,8 1,8 (Alkanen) bis 170-180 (N-Alkylamiden aliphatischer Carbonsäuren). Die der Einstufung von Lösungsmitteln nach DP zugrunde liegende Terminologie ist nicht in allen Punkten definiert und konsistent. Lösungsmittel mit hohem DP werden als polar bezeichnet und sogar hoch polar, obwohl sich der Begriff „polar“ streng genommen auf das Dipolmoment µ des Lösungsmittelmoleküls bezieht, dh nicht die Makro-, sondern die Mikroeigenschaften des Lösungsmittels charakterisiert.
Wie sich jedoch aus der Theorie ergibt, die mit µ verknüpft, kommt es im allgemeinen Fall zu einer symbolischen Änderung dieser Größen. Um Lösungsmittel durch die Anwesenheit oder Abwesenheit eines Dipolmoments in ihren Molekülen zu charakterisieren, wird zusätzlich die Terminologie "Dipol" (µ (0) und "unpolare" (u \u003d 0) Lösungsmittel.
Lösungsmittel, deren DP im Bereich \u003d 1, 8h12 liegt, werden als niedrigpolar eingestuft, Lösungsmittel mit \u003d 12h50 sind mittelpolar und \u003e 50 sind hochpolar, diese Einteilung hängt nicht nur und nicht so sehr mit diesen eher zufällig ausgewählten Intervallen zusammen, sondern auch in einem viel bedeutenderen Umstand.
Trotz des durch die Theorie eindeutig festgestellten Zusammenhangs zwischen dem DP und dem Dipolmoment einer einzelnen Flüssigkeit ist von einer kategorisch eindeutigen Parallelität der Größen und μ abzusehen . Tatsache ist, dass die antiparallele (aber nicht kettenförmige) Assoziation von Dipolen zu einer Abnahme des Dipolmoments von Assoziaten im Vergleich zum Dipolmoment eines einzelnen Moleküls und folglich zu einem Abfall des flüssigen DP führt. Aus diesem Grund kann der DP von Flüssigkeiten, die von Molekülen mit einem relativ großen Dipolmoment gebildet werden, ziemlich niedrig sein.
Ein signifikanter Einfluss auf die Polarität des Lösungsmittels wird durch seine strukturellen Merkmale ausgeübt. Strukturierte Lösemittel haben in der Regel einen hohen DP.
Die Dielektrizitätskonstante ist neben der Bildung homomolekularer chemischer Bindungen einer der wichtigsten Faktoren, die die Eigenschaften einzelner Flüssigkeiten bestimmen, die von der Energie der intermolekularen Wechselwirkung abhängen. Letzteres wird durch die reaktive Wechselwirkung bestimmt, deren Energie von der statischen DP () abhängt, die DP auf eine unendlich lange Wellenlänge ( ) extrapoliert und mit? 1,1 n D sowie das Dipolmoment µ und das Molvolumen?
E R \u003d 
Die Energien der reaktiven Wechselwirkung von Dipolmolekülen einer Reihe von Lösungsmitteln sind in Tabelle 1 angegeben.
Wie MI Shakhparonov betont, führt das reaktive Feld polarer Moleküle nicht zur Bildung chemischer Strukturen (homomolekularer Assoziate), deren Existenz durch chemische Wechselwirkungen bestimmt wird. Die Stabilität der letzteren nimmt mit zunehmender Blindfeldenergie ab.
Die reaktive Feldenergie erklärt eine Reihe physikalischer Merkmale von Lösungsmitteln. Daher kann es nützlich sein, Lösungsmittel nach ihrem Wert zu klassifizieren - Äh .
Offensichtlich bilden alle Lösungsmittel, deren Moleküle kein Dipolmoment aufweisen, eine Klasse von nicht reaktiven Lösungsmitteln flüssigkeiten. Lösungsmittel mit Blindleistung im Bereich - Äh = 0h5 kJ · mol -1 bilden eine niedrigreaktive Klasse, im Bereich Er \u003d 5ch15 kJ mol -1 mittelreaktiv und schließlich bilden Lösungsmittel mit -E R ≤ 25 kJ · mol -1 eine Klasse hochreaktive Lösungsmittel.
Hochreaktive Flüssigkeiten lösen in der Regel sowohl Nichtelektrolyte als auch Elektrolyte gut auf und diese dissoziieren in ihnen besser als andere Klassen (nach diesem Klassifizierungssystem) von Lösungsmitteln. Dies erklärt sich aus der Tatsache, dass hochreaktive Lösungsmittel hohe DP- und Dipolmomente kombinieren.
Tabelle 2
Die reaktive Energie einiger Lösungsmittel bei 298,15 K.
| Lösungsmittel | -ER, kJ · mol & supmin; ¹ | lösungsmittel | -ER, kJ · mol & supmin; ¹ |
| Anilin | 2,9 | Methylethylketon | 3,4 |
| Aceton | 9,1 | Ameisensäure | 5,2 |
| Acetonitril | 20,9 | Nitrobenzol | 17,1 |
| Butylalkohol | 2,9 | Nitromethan | 17,5 |
| Wasser | 18,6 | Pyridin | 5,7 |
| Hexen 1 | 0,15 | Propylencarbonat | 43,8 |
| N, N-Dimethylacetamid | 15,8 | Propylalkohol | 3,6 |
| Dimethylsulfoxid | 6,4 | Toluol | 0,05 |
| Dimethylformamid | 19,5 | Essigsäure | 3,7 |
| Dioxan | 0,07 | Tetrahydrofuran | 2,9 |
| 1,2-Dichlorethan | 4,2 | Chlorbenzol | 1,8 |
| über - Xylol | 0,12 | Ethylacetat | 2,45 |
| n-Xylol | 0,05 | Ethylenglykol | 8,9 |
| N-Methylacetamid | 24,1 | Ethylalkohol | 4,7 |
| Methylformiat | 4,0 |
Nach Viskosität (genauer gesagt nach Viskositätskoeffizient ) flüssigkeiten werden in niedrigviskose mit 10 -2 Pa · s unterteilt.
Leitfähigkeit Flüssigkeiten werden mit in „leitfähige“ Flüssigkeiten unterteilt ungefähr 10 2 - 10 –1 cm · m –1 und darüber; "Mäßig leitend" - mit etwa 10 -1 - 10 -4 und mit 10 -4 cm · m -1 wird als "nicht leitend" bezeichnet.
Erwähnt wird auch die Klassifizierung von Lösungsmitteln nach Siedepunkt, bei der Lösungsmittel in Leichtsieder (1 50 0 С) eingeteilt werden.
Für die Klassifizierung von Lösungsmitteln nach ihrer Verdunstungsfähigkeit wird eine relative Skala vorgeschlagen, die auf den Verdunstungswärmen basiert. Daher werden flüchtige (relative Flüchtigkeit 35) Lösungsmittel unterschieden. Wenn wir uns direkt auf die Verdampfungswärme konzentrieren, dann sollten den flüchtigen Lösungsmitteln durch die Verdampfungswärme charakterisierte Lösungsmittel zugeschrieben werden Tabelle 3
Klassifizierung von Lösungsmitteln nach Dielektrizitätskonstante
| STARK POLAR |
|||
| LÖSUNGSMITTEL |  r r | LÖSUNGSMITTEL | r |
| Wasser | 78,30 | DMF | 36,71 |
| Ethylenglykol | 37,7 | Benzonitril | 26,20 |
| Methanol | 32,66 | Nitrobenzol | 34,78 |
| DMSO | 46,45 | Glycerin | 51,7 |
| SCHWACH POLAR |
|||
| THF | 7,58 | Essigsäureanhydrid | 20,7 |
| Diethylether | 4,20 | Butanon - 2 | 18,51 |
| Aceton | 20,70 | Pentanon - 2 | 15,38 |
| Ethanol | 24,55 | Pyridin | 12,91 |
| Essigsäure | 6,17 | Methylacetat | 6,68 |
| Propanol - 1 | 20,45 | Cyclohexanon | 16,10 |
| Butanol - 1 | 17,51 | Quinalin | 8,95 |
| Isoamylalkohol | 15,19 | Chloroform | 4,81 |
| Anilin | 6,71 | Amylalkohol | 13,9 |
| Unpolar |
|||
| 1,4 - Dioxan | 2,21 | Cyclohexan | 2,02 |
| Trichlorethylen | 3,42 | N - Pentan | 1,84 |
| Benzol | 2,27 | Schwefelkohlenstoff | 2,64 |
| Toluol | 2,38 | Diethylamin | 3,78 |
| Tetrachlormethan | 2,23 | diethylcarbonat | 2,82 |
| Triethylamin | 2,42 | ||
| n - Heptan | 1,92 | ||
| n - Hexan | 1,88 | ||
1.6.2 Lösuauf der Grundlage ihrer chemischen Eigenschaften
Die meisten Systeme zur Klassifizierung von Lösungsmitteln nach chemischen Eigenschaften in expliziter oder impliziter Form berücksichtigen deren Säure-Base-Eigenschaften. Aus diesem Grund besteht das gängigste System zur Klassifizierung von Lösungsmitteln darin, sie in zwei große Klassen zu unterteilen - Donor
(basisch) und Akzeptor (sauer), deren Definition offensichtlich die Zuordnung einer anderen Klasse von indifferenten Lösungsmitteln vorgibt. Die Bedingung, jedes einzelne Lösungsmittel als eine dieser Klassen zu klassifizieren, hängt von den Eigenschaften sowohl des Lösungsmittels als auch der gelösten Verbindung ab, schon allein deshalb, weil das Lösungsmittelmolekül ein Elektronenpaar von einem Partner abgeben oder empfangen kann. Aus diesem Grund liefert diese Klassifizierung das charakteristische Verhalten eines Lösungsmittels bei Reaktionen oder Solvatisierungsprozessen.
Ein gemeinsames Merkmal von Donorlösungsmitteln ist die vorherrschende Solvatisierung von Kationen als Teilchen, die durch Elektronenmangel gekennzeichnet sind. In ähnlicher Weise solvatisieren Akzeptorlösungsmittel überwiegend Anionen als Teilchen mit einem Überschuss an Elektronen.
Die Vielfalt der Donatorlösungsmittel wird durch die relativ große Anzahl der Elemente, deren Atome als Donatoren des Elektronenpaares fungieren können, und die Vielfalt der chemischen Verbindungen dieser Elemente bestimmt. Vertreter dieser Klasse von Lösungsmitteln werden daher in N-Basen (Amine oder Amide verschiedener Arten), 0-Basen (Ether und Ester, Alkohole, Ketone, seltener Aldehyde), S-Basen (Thioether, Thioalkohole, Sulfoxide), P-Basen unterteilt (Trialkyl-, Triaryl- oder Alkylarylphosphine) und dergleichen.
Akzeptorlösungsmittel werden in protische unterteilt und aprotisch.
Lösungsmittel, die in Abhängigkeit von ihrer Funktion am protolytischen Gleichgewicht teilnehmen können, werden oft als protophil (basisch) und protogen bezeichnet (sauer). Lösungsmittel, die beide Funktionen (Alkohole, Ketone) gleichermaßen bereitwillig ausüben, werden als amphiprotisch bezeichnet.
Die Moleküle vieler Lösungsmittel sind an der Solvatisierung durch Bildung einer Wasserstoff- (H-) Bindung beteiligt. Demgemäß wird eine Klassifizierung von Lösungsmitteln nach ihrer Fähigkeit zur Bildung einer H-Bindung vorgeschlagen.
Die erste Klasse in diesem Klassifizierungssystem besteht aus Flüssigkeiten, in denen ein dreidimensionales Netzwerk von H-Bindungen existiert. Lösungsmittel dieser Klasse (Wasser, Ameisensäure, Schwefelsäure, Glykole) zeichnen sich durch einen sehr hohen DP und eine relativ hohe Viskosität und Aktivierungsenergie eines viskosen Flusses aus. Lösungsmittel dieser Klasse lösen sich in der Regel gut ineinander und bilden über die H-Bindung heteromolekulare Assoziate.
Die zweite Klasse sind Flüssigkeiten mit einem zweidimensionalen Netzwerk von H-Bindungen. Lösungsmittelmoleküle dieser Klasse enthalten in der Regel eine Hydroxylgruppe (einwertige Alkohole, einbasige Carbonsäuren, Phonole usw.). Der Wunsch, heteromolekulare Assoziate in dieser Gruppe von Lösungsmitteln zu bilden, ist im Allgemeinen weniger ausgeprägt als bei Vertretern der ersten Klasse.
Die dritte Klasse vereint Flüssigkeiten, deren Moleküle Stickstoff-, Sauerstoff-, Schwefel-, Fluoratome usw. umfassen, die mit Protonendonatoren eine H-Bindung eingehen können. Ether, Amine, Ketone, Aldehyde usw. sind in dieser Klasse enthalten.
Die vierte Klasse umfasst Flüssigkeiten, deren Moleküle Protonendonoren sein können. Dazu gehören Chloroform, Dichlorethan usw.
Die fünfte Klasse kombiniert Flüssigkeiten, deren Moleküle unter normalen Bedingungen nicht an der Bildung einer H-Bindung teilnehmen können. Diese Gruppe umfasst Alkane, Tetrachlorkohlenstoff, Perhalogenalkane usw.
Parker schlug vor, Lösungsmittel nach ihrer Fähigkeit zur Solvatisierung von Ionen zu klassifizieren. In dieser Klassifizierung werden Lösungsmittel in Gruppen eingeteilt.
Apolare aprotische Flüssigkeiten mit niedrigem DP (
Dipolare aprotische Flüssigkeiten mit relativ hohen DP-Werten (\u003e 15) und Dipolmomenten (μ\u003e 2D) ,
kein Wasserstoff enthaltend, der eine H-Bindung bilden kann. Vertreter dieser Gruppe von Lösungsmitteln sind Schwefeldioxid, Nitrobenzol, Nitromethan, Acetonitril, Propylencarbonat, DMSO usw.
Protonische Flüssigkeiten, deren Moleküle Gruppen enthalten, in denen das Wasserstoffatom mit einem elektronegativen Atom verbunden ist. Zu dieser Gruppe gehörende Verbindungen (Carbonsäuren, Alkohole, Phenole usw.) zeichnen sich durch eine ausgeprägte Fähigkeit zur Bildung einer H-Bindung aus.
Das Lösungsvermögen von Lösungsmitteln nimmt im Allgemeinen von der ersten zur dritten Gruppe zu.
Bronsted schlug vor, Lösungsmittel anhand einer Kombination aus Permittivität und Protogenität zu klassifizieren. Entsprechend diesen Eigenschaften teilte er die Lösungsmittel in acht Gruppen ein.
Beispiele für Lösungsmittel verschiedener Gruppen im Rahmen der Bre'nsted-Klassifikation sind: I - Wasser, II - Schwefelsäure, Ameisensäure, III - Hydrazin, DMSO, IV - Propylencarbonat, Nitrobenzol, Acetonitril, Nitromethan, V - Butanol, VI - flüssiges Brom und Iodwasserstoff, VII-Triethylamin, Pyridin, VIII-Hexan, Chlorbenzol.
Die Bronsted-Klassifikation ermöglicht es uns, die Säure-Base-Eigenschaften von gelösten Verbindungen in den Lösungsmitteln jeder Gruppe vorherzusagen. So ist in einem Lösungsmittel der Gruppe II die Festigkeit der Basen deutlich höher als in einem Lösungsmittel der Gruppe III; Die Säurestärke in Lösungsmitteln der Gruppe III ist im Allgemeinen höher als in Lösungsmitteln der Gruppe VII usw.
Tabelle 4
Lösungsmittelklassifizierung nach Bronsted.
| Eigentum | Lösungsmitteltyp |
|||||||
| Ich | II | III | IV | V | VI | VII | VIII |
|
| Dp | + | + | + | + | - | - | - | - |
| Protogenität | + | + | - | - | + | + | - | - |
| Reichlich | + | - | + | - | + | - | + | - |
* Die Vorzeichen + und - in der ersten Zeile entsprechen dem hohen und niedrigen AP, in den übrigen Zeilen dem Vorhandensein oder Fehlen dieser Eigenschaft.
Eine Klassifizierung von Lösungsmitteln wird ebenfalls vorgeschlagen, basierend auf acht physikalischen Eigenschaften: der Kirkwood-Funktion, der molaren Brechung, dem Hildebrand-Löslichkeitsparameter, dem Brechungsindex, dem Siedepunkt, dem Dipolmoment sowie den Energien von höher gefüllten und niedriger ungefüllten Molekülorbitalen. Durch die Kombination dieser Eigenschaften wird vorgeschlagen, die Lösungsmittel in neun Gruppen zu unterteilen:
1) aprotisch dipolar (zum Beispiel Acetonitril, Nitromethan, Aceton, 1,2-Dichlorethan);
2) aprotisch hoch dipolar (DMSO, DMF, DMAA, Propylencarbonat, Nitrobenzol);
3) aprotisch, stark dipolar und stark polarisierbar (Sulfolan, HMPA);
4) aromatisches unpolares (Benzol, Toluol);
relativ polarer Aromat (Chlorbenzol, o-Dichlorbenzol, Acetophenon);
Elektronendonor (Triethylamin, Ether, Dioxan);
H-Bindungslösungsmittel (Alkohole, Carbonsäuren);
stark assoziierte Lösungsmittel mit einer H-Bindung (Formamid,
diethylenglykol, Wasser);
Lösungsmittel mit undefinierter Funktion (Schwefelkohlenstoff, Chloroform).
1.7 Übersicht über Löslichkeitsfeststoffe
1.7.1 Gravimetrische Löslichkeitsbestimmung
Das Verfahren besteht darin, die Masse eines Stoffes zu bestimmen, der in einer bestimmten Masse Lösungsmittel gelöst ist (spezifische Löslichkeit P ` ) und die Berechnung der Löslichkeit als Masse einer Substanz, die sich in 100 g eines bestimmten Lösungsmittels lösen kann. Die Methode ist eine Bewertung.Auf einer technochemischen Waage wird eine Probe der Testsubstanz gewogen (g 1) ` ) Das Lösungsmittel wird gewogen (g p). Die trockene Filtermasse (g 2) wird bestimmt. Gießen Sie eine Probe der Substanz in das Lösungsmittel. Wenn die Substanz vollständig aufgelöst ist, muss sie hinzugefügt werden, bis die Auflösung aufhört. Notieren Sie die vollständige Probe der Substanz, die in das Lösungsmittel gegossen wurde (g 1). Unlösliches durch den Filter herausfiltern und die Masse des Nassfilters mit Restsubstanz (g 3) bestimmen. Trocknen Sie den Filter mit Restmaterial bis zur Gewichtskonstanz (g 4). Berechnen Sie die spezifische Löslichkeit mit der Formel:
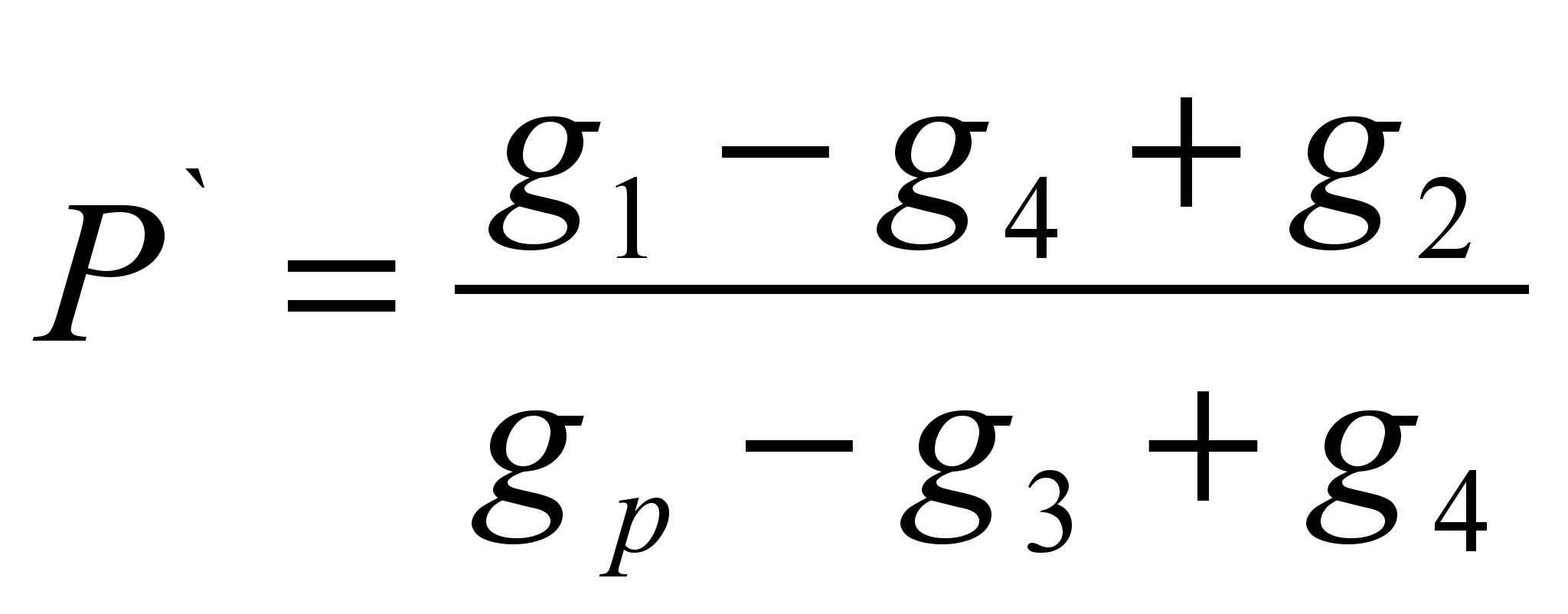
P \u003d P'100 (g / 100 g)
Tabelle 5
Löslichkeit von Phenolphthalein in einigen Lösungsmitteln
| lösungsmittel | löslichkeit | r |
| Sehr polar |
||
| Wasser | 0,0002 | 78,30 |
| Methylalkohol | 19,42 | 52,66 |
| Schwach polar |
||
| Ethylalkohol | 17,29 | 24,55 |
| Aceton | 16,98 | 20,70 |
| chloroform | 2,97 | 4,81 |
| Nicht polar |
||
| xylol | 0,19 | 2,43 |
| toluol | 0,17 | 2,38 |
| benzol | 0,16 | 2,27 |
1.7.2 Elektrochemisches Verfahren.
1. Bauen Sie die Anlage zusammen, um den Widerstand des Volumens der Elektrolytlösung gemäß dem Schema zu bestimmen (siehe Abb. 3).
2. Eine wässrige Lösung von Kaliumchlorid einer bestimmten Konzentration wird bis zur Marke in das Messgefäß gegossen und das Gefäß mit den Elektroden im Thermostat auf einer bestimmten Temperatur gehalten. Schließen Sie das Gefäß nach 15-20 Minuten an den Punkten B und D an die Anlage an.
3. Mit dem Widerstandsspeicher und dem beweglichen Kontakt C wird die Brücke ausbalanciert und erreicht entweder den kleinsten Ton im Telefon oder die minimale Amplitude der Sinuswelle auf dem Bildschirm des Oszilloskops. Der Kompensationspunkt wird entweder von einem Ende des Rechords oder von dem anderen angefahren. Messung und anschließende Berechnung von R x:
R x \u003d R 1 
Wiederholen Sie 3-4 mal bei verschiedenen Widerständen R 1. Der bewegliche Kontakt sollte sich nicht den Enden des Akkords nähern. Wenn die Abweichungen bei den Messungen weniger als 0,5% betragen, werden die Ergebnisse als zufriedenstellend angesehen und beginnen mit der Berechnung des konstanten Gefäßes nach der Formel:
K \u003d  /
w =
R x
/
w =
R x
Wobei R x der Widerstand der Lösung ist; -
elektrische Leitfähigkeit.
4. Eine kleine Menge Salz wird in 100 ml Wasser gegossen und der Kolben mit einem Stopfen fest verschlossen und 20 Minuten lang kontinuierlich geschüttelt. Die entstandene Suspension wird über ein Glasfilter abgesaugt und aus dem Niederschlag eine gesättigte Lösung hergestellt. Die resultierende Lösung wird in ein Gefäß zum Messen der elektrischen Leitfähigkeit gegossen und nach dem Temperieren wird der Widerstand der Lösung gemessen.
=
k /
R x  = /
C
= /
C
Wobei C die Normalität der Lösung ist, kg Äq / m 3.
Da die Salzkonzentration in der gesättigten Lösung niedrig ist, ist \u003d . Basierend auf der Gleichung:
C \u003d ( p - in ) /
Wo p - die elektrische Leitfähigkeit der Salzlösung.
Löslichkeitsprodukt für einwertigen Elektrolyten:
![]() = (C ) 2
= (C ) 2
6. Die Ergebnisse sind in der Tabelle aufgeführt:
| salz | t, C 0 | cm / m | Widerstand, Ohm | K | | | C | L |
|||
| R 1 | R 2 (AC) | R 3 (CB) | R x |
||||||||
Tabelle 6
Leitfähigkeit der KCI-Lösung
| t, C 0 | 1 N KCl | 0,1 N | 0,02 N | 0,01 N |
| 10 4, Ohm -1 cm -1 |
||||
| 0 | 654,1 | 71,5 | 15,21 | 7,76 |
| 10 | 831,9 | 93,3 | 19,94 | 10,20 |
| 14 | 906,3 | 102,5 | 21,93 | 11,21 |
| 16 | 944,1 | 107,2 | 22,94 | 11,73 |
| 18 | 982,2 | 111,9 | 23,97 | 12,25 |
| 20 | 1020,7 | 116,7 | 25,01 | 12,78 |
| 22 | 1055,4 | 121,5 | 26,06 | 13,32 |
| 24 | 1098,4 | 126,4 | 27,12 | 13,86 |
| 25 | 1118,0 | 128,8 | 27,65 | 14,13 |
| 26 | 1137,7 | 131,8 | 28,19 | 14,41 |
| 28 | 136,2 | 29,27 | 14,96 |
|
| 30 | 141,2 | 30,36 | 15,52 |
|
| 32 | 146,2 | 31,46 | 16,09 |
|
| 34 | 151,3 | 32,56 | 16,67 |
|
| 36 | 156,4 | 33,68 | ||
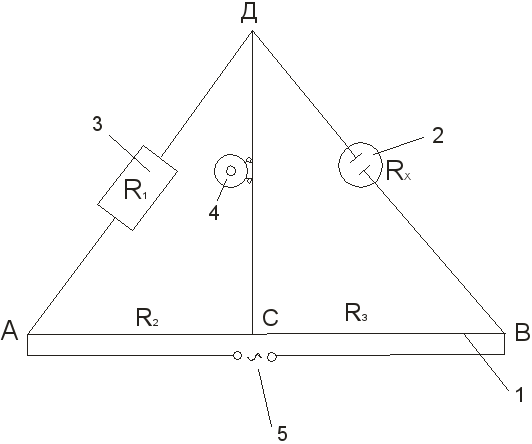
Abb.3 Installationsschema zur Bestimmung der elektrischen Leitfähigkeit:
1 - Draht auf einem Lineal gespannt; 2 - Messgefäß mit Elektroden; 3 - Rheostat; 4 - niederohmiges Telefon; 5 - Stromquelle.
1.7.3
Photoelektrokalometrisches Verfahren.
Das Verfahren basiert auf dem Gesetz der Additivität der optischen Dichte, das dem Grundgesetz der Lichtabsorption unterliegt.
Arbeitsfortschritt
1. Die Auswahl der optimalen Filter.
1.1. In einen 25 ml Messkolben geben:
Mischen Sie Lösungen und messen Sie die optischen Dichten in Bezug auf das ausgewählte Lösungsmittel an verschiedenen Filtern in den dafür am besten geeigneten Küvetten. Die Größe der Zelle wird angezeigt. Die Arbeitsweise bei der FEC finden Sie im Instrumentenpass.
1.2. Tragen Sie die empfangenen Daten in die Tabelle ein:
1.3. Erstellen Sie auf Millimeterpapier Lichtabsorptionskurven A \u003d f (, nm) und bestimmen Sie, welche Filter mit welchen Wellenlängen im Betrieb am besten verwendet werden.
2. Charting.
2.1. Bereiten Sie eine Reihe von Standardlösungen vor. Messen Sie die optische Dichte jeder vorbereiteten Serie von Standardlösungen mit zuvor ausgewählten Filtern.
2.2. Geben Sie die experimentellen Daten für jede Reihe von Lösungen separat in die Tabelle (siehe unten) ein und führen Sie eine statistische Verarbeitung der Ergebnisse durch.
2.3. Zeichnen Sie mit Hilfe von tabellarischen Daten auf Millimeterpapier die Diagramme A \u003d f (C der Substanz) und berechnen Sie die Löslichkeit von Phenolphthalein in Lösungsmitteln.
Nach dem Studium der Literatur zur Löslichkeit von Phenolphthalein wurden die oben genannten Methoden ausgewählt. Und verglichen mit ihnen für die Möglichkeit der Anwendung unter unseren Laborbedingungen, für die Dauer des Tests, für die Einfachheit der Ausführung wurde die Methode zur gravimetrischen Bestimmung der Löslichkeit gewählt.
2. Der experimentelle Teil
2.1 Synthese von Phenolphthalein
Die Synthese wurde gemäß der in der Literaturübersicht angegebenen Methode (Abschnitt 1.4.1) durchgeführt.
| Aktion | beobachtung |
| 1. Beantwortet: 5 g Phthalsäureanhydrid | Weißes kristallines Pulver Rosafarbene, verschwommene Kristalle |
| 2. Ich legte die Reagenzien in einen Erlenmeyerkolben mit flachem Boden (pro 100 ml) und rührte sie mit einem Thermometer. | Es bildet sich eine matschige Masse, es kommt zu einer leichten Erwärmung der Mischung (t? 37 0 C). |
| 3. Stellen Sie den Kolben in ein beheiztes Sandbad (Temperatur zwischen 125 und 130 ° C). 1,5 Stunden erhitzt. | Bei einer Temperatur von 45 ° C schmilzt Phenol, Phthalsäureanhydrid (weiße Flocken) schwimmt in einer bräunlichen Schmelze. Nach 30-minütigem Erhitzen (~ 130 ° C) bildete sich eine gleichmäßige Braun-Himbeer-Schmelze. Nach 1 Stunde Erhitzen - eine homogene Schmelze von blutroter Farbe. Nach 1,5 Stunden hörte das Erhitzen auf. |
| 4. Heiße Schmelze mit kochendem Wasser in einen Kolben gießen und nicht umgesetztes Phenol mit Wasserdampf abdestillieren (Einbauzeichnung siehe entsprechenden Abschnitt der Literaturübersicht). | Nach dem Eingießen von heißer Schmelze in einen Kolben mit kochendem Wasser begannen hellgelbe Phenolphthaleinstücke zu schwimmen, eine leichte Trübung des Wassers tritt auf, t? Es erfolgt eine trübe Destillation (V \u003d 50 ml). Nach 15 Minuten Destillation begann ein klares Destillat zu tropfen. |
| 5. Dekantiere die Lösung mit Phenolphthalein in den Büchner-Trichter, ohne den Niederschlag auf den Filter zu übertragen. Der Niederschlag wurde mit drei Portionen kaltem Wasser von jeweils 100 ml gewaschen. | Die Temperatur der Lösung beträgt 26 ° C, in der Lösung (170 ml) körnerartige Phenolphthaleinstücke, leicht gelblich. |
| 6. Das filtrierte Phenolphthalein wird in 15 ml einer warmen Natriumhydroxidlösung (& alpha; \u003d 5%) gelöst. | T NaOH \u003d 42 ° C, es trat eine Färbung der Lösung auf - eine dunkelrote Farbe. |
| 7. Es wurde eine Filtration einer dunkelroten Lösung durchgeführt. | Die Temperatur der Lösung? 35 0 C. Nach dem Ende der Filterung hat der Esel eine dünne, rosa-weiße, feinkristalline Materieschicht (höchstwahrscheinlich handelt es sich um nicht umgesetztes Phthalsäureanhydrid). |
| 8. Zu dem Filtrat (V & sub5; & sub0; ml) wurden 5 ml Essigsäure (c) in 1-ml-Portionen unter Rühren gegeben. | Die Farbe der Lösung änderte sich von dunkelrot zu grauweißer, trüber (flockiger) Lösung. Das Erhitzen der Lösung trat nicht auf. Die Temperatur der Lösung? 31 0 C. |
| 9. 2 Tropfen Salzsäure (K.) zugeben | Keine visuellen Änderungen |
| 10. 1 Stunde stehen lassen. | Die Flocken setzten sich auf dem Boden des Glases ab, eine klare Lösung befand sich über dem Sediment und die Flocken waren grauweiß. |
| 11. Filtrierte den resultierenden Niederschlag. | Auf dem Filter befindet sich eine weißgraue Aufschlämmung. Mow? 5,07 g. |
Es wurden insgesamt 5,07 g Nasspräparat erhalten.
2.2 Umkristallisation aus heißem Alkohol
Die Rekristallisation wurde gemäß dem in der Literaturübersicht angegebenen Verfahren durchgeführt (Abschnitt 1.4.4). Eine Wiederholung wurde durchgeführt. Die Gerätezeichnung ist in Abschnitt 1.4.4 der Literaturübersicht dargestellt.
| Aktion | Beobachtung |
| Eine Portion Phenolphthalein (5,07 g) wurde in einen Kolben gegeben und mit 50 ml 96% igem Ethanol versetzt. | Eine kleine Portion Pheolphthalein hat sich aufgelöst. Alkohol wurde leicht trüb. |
| Er erhitzte den Kolben leicht zum Kochen. Alkohol wird zugegeben, bis sich das Phenolphthalein vollständig aufgelöst hat (jeweils 0,5 ml). VETOH \u003d 7 ml. | phenolphthalein ist vollständig gelöst. Alkohol ist unklar. t Gemisch \u003d 85 um C. |
| Die Mischung wurde langsam auf Raumtemperatur abgekühlt. | t Gemisch \u003d 19 um C. Viele weiße Kristalle fielen in Form kleiner Kristalle aus der Lösung. Die Lösung ist klar. |
| Die ausgefallenen Kristalle wurden abgesaugt und auf dem Filter mit Eiswasser gewaschen und zwischen Bögen Filterpapier getrocknet. | phenolphthalein wird in Form von weißgrauen, feinkörnigen Luftkristallen erhalten. m (Phenolphthalein) \u003d 4,08 g. Die Rekristallisationsausbeute betrug 83,5%. |
Rekristallisationsberechnung:
Rekristallisationsausgang:
W,% \u003d (m (Phenolphthalein) cross-dry 100%) / m (Phenolphthalein) ow
W,% \u003d  % = 83,5 %
% = 83,5 %
Berechnung der Syntheseausbeute:
Man erhält 0,0388 Mol Phenolphthalein (theoretisch) oder m \u003d 0,0338 Mol · 318 g / Mol \u003d 10,7 g.
Das Ergebnis der theoretischen:
W \u003d  100 % = 40, 5 %
100 % = 40, 5 %
So wurde im Prinzip eine ausreichende Menge Phenolphthalein (ca. 4,08 g) für die weitere Forschung erhalten. Die Synthese wurde mit akzeptabler Ausbeute durchgeführt.
2.3 Bestimmung der Löslichkeit
Die Löslichkeit von Phenolphthalein wurde gravimetrisch bestimmt (siehe Abschnitt 1.7.1).
Chloroform, Benzol und Xylol wurden als Lösungsmittel ausgewählt. da gemäß der Literatur (siehe Tabelle 5) Phenolphthalein in ihnen eine annehmbare Löslichkeit für die verfügbare Masse an Phenolphthalein aufweist. Ich habe kein Wasser verwendet, da Phenolphthalein eine sehr geringe Löslichkeit aufweist (etwa 10 -4 g pro 100 g). Ich habe auch kein Ethanol verwendet, da Phenolphthalein eine sehr gute Löslichkeit in Alkohol aufweist und ein hoher Verbrauch der Substanz erforderlich sein wird. Die Bestimmung wurde bei 21 ± 1 ° C (Temperatur der flüssigen Phase) durchgeführt. Die Infusion dauerte 30 ± 1 min unter kräftigem Rühren.
Berechnungsformeln:
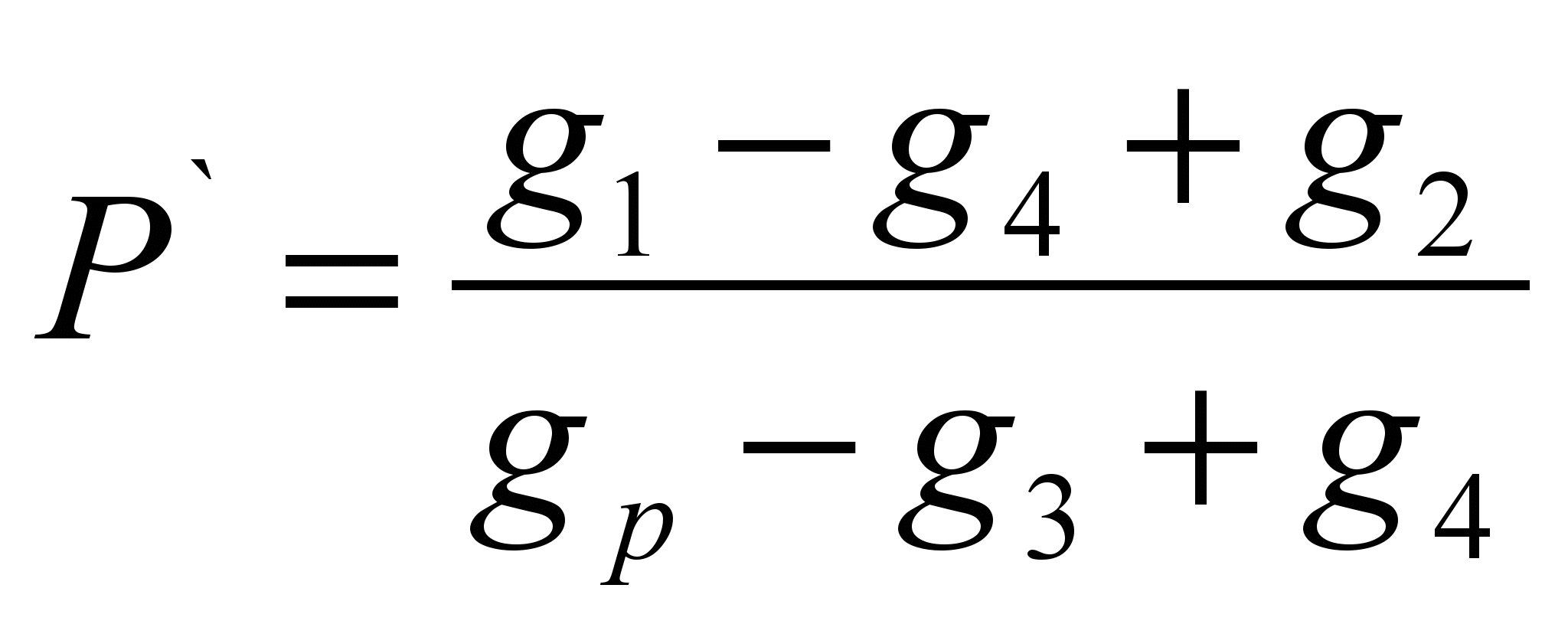 ; P \u003d P'100 (g / 100 g)
; P \u003d P'100 (g / 100 g)
Worin g 1 - eine Portion Phenolphthalein, g;
G 2 - Trockenfiltermasse, g;
G 3 - die Masse des Nassfilters mit Phenolphthaleinresten, g;
G 4 - trockene Filtermasse mit Phenolphthaleinresten, g;
G p - Probe des Lösungsmittels, g;
P - Löslichkeit, g / 100 g Sol;
P` - spezifische Löslichkeit, g / 1 g sol.
Definitionsergebnisse:
P (Phenolphthalein / Chloroform) \u003d (3,0 ± 0,03) g / 100 g Chloroform; ? \u003d 1%.
P (Phenolphthalein / Xylol) \u003d (0,22 ± 0,01) g / 100 g Xylol; ? \u003d 6%.
P (Phenolphthalein / Benzol) \u003d (0,19 - 0,01) g / 100 g Benzol; \u003d 6%.
Entsprechend dem Experiment werden eine Pivot-Tabelle und eine Grafik erstellt.
Tabelle 7
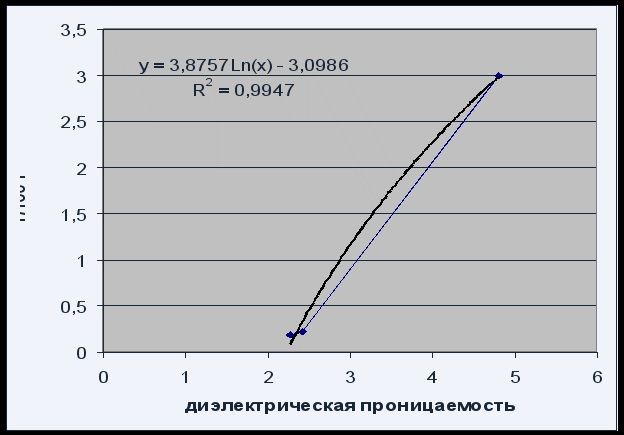
Abb. 4 Löslichkeit gegen Lösungsmitteldielektrizitätskonstante
Die Abhängigkeit der Löslichkeit von der Dielektrizitätskonstante des Lösungsmittels kann durch die logarithmische Gleichung P \u003d 3,8757 Ln (x) - 3,0986 mit einer zufriedenstellenden Qualität von R 2 \u003d 0,995 beschrieben werden.
Aufgrund der Tatsache, dass die Löslichkeit von Phenolphthalein mit zunehmender Dielektrizitätskonstante des Lösungsmittels (zunehmender Polarität) zunimmt, kann man sagen, dass Phenolphthalein eine polare Verbindung ist.
Fazit
Im Laufe der Arbeit wurden 26 literarische Quellen analysiert. Die allgemeine Position des Erhaltens unter Verwendung der Reaktion der Wechselwirkung von Phenol und Phthalsäureanhydrid wird beschrieben. Eine Überprüfung der Synthesemethoden wurde durchgeführt (eine Methode wurde gefunden, in verschiedenen Literaturquellen unterschied sich die Methode in der Masse der Reagensbeladung) von Phenolphthalein. Die Synthese nach dieser Technik wird durch Nebenprozesse nicht erschwert. Die Hauptgefahren bei der Synthese und Handhabung der verwendeten Substanzen werden ermittelt. Methoden zur Bestimmung der Löslichkeit wurden ausgewählt. Zur Bestimmung der Löslichkeit wurden Chloroform, Xylol und Benzol als Lösungsmittel gewählt.
Die Synthese von Phenolphthalein wurde mit einer Ausbeute von 40,5% durchgeführt. Die Bedingungen der Synthese, Reinigung und Isolierung wurden streng nach den Angaben der Methodik eingehalten.
Die Löslichkeit von Phenolphthalein (gemäß gravimetrischer Bestimmung) betrug: 3,00 ± 0,03 g / 100 g Chloroform, 0,22 ± 0,01 g / 100 g Xylol, 0,19 ± 0,01 g / 100 g Benzol.
Eine Erhöhung der Löslichkeit von Phenolphthalein mit einer Erhöhung der Dielektrizitätskonstante des Lösungsmittels bestätigt, dass Phenolphthalein eine polare Verbindung ist.
Referenzliste
1.Agronomov A.E. Laborarbeit in der organischen Chemie. - M .: Education, 1977.230 s.2.Astakhova L. I., Krivenko A.P. Workshop über organische Chemie. - M .: Mir, 1990, 180 s.
3. Bishot E. Indikatoren. - M .: Mir, 1976, 356 s.
4. Buler K., Pearson D. Organische Synthesen. M .: Höher. Shk., 1973, 340 s.
5.Gerasimov Y.I. Thermodynamik von Lösungen. - M .: Verlag der Moskauer Staatlichen Universität, 1980.170 s.
6. Gitis S. S. Workshop über Organische Chemie / S. S. Gitis, A. I. Glaz, A. I. Ivanov. - M .: VSH, 1991.
7.Golodnikov G.V. Workshop über organische Chemie. - M .: Chemistry, 1978.160s.
8.Grandberg I. Praktische Arbeit und Seminare in organischer Chemie: Ein Handbuch für Studenten. Universitäten. - 4. Auflage, überarbeitet. und hinzufügen. - M .: Bustard, 2001.
9. Ivanov V. G. Workshop on Organic Chemistry: Textbook. Handbuch für Studenten. höher ped Lehrbuch. Institutionen / B. G. Ivanov, O. N. Geva, Yu. G. Gaverova. - M .: Publishing Center "Academy", 2000.
10.Karapetyants M.Kh. Einführung in die Theorie chemischer Prozesse. - M .: Höher. Shk., 1975, 280 s.
11.Kirilin V.A. Thermodynamik von Lösungen. - M .: Energie, 1980.80 s.
12.Kogan V.B. Löslichkeitsleitfaden. - M .: L. Verlag Akademie der Wissenschaften, 1961.300 p.
13. Levina R. Ya. Praktische Arbeit in der organischen Chemie. - M .: Chemie, 1980.
14.Organicum: Praktische Arbeit in der organischen Chemie. - M .: Mir, 1979 - V.2.
15.Petrov A. A. Organische Chemie: Lehrbuch für Gymnasien / A. A. Petrov, H. V. Balyan, A. T. Troshchenko. - 5. Auflage, überarbeitet. und hinzufügen. - St. Petersburg: Ivan Fedorov, 2002.
16. Raykhard K. Lösungsmittel und Umwelteinflüsse in der organischen Chemie. - M .: Mir, 1991,182 s.
17. Ein Leitfaden für Laborklassen in organischer Chemie: Ein Handbuch für Universitäten / N. N. Artemjew, V. L. Beloborodowa, S. E. Zurabyan und andere; Ed. N. A. Tyukavkina. - 2. Aufl., Überarbeitet. und hinzufügen. - M .: Bustard, 2002.
18. Eigenschaften organischer Verbindungen: Nachschlagewerk / Ed. A. A. Potekhin. - L.: Chemie, 1984.
19. Smolina T. A. Praktische Arbeit in der organischen Chemie: eine kleine Werkstatt / T. A. Smolina, N. V. Vasilieva, N. B. Kupletskaya. - 2. Aufl., Überarbeitet. - M .: Ausbildung, 1986.
20. Handbuch eines Chemikers / Ed. B. N. Nikolsky und andere. - L.: Chemistry, 1964.
21. Stromberg A. G. Physical chemistry: Textbook. für chem. speziell Universitäten / A. G. Stromberg, D. P. Semchenko; Ed. A. G. Stromberg. - 5th ed., Rev. - M .: VSH, 2003.
22.Traven V. F. Organic chemistry: Lehrbuch für Gymnasien. - M .: IKC "Akademkniga", 2004. - T.1.
23. Physikalische Chemie. In 2 Büchern Prinz 1. Die Struktur des Stoffes. Thermodynamik: Lehrbuch. für Universitäten / K. S. Krasnov, N. K. Vorobyov, I. I. Godnev und andere; Ed. K. S. Krasnova - 3. Aufl., Rev. - M .: VSH, 2001.
24.Fialkov Yu.A. Lösungsmittel zur Steuerung eines chemischen Prozesses. - L.: Chemie, 1990.240 s.
25. Chemisches Lexikon / Ed. I. L. Knunyantsa ua - M .: Soviet Encyclopedia, 1983.
26. Khramkina M.N. Workshop zur organischen Synthese. - M .: Verlag der Moskauer Staatlichen Universität, 1985.473 s.
Die empirische Formel von Phenolphthalein lautet: C20H14O4 .
Was ist Phenolphthalein?
Laut Wikipedia 4,4'-Dioxophthalophenon oder 3,3-Bis- (4-hydroxyphenyl) phthalid bildet säure-Base-Indikator .
Substanzen wie lackmus, Phenolphthalein, Methylorange weit verbreitet in der Chemie zur Bestimmung des Säuregehalts von Lösungen.
In unveränderter Form ist das Mittel ein transparenter Kristall, der in Wasser schwer löslich ist, jedoch in Alkoholen und diethylether . Sie können eine Substanz aus synthetisieren phenol und phthalsäureanhydrid unter Verwendung einer Kondensationsreaktion unter Verwendung von Zinkchlorid wie katalysator (Sie können immer noch konzentriert verwenden Schwefelsäure ).
Dieser Stoff in einer sauren Umgebung ( pH von 0 bis 3) erhält einen ausgeprägten Orangeton. In leicht saurer und neutraler Umgebung ( pH von 4 bis 7) ändert die Lösung ihre Farbe nicht. Mit Phenolphthalein kann ein alkalisches Medium erkannt werden. Da das Produkt in Lösung eine Himbeerfarbe annimmt, pH die von 8 bis 10 (alkalische Lösung). Wenn die Werte wasserstoff-Indikator Von 11 bis 14 beeinflusst der Indikator die Farbe des Arzneimittels nicht. Phenolphthalein wird verwendet für Titration verschiedene wässrige Lösungen in analytische Chemie In der Regel wird eine in Alkohol gelöste Substanz verwendet.
Phenolphthalein ist auch in der Medizin weit verbreitet. Was Purgen ? Es ist ein Synonym für Phenolphthalein. Im letzten Jahrhundert wurde die Substanz aktiv als Abführmittel eingesetzt. Das Medikament stimuliert aktiv die Darmmotilität. Jetzt wird Purgen-Abführmittel aufgrund seiner Fähigkeit, sich im Körper anzusammeln und die Funktion der Nieren zu beeinträchtigen, selten verwendet.
Pharmakologische Wirkung
Abführmittel.
Pharmakodynamik und Pharmakokinetik
Phenolphthalein, was ist das?
Purgen ist ein starkes Abführmittel. Der Wirkungsmechanismus beruht auf der Stärkung peristaltik därme. Dies ist auf die Fähigkeit der Substanz zur Hemmung zurückzuführen natrium-Kalium-ATPase durch anregung adenylcyclase und erhöhen biosynthese . Die Substanz stimuliert die Synapsen und Nervenenden der Darmwände, ist gestört wasser-Elektrolyt-Gleichgewicht in Magen-Darm-Trakt Flüssigkeit sammelt sich an.
Nach der ersten Dosis tritt die Wirkung des Arzneimittels innerhalb eines Tages auf. Die Substanz hat die Eigenschaft, sich im Körper anzusammeln, hat eine reizende Wirkung auf die Nieren, hat krebserzeugend eigenschaften.
Indikationen zur Verwendung
Zubereitungen, die diesen Stoff enthalten, werden als Abführmittel für chronische verwendet.
Gegenanzeigen
Abführmittel Purgen ist kontraindiziert bei:
- mit Nierenerkrankungen;
- patienten mit darmverschluss ;
- wenn auf Phenolphthalein;
- wenn ein Patient einen Symptomkomplex hat “ scharfer Bauch ”.
Das Arzneimittel kann für längere Zeit nicht angewendet werden. Besondere Vorsicht ist bei der Behandlung älterer Menschen geboten.
Nebenwirkungen
Purgen-Tabletten können verursachen:
- herzklopfen aufgrund von Störungen wasser-Elektrolyt-Gleichgewicht ;
- albuminurie ;
- zusammenbrechen ;
- eine Abnahme des Kaliums im Blut;
- verfärbung des Urins von gelb nach rosa oder braun;
- hautausschläge und.
Anweisungen für Purgen (Methode und Dosierung)
Abführmittel wird in Form von Tabletten, verschiedenen Dosierungen oder Pulver zur oralen Verabreichung freigesetzt.
Gebrauchsanweisung Phenolphthalein
Die durchschnittliche Tagesdosis für einen Erwachsenen beträgt 100 mg.
Kindern werden je nach Alter und Gewicht 50 bis 200 mg des Arzneimittels pro Tag verschrieben.
Die maximale Menge einer Substanz, die innerhalb von 24 Stunden eingenommen werden kann, beträgt 300 mg.
Der Verlauf der Behandlung wird von einem Spezialisten verschrieben. Arzneimittel, die diese Komponente enthalten, können für längere Zeit nicht eingenommen werden.
Überdosis
Medizin kann verursachen hämorrhoiden blutungen ein deutlicher Rückgang, bis zu zusammenbrechen das Auftreten von Protein im Urin. Im Falle einer Überdosierung wird empfohlen, einen Arzt aufzusuchen.
Interaktion
Phenolphthalein kann zu einer Verzögerung des Kaliums im Körper führen, wenn die Therapie parallel durchgeführt wird kaliumsparende Diuretika .
Verkaufsbedingungen
Kein Rezept erforderlich.
Lagerbedingungen
Zubereitungen auf Phenolphthaleinbasis werden an einem trockenen, dunklen und vor Kindern geschützten Ort bei Raumtemperatur gelagert.
Verfallsdatum
Das Pulver ist unbegrenzt haltbar, Tabletten können 10 Jahre gelagert werden (sofern nicht vom Hersteller auf der Verpackung anders angegeben).
Besondere Anweisungen
Heutzutage werden Phenolphthalein-haltige Medikamente in der Medizin selten eingesetzt. Am häufigsten bevorzugen sie andere moderne, sichere Abführmittel.
Für Kinder
Der Stoff wird mit Vorsicht verschrieben. Je nach Alter und Gewicht des Kindes ist eine Dosisanpassung erforderlich.
Ältere Menschen
Bei älteren Menschen tritt die Wirkung der Einnahme dieses Arzneimittels innerhalb von 24 bis 72 Stunden auf.
Zum Abnehmen
Zu Beginn des letzten Jahrhunderts wurde die Substanz zum Abnehmen verwendet. Nun gibt es andere Medikamente, die einen ähnlichen Effekt haben. Viele Mädchen im Wetter für eine ideale Figur missbrauchen Abführmittel, die nicht gemacht werden sollten. Es kann gefährlich für Ihre Gesundheit sein.
Zubereitungen, die enthalten (Analoga)
Übereinstimmungen mit dem ATX Level 4 Code:
Ex Lax, Purgen, Purgofen, Purgil, Phenaloin, Laxatol, Laxoyl.
Purgen Preis, wo zu kaufen
Der Preis für Abführmittel in Form von Phenolphthaleinpulver im Großhandel beträgt etwa 1700 Rubel pro 1 kg.
Ein Medikament in Moskau zu kaufen ist fast unmöglich, da Medikamente, die darauf basieren, schon lange nicht mehr an Apotheken geliefert werden.
Der Preis für Phenolphthalein kann je nach Hersteller variieren.
