Die Gefriertemperatur der Lösung. Lösungen gefrieren bei einer niedrigeren Temperatur als reines Lösungsmittel
Verdünnte Nichtelektrolytlösungen.
Kolligative Eigenschaften der Extraktoren
Sattdampfdruck
Das "individuelle Flüssigkeit-Dampf" -Gleichgewicht wird durch die Gleichgewichtskonstante beschrieben
K p \u003d p über uns. Paar / a ungefähr w (1)
Da die Aktivität der einzelnen Flüssigkeit ao \u003d 1 ist, beträgt der Sättigungsdampfdruck daher
p ® pair \u003d K p (2)
und hängt nur von der Temperatur ab.
Da die Aktivität des Lösungsmittels gleich dem Produkt a o a ist durch seinen Molenbruch N 1 oder durch (1 - N 2), wobei N 2 der Molenbruch der gelösten Substanz ist, ist die Gleichgewichtskonstante gleich:
K p \u003d p 1 ® \u003d (p 1 / a ® N 1) \u003d (p 1/1-N 2) (3)
Von hier bekommen wir raouls Gesetz (1886):
p 1 \u003d p 1 o (1-N 2) \u003d p 1 o N 1 (4)
(p 1 ® -p 1) / p 1 ®) \u003d N 2 (5)
Der gesättigte Dampfdruck der Lösung ist gleich ihrem Druck über dem reinen Lösungsmittel multipliziert mit dem Molenbruch des Lösungsmittels.
Die relative Abnahme des Drucks des gesättigten Dampfes des Lösungsmittels gegenüber der reinen Lösung ist gleich dem molaren Anteil der gelösten Substanz.
Somit hängt der Dampfdruck bereits vom Gehalt des gelösten Stoffes ab. Das Raoulsche Gesetz kann verwendet werden, um die Molmasse eines gelösten Stoffes zu bestimmen:
D p / p 1 ° \u003d N 2 \u003d n 2 / n 1 + n 2 · m 2 M 1 / m 1 M 2 (6)
Der Siedepunkt von Lösungen
Die Flüssigkeit kocht, wenn der gesättigte Dampfdruck gleich dem Außendruck wird. Da nach Raouls Gesetz der Dampfdruck über der Lösung geringer ist als der Dampfdruck über dem reinen Lösungsmittel, ist der Siedepunkt der Lösung höher als der Siedepunkt des reinen Lösungsmittels.
Die Versuche zeigten, dass für verdünnte Lösungen von Nichtelektrolyten:
wobei DТ die Erhöhung des Siedepunkts der Lösung im Vergleich zu einem reinen Lösungsmittel ist, b die Molarität ([E] \u003d K kg / mol) ist, E die ebulioskopische Konstante (von ebbulio (lat.) - wegkochen), abhängig nur von den Eigenschaften des Lösungsmittels (seiner Temperatur) Siedetemperatur und spezifische Verdampfungswärme L 1):
E \u003d RTo2 / 1000L1 (8)
Der Siedepunkt eines reinen Lösungsmittels hat bei festem Außendruck einen bestimmten Wert. Der Siedepunkt der Lösung ist nicht konstant - er steigt mit dem Sieden an, da sich die Konzentration der Lösung aufgrund des Verdampfens des Lösungsmittels erhöht. In diesem Fall nimmt der Sattdampfdruck ständig ab. Daher wird der Siedepunkt einer Lösung als die Temperatur angesehen, die dem Auftreten der ersten Dampfblase darin entspricht.
Gefriertemperatur von Lösungen
Oberhalb der Lösung ist der Dampfdruck des Lösungsmittels niedriger als der Dampfdruck oberhalb des reinen Lösungsmittels. Der Dampfdruck über der festen und der flüssigen Phase ist ebenfalls geringer. Dies kann nur bei einem niedrigeren Gefrierpunkt der Lösung im Vergleich zu einem reinen Lösungsmittel sein. Die Absenkung der Gefriertemperatur von Nichtelektrolytlösungen gegenüber der Gefriertemperatur eines reinen Lösungsmittels ist proportional zur Molalität der Lösung:
wobei K eine Kryokonstante ist (von den griechischen „Kryos“ - kalt), abhängig nur von den Eigenschaften des Lösungsmittels:
K \u003d RTO 2 / 1000L 1, (10)
wobei T ungefähr, L * 1 - Gefriertemperatur und spezifische Schmelzwärme eines reinen Lösungsmittels.
Da die Konzentration des gelösten Stoffes mit der Verfestigung des Lösungsmittels zunimmt, ist die Gefriertemperatur der Lösung instabil und nimmt während des Prozesses ab. Daher wird der Gefrierpunkt der Lösung als die Bildungstemperatur des ersten Kristalls angenommen.
Tabelle 2 zeigt die Werte von E und K für einige Lösungsmittel.
Tabelle 2.
Die Gefriertemperatur der Lösung.
| Parametername | Wert |
| Thema des Artikels: | Die Gefriertemperatur der Lösung. |
| Kategorie (thematische Kategorie) | Bildung |
Der Siedepunkt der Lösung.
Die relative Abnahme des Sättigungsdampfdrucks über der Lösung ist gleich dem Molenbruch der gelösten Substanz.
Lösungen von Nichtelektrolyten.
Die Eigenschaften von Lösungen werden am Beispiel von verdünnten Lösungen betrachtet, bei deren Bildung die Wärme- und Volumeneffekte 0 sind (ideale Lösungen). In solchen Lösungen befindet sich das Teilchen in einem großen Abstand voneinander und die Kräfte der gegenseitigen Beeinflussung können vernachlässigt werden.
Die Abnahme des Dampfdrucks wird dadurch verursacht, dass die Oberfläche der Lösung im Gegensatz zur Oberfläche des Lösungsmittels teilweise von Partikeln eines nichtflüchtigen gelösten Stoffes besetzt ist. Dies führt zu einer Verringerung der Anzahl von Lösungsmittelmolekülen, die pro Zeiteinheit verdampfen; Die Anzahl der Lösungsmittelmoleküle, die vom Gas in die Lösung übergehen, bleibt unverändert. In diesem Fall spielen die Kräfte der Solvatationswechselwirkung die Hauptrolle. Οʜᴎ ist viel stärker als die Adhäsionskräfte zwischen Lösungsmittelmolekülen, was den Übergang einer geringeren Anzahl von Lösungsmittelmolekülen in die Gasphase erklärt.
Betrachten Sie eine Zweikomponenten-Ideallösung.
Gepostet am ref.rf
Lassen Sie den Druck des gesättigten Dampfes des Lösungsmittels und der gelösten Substanz: P 0 1 bzw. P 0 2. Molare Fraktionen: X1 und X2. Ist die gelöste Substanz nichtflüchtig, so ist P 0 2 \u003d 0. Dann ist der Gesamtdampfdruck gleich dem Partialdampfdruck des Lösungsmittels: P \u003d P1 \u003d P 0 1 · X1. Der Gesamtdruck des gesättigten Dampfes der Lösung wird nur durch den Partialdampfdruck der flüchtigen Komponente bestimmt.
das heißt, der Druck des gesättigten Dampfes des Lösungsmittels über der Lösung ist gleich dem Produkt seines Drucks über dem reinen Lösungsmittel und dem Molenbruch des Lösungsmittels (das erste Gesetz von Raul, 1887 ᴦ).
Gleichung (2.55) kann eine etwas andere Form gegeben werden. Da x I \u003d 1 - x 2 (wobei x 2 der molare Anteil des gelösten Stoffes ist), dann
p 1 \u003d p 0 1 (1 - x 2) \u003d p 0 1 - p 0 1 x 2 oder p 0 1 - p 1 \u003d p 0 1 x 2
p 0 1 –p 1 / p 0 1 \u003d x 2
Jede Flüssigkeit beginnt bei einer Temperatur zu kochen, bei der der Druck ihres gesättigten Dampfes den Außendruck erreicht. T siedet - T, bei dem der Dampfdruck \u003d 101,3 kPa. Wasser siedet bei 100 ° C, weil Der Druck an dieser Stelle im Phasendiagramm beträgt 1 atm. Nach dem Gesetz von Raul verringert sich der Dampfdruck, wenn eine nichtflüchtige Komponente in die Lösung eingeführt wird. Nun ist es bereits notwendig, die Lösung über 100 s zu erhitzen, um den Druck auf 1 atm zu bringen.
T Stellvertreter - T, bei dem der Dampfdruck Wasser \u003d Druck e Dampfeis \u003d 613 PA.
DТ \u003d Tr-r - Tr-l \u003d Ес m, mit m - Molarität des gelösten Stoffes, Е - ebulioskopische Konstante r-la.
Gib ein Diagramm.
Lösungsmittelkristalle sind nur dann im Gleichgewicht mit der Lösung, wenn der gesättigte Dampfdruck über den Kristallen und über der Lösung gleich ist. Da der Dampfdruck des Lösungsmittels über der Lösung immer niedriger als über dem reinen Lösungsmittel ist, ist die diesem Zustand entsprechende Temperatur immer niedriger als die Gefriertemperatur des reinen Lösungsmittels. Darüber hinaus hängt die Absenkung der Gefriertemperatur der Lösung ΔT deputy nicht von der Art der gelösten Substanz ab und wird nur durch das Verhältnis der Partikelanzahl des Lösungsmittels zur gelösten Substanz bestimmt.
Es kann gezeigt werden, dass die Absenkung der Gefriertemperatur der Lösung ΔT deputy direkt proportional zur molaren Konzentration der Lösung ist:
Zweites Gesetz von Raul: Die Zunahme von Tkip und die Abnahme von Tzam rr sind proportional zur Anzahl der Partikel des gelösten Stoffs und hängen nicht von seiner Art ab.
Die Gefriertemperatur der Lösung. - Konzept und Typen. Einteilung und Merkmale der Kategorie "Gefrierpunkt einer Lösung". 2014, 2015
Einfrieren ist ein Phasenübergang, bei dem eine Flüssigkeit in einen Feststoff umgewandelt wird. Die Gefriertemperatur 9 (Kristallisation) einer Flüssigkeit ist die Temperatur, bei der der Sättigungsdampfdruck über der Flüssigkeit gleich dem Sättigungsdampfdruck über den ausfallenden Festphasenkristallen ist.
Bei dieser Temperatur und dem entsprechenden gesättigten Dampfdruck ist die Kristallisationsrate gleich der Schmelzrate und beide Phasen können für eine lange Zeit nebeneinander existieren.
Mehr M.V. Lomonosov stellte fest, dass eine verdünnte Lösung bei einer Temperatur unter einem reinen Lösungsmittel gefriert. Meerwasser gefriert also nicht bei 273 K, sondern bei einer etwas niedrigeren Temperatur. Zahlreiche Versuche haben gezeigt, dass eine solche Änderung der Gefriertemperatur einer Lösung als allgemeine Regel angesehen werden kann.
Die Prozesse des Einfrierens und Kochens wurden von Raul eingehend untersucht und in Form eines Gesetzes dargestellt, das später das zweite Gesetz von Raul genannt wurde.
betrachten Sie die einfachste Schlussfolgerung dieses Gesetzes. 2 zeigt ein Diagramm, das die Abhängigkeit des Sättigungsdampfdrucks von der Temperatur über ein reines Lösungsmittel und über eine Lösung ausdrückt.
Die Kurve 0A ist die Temperaturabhängigkeit des Sattdampfdrucks von reinem Wasser.
Kurve BC, DE - Abhängigkeit des gesättigten Wasserdampfdrucks von Lösungen mit unterschiedlichen Konzentrationen an gelöstem Stoff
0D - drückt die Temperaturabhängigkeit des Drucks von gesättigtem Wasserdampf über Eis aus.
Aus 2 ist ersichtlich, dass der Dampfdruck über der Lösung bei 273 K niedriger als über Wasser ist, jedoch nicht gleich dem Dampfdruck über Eis bei derselben Temperatur ist. Erst bei Temperaturen unter 273 K (T) sinkt der Dampfdruck über der Lösung so stark, dass er dem Dampfdruck über dem Eis entspricht. Punkt B entspricht dem. Bei höheren Konzentrationen der Lösung liegen die Kurven, die die Temperaturabhängigkeit des Wasserdampfdrucks über der Lösung ausdrücken, unterhalb der BC-Kurve, jedoch parallel dazu.
Wir führen die folgende Notation ein:
P 0 A - Dampfdruck über einem reinen Lösungsmittel bei 273 K
P A ist der Dampfdruck über der Lösung bei ihrer Gefriertemperatur T ’s
Aus einem rechtwinkligen Wok bestimmen
Abbildung 2 zeigt, wo die Gefriertemperatur der Lösung sinkt.
Durch Einsetzen dieser Werte in die obige Gleichung erhalten wir

 (3)
(3)
Ab dem ersten Raoult-Gesetz für stark verdünnte Lösungen haben wir
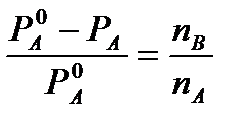
 und
und  (4)
(4)
dabei behalten n A, n B, m A die zuvor zugewiesenen Bezeichnungen bei (siehe oben). Wenn durch M 0 A die Molmasse des Lösungsmittels bezeichnet wird, dann

Wenn wir diesen Ausdruck in Gleichung (4) einsetzen, erhalten wir

Multiplizieren und dividieren Sie dann die rechte Seite dieses Ausdrucks durch 1000
 (5)
(5)
Kombiniere alle konstanten Werte in Gleichung (5) zu einer Konstanten K (  ) erhalten wir den folgenden Ausdruck
) erhalten wir den folgenden Ausdruck
 (6)
(6)
Ausdruck  repräsentiert die Molalität von St.
repräsentiert die Molalität von St.
Wenn wir diesen Ausdruck in Gleichung (6) einsetzen, erhalten wir die endgültige Gleichung.
 (7)
(7)
Dies ist der mathematische Ausdruck von Raoults zweitem Gesetz: Die Absenkung der Gefriertemperatur oder die Erhöhung des Siedepunkts von Lösungen ist direkt proportional zu ihrer molaren Konzentration.
Der Koeffizient K in Gleichung (7) wird als Kryokonstante bezeichnet, zeigt die molare Abnahme der Gefriertemperatur der Lösung, ist eine individuelle Eigenschaft des Lösungsmittels (K H2O \u003d 1,86º) und hat die gleiche Dimension wie E (Kº · kg · mol -1).
Eine Forschungsmethode, die auf der Messung der Abnahme der Gefriertemperatur von Lösungen beruht, wird als Kryoskopie bezeichnet. Ebenso wie bei ebullioscopic können Sie die Molmasse des gelösten Stoffes berechnen

Abbildung 3 zeigt eine Vorrichtung zur Messung der Gefriertemperatur von Lösungen.
 |
OSMOSE UND OSMOTISCHER DRUCK.
Eine sehr wichtige biologische Eigenschaft von Lösungen ist die Osmose.
In der Natur werden Lösungen häufig durch Membranen vom Lösungsmittel getrennt, die nur für Lösungsmittelpartikel durchlässig sind. In diesem Fall kann die gelöste Substanz nicht in das Lösungsmittel diffundieren, und es wird nur der Übergang des Lösungsmittels in die Lösung beobachtet, d.h. Das Lösungsmittel bewegt sich in beide Richtungen, es gelangt jedoch etwas mehr in die Lösung als in die entgegengesetzte Richtung.
Der Osmosemechanismus ist aufgrund der isothermen Destillation leicht vorstellbar. Lassen Sie eine semipermeable Membran mit Mikroporen das Lösungsmittel und die Lösung mit der Konzentration C in trennen (Abb. 4)

Zu einem Zeitpunkt, der einerseits durch ein Lösungsmittel und andererseits durch eine Lösung begrenzt ist, tritt Verdunstung auf. Aufgrund der Erhöhung des Raoult-Gesetzes wird die Elastizität des gesättigten Dampfes von der Lösungsmittelseite aus der Dampfphase konzentriert und geht in die Lösung über.
Infolge der Osmose nimmt das Volumen der Lösung zu und ihre Konzentration nimmt allmählich ab; Das durch die Membran in die Lösung eindringende Lösungsmittel erhöht die Flüssigkeitssäule h und damit den hydrostatischen Druck (siehe Abb. 5). Gleichzeitig nimmt die Anzahl der Lösungsmittelmoleküle, die sich in entgegengesetzter Richtung über die Membran bewegen, zu, d.h. von der Lösung zum Lösungsmittel. allmählich erreichen der hydrostatische Druck und die Verdünnung der Lösung Werte, bei denen die Anzahl der Lösungsmittelmoleküle, die sich in beide Richtungen bewegen, ausgeglichen wird und sich ein osmotisches Gleichgewicht einstellt. Als Ergebnis der Osmose entstandener übermäßiger hydrostatischer Druck, gemessen an einer Lösungssäule der Höhe h, bei der sich das osmotische Gleichgewicht einstellt, wird als osmotischer Druck bezeichnet.
![]() fig. 5
fig. 5
Für viele Lösungen semipermeabel sind Membranen aus Kollodium, Cellophan, eisenhaltigem Kupfer und anderen.
GESETZE DES OSMOTISCHEN DRUCKS.
Die Untersuchung der Gesetze des osmotischen Drucks ergab eine vollständige Analogie zu den Gasgesetzen. Für verdünnte Lösungen von Nichtelektrolyten können sie wie folgt formuliert werden:
bei konstanter Temperatur ist der osmotische Druck direkt proportional zur molaren Konzentration der gelösten Substanz (Analogie zum Boyle-Mariotte-Gesetz):

bei konstanter molarer Konzentration ist der osmotische Druck direkt proportional zur absoluten Temperatur (analog zum Gay-Lussac-Gesetz):

Aus diesen beiden Gesetzen folgt, dass Lösungen verschiedener Nichtelektrolyte bei gleichen molaren Konzentrationen und Temperaturen den gleichen osmotischen Druck erzeugen, d.h. äquimolare Lösungen von Nichtelektrolyten sind isotonisch (analog zum Avogadro-Gesetz).
Vant-Hoff schlug ein gemeinsames Gesetz für den osmotischen Druck in Lösungen vor (ähnlich dem kombinierten Gasgesetz von Mendeleev-Klaiperon): Der osmotische Druck verdünnter Lösungen von Nichtelektrolyten ist direkt proportional zur Molkonzentration, zum Proportionalitätskoeffizienten und zur absoluten Temperatur:
da c \u003d n / V ist, wobei n die Anzahl der Mol Nichtelektrolyt und V das Volumen der Lösung ist, dann  oder
oder ![]()
Seite 1
Die Herabsetzung des Gefrierpunkts verdünnter Lösungen ist proportional zur Konzentration des gelösten Stoffes. Diese Schlussfolgerung kann erhalten werden, indem alle Argumente und mathematischen Operationen wiederholt werden, die durchgeführt wurden, um die Konzentrationsabhängigkeit des Anstiegs der Siedetemperatur der Lösung abzuleiten.
Die Herabsetzung des Gefrierpunkts einer verdünnten Lösung sowie die Erhöhung ihres Siedepunkts ist also proportional zur Konzentration der gelösten Substanz. Diese Aussage wurde auch zuerst von Raul gemacht und heißt Raoults zweites Gesetz.
Es wurde experimentell festgestellt, dass die Erniedrigung des Gefrierpunktes einer verdünnten Lösung proportional zur Konzentration der gelösten Substanz ist. 1883 machte der französische Chemiker F. M. Raul eine sehr interessante Entdeckung: Die Absenkung der Gefriertemperatur durch unterschiedliche gelöste Stoffe in den gleichen molaren Mengen ist für dieses Lösungsmittel gleich.
Es wurde experimentell festgestellt, dass die Erniedrigung des Gefrierpunktes einer verdünnten Lösung proportional zur Konzentration der gelösten Substanz ist. 1883 machte der französische Chemiker F. M. Raoul eine sehr interessante Entdeckung: Die Absenkung der Gefriertemperatur durch verschiedene gelöste Stoffe in den gleichen molaren Mengen stellte sich für dieses Lösungsmittel als gleich heraus.
Grundlage der kryoskopischen Messungen ist die Bestimmung der Gefrierpunkterniedrigung einer verdünnten Lösung (AG3) gegenüber einem reinen Lösungsmittel.
Die durchschnittliche Wirksamkeit eines starken Elektrolyten wird berechnet, indem der Gefrierpunkt einer verdünnten Elektrolytlösung gesenkt wird.
Der Wert von K3 hängt nur von den Eigenschaften des Lösungsmittels ab, daher wird die Herabsetzung des Gefrierpunkts verdünnter Lösungen nur von der Konzentration und nicht von der Art der gelösten Substanz bestimmt.
Tamman [4, Carrara, Orndorf und White 16] und Mendel führten eine Reihe von Messungen durch, um den Gefrierpunkt von verdünnten Wasserstoffperoxidlösungen (mit weniger als 5 Gew .-%) zu senken.
Der Wert von K3 hängt nur von den Eigenschaften des Lösungsmittels ab. Die Abnahme des Gefrierpunktes verdünnter Lösungen in diesem Lösungsmittel wird daher nur durch die Konzentration der gelösten Substanz bestimmt.
Der Wert von / (3 hängt nur von den Eigenschaften des Lösungsmittels ab. Daher wird die Herabsetzung des Gefrierpunkts verdünnter Lösungen in diesem Lösungsmittel nur durch die Konzentration der gelösten Substanz bestimmt.
Erfahrungsgemäß gefrieren Lösungen bei einer niedrigeren Temperatur und sieden bei einer höheren Temperatur als die Gefrier- und Siedepunkte eines reinen Lösungsmittels. Messungen ergaben, dass die Herabsetzung des Gefrierpunkts einer verdünnten Lösung sowie die Erhöhung ihres Siedepunkts nur von der Konzentration der Lösung abhängt, jedoch nicht von der Art der gelösten Substanz.
Das nahezu durchschnittliche Molekulargewicht wird berechnet, indem das Gewicht der Probe durch die Anzahl der darin enthaltenen Moleküle dividiert wird. Das zahlenmittlere Molekulargewicht wird durch den osmotischen Druck, durch Erhöhen des Siedepunktes und Erniedrigen der Gefriertemperatur verdünnter Polymerlösungen sowie durch Bestimmen der Anzahl der Endgruppen bestimmt.
Die Lösungen gefrieren bei einer niedrigeren Temperatur und sieden bei einer höheren Temperatur als ein reines Lösungsmittel. Diese Muster gelten nur für Lösungen nichtflüchtiger Substanzen. Es wurde gefunden, dass eine Abnahme des Gefrierpunktes einer verdünnten Lösung sowie eine Erhöhung ihres Siedepunktes nur von der Konzentration der Lösung abhängen, jedoch nicht von der Art des gelösten Stoffes.
Die Gefrierkonstante (Kryoskopie-Konstante) Kzan oder die Gebetsabsenkung der Gefriertemperatur ist ein für ein bestimmtes Lösungsmittel charakteristischer Wert und unabhängig von der Art der gelösten Substanz. Seine physikalische Bedeutung ergibt sich aus der obigen Gleichung: Chzam ist eine Abnahme der Gefriertemperatur einer Lösung, die 1 Mol einer Substanz in 1000 g Lösungsmittel enthält, vorausgesetzt, die Lösung dieser Konzentration hat ideale Eigenschaften und die gelöste Substanz dissoziiert nicht und assoziiert nicht. Messen Sie für die experimentelle Bestimmung von / (Stellvertreter die Abnahme des Gefrierpunkts verdünnter Lösungen und berechnen Sie diese Daten erneut um 1 Mol.
Lösungsmittelkristalle sind nur dann im Gleichgewicht mit der Lösung, wenn der gesättigte Dampfdruck über den Kristallen und über der Lösung gleich ist. Da der Dampfdruck des Lösungsmittels über der Lösung immer niedriger als über dem reinen Lösungsmittel ist, ist die diesem Zustand entsprechende Temperatur immer niedriger als die Gefriertemperatur des reinen Lösungsmittels. Darüber hinaus hängt die Absenkung der Gefriertemperatur der Lösung ΔT deputy nicht von der Art der gelösten Substanz ab und wird nur durch das Verhältnis der Partikelanzahl des Lösungsmittels zur gelösten Substanz bestimmt.
Es kann gezeigt werden, dass die Absenkung der Gefriertemperatur der Lösung ΔT deputy direkt proportional zur molaren Konzentration der Lösung ist:
Zweites Gesetz von Raul: Die Zunahme von Tkip und die Abnahme von Tzam rr sind proportional zur Anzahl der Partikel des gelösten Stoffs und hängen nicht von seiner Art ab.
Arbeitsende -
Dieses Thema gehört zu der Sektion:
Vorlesung Nr. 5. Phasengleichgewichte. Lösungen von Nichtelektrolyten
Der gasförmige Zustand eines Stoffes ist durch eine schwache Wechselwirkung zwischen Partikeln und große Abstände zwischen ihnen gekennzeichnet, daher werden die Gase gemischt ... Der Gesamtdruck des Gasgemisches ist gleich der Summe der Partialdrücke aller Bestandteile ...
Wenn Sie zusätzliches Material zu diesem Thema benötigen oder nicht gefunden haben, wonach Sie gesucht haben, empfehlen wir Ihnen, die Suche in unserer Werkdatenbank zu verwenden:
Was machen wir mit dem erhaltenen Material:
Wenn sich dieses Material für Sie als nützlich erwiesen hat, können Sie es auf Ihrer Seite in sozialen Netzwerken speichern:
| Tweet |
Alle Themen in diesem Abschnitt:
Vorlesung Nr. 5. Phasengleichgewichte. Lösungen von Nichtelektrolyten.
Phasengleichgewicht. In der letzten Vorlesung haben wir das chemische Gleichgewicht, die Gleichgewichtskonstante, seine Beziehung zu usw. untersucht. Größen und Faktoren, die die Gleichgewichtsverschiebung beeinflussen.
Zweikomponentensysteme.
Eine Lösung ist ein homogenes System, das aus zwei oder mehr Komponenten besteht, deren Zusammensetzung sich in bestimmten Grenzen kontinuierlich ändern kann, ohne dass sich ihre Eigenschaften krampfhaft ändern.
Lösungsbildung
Die Bildung einer Lösung ist ein komplexer physikalisch-chemischer Prozess. Der Auflösungsprozess geht immer mit einer Zunahme der Entropie des Systems einher; Bei der Bildung von Lösungen kommt es häufig zu einer Isolierung von beiden
Löslichkeit
Der Auflösungsprozess ist mit Diffusion verbunden, d. H. Mit der spontanen Verteilung von Partikeln einer Substanz zwischen Partikeln einer anderen. Wenn ein gelöster Stoff in ein Lösungsmittel eingebracht wird, erfolgt der Auflösungsvorgang
Löslichkeit von Gasen in Flüssigkeiten
Die Löslichkeit von Gasen in Flüssigkeiten hängt von einer Reihe von Faktoren ab: Art des Gases und der Flüssigkeit, Druck, Temperatur, Konzentration der in der Flüssigkeit gelösten Substanzen (wirkt sich insbesondere auf die Löslichkeit von Gasen aus)
Lösungen von Nichtelektrolyten.
Die Eigenschaften von Lösungen werden am Beispiel von verdünnten Lösungen betrachtet, bei deren Bildung die Wärme- und Volumeneffekte 0 sind (ideale Lösungen). In solchen Lösungen ist das Partikel
Die relative Abnahme des Sättigungsdampfdrucks über der Lösung ist gleich dem Molenbruch der gelösten Substanz.
Jede Flüssigkeit beginnt bei einer Temperatur zu kochen, bei der der Druck ihres gesättigten Dampfes den Außendruck erreicht. T siedet - T, bei dem der Dampfdruck \u003d 101,3 kPa. Wasser siedet bei 100 ° C,
Osmotischer Druck
Wenn zwei Lösungen mit unterschiedlichen Konzentrationen durch ein semipermeables Septum getrennt sind, das den Durchtritt von Lösungsmittelmolekülen ermöglicht, aber den Durchtritt von Partikeln der gelösten Substanz verhindert, werde ich beobachten
