Šta je fenoftalein? Glavne opasnosti u destilaciji parom.
(Dokument)
n2.doc
Federalna agencija za obrazovanje
Opšti eksperiment 1: Titracija
Zašto biste trebali biti sigurni da su vam oči u ravni sa oznakom kada dodajete posljednjih nekoliko kapi vode?
- Kolika je koncentracija ove standardne otopine?
- Koja je svrha ispiranja čaše i lijevka vodom?
- Koja je svrha pranja unutrašnjosti volumetrijske tikvice vodom?
Metoda rekristalizacije iz vrućeg alkohola
Iz tabele odredite prosječnu zapreminu titracije za ovaj eksperiment i koristite ovu vrijednost u ostatku vaših proračuna. Koristeći prethodne primjere, odredite koncentraciju octene kiseline u uzorku octa. Zapamtite da imate sljedeće podatke: zapreminu rastvora natrijum hidroksida vinove loze, koncentraciju rastvora natrijum hidroksida. Odredite koncentraciju otopine natrijevog hidroksida nepoznate koncentracije.
Država obrazovna ustanova visoko stručno obrazovanje
Pomeranac državni univerzitet nazvan po M.V.Lomonosovu
Katedra za hemiju
Kurs
Sinteza fenolftaleina.
Proučavanje rastvorljivosti u rastvaračima sa različitim dielektričnim konstantama
Završeno:
Koncentrovane kiseline i baze mogu izazvati ozbiljne opekotine. Predlažemo korištenje rukavica i zaštitnih naočala kada radite s kiselinom ili bazom. Nakon što se uvjerite da je bireta zatvorena, pažljivo dodajte standardnu otopinu oksalne kiseline u biretu dok se bireta ne napuni. Stavite čistu čašu ispod birete i pažljivo stavite dio otopine oksalne kiseline u nju. Ovo će osigurati da u bireti nema mjehurića zraka. Vrh rješenja bi sada trebao biti između 0 i 1 cm 3 Upišite vrijednost na drugu decimalu. Pipetom izmjerite 20 cm 3 \\ rastvora u konusnoj tikvici. Dodajte 3-4 kapi indikatora fenolftaleina u konusnu tikvicu. Izvedite grubi eksperiment titracije tako što ćete brzo dodati oksalnu kiselinu u konusnu tikvicu i neprestano ju okretati. Zaustavite se čim se promeni boja rastvora i nakon mešanja se promeni. Ako promjena boje ne ostane kada se tikvica okreće, dodajte još oksalne kiseline dok boja ne ostane. Ponovite korake 4-7 sa drugom konusnom tikvicom. Brzo dodajte oksalnu kiselinu u konusnu tikvicu dok ne dodate 2 cc manje od vaše sirove zapremine za titraciju. On trenutno Ne bi trebalo biti trajne promjene boje. Postepeno dodajte oksalnu kiselinu. Zavrtite između svake kapi i, ako je potrebno, isperite strane tikvice vodom. Kada rastvor promeni boju i ostane u novoj boji, obratite pažnju na zapreminu na bireti. Zapamtite da je titrirani volumen: -. Radi preciznosti, ponavljajte korake 9-11 dok ne dobijete tri očitanja s razlikom od najviše 0,1 cm3.
- Označite jednu od čaša \\.
- Pipetom izmjerite 100 cm 3 vode u čašu.
- Dodajte oko 4 g\\ u čašu i promiješajte.
- Pričvrstite biretu na postolje retorte i postavite mali lijevak na vrh.
- Koje je boje bio rastvor natrijum hidroksida kada je dodat fenolftalen?
- Koje je boje bilo kada je dodano dovoljno kiseline?
Student 3. godine
Katedra za hemiju
Alferov Vladimir Ivanovič
Provjereno:
Vanredni profesor, kandidat nauka chem. nauke
Levandovskaya T.V.
Vanredni profesor, kandidat nauka tech. nauke
Čagina N. B.
ARKHANGELSK
1. Pregled literature………………………………………………………..5
Izgled i fizička svojstva fenolftaleina………….5
Primjena fenolftaleina………………………………………………...6
Hemijska svojstva………………………………………………………….8
Priprema fenolftaleina……………………………………11
1.4.2 Fizička svojstva supstance koje se koriste u sintezi….15
Koristeći prethodne primjere, odredite koncentraciju otopine natrijevog hidroksida. Zapamtite da imate sljedeće informacije: volumen otopine natrijum hidroksida volumen otopine oksalne kiseline koncentracija otopine oksalne kiseline. Uravnotežena hemijska jednačina za ovu reakciju.
Izračunajte masu oksalne kiseline koju učenik mora otopiti da bi nastao traženi standardni rastvor. On smatra da će 40 cm 3 rastvora oksalne kiseline potpuno neutralisati 35 cm 3 rastvora natrijum hidroksida.
- Treba nam puno oksalne kiseline.
- Međutim, još ne znamo broj mladeža.
1.4.3 Tehnika parne destilacije………………………………….16
1.4.4 Metoda rekristalizacije iz vrućeg alkohola………….18
1.5 Sigurnosne mjere………………………………………………20
1.5.1 Glavne opasnosti pri radu s koncentriranim kiselinama…………………………………………………………………………..20
1.5.2 Glavne opasnosti tokom destilacije vodenom parom……..21
- Napišite uravnoteženu hemijsku jednačinu za reakciju.
- Izračunajte koncentraciju kiseline.
Ova često kisela kiša prvi put je primećena u devetnaestom veku, ali je tek u dvadesetom veku ova kiselost postala široko rasprostranjena na opasnim nivoima koje povezujemo sa terminom "kisela kiša". Ispostavilo se da je glavni krivac ugalj koji sadrži sumpor kao nečistoću. Kada se sagori u elektrani, ovaj sumpor se kombinuje sa kiseonikom i formira sumpor-dioksid, koji se diže kroz dimnjak i raspršuje se kroz atmosferu.
1.5.3 Glavne opasnosti tokom rekristalizacije iz vrućeg alkohola…………………………………………………………………………………….21
1.5.4 Osobine rada sa supstancama koje se koriste u sintezi……………………………………………………………………………………22
1.6 Karakteristike rastvarača……………………………………………….24
1.6.1 Klasifikacija rastvarača prema fizičkim svojstvima...25
Sumporna kiselina je vrlo jaka kiselina i kada se voda kondenzira iz zraka i formira kapi kiše, kiselina se rastvara u vodi. Tada kiša pada i skuplja se u telima svježa voda, povećavajući njihovu kiselost. Sjeveroistočne Sjedinjene Američke Države najviše su patile od ovoga jer je dolina Ohajo, uključujući područja Ohaja i Pensilvanije, mjesto gdje se najveći dio industrije uglja u prošlom i po vijeku. Zbog preovlađujućih vremenskih uslova, ovi dimni gasovi ulaze u atmosferu u dolini Ohajo, ali kiša pada u severnom delu Njujorka i Nove Engleske.
1.6.2 Sistemi klasifikacije rastvarača na osnovu njihovih hemijska svojstva………………………………………………..30
1.7 Pregled metoda za određivanje rastvorljivosti čvrstih materija………………………………………………………………………………………..35
1.7.1 Gravimetrijska metoda……………………………………………….35
1.7.2 Elektrohemijska metoda……………………………………37
1.7.3 Fotoelektrokalorimetrijska metoda………………………..41
Povećanje kiselosti na kiši može imati razorne posljedice. Metalni zagađivači u tlu, koji su obično čvrsto vezani za druga jedinjenja, mogu se isprati kiselom kišom u jezera i potoke; u jednom trenutku mnoga jezera u Novoj Engleskoj nisu bila u stanju izdržavati potočnu pastrmku zbog toga. Biljke su takođe veoma osetljive na pH vrednosti zemljišta. korisni nutrijenti se također mogu isprati iz tla, ostavljajući biljke nesposobnim da prežive u njemu. U posebno teško pogođenim područjima može se naći na desetine mrtvih stabala, kao što je prikazano iznad.
2. Eksperimentalni dio………………………………………………………43
2.1 Sinteza fenolftaleina……………………………………………………………43
2.2 Rekristalizacija iz vrućeg alkohola……………..45
2.3 Određivanje rastvorljivosti…………………………………….47
Zaključak…………………………………………………………………50
Bibliografija……………………………………………………….51
Zgrade i kipovi su također oštećeni kiselim kišama, koje izjedaju kamen, posebno krečnjak. Povećana erozija skulptura, nadgrobnih spomenika, pa čak i nekih zgrada dovela je do ogromnih gubitaka – neka umjetnička djela su potpuno uništena.
Od tada su emisije značajno smanjene, kao i kisele kiše. Međutim, problem još uvijek nije otklonjen i još mnogo toga treba učiniti po pitanju ovog ozbiljnog ekološkog problema. Pogledajmo hlorovodoničnu kiselinu, koja je glavna komponenta želučane kiseline, i natrijum hidroksid, koji se često naziva "lužinom" i koristi se u sapunu. Međutim, gotovo sav hidronjon i hidroksid se kombinuju da bi napravili molekule vode, ostavljajući za sobom samo hloridni spektator i natrijeve ione.
Uvod
Fenolftalein je jedan od najčešće korištenih acido-baznih indikatora u hemiji. Spada u triarilmetanske boje koje se nazivaju ftaleinske boje.
Svrha ovog rada je sinteza fenolftaleina i proučavanje njegove rastvorljivosti u rastvaračima sa različitim dielektričnim konstantama. Za postizanje ovog cilja potrebno je riješiti sljedeće zadatke:
Ako je količina hlorovodonične kiseline potpuno ista kao i količina natrijum hidroksida, u molovima, tada svaki hidronij mora imati hidroksid da bi reagovao ostavljajući rastvor koji je sada neutralan. sada bi to trebala biti čaša čiste vode sa pH 7 i u njoj otopljene obične kuhinjske soli. Počinjemo s dvije izrazito kaustične tvari i završavamo s benignim proizvodima.
Općenito, kada kiseline i baze međusobno djeluju, one neutraliziraju jedna drugu i pH otopine se približava ovome. Ovo se zove ".". Samo kada se dodaju jednake količine jake kiseline i jake baze, pH će biti tačan. Ali u mnogim slučajevima slabe kiseline i slabe baze se kombinuju. Međutim, pH će se približiti 7, ali otopina neće biti neutralna. U slučaju kiselih kiša, često su glavne stijene i tlo, posebno karbonatne stijene koje se nalaze u nekim dijelovima zemlje.
1. Analizirati literaturu o ovom pitanju;
2. Odaberite metode sinteze i odaberite najprikladniju;
3. Sprovesti sintezu, izolaciju i pročišćavanje proizvoda;
4. Ispitati rastvorljivost u rastvaračima sa različitim dielektričnim konstantama, uporediti dobijene rezultate sa podacima iz literature;
Kako slabe kiseline u kiselim kišama padaju na stijenu, neutraliziraju ih baze u lišću, u prljavštini i u stijenama. Međutim, mnoge od ovih baza, poput onih koje se nalaze u stijenama, nisu obnovljive. Nakon jednog stoljeća kiselih kiša, kamenje neutralizira svu bazu u stijenama, kisela kiša samo ulazi u ekosistem i ništa ga ne neutralizira.
Fenolftalein: opšti laboratorijski indikator
Molekula fenolftaleina je prozirna u prisustvu kiseline i ružičasta u prisustvu baze. Ovo je odličan pokazatelj za pronalaženje tačke ekvivalencije u kiselo-baznim titracijama za jednostavne kiseline. U Odjeljku 5 Odjeljak 8 titracije su uvedene kao način kombinovanja dvaju rastvora kako bi se dobila kontrolisana stehiometrijska reakcija. Zahtijeva otopinu poznate koncentracije, obično u bireti, koja će reagirati s otopinom nepoznate koncentracije u čaši ispod. Svaka reakcija će raditi za titraciju, ali da bi se moglo reći kada je reakcija završena mora postojati vidljiva krajnja tačka.
5.
Izvedite zaključak o obavljenom poslu.
1. Pregled literature
1.1 Izgled i fizička svojstva fenolftaleina
Fenolftalein (Di-n-dioksidifenilftalid, 2,2-bis(n-hidroksifenil)ftalid) – bijeli ili blago žućkasti kristalni prah; rekristalizacijom iz razrijeđenog etilnog alkohola nastaju bezbojne rombične iglice. Fenolftalein je bez mirisa i nije stabilan na vazduhu. Molekularna težina je 318,3 g/mol. Fenolftalein se topi na temperaturi od 250 0 C (258 0 C) i na više visoke temperature sublimira .
Fenolftalein kao sredstvo za mršavljenje
Za kiselo-bazne reakcije, indikatori mogu pružiti ovu vrstu informacija s promjenom boje kako bi se označila krajnja točka. Stoga su reakcije neutralizacije kiselinske baze jedna od najčešćih vrsta reakcija koje se koriste u titracijskim testovima. Dakle, titracija se može koristiti za određivanje količine kiseline ili baze u nepoznatom rastvoru.
Tokom titracije jake kiseline sa jakim bazama, krajnja tačka se postiže kada je pH tačno 7, jer rastvor treba da bude čista vodena otopina sa neutralnim elektrolitima u sebi. Nakon što kiselina nestane, bilo koja baza koju dodamo u tikvicu neće biti neutralizirana i pH otopine će početi rasti. Međutim, čak i mali dio biretne kapi viška jake baze promijenit će pH Jedan ili takav indikator, fenolftalein, je bistar i bezbojan u kiselim otopinama, ali postaje tamnoružičast u bazičnim otopinama ako je pH iznad 2.
Fenolftalein je rastvorljiv u etanolu, dietil eteru, hloroformu, acetonu, petrolej eteru, benzenu, toluenu i slabo u vodi.
1.2 Upotreba fenolftaleina
Fenolftalein je jedan od najčešće korištenih indikatora, posebno za volumetrijsko određivanje slabih kiselina.
Ima niz prednosti: nije osjetljiv na povišene temperature, greška od prisustva proteinskih supstanci i koloida je beznačajna. Može se široko koristiti čak iu otopinama koje sadrže alkohol, samo se boja alkalne otopine razlikuje od ljubičastog tona karakterističnog za vodenu otopinu. U koncentriranim alkoholnim otopinama, glavni oblik ima plavo-ljubičastu boju. Fenolftalein se može koristiti za titraciju organskih kiselina u alkoholnim rastvorima ili za određivanje kiselosti alkohola i estera. Hejort i Ham predlažu upotrebu polinatrijum glikolata za uspostavljanje baznih titara u prisustvu fenolftaleina. Zadovoljavajući rezultati se dobijaju titriranjem 2•10 -6 - 30•10 -6 g organskih kiselina u zapremini od 2,7•10 -6 - 40•10 -6 l u prisustvu fenolftaleina. Prema Mickovom istraživanju, koncentracija indikatora igra vrlo važnu ulogu u mikroacidimetriji. Fenolftalein je komponenta mnogih mješovitih indikatora. Zbog svojih svojstava pogodan je za kalorimetrijsko određivanje pH pomoću puferske otopine ili po Michaelis metodi bez puferskih otopina. Obojena forma poštuje Beerov zakon u širokom rasponu koncentracija.
Indikatori kiseline dolaze u više vrsta
Činjenica da fenolftalein mijenja boju nešto iznad 0 obično rezultira vrlo malom greškom u eksperimentu. Pored fenolftaleina, drugi indikatori uključuju bromotimol plavo i metilnarandžastu. Za rješenja koja se samo malo razlikuju od svoje krajnje tačke, bromotimol plava je dobar pokazatelj. Nešto ispod pH vrijednosti od 7, otopina je žute boje, koja postaje plava neposredno iznad pH vrijednosti. Kada je krajnja tačka titracije prilično kisela, koristi se metilnarandžasta.
Fenolftalein se takođe može koristiti kao reagens u kvalitativnoj analizi. Prema Sachsu, neki nerastvorljivi hidroksidi metala, kao što su olovo, kadmijum, cink, magnezij, itd., kada se prskaju fenolftaleinom, daju boju, što se objašnjava adsorpcijom indikatora. Druga grupa reakcija zasniva se na činjenici da se u alkalnoj sredini fenolftalein redukuje cinkom u bezbojni fenolftalein. Ovo leuko jedinjenje oksidira se određenim supstancama, a zatim se ponovo pojavljuje crvena boja fenolftaleina. Sličan efekat je primećen sa vrlo malim količinama jona cijanida (0,01-0,05 mg/l) u prisustvu bakar sulfata u tragovima. Sa vrlo malim količinama bakra (10 -4 - 10 -5%), uvođenje vodonik peroksida u sistem dovodi do povećanja brzine oksidacije leuko jedinjenja.
Jedan od derivata fenolftaleina, fenolftalein fosfat, koristi se za određivanje aktivnosti enzima fosfataze. Fenolftalein fosfat sam po sebi nema indikatorska svojstva, već se uništava djelovanjem enzima; fosfatne grupe se odcjepljuju djelovanjem supstrata i pojavljuje se crvena boja fenolftaleina.
U medicini se fenolftalein koristi kao laksativ, a lijek se zove purgen.
1.3 Hemijska svojstva
Interval prelaza boje fenolftaleina kreće se od pH 8,2 (bezbojno) do pH 9,8 (ljubičasto). Za određivanje prelaznog intervala koristi se niz puferskih otopina sa sljedećim pH vrijednostima: 7,8-8,0-8,2-8,4-9,0-9,6-9,8-10,0-10,2. pH vrijednosti na kojima se pojavljuje prva ružičasta boja ovise o koncentraciji indikatora. Intenzitet ljubičaste boje postepeno se povećava do pH 9,8: pH 1/2 9,53.
Proces nastajanja obojenog dianona kinoidne strukture (III), koji nastaje kao rezultat interakcije fenolftaleina sa razrijeđenim alkalnim rastvorom (pH8,5), može se predstaviti na sljedeći način:
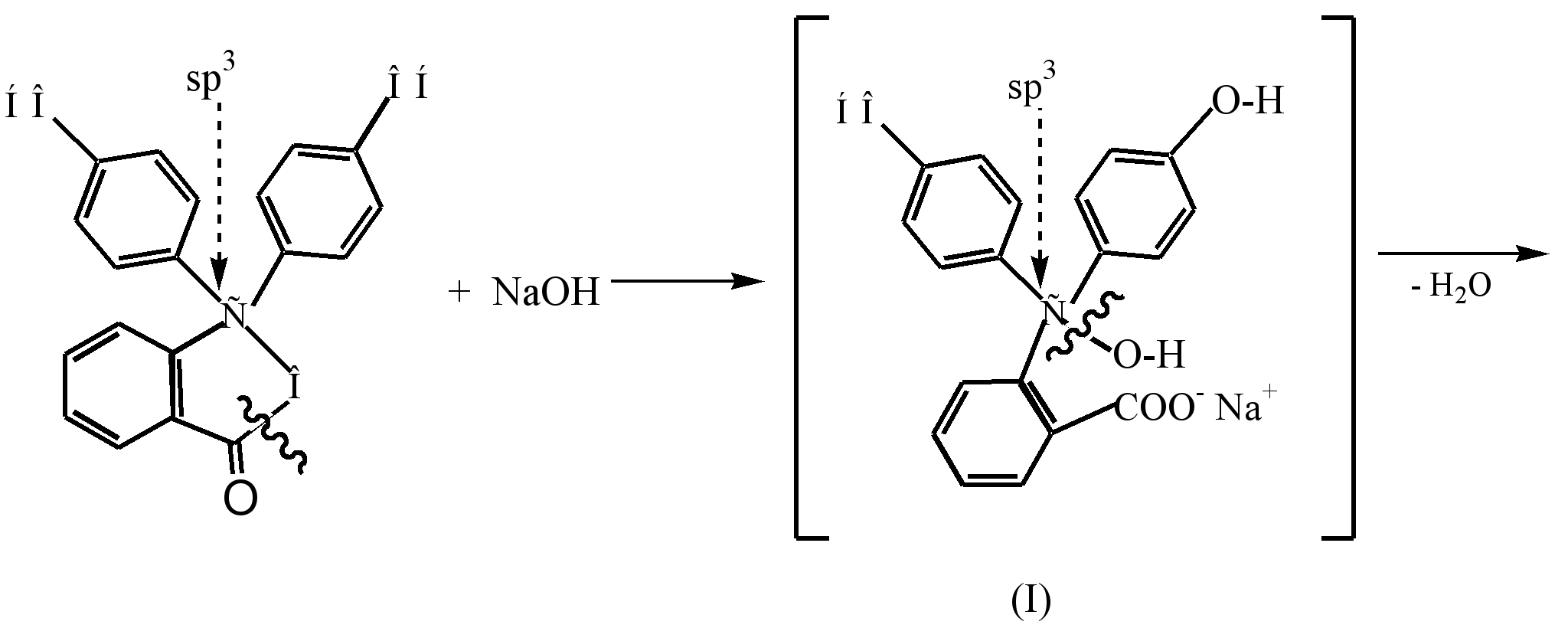

Pod uticajem alkalija u bezbojnom fenolftaleinu, β-laktonski prsten se otvara (hidrolizira), a nastali bezbojni alkohol (I) spontano se odvaja od molekule vode i formira mononatrijumovu so (II) žuta. Dalja interakcija sa alkalijom dovodi do stvaranja dinatrijumove soli (III) i produbljivanja boje do grimizne, što je posledica produžavanja lanca konjugacije.
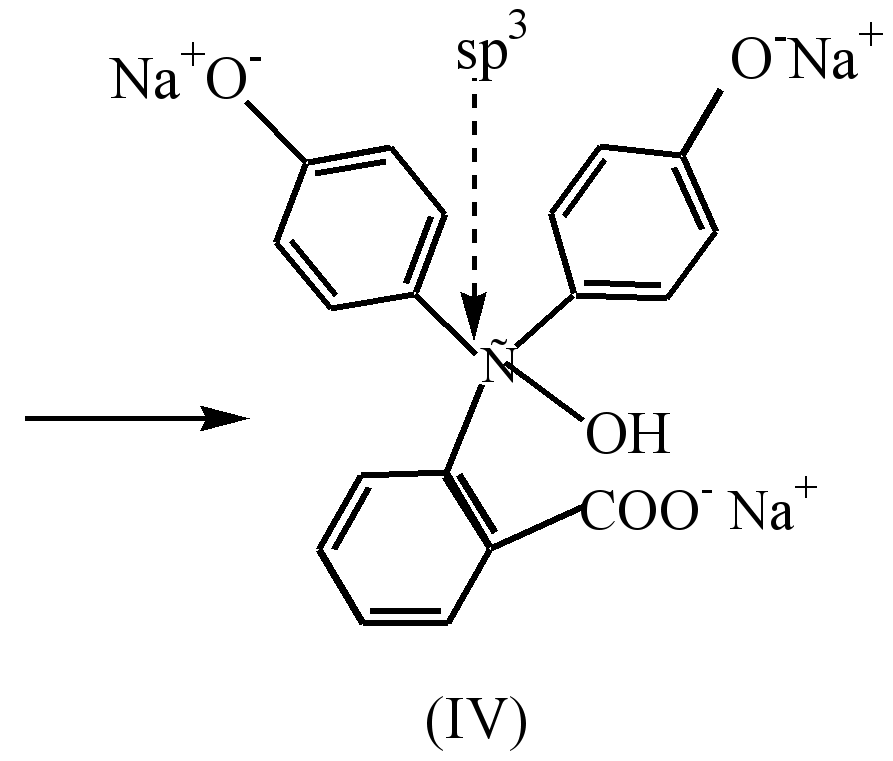
U jako alkalnoj sredini (pH10), promjena boje otopine je uočena kao rezultat tranzicije dinatrijumove soli (III) u trinatrijumovu so (IV), u kojoj prstenovi nisu međusobno konjugovani.
U kiseloj sredini je bezbojan, jer su slabi benzenski hromofori izolovani, autonomni i u?,? – sljedeće ne stupaju u interakciju (sučelje) jedno s drugim:
Da li su odvojeni od sp 3 - atoma ugljika koji je izolator, a ne provodnik? – elektroni. U alkalnoj sredini, ciklus laktona je prekinut, jedan od fenolnih hidroksila se jonizuje, a atom C sp 3 poprima konfiguraciju C sp 2, postajući provodnik? – elektroni između benzen hromofora, pored polarizovanih auksohroma – COO - i –O -. U koncentrovanoj sumpornoj kiselini indikator se okreće narandžasta. Intenzitet boje ljubičastih alkalnih otopina opada stajanjem, dijelom zbog stvaranja bezbojne karboksilne baze (ovo je reverzibilna transformacija), dijelom zbog ireverzibilne oksidacije zrakom
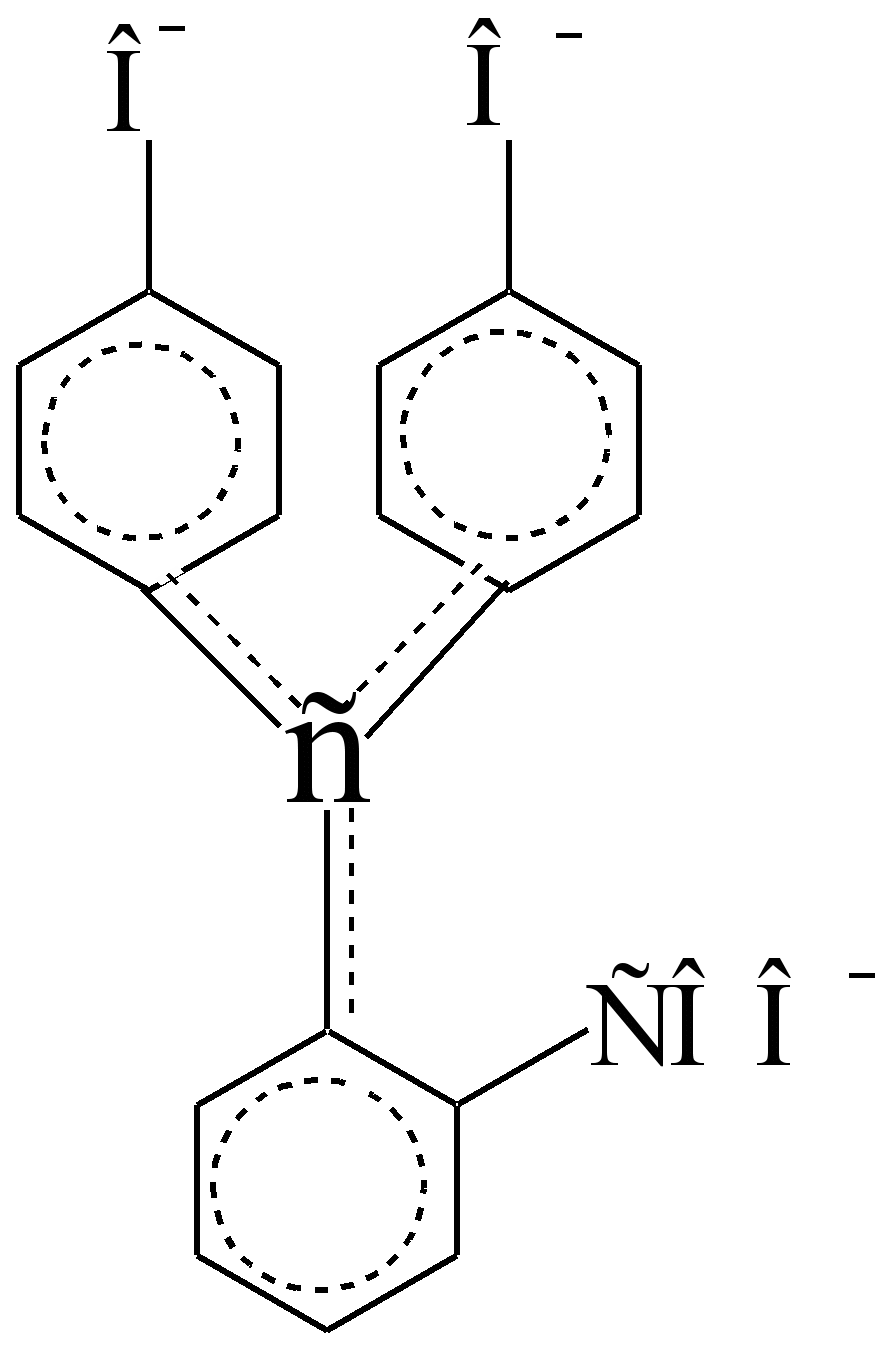
Fenolftalein hromofor
(alkalni oblik, 1 = 553 nm, 1 = 9000)
1.4 Priprema fenolftaleina
Glavna metoda za proizvodnju fenolftaleina je kondenzacija fenola sa ftalnim anhidridom. Ova reakcija je poseban slučaj Friedel-Craftsove acilacije. Reakcija se događa kada se zagrije s kiselim katalizatorom (koncentrirana sumporna kiselina ili cink klorid):
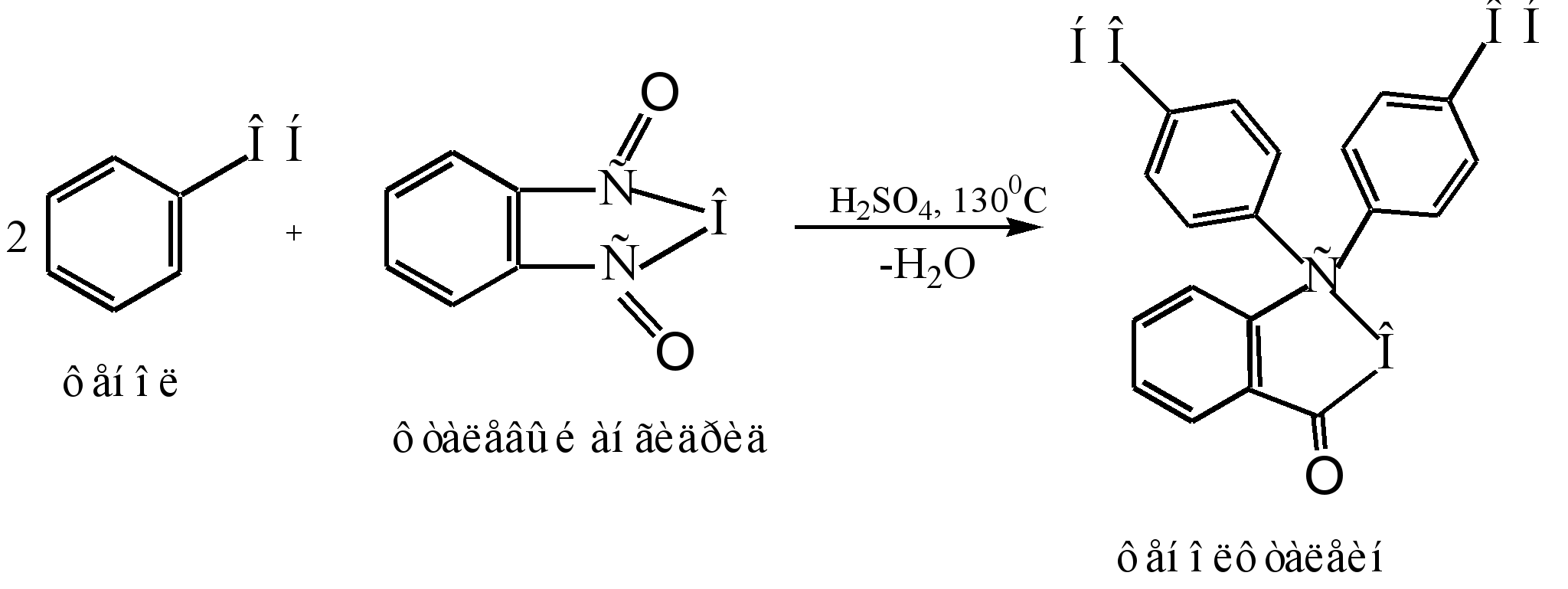
Mehanizam reakcije se može predstaviti na sljedeći način:

Sigma - kompleks
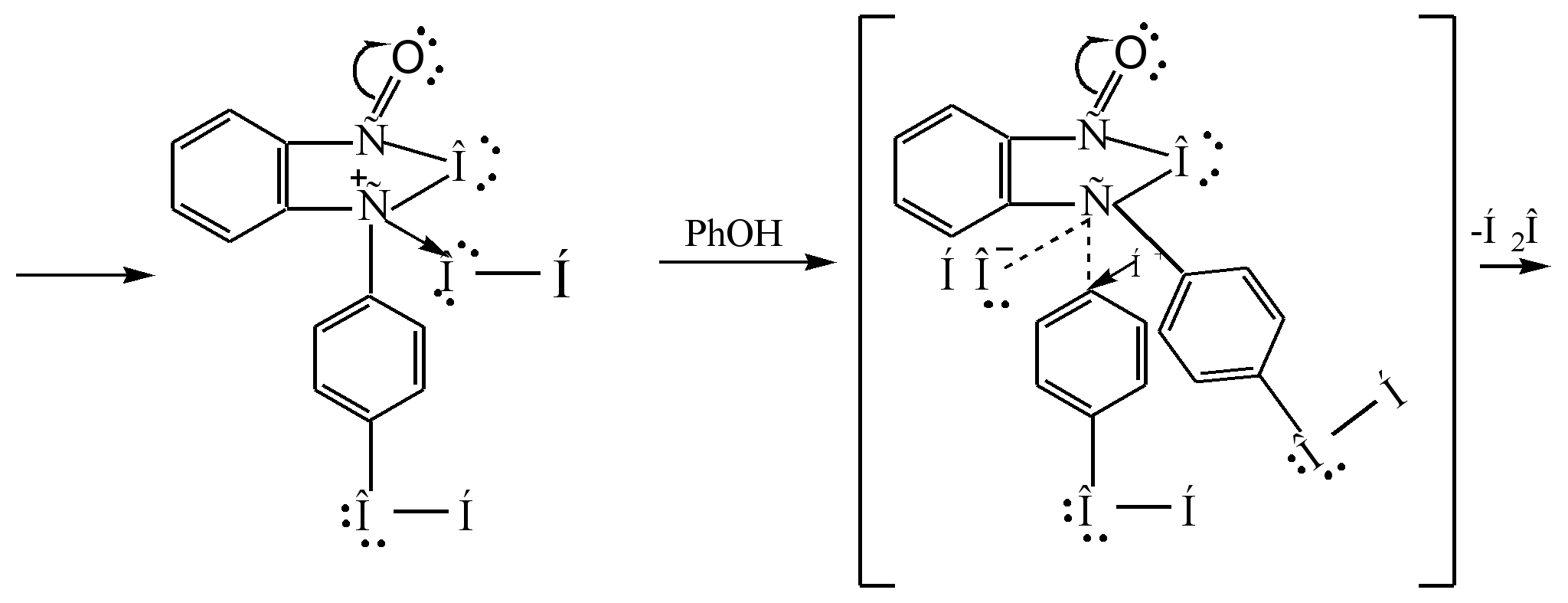
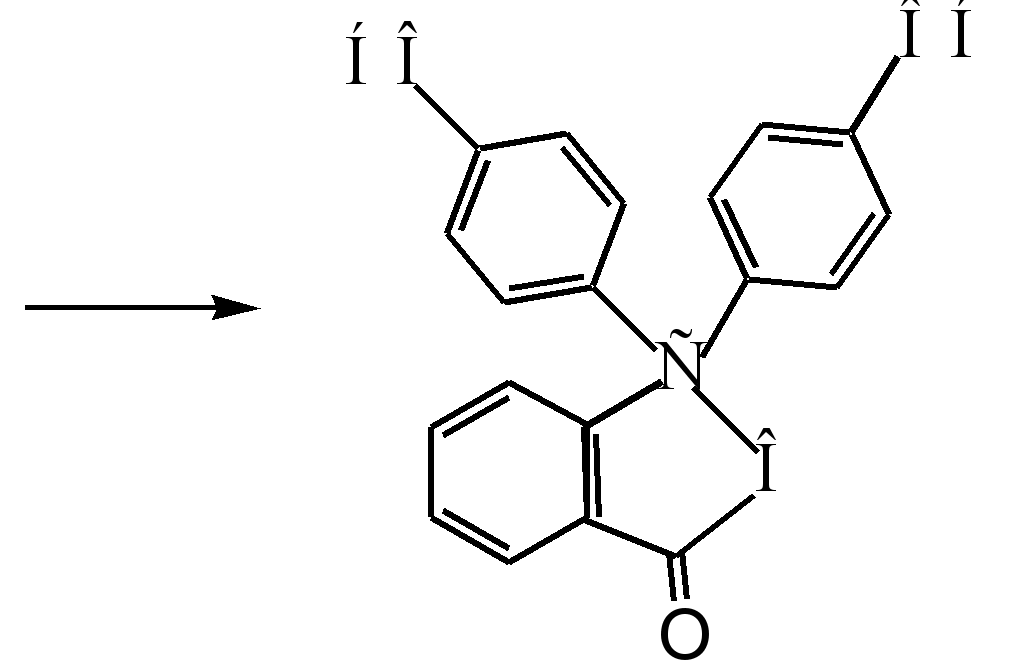
fenolftalein
1.4.1 Metode za dobijanje fenolftaleina
Analizom literarnih izvora o ovoj problematici, ustanovljeno je da u svemu metodološki priručnici Dat je isti metod za dobijanje fenolftaleina. Zasnovan je na gore predstavljenoj reakciji. Tehnika je u potpunosti prikladna za naše laboratorijske uslove.
Za sintezu će vam trebati sljedeći reagensi, stakleno posuđe i oprema:
Ftalni anhidrid-5g; fenol - 10g; sumporna kiselina - 2ml; natrijum hidroksid - 4-5%; octena kiselina (koncentrovana); hlorovodonična kiselina (koncentrovana); etil alkohol (apsolutni).
Tikvica sa okruglim dnom (50ml) – 1 kom; čaša (100ml) – 1 kom.; porcelanska šolja – 1 kom.; konusne tikvice (250ml) – 2 kom.; termometar; uređaj za destilaciju parom; peščano kupatilo.
Sinteza napretka:
Smjesa od 5 g ftalnog anhidrida, 10 g fenola i 2 ml sumporne kiseline stavi se u tikvicu i zagrijava u pješčanoj kupelji 1,5 sat, strogo održavajući temperaturu od 125 - 130 C 0 (termometar u topljeni i periodično mešanje sadržaja). Vruća smjesa se sipa u tikvicu sa 100 ml ključale vode, fenol koji nije izreagovao se destiluje parom. Kako bi se izbjeglo prskanje i rezultirajući gubitak tvari, tekućina se mora stalno miješati. Završetak destilacije može se uočiti po promjeni zamućenosti destilata: ako destilat otječe pomalo zamućen, destilaciju treba nastaviti, ako je destilat bistar, destilaciju se može zaustaviti. Rastvor se ostavi da se ohladi, nakon čega se dekantira u Buchnerov lijevak, pokušavajući, ako je moguće, da se talog ne prenese u filter. Proizvod se zatim pere dekantiranjem u dvije male porcije hladnom vodom, dodati ono što je završilo na filteru u masu čvrste tvari u čaši, otopiti u mala količina topli 4-5% natrijum hidroksid i neizreagirani ftalni anhidrid se odvaja filtracijom. U tamnocrveni filtrat se dodaje sirćetna kiselina dok se fenolftalein potpuno ne istaloži, zatim se doda 1-2 kapi hlorovodonične kiseline i ostavi 1 sat.
Oslobođeni fenolftalein u obliku žućkastog pijeska se odsisava pomoću Buchnerovog lijevka. Sirovi proizvod se prebaci u čašu i rastvori uz zagrijavanje u približno 10 ml alkohola. Vrući rastvor se odsisa, a talog na filteru se ispere vrelim alkoholom. Filtrirajte kroz filter navlažen alkoholom kako biste uklonili sve ispuštene kapljice ulja. Filtrat se prenosi u porculansku čašu i zagrijava u vrućoj pješčanoj kupelji kako bi se uklonio veći dio alkohola. Smjesa u šolji se ostavi da odstoji 30 minuta. Oslobođeni bezbojni ili svijetložuti kristali se odsisavaju i suše na zraku između listova filter papira.
1.4.2 Fizička svojstva supstanci koje se koriste u sintezi
Tabela 1
Fizička svojstva supstanci koje se koriste u sintezi
| Ime | Formula | izgled | T pl, 0 C | T ključanja, 0 C | rastvorljivost |
|
| U vodi | u drugom |
|||||
| Fenolftalein | C 20 H 14 O 4 | Bezbojne ili peščane iglice u obliku dijamanta, bez mirisa, nisu postojane na vazduhu | 261 | vatra- izgleda | Slabo rastvorljiv (0,0002 g u 100 g vode) | Dobar u etanolu, umeren u dietil eteru, takođe rastvorljiv u alkalnim rastvorima. |
| fenol | C 6 H 5 OH | Bezbojne ili ružičaste rombične iglice | 41-43 | 182 | Na hladnom - umjereno Vruće - dobro | Dobar u etanolu, eteru, hloroformu, glicerinu, ugljen-disulfidu |
| Ftalni anhidrid | C 8 H 4 O 3 | Bijele dijamantske igle | 130,8 | Vozg 284.3 | Loše | U etanolu, etru, hloroformu |
| Sumporna kiselina | H2SO4 | Bezbojna, viskozna tečnost, neprijatnog mirisa | 10,37 | 330 | | reaguje |
| Natrijum hidroksid | NaOH | Bijeli difuzni, rombični kristali | 320 | 1378 | Rastvorljiv sa oslobađanjem toplote | U alkoholu, glicerinu, fenolu, etru, acetonu |
| sirćetne kiseline | CH 3 COOH | Bezbojna tečnost sa jakim neprijatnim mirisom | 16,6 | 118,1 | | U etanolu, eter |
| Hlorovodonična kiselina | HCI | Žućkasta tečnost, dimi se na vazduhu, neprijatnog mirisa | -15,35 | - | U redu | U alkoholu |
1.4.3 Tehnika destilacije parom
Budući da će tokom sinteze biti potrebno destilirati neizreagirani fenol destilacijom vodenom parom, potrebno je razmotriti metodologiju za njegovu provedbu.
Destilacija se vrši u uređaju koji se sastoji od generatora pare sa sigurnosnom cijevi, Claisen tikvice za destilaciju (250 ml), termometra, direktnog Liebigovog kondenzatora, alonže i prijemnika. Generator pare i tikvica za destilaciju su spojeni preko T-a na jedan od ogranaka na koji se stavlja gumena cijev sa Hoffmannovom stezaljkom i zagrijavaju u pješčanoj kupelji.
Napredak destilacije (destilacije): vruća talina se stavlja u tikvicu za destilaciju sa 100 ml kipuće vode. Zagrijavanjem generatora pare i tikvice za destilaciju sakuplja se destilat koji sadrži neizreagirani fenol. Na njegovo prisustvo ukazuje zamućenost destilata. Destilacija se prekida kada se mutni destilat ocijedi, odnosno dok se ne pojavi bistar destilat. 
Fig.1 Aparat za destilaciju parom
1- sigurnosna cijev; 2 – cijev za dovod pare; 3 – trojnica; 4 – stezaljka; 5 – generator pare; 6 – Claisen boca; 7 – termometar; 8 – Liebig frižider; 9 – alonž; 10 – prijemnik; 11 – grejni plašt; 12 – pločica.
1.4.4 Metoda rekristalizacije iz vrućeg alkohola
Eksperimentalno, rekristalizacija se provodi na sljedeći način: Supstanca se stavlja u tikvicu okruglog dna i dodaje joj se malo rastvarača. Smjesa se zagrijava pod refluksom u vodenom kupatilu zagrijanom na ringli.
Većina tečnosti ima tendenciju da se pregrije i stoga snažno ključa. Da bi se to izbjeglo, u tikvicu se dodaje kipuća voda prije početka zagrijavanja.Kroz refluks kondenzator, rastvarač se postepeno dodaje u malim obrocima dok se supstanca potpuno ne otopi.
Nakon što se supstanca potpuno otopi, zagrijavanje se prekida i smjesa se ostavlja da se ohladi zajedno s vodom u kadi. Precipitirana supstanca se odfiltrira.
U većini slučajeva rekristalizacija je u dva koraka na pouzdan način prečišćavanje supstanci. 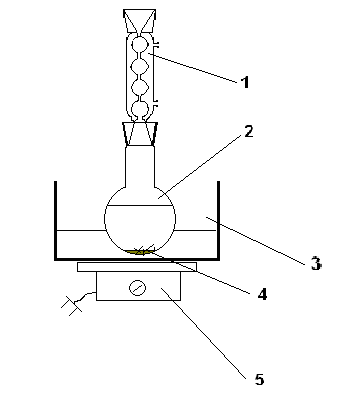
Fig.2 Uređaj za rekristalizaciju
1- refluks frižider; 2 – tikvica okruglog dna; 3 – vodeno kupatilo; 4 – lonci za vrenje; 5 – pločica.
1.5 Sigurnosne mjere pri izvođenju sinteze
1.5.1 Glavne opasnosti pri radu sa koncentrisanim kiselinama
1. Jake neorganske kiseline izazivaju hemijske opekotine ako dođu u kontakt sa kožom.Za hemijske opekotine uzrokovane kontaktom s kožom koncentrisane kiseline, operite opečeno područje jakom mlazom vode, a zatim 1% rastvorom natrijum bikarbonata (koji se nalazi u kompletu prve pomoći). Ako vam kiselina dospije u oči, treba ih odmah isprati 1% rastvorom natrijum bikarbonata i destilovanom vodom sobne temperature. Potražite pomoć od ljekara.
2. Zbog činjenice da se koncentrovana hlorovodonična kiselina pari sa hlorovodonikom, potrebno je raditi sa njom pod dobro funkcionalnom propuhom i spuštenom promajnom zavesom. Ako ste otrovani parama hlorovodonika, morate odmah izaći na svež vazduh.
3. Prosuta kiselina mora se prekriti pijeskom i neutralizirati čvrstim natrijum karbonatom dok ne prestane razvijanje plina. Nakon potpune neutralizacije, isperite pijesak velikom količinom vode iz slavine, provjerite potpunost ispiranja (provjerite na Cl - pomoću AgNO 3) i nakon sušenja u sušioniku vratite u kutiju s pijeskom.
1.5.2 Glavne opasnosti tokom destilacije vodenom parom
Glavne opasnosti tokom destilacije povezane su s korištenjem električnih uređaja za grijanje (električni štednjaci, grijalice za plašt).1. Kabel (ne možete koristiti peći sa kablom umotanim u krpe), utikač i tijelo električne peći ne smiju imati vidljiva oštećenja.
2. Neprihvatljivo je provjeravati temperaturu površine koja emituje toplinu rukama.
3. Električni štednjak treba uključiti i isključiti iz mreže umetanjem i izvlačenjem utikača, držeći jednom rukom utičnicu, a drugom utikač. Koristite prekidač za podešavanje grijanja.
4. U slučaju termičke opekotine potrebno je dugotrajno namazati opečeno područje sa 0,5% rastvorom kalijum permanganata, zatim ga pokriti sterilnim zavojem i obratiti se lekaru. Kod opekotina 3. i 4. stepena odmah staviti sterilni zavoj i obratiti se lekaru.
1.5.3 Glavne opasnosti tokom rekristalizacije iz vrućeg alkohola
1. Ukupna zapremina dodanog alkohola ne bi trebalo da prelazi 200 ml i ne sme da zauzima više od 1/3 zapremine tikvice.2. Veličina vodenog kupatila treba da bude veća veličina površina pločice koja zrači toplotom.
1.5.4 Osobine rada sa supstancama koje se koriste u sintezi
Većina hemikalije otrovan u jednom ili drugom stepenu. Mjere opreza pri radu s njima usmjerene su na sprječavanje prodiranja ovih tvari u tijelo kroz usta, pluća i kožu.Pri sintezi će se koristiti potencijalno opasne supstance: fenol, sumporna kiselina, sirćetna kiselina i hlorovodonična kiselina.
Fenol je bezbojna (ružičasta), kristalna supstanca sa karakterističnim mirisom. Maksimalna dozvoljena koncentracija u vazduhu radnog prostora je 0,3 mg/m 3. Klasa opasnosti dva. Svi radovi s fenolom se izvode u dimovodu. Toksično dejstvo: nervni otrov, ima jako lokalno nadražujuće i kauterizirajuće dejstvo, izaziva opšte teško trovanje. Moguća smrt. Situacija je komplicirana činjenicom da tvar uzrokuje lokalnu anesteziju. Prva pomoć: ako dospije na odjeću, odmah je promijenite, ako dospije na kožu, isperite. biljno ulje ili rastvor sa masenim udelom etanola 10 - 40%.
Hlorovodonična kiselina spada u drugu klasu opasnosti (maksimalna koncentracija u vazduhu radnog prostora je 5 mg/m 3 u odnosu na HCl, svi radovi sa koncentrovanom hlorovodoničnom kiselinom moraju se obavljati i u dimovodu); emituje pare hlorovodonika. Ako ste otrovani parama hlorovodonika, morate izaći na svež vazduh.
Sumporna kiselina ( = 1,84 g/cm 3) – MPC rz = 1 mg/m 3. Klasa opasnosti dva. Nakon otprilike 5 s počinje snažna dehidracija tkiva u koje je kap ušla. Prva pomoć: pranje kože tekuća voda nakon čega slijedi neutralizacija.
Sirćetna kiselina – MPC rz = 5 mg/m3. Klasa opasnosti tri7. Pare iritiraju gornje disajne puteve sa masenim udjelom tvari preko 30% djeluju na kožu, a preko 2% na oči. Prva pomoć: (vidi sumporna kiselina i hlorovodonična kiselina).
1.6 Karakteristike rastvarača
Dielektrična konstanta zauzima posebno mjesto u karakteristikama rastvarača. Prednost ovog drugog u odnosu na druge kriterije je zbog jednostavnosti elektrostatičkih modela solvatacije, te je stoga dielektrična konstanta postala korisna mjera polariteta rastvarača. U tom smislu, važno je jasno znati šta tačno odražava makroskopska permeabilnost otapala, koja se naziva i relativna dielektrična konstanta:
r = 0 /
0 – dielektrična konstanta vakuuma.
Dielektrična konstanta se određuje stavljanjem rastvarača između dvije nabijene ploče kondenzatora. U prisustvu rastvarača, napetost električno polje između ploča E opada u odnosu na napetost E 0 izmjerenu u vakuumu, a odnos E 0 / predstavlja dielektričnu konstantu rastvarača. Ako molekuli rastvarača nemaju svoj trajni dipolni moment, tada se pod utjecajem vanjskog polja unutarmolekulski naboji razdvajaju, izazivajući dipol.
IN električno polje molekule sa trajnim ili induciranim dipolom su orijentisane na određeni način; ovaj fenomen se naziva polarizacija. Što je veći stepen polarizacije, to je veći pad jačine električnog polja. Stoga je dielektrična konstanta direktno povezana sa sposobnošću rastvarača da odvaja naelektrisanja i orijentiše sopstvene dipole.
1.6.1 Klasifikacija rastvarača prema fizičkim svojstvima.
Dielektrična konstanta (DP) otopine je jedan od najvažnijih faktora među onima koji imaju najviše jak uticaj na karakteristike procesa koji se odvija u rastvoru.
Vrijednosti DP pojedinačnih rastvarača variraju u vrlo značajnim granicama - od -1,8 (alkani) do 170-180 (N-alkilamidi alifatičnih karboksilnih kiselina). Terminologija koja je u osnovi gradacije rastvarača prema DP nije sasvim jasna i konzistentna. Rastvarači sa visokim DP nazivaju se polarnim pa čak i visoko polarno, iako se, striktno govoreći, izraz "polarni" odnosi na dipolni moment µ molekule rastvarača, tj. karakteriše ne makro- već mikrosvojstvo rastvarača.
Međutim, kao što slijedi iz teorije koja povezuje sa µ, u opštem slučaju dolazi do simpatične promjene ovih veličina. Osim toga, da bi se otapala okarakterizirali prisustvom ili odsutnošću dipolnog momenta u njihovim molekulima, uvedena je terminologija "dipol" (µ0). i “apolarni” (µ = 0) rastvarači.
Niskopolarni uključuju rastvarače čiji je DP u opsegu = l.8h12, srednjepolarni rastvarači uključuju rastvarače sa = 12h50, a visokopolarne rastvarače sa > 50. Relativnost ove podjele leži ne samo, pa čak ni tako mnogo u ovim prilično proizvoljno odabranim intervalima, ali i u mnogo značajnijim okolnostima.
Uprkos povezanosti između DP i dipolnog momenta pojedinačnog fluida, koja je prilično jasno utvrđena teorijom, treba upozoriti na kategorički nedvosmislen paralelizam između veličina i µ . Činjenica je da antiparalelno (ali ne i lančano) udruživanje dipola dovodi do smanjenja dipolnog momenta suradnika u odnosu na dipolni moment jedne molekule i, posljedično, do smanjenja DP tekućine. Zbog toga DP tekućina formiranih od molekula s relativno velikim dipolnim momentom može biti prilično nizak.
Na polaritet rastvarača značajno utiču njegove strukturne karakteristike. Strukturirani rastvarači, po pravilu, imaju visok DP.
Dielektrična konstanta zajedno sa formiranjem homomolekula hemijske veze- jedan od najvažnijih faktora koji određuju svojstva pojedinih tečnosti, koja zavise od energije međumolekulske interakcije. Ovo posljednje je određeno reaktivnom interakcijom, čija energija ovisi o statičkom DP (), DP ekstrapoliranom na beskonačno dugu valnu dužinu ( ) i uzetom jednakim? 1,1 n D, kao i dipolni moment µ i molarni volumen?:
E R = 
Vrijednosti energije reaktivne interakcije dipolnih molekula niza otapala date su u tabeli 1.
Kako naglašava M.I. Shakhparonov, reaktivno polje polarnih molekula ne dovodi do stvaranja hemijskih struktura (homomolekularnih saradnika), čije postojanje je određeno hemijskim interakcijama. Stabilnost potonjeg opada sa povećanjem energije reaktivnog polja.
Energija reaktivnog polja objašnjava brojna fizička svojstva otapala, pa bi stoga moglo biti korisno klasificirati otapala prema njihovoj vrijednosti - Er .
Očigledno, svi rastvarači čiji molekuli nemaju dipolni moment formiraće klasu nereaktivnih tečnosti. Rastvarači sa energijom reaktivnog polja u opsegu - Er = 0h5 kJ·mol -1 čine klasu niskoreaktivnih, u opsegu - Er =5h15 kJ mol -1 - srednje reaktivne i, konačno, rastvarači sa – E R 25 kJ mol -1 čine klasu visoko reaktivni rastvarači.
Visoko reaktivne tečnosti po pravilu dobro otapaju i neelektrolite i elektrolite, a ovi se u njima bolje disociraju u odnosu na druge klase (prema ovom sistemu klasifikacije) rastvarača. To se objašnjava činjenicom da visoko reaktivna otapala kombinuju visoke vrijednosti DP i dipolnog momenta.
Tabela 2
Energija reaktivnog polja nekih rastvarača na 298,15 K.
| Solvent | -E R , kJ mol -1 | rastvarač | -E R , kJ mol -1 |
| Anilin | 2,9 | Metil etil keton | 3,4 |
| Aceton | 9,1 | Mravlja kiselina | 5,2 |
| Acetonitril | 20,9 | Nitrobenzen | 17,1 |
| Butil alkohol | 2,9 | Nitrometan | 17,5 |
| Voda | 18,6 | Piridin | 5,7 |
| Hexen-1 | 0,15 | Propilen karbonat | 43,8 |
| N,N-dimetilacetamid | 15,8 | Propil alkohol | 3,6 |
| Dimetil sulfoksid | 6,4 | Toluen | 0,05 |
| Dimetilformamid | 19,5 | Sirćetna kiselina | 3,7 |
| Dioxane | 0,07 | Tetrahidrofuran | 2,9 |
| 1,2 – dihloretan | 4,2 | Klorobenzen | 1,8 |
| o – ksilen | 0,12 | Etil acetat | 2,45 |
| n – ksilen | 0,05 | Etilen glikol | 8,9 |
| N-metilacetamid | 24,1 | Etanol | 4,7 |
| Metil format | 4,0 |
Po viskoznosti (tačnije, po koeficijentu viskoznosti ) tečnosti se dele na niskoviskozne sa 10 -2 Pa s.
Na osnovu specifične električne provodljivosti tečnosti se dijele na „provodne” tekućine sa oko 10 2 - 10 -1 cm·m -1 i više; “umjereno provodljiv” – sa oko 10 -1 – 10 -4 i sa 10 -4 cm·m -1 je klasifikovan kao “neprovodni”.
Pominje se i klasifikacija rastvarača po tačkama ključanja, u okviru koje se rastvarači dele na nisko vrela (150 0 C).
Za klasifikaciju rastvarača prema njihovoj sposobnosti isparavanja, predložena je relativna skala zasnovana na toplinama isparavanja. Stoga se razlikuju visoko hlapljiva (relativna isparljivost 35) otapala. Ako se fokusiramo direktno na toplinu isparavanja, onda bi visoko hlapljiva otapala trebala biti ona koja karakterizira toplina isparavanja H isparavanja Tabela 3
Klasifikacija rastvarača prema dielektričnoj konstanti
| HIGHLY POLAR |
|||
| SOLVENT |  r r | SOLVENT | r |
| Voda | 78,30 | DMF | 36,71 |
| Etilen glikol | 37,7 | benzonitril | 26,20 |
| Metanol | 32,66 | Nitrobenzen | 34,78 |
| DMSO | 46,45 | Glicerol | 51,7 |
| WEAK POLAR |
|||
| THF | 7,58 | Anhidrid sirćetne kiseline | 20,7 |
| Dietil eter | 4,20 | Butanon – 2 | 18,51 |
| Aceton | 20,70 | Pentanon – 2 | 15,38 |
| Etanol | 24,55 | Piridin | 12,91 |
| Sirćetna kiselina | 6,17 | Metil acetat | 6,68 |
| Propanol – 1 | 20,45 | Cikloheksanon | 16,10 |
| Butanol – 1 | 17,51 | Kinalin | 8,95 |
| Izoamil alkohol | 15,19 | Hloroform | 4,81 |
| Anilin | 6,71 | Amil alkohol | 13,9 |
| NON-POLARNI |
|||
| 1,4 - dioksan | 2,21 | Cikloheksan | 2,02 |
| Trihloretilen | 3,42 | N – pentan | 1,84 |
| Benzen | 2,27 | Ugljen disulfid | 2,64 |
| Toluen | 2,38 | Dietilamin | 3,78 |
| Tetrahlorid ugljenika | 2,23 | dietil karbonat | 2,82 |
| Trietilamin | 2,42 | ||
| n – heptan | 1,92 | ||
| n – heksan | 1,88 | ||
1.6.2 Sistemi klasifikacije rastvarača na osnovu njihovih hemijskih svojstava
Većina sistema za klasifikaciju rastvarača prema hemijskim karakteristikama, eksplicitno ili implicitno, uzimaju u obzir njihova kiselinsko-bazna svojstva. Stoga najviše opšti sistem klasifikacija rastvarača predviđa njihovu podjelu u dvije široke klase - donor
(bazni) i akceptor (kiseli), čija definicija, očigledno, predodređuje identifikaciju druge klase indiferentnih rastvarača. Uobičajeno je klasifikovati svako specifično otapalo kao jednu od ovih klasa, makar samo zato što sposobnost molekula rastvarača da donira ili prihvati elektronski par od partnera zavisi od svojstava i rastvarača i otopljenog jedinjenja. Zbog toga ova klasifikacija predviđa karakteristično ponašanje rastvarača u reakcijama ili procesima solvatacije.
Zajednička karakteristika donora otapala je preferencijalna solvatacija kationa kao čestica koje karakteriše nedostatak elektrona. Isto tako, akceptorski rastvarači prvenstveno solvatiraju anione kao vrste sa viškom elektrona.
Raznolikost donorskih rastvarača određena je relativno velikim brojem elemenata čiji atomi mogu djelovati kao donori elektronskog para, te raznolikošću hemijskih spojeva ovih elemenata. Predstavnici ove klase rastvarača se stoga dijele na N-baze (amine ili amide razne vrste), 0-baze (eteri i estri, alkoholi, ketoni, rjeđe aldehidi), S-baze (tioeteri, tioalkoholi, sulfoksidi), P-baze (trialkil-, triaril- ili alkilarilfosfini) itd.
Akceptorski rastvarači se dijele na protonske and aprotic.
Otapala koja mogu sudjelovati u protolitičkoj ravnoteži, ovisno o funkciji koju pokazuju, često se nazivaju protofilni (bazni) i protogeni (kiseli). Otapala koja podjednako lako pokazuju obje funkcije (alkoholi, ketoni) nazivaju se amfiprotični.
Mnogi molekuli rastvarača učestvuju u solvataciji stvaranjem vodoničnih (H-) veza. U skladu s tim, predložena je klasifikacija rastvarača prema njihovoj sposobnosti stvaranja H-veza.
Prvu klasu u ovom klasifikacionom sistemu čine tečnosti u kojima postoji trodimenzionalna mreža H-veza. Rastvarači ove klase (voda, mravlja kiselina, sumporna kiselina, glikoli) odlikuju se veoma visokim DP i relativno visokim viskozitetom i energijom aktivacije viskoznog toka. Po pravilu, rastvarači ove klase se dobro rastvaraju jedno u drugom, formirajući heteromolekularne asociate preko H-veze.
Druga klasa su tečnosti sa dvodimenzionalnom mrežom H-veza. Molekuli rastvarača ove klase po pravilu sadrže jednu hidroksilnu grupu (monohidrični alkoholi, jednobazne karboksilne kiseline, fonoli itd.). Tendencija formiranja heteromolekularnih asocijacija u ovoj grupi rastvarača je generalno manje izražena nego kod predstavnika prve klase.
Treća klasa objedinjuje tečnosti čiji molekuli sadrže atome azota, kiseonika, sumpora, fluora itd., sposobne da formiraju H-veze sa donorima protona. Ova klasa uključuje estre, amine, ketone, aldehide, itd.
Četvrta klasa uključuje tečnosti čiji molekuli mogu biti donori protona. To uključuje hloroform, dihloretan itd.
Peta klasa objedinjuje tečnosti čiji molekuli nisu sposobni normalnim uslovima učestvuju u formiranju H-veza. U ovu grupu spadaju alkani, ugljen-tetrahlorid, perhaloalkani itd.
Parker je predložio klasifikaciju rastvarača prema njihovoj sposobnosti da solvatiraju jone. U okviru ove klasifikacije, rastvarači su podijeljeni u grupe.
Apolarni aprotik - tečnosti sa niskim DP (
Dipolarni aprotični - tečnosti sa relativno visokim vrednostima DP ( > 15) i dipolnih momenata (µ > 2D) ,
ne sadrži vodonik sposoban za stvaranje H-veze. Predstavnici ove grupe rastvarača su sumpor dioksid, nitrobenzen, nitrometan, acetonitril, propilen karbonat, DMSO itd.
Protične - tečnosti čije molekule sadrže grupe u kojima je atom vodonika povezan sa elektronegativnim atomom. Jedinjenja uključena u ovu grupu (karboksilne kiseline, alkoholi, fenoli, itd.) odlikuju se jasno izraženom sposobnošću formiranja H-veze.
Sposobnost rastvaranja rastvarača uglavnom raste od prve grupe do treće.
Brønsted je predložio klasifikaciju otapala na osnovu kombinacije dielektrične konstante i protogenosti. U skladu sa ovim karakteristikama, podelio je rastvarače u osam grupa.
Primjeri otapala u okviru klasifikacije Brensted su: I - voda II - hidrazin, DMSO IV - propilen, nitrometan; tečni bromo- i vodonik jodid VII - trietilamin, piridin VIII - heksan, hlorobenzol;
Brønstedova klasifikacija omogućava predviđanje kiselinsko-baznih svojstava otopljenih jedinjenja u rastvaračima svake grupe. Dakle, u rastvaraču grupe II jačina baza je znatno veća nego u rastvaraču grupe III; Jačina kiselina u rastvaračima grupe III je generalno veća nego u rastvaračima grupe VII itd.
Tabela 4
Klasifikacija rastvarača prema Brønstedu.
| Nekretnina | Tip rastvarača |
|||||||
| I | II | III | IV | V | VI | VII | VIII |
|
| DP | + | + | + | + | - | - | - | - |
| Protogenost | + | + | - | - | + | + | - | - |
| Protofilnost | + | - | + | - | + | - | + | - |
* Znakovi + i – u prvom redu odgovaraju visokom i niskom DP, u preostalim redovima - prisutnosti ili odsustvu ovog svojstva.
Predložena je i klasifikacija rastvarača na osnovu osam fizičkih karakteristika: Kirkwoodove funkcije, molarne refrakcije, Hildebrandovog parametra rastvorljivosti, indeksa prelamanja, tačke ključanja, dipolnog momenta, kao i energija najviše popunjene i najniže nepopunjene molekularne orbitale. Na osnovu kombinacije ovih svojstava, predlaže se podjela otapala u devet grupa:
1) aprotični dipolarni (npr. acetonitril, nitrometan, aceton, 1,2-dihloretan);
2) aprotični visoko dipolarni (DMSO, DMF, DMAA, propilen karbonat, nitrobenzen);
3) aprotični, visoko dipolarni i visoko polarizabilni (sulfolan, HMFTA);
4) aromatični nepolarni (benzen, toluen);
aromatični relativno polarni (hlorobenzen, o-dihlorobenzen, acetofenon);
donor elektrona (trietilamin, etri, dioksan);
rastvarači sa H-vezama (alkoholi, karboksilne kiseline);
snažno povezani rastvarači sa H-vezom (formamid,
dietilen glikol, voda);
rastvarači s neodređenom funkcijom (ugljični disulfid, kloroform).
1.7 Pregled metoda za određivanje rastvorljivosti čvrstih materija
1.7.1 Gravimetrijsko određivanje rastvorljivosti
Metoda se sastoji u određivanju mase supstance rastvorene u određenoj masi rastvarača (specifična rastvorljivost P ` ) i izračunavanje rastvorljivosti kao mase supstance koja se može rastvoriti u 100 grama datog rastvarača. Metoda je evaluativna.Uzorak ispitivane supstance se važe na tehnohemijskoj vagi (g 1 ` ). Odvažite uzorak rastvarača (g p). Odredite masu suvog filtera (g 2). Sipati uzorak supstance u rastvarač, ako se supstanca potpuno otopila, potrebno je dodavati dok se otapanje ne zaustavi, zabilježiti kompletan uzorak supstance uliven u rastvarač (g 1). Filtrirajte neotopljenu supstancu kroz filter i odredite masu mokrog filtera sa preostalom supstancom (g 3). Osušite filter sa preostalom tvari do konstantne težine (g 4). Izračunajte specifičnu rastvorljivost koristeći formulu:
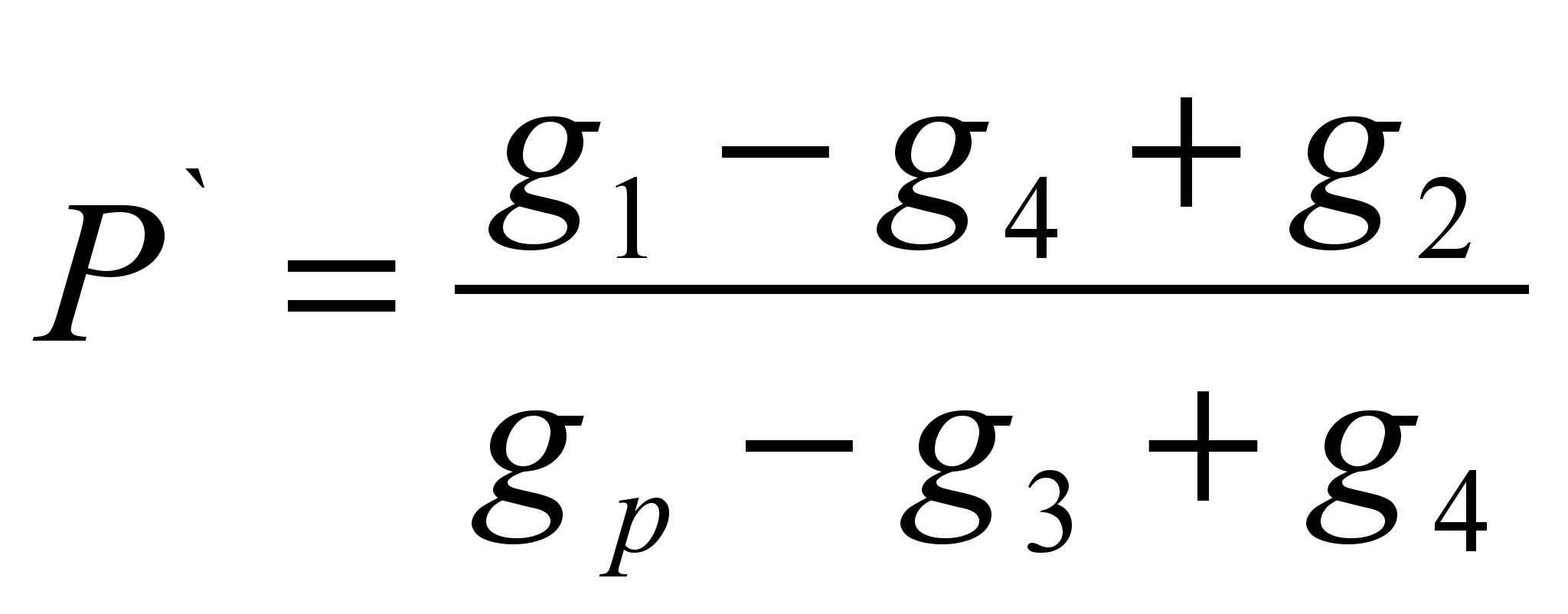
P = P` 100 (g/100 g)
Tabela 5
Rastvorljivost fenolftaleina u nekim rastvaračima
| rastvarač | rastvorljivost | r |
| Jako polarna |
||
| Voda | 0,0002 | 78,30 |
| Metil alkohol | 19,42 | 52,66 |
| Slabo polarna |
||
| Etanol | 17,29 | 24,55 |
| Aceton | 16,98 | 20,70 |
| hloroform | 2,97 | 4,81 |
| Nije polarna |
||
| ksilen | 0,19 | 2,43 |
| toluen | 0,17 | 2,38 |
| benzen | 0,16 | 2,27 |
1.7.2 Elektrohemijska metoda.
1. Montirajte instalaciju da odredite otpor zapremine rastvora elektrolita prema dijagramu (vidi sliku 3).
2. Vodeni rastvor kalijum hlorida određene koncentracije se sipa u mernu posudu do oznake i posuda sa elektrodama se drži u termostatu na datoj temperaturi. Nakon 15-20 minuta spojite posudu na tačke B i D na instalaciju.
3. Koristeći spremnik otpornika i pokretni kontakt C, most se balansira, postižući ili najmanji zvuk u telefonu ili minimalnu amplitudu sinusnog vala na ekranu ascilografa. Točki kompenzacije se pristupa ili s jednog kraja reokorda ili s drugog. Mjerenje i naknadno izračunavanje R x:
R x = R 1 
Ponovite 3-4 puta na različitim otporima R 1 . U ovom slučaju, pokretni kontakt ne bi trebao prilaziti krajevima reohorda. Ako su odstupanja u mjerenjima manja od 0,5%, rezultati se smatraju zadovoljavajućim i prelazi se na izračunavanje konstante posude koristeći formulu:
K=  /
w =
Rx
/
w =
Rx
gdje je R x otpor rješenja; -
specifična električna provodljivost.
4. Mala količina soli se sipa u 100 ml vode i, čvrsto zatvarajući tikvicu čepom, neprestano trese 20 minuta. Dobivena suspenzija se usisava kroz stakleni filter, a talog se koristi za pripremu zasićene otopine. Dobivena otopina se sipa u posudu za mjerenje električne provodljivosti i, nakon termostatiranja, mjeri se otpor otopine.
=
k /
Rx  = /
C
= /
C
Gdje je C normalnost rješenja, kg ekv/m 3.
Budući da je koncentracija soli u zasićenoj otopini niska, tada je = . Na osnovu jednadžbe:
C = ( r - V ) /
Gdje r– specifična električna provodljivost rastvora soli.
Proizvod rastvorljivosti za monovalentni elektrolit:
![]() = ( C ) 2
= ( C ) 2
6. Unesite rezultate u tabelu:
| sol | t, C 0 | , cm/m | Otpor, Ohm | K | | | C | L |
|||
| R 1 | R2(AC) | R 3(CB) | R X |
||||||||
Tabela 6
Specifična električna provodljivost KCI rastvora
| t, C 0 | 1 N KCI | 0,1 N | 0,02 N | 0,01 N |
| 10 4 , Ohm -1 cm -1 |
||||
| 0 | 654,1 | 71,5 | 15,21 | 7,76 |
| 10 | 831,9 | 93,3 | 19,94 | 10,20 |
| 14 | 906,3 | 102,5 | 21,93 | 11,21 |
| 16 | 944,1 | 107,2 | 22,94 | 11,73 |
| 18 | 982,2 | 111,9 | 23,97 | 12,25 |
| 20 | 1020,7 | 116,7 | 25,01 | 12,78 |
| 22 | 1055,4 | 121,5 | 26,06 | 13,32 |
| 24 | 1098,4 | 126,4 | 27,12 | 13,86 |
| 25 | 1118,0 | 128,8 | 27,65 | 14,13 |
| 26 | 1137,7 | 131,8 | 28,19 | 14,41 |
| 28 | 136,2 | 29,27 | 14,96 |
|
| 30 | 141,2 | 30,36 | 15,52 |
|
| 32 | 146,2 | 31,46 | 16,09 |
|
| 34 | 151,3 | 32,56 | 16,67 |
|
| 36 | 156,4 | 33,68 | ||
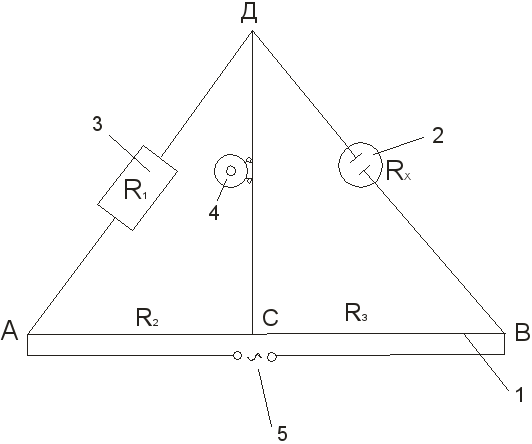
Fig.3 Instalacioni dijagram za određivanje električne provodljivosti:
1 – žica zategnuta preko ravnala; 2 – mjerna posuda sa elektrodama; 3 – reostat; 4 – niskoimpedansni telefon; 5 – izvor struje.
1.7.3
Fotoelektrokalometrijska metoda.
Metoda se zasniva na zakonu aditivnosti optičke gustine uz poštovanje osnovnog zakona apsorpcije svetlosti.
Napredak rada
1.Odabir optimalnih svjetlosnih filtera.
1.1. Stavite u odmjernu tikvicu od 25 ml:
Pomiješajte otopine i izmjerite optičke gustine u odnosu na odabrani rastvarač koristeći različite svjetlosne filtere u najpogodnijim kivetama. Odredite veličinu kivete. Pogledajte tehnički list uređaja za radnu proceduru za FEC.
1.2. Dobijene podatke unesite u tabelu:
1.3. Nacrtajte krivulje apsorpcije svjetlosti A = f(, nm) na milimetarskom papiru i odredite koji filteri talasne dužine se najbolje koriste tokom rada.
2. Konstrukcija grafova.
2.1. Pripremite seriju standardnih rješenja. Izmjerite optičku gustoću svake pripremljene serije standardnih otopina koristeći prethodno odabrane svjetlosne filtere.
2.2. Eksperimentalne podatke uneti u tabelu (vidi dole) za svaku seriju rešenja posebno i izvršiti statističku obradu dobijenih rezultata.
2.3. Koristeći tabelarne podatke na milimetarskom papiru, konstruišite grafove A = f(C supstance) i izračunajte rastvorljivost fenolftaleina u rastvaračima.
Proučavanjem literature o pitanju rastvorljivosti fenolftaleina, odabrane su gore navedene metode. I upoređujući ih prema mogućnosti upotrebe u našim laboratorijskim uslovima, u smislu trajanja i lakoće implementacije, odabrana je gravimetrijska metoda za određivanje rastvorljivosti.
2. Eksperimentalni dio
2.1 Sinteza fenolftaleina
Sinteza je izvedena prema metodi navedenoj u pregledu literature (tačka 1.4.1).
| Akcija | posmatranje |
| 1. Izvagano: 5 g – ftalni anhidrid (klasa reagensa) | Bijeli kristalni prah Ružičasti, difuzni kristali |
| 2. Stavite reagense u konusnu tikvicu sa ravnim dnom (100 ml), promešajte sa termometrom u njoj. | Nastala je kašasta masa, a smjesa se lagano zagrijava (t ≈ 37 0 C). |
| 3. Stavite tikvicu i zagrijte je u pješčanoj kupelji (temperatura unutar 125 - 130 0 C). Zagreva se 1,5 sat. | Na temperaturi od 45 0 C, fenol se topi, ftalni anhidrid (bijele ljuspice) pliva u smeđkastom topljenju. Nakon zagrijavanja od 30 minuta (t ≤ 130 0 C), nastala je homogena smeđe-grimizna talina. Nakon 1 sata zagrijavanja - homogena talina krvavocrvene boje. Nakon 1,5 sata grijanje je prestalo. |
| 4. Toplinu je izlio u tikvicu sa kipućom vodom i oddestilisao neizreagovani fenol vodenom parom (vidi sliku instalacije u odgovarajućem delu pregleda literature). | U tikvici sa kipućom vodom, nakon izlivanja vrućeg taline, počeli su da plutaju svetložuti neoboljeni komadi fenolftaleina, došlo je do blagog zamućenja vode, t ? 99 0 C. Oslobađa se mutni destilat (V = 50 ml). Nakon 15 minuta destilacije, bistri destilat je počeo da kaplje. |
| 5. Dekantira se rastvor sa fenolftaleinom u Buhnerov levak bez prenošenja taloga u filter. Talog sam ispirao sa tri porcije hladne vode po 100 ml. | Temperatura rastvora je 26 0 C, u rastvoru (V? 170 ml) nalaze se komadići fenolftaleina u obliku zrna, blago žućkaste boje. |
| 6. Filtrirani fenolftalein rastvoriti u 15 ml toplog rastvora natrijum hidroksida (? = 5%). | T NaOH ?42 0 C, rastvor je postao tamnocrven. |
| 7. Procijedio sam tamnocrvenu otopinu. | Temperatura rastvora? 35 0 C. Nakon završetka filtracije, na filter se taložio tanak, ružičasto-bijeli, fino kristalni sloj supstance (najvjerovatnije je to neizreagirani ftalni anhidrid). |
| 8. Filtratu (V? 50 ml) doda se 5 ml sirćetne kiseline (c.), u porcijama od 1 ml, uz mešanje. | Došlo je do promjene boje otopine od tamno crvene do sivo-bijele, mutne (ljuskave) otopine. Rešenje se nije zagrejalo. Temperatura rastvora? 31 0 C. |
| 9.Dodane 2 kapi hlorovodonične kiseline (k.) | Vizuelne promjene nije se desilo |
| 10. Ostavite da odstoji 1 sat. | Pahuljice su se taložile na dnu čaše, iznad sedimenta je bio providan rastvor, ljuspice su bile sivkasto-bele boje. |
| 11. Filtrirati nastali talog. | Na filteru se nalazi belo-sivkasta kaša. M ow? 5.07 |
Dobijeno je ukupno 5,07 g vlažnog preparata.
2.2 Rekristalizacija iz vrućeg alkohola
Rekristalizacija je izvršena prema metodi navedenoj u pregledu literature (odjeljak 1.4.4). Urađena je jedna replika. Crtež uređaja je prikazan u paragrafu 1.4.4 pregleda literature.
| Akcija | Opservation |
| U tikvicu je stavljen uzorak fenolftaleina (5,07 g) i dodano je 50 ml 96% etanola. | Mali dio feolftaleina se rastvorio. Alkohol se malo zamutio. |
| Zagrijte tikvicu do laganog ključanja. Alkohol se dodaje dok se fenolftalein potpuno ne otopi (po 0,5 ml). V ETOH = 7 ml. | fenolftalein je potpuno otopljen. Alkohol je zamućen. t mješavine = 85 o C. |
| Smjesa je polako ohlađena na sobnu temperaturu. | t smjesa = 19 o C. Mnogi bijeli kristali su ispali iz otopine u obliku malih kristala. Rešenje je transparentno. |
| Kristali koji su ispali su izvučeni, isprani na filteru sa ledenom vodom i sušeni između listova filter papira. | fenolftalein dobijen u obliku zračnih kristala bijelo-sive boje, sitnozrnati. m(fenolftalein) = 4,08 g. Prinos rekristalizacije bio je 83,5%. |
Proračun rekristalizacije:
Izlaz rekristalizacije:
W,% = (m(fenolftalein) unakrsno suho 100%) / m(fenolftalein) suho
W,% =  % = 83,5 %
% = 83,5 %
Izračun prinosa sinteze:
Za dobijanje 0,0388 mol fenolftaleina (teoretski) ili m = 0,0338 mol 318 g/mol = 10,7 g.
Izlaz iz teorijskog:
W=  100 % = 40, 5 %
100 % = 40, 5 %
Tako se dobija u principu dovoljna količina fenolftalein (oko 4,08 g) za dalja istraživanja. Sinteza je izvedena sa prihvatljivim prinosom proizvoda.
2.3 Određivanje rastvorljivosti
Određivanje rastvorljivosti fenolftaleina izvršeno je gravimetrijom (vidi paragraf 1.7.1).
Kao rastvarači odabrani su hloroform, benzen i ksilen. budući da prema literaturnim podacima (vidi tabelu 5) fenolftalein u njima ima prihvatljivu rastvorljivost za dostupnu masu fenolftaleina. Nisam koristio vodu, jer je fenolftalein vrlo slabo rastvorljiv (oko 10-4 g na 100 g). Takođe nisam koristio etanol, jer fenolftalein ima vrlo dobru rastvorljivost u alkoholu i biće potrebna velika potrošnja supstance. Određivanje je izvršeno na 21 ± 1 o C (temperatura tečne faze). Infuzija je trajala 30 ± 1 min, uz snažno mešanje.
Formule za izračun:
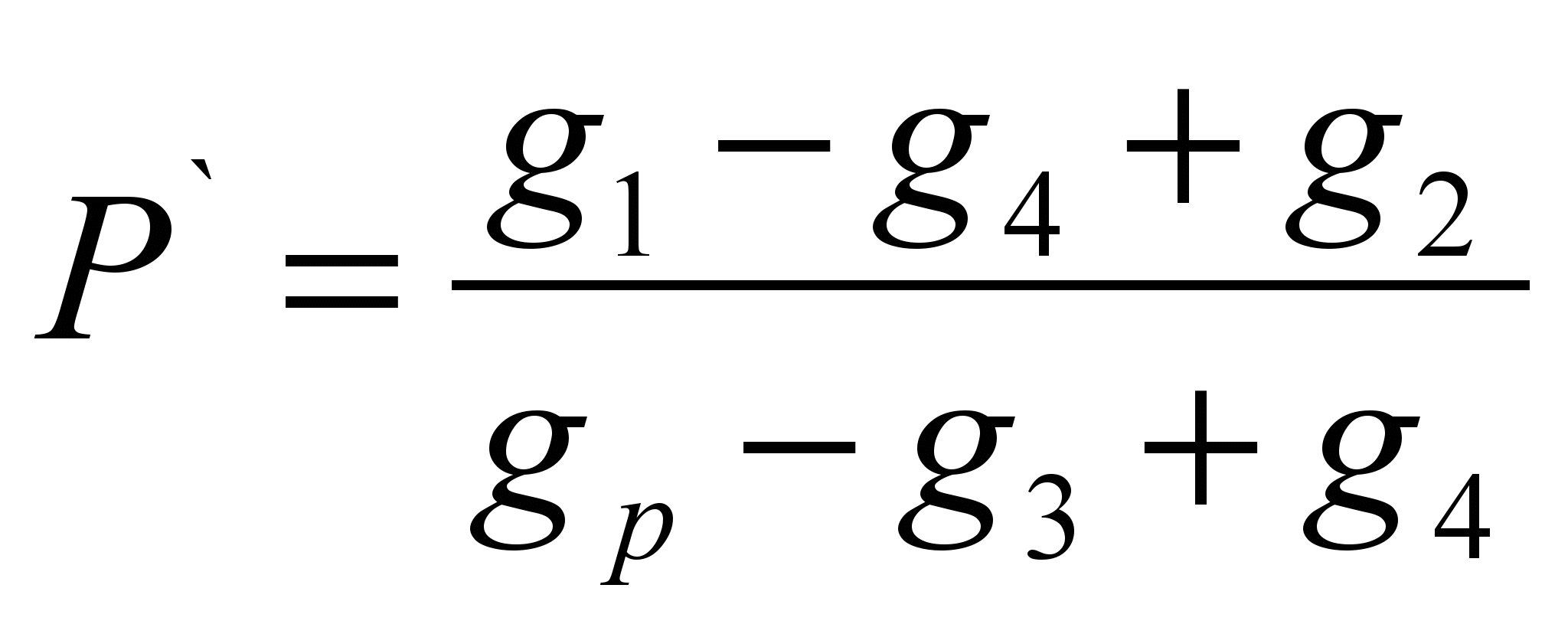 ; P = P` 100 (g/100 g)
; P = P` 100 (g/100 g)
Gdje je, g 1 – uzorak fenolftaleina, g;
G 2 – masa suvog filtera, g;
G 3 – masa vlažnog filtera sa ostacima fenolftaleina, g;
G 4 – masa suvog filtera sa ostacima fenolftaleina, g;
G p—težina rastvarača, g;
P – rastvorljivost, g/100 g rastvora;
R` - specifična rastvorljivost, g/1 g rastvora.
Rezultati određivanja:
P (fenolftalein / hloroform) = (3,0 ± 0,03) g / 100 g hloroforma; ? = 1%.
P (fenolftalein / ksilen) = (0,22 ± 0,01) g / 100 g ksilena; ? = 6%.
P (fenolftalein / benzen) = (0,19 0,01) g / 100 g benzena; = 6%.
Na osnovu podataka eksperimenta napravljena je zbirna tabela i grafikon.
Tabela 7
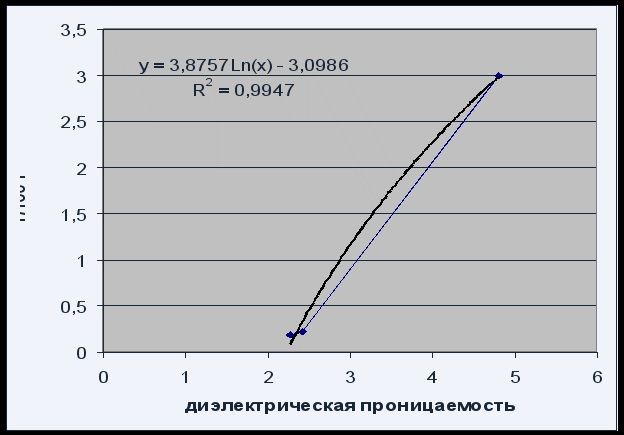
Fig.4 Ovisnost rastvorljivosti o dielektričnoj konstanti rastvarača
Ovisnost rastvorljivosti o dielektričnoj konstanti rastvarača može se opisati logaritamskom jednačinom P = 3,8757 Ln(x) – 3,0986 sa zadovoljavajućim kvalitetom R 2 = 0,995.
Zbog činjenice da se rastvorljivost fenolftaleina povećava sa povećanjem dielektrične konstante rastvarača (povećanjem njegovog polariteta), možemo reći da je fenolftalein polarno jedinjenje.
Zaključak
Tokom rada analizirano je 26 književnih izvora. Opisano opšti položaj dobiveno reakcijom fenola i ftalnog anhidrida. Izvršen je pregled metoda sinteze (pronađena je jedna metoda, u različitim literaturnim izvorima metoda se razlikovala po težini opterećenja reagensa) fenolftaleina. Provođenje sinteze ovom metodom nije komplicirano sporednim procesima. Identificirane su glavne opasnosti tokom sinteze i rukovanja korištenim supstancama. Odabrane su metode za određivanje rastvorljivosti. Kao rastvarači za određivanje rastvorljivosti izabrani su hloroform, ksilen i benzol.
Fenolftalein je sintetizovan sa prinosom od 40,5%. Uslovi za sintezu, prečišćavanje i izolaciju su poštovani u strogom skladu sa podacima metode.
Rastvorljivost fenolftaleina (prema gravimetrijskom određivanju) bila je: 3,00 ± 0,03 g/100 g hloroforma, 0,22 ± 0,01 g/100 g ksilena, 0,19 ± 0,01 g/100 g benzena.
Povećanje rastvorljivosti fenolftaleina sa povećanjem dielektrične konstante rastvarača potvrđuje da je fenolftalein ipolarno jedinjenje.
Spisak korišćene literature
1.Agronomov A.E. laboratorijski rad u organskoj hemiji. – M.: Obrazovanje, 1977. 230 str.2. Astakhova L.I., Krivenko A.P. Radionica organske hemije. – M.: Mir, 1990. 180 str.
3. Bichot E. Indikatori. – M.: Mir, 1976. 356 str.
4. Buhler K., Pearson D. Organske sinteze. M.: Više. Šk., 1973. 340 str.
5. Gerasimov Ya.I. Termodinamika rastvora. – M.: Izdavačka kuća – Moskovski državni univerzitet, 1980. 170 str.
6.Gitis S.S. Radionica o organskoj hemiji /S. S. Gitis, A. I. Glaz, A. I. Ivanov. – M.: VŠ, 1991.
7.Golodnikov G.V. Radionica organske hemije. – M.: Hemija, 1978. 160 str.
8. Grandberg I. I. Praktični rad i seminari iz organske hemije: Priručnik za studente. univerziteti – 4. izd., prerađeno. i dodatne – M.: Drfa, 2001.
9. Ivanov V. G. Radionica o organskoj hemiji: Udžbenik. Priručnik za studente. viši ped. udžbenik ustanove /V. G. Ivanov, O. N. Geva, Yu. G. Gaverova. – M.: Izdavački centar „Akademija“, 2000.
10. Karapetyants M.Kh. Uvod u teoriju hemijskih procesa. – M.: Više. Šk., 1975. 280 str.
11.Kirilin V.A. Termodinamika rastvora. – M.: Energija, 1980. 80 str.
12.Kogan V.B. Priručnik o rastvorljivosti. – M.: Izdavačka kuća Akademije nauka, 1961. 300 str.
13. Levina R. Ya. Praktični rad iz organske hemije. – M.: Hemija, 1980.
14. Organicum: Praktični rad iz organske hemije. – M.: Mir, 1979 – T.2.
15. Petrov A. A. Organska hemija: Udžbenik za univerzitete / A. A. Petrov, H. V. Balyan, A. T. Troshchenko. – 5. izd., prerađeno. i dodatne – Sankt Peterburg: Ivan Fedorov, 2002.
16. Reichard K. Rastvarači i uticaji na životnu sredinu u organskoj hemiji. – M.: Mir, 1991. 182 str.
17. Vodič za laboratorijsku nastavu iz organske hemije: Priručnik za univerzitete / N. N. Artemyeva, V. L. Beloborodova, S. E. Zurabyan i drugi; Ed. N. A. Tyukavkina. – 2. izd., prerađeno. i dodatne – M.: Drfa, 2002.
18. Svojstva organska jedinjenja: priručnik /Ed. A. A. Potekhina. – L.: Hemija, 1984.
19. Smolina T. A. Praktični rad iz organske hemije: mala radionica /T. A. Smolina, N. V. Vasiljeva, N. B. Kupletskaya. – 2. izd., prerađeno. – M.: Obrazovanje, 1986.
20. Hemičarski priručnik / Ed. B. N. Nikolsky i drugi - L.: Hemija, 1964.
21. Stromberg A. G. Fizička hemija: Udžbenik. za kem. specijalista. univerziteti /A. G. Stromberg, D. P. Semchenko; Ed. A. G. Stromberg. – 5. izd., rev. – M.: VŠ, 2003.
22. Traven V. F. Organska hemija: Udžbenik za univerzitete. – M.: ICC “Akademkniga”, 2004. – T.1.
23.Fizička hemija. U 2 knjige. Book 1. Struktura materije. Termodinamika: Udžbenik. za univerzitete /K. S. Krasnov, N.K. Vorobyov, I.I. Ed. K. S. Krasnova – 3. izd., revidirano. – M.: VŠ, 2001.
24. Fialkov Yu.A. Rastvarač kao kontrolni agens hemijski proces. - L.: Hemija, 1990. 240 str.
25.Hemijska enciklopedijski rečnik/Ed. I. L. Knunyants i drugi - M.: Sovjetska enciklopedija, 1983.
26. Khramkina M.N. Radionica o organskoj sintezi. – M.: Izdavačka kuća Moskovskog državnog univerziteta, 1985. 473 str.
Empirijska formula fenolftaleina: C20H14O4 .
Šta je fenolftalein?
Prema Wikipediji, 4,4′-dioksiftalofenon ili 3,3-bis-(4-hidroksifenil)ftalid predstavlja acido-bazni indikator .
Supstance kao što su lakmus, fenolftalein, metilnarandža široko se koristi u hemiji za određivanje kiselosti rastvora.
U nepromijenjenom obliku, proizvod su prozirni kristali koji su slabo rastvorljivi u vodi, ali su veoma rastvorljivi u alkoholima i dietil eter . Supstanca se može sintetizirati iz fenol I ftalni anhidrid reakcijom kondenzacije, upotrebom cink hlorid Kako katalizator (možete koristiti i koncentrovane sumporna kiselina ).
Ova supstanca u kiseloj sredini ( pH od 0 do 3) poprima izraženu narandžastu nijansu. U blago kiselim i neutralnim sredinama ( pH od 4 do 7) rastvor neće promeniti boju. Uz pomoć fenolftaleina možete prepoznati alkalno okruženje. Pošto proizvod u rastvoru poprima grimiznu boju, pH što je od 8 do 10 ( alkalni rastvor). Ako vrijednosti pH vrijednost od 11 do 14, tada indikator ni na koji način neće utjecati na boju lijeka. Fenolftalein se koristi za titracija razne vodeni rastvori V analitička hemija , obično se koristi supstanca rastvorena u alkoholu.
Fenolftalein se takođe široko koristi u medicini. Šta se desilo Purgen ? To je sinonim za fenolftalein. U prošlom stoljeću supstanca se aktivno koristila kao laksativ. Lijek aktivno stimulira pokretljivost crijeva. Sada se Purgen laksativ rijetko koristi zbog svoje sposobnosti da se akumulira u tijelu i negativno utječe na funkciju bubrega.
Farmakološko djelovanje
Laksativ.
Farmakodinamika i farmakokinetika
Fenolftalein, šta je to?
Purgen je moćan laksativ. Njegov mehanizam djelovanja zasniva se na poboljšanju peristaltiku crijeva. To se događa zbog sposobnosti tvari da depresira natrijum-kalijum ATPaza , stimulativno adenil ciklaza i povećava biosinteza . Supstanca stimulira sinapse i nervne završetke crijevnih zidova, narušavajući ravnoteža vode i elektrolita V Gastrointestinalni trakt , tečnost se akumulira.
Nakon prve doze, učinak proizvoda se javlja u roku od 24 sata. Supstanca ima tendenciju da se akumulira u tijelu, djeluje iritativno na bubrege i ima prokancerogeno svojstva.
Indikacije za upotrebu
Preparati koji sadrže ovu supstancu koriste se kao laksativ za hronične.
Kontraindikacije
Laxative Purgen je kontraindiciran:
- za bolesti bubrega;
- pacijenti sa opstrukcija crijeva ;
- kada je na fenolftaleinu;
- kada se kod pacijenta otkrije kompleks simptoma” akutni želudac ”.
Lijek se ne može koristiti duže vrijeme. Posebnu pažnju treba posvetiti liječenju starijih osoba.
Nuspojave
Purgen tablete mogu uzrokovati:
- ubrzan rad srca zbog abnormalnog ravnoteža vode i elektrolita ;
- albuminurija ;
- kolaps ;
- smanjen nivo kalija u krvi;
- promjena boje urina od žute do ružičaste ili smeđe;
- kožni osip itd.
Uputstvo za Purgen (Metoda i doziranje)
Laksativ je dostupan u obliku tableta, različitih doza ili praha za oralnu primjenu.
Uputstvo za upotrebu Fenolftaleina
U prosjeku, dnevna doza za odraslu osobu je 100 mg.
Djeci se propisuje 50-200 mg lijeka dnevno, ovisno o njihovoj dobi i težini.
Maksimalna količina supstance koja se može uzeti u roku od 24 sata je 300 mg.
Tijek liječenja propisuje specijalista. Lijekove koji sadrže ovu komponentu ne treba uzimati duže vrijeme.
Predoziranje
Lijek može uzrokovati hemoroidno krvarenje , značajno smanjenje, do kolaps , pojava proteina u urinu. U slučaju predoziranja preporučuje se konsultacija sa lekarom.
Interakcija
Fenolftalein može dovesti do zadržavanja kalija u tijelu ako se terapija provodi istovremeno diuretici koji štede kalijum .
Uslovi prodaje
Nije potreban recept.
Uslovi skladištenja
Preparate na bazi fenolftaleina čuvati na suvom, tamnom mestu, zaštićeno od dece, na sobnoj temperaturi.
Najbolje do datuma
Prašak ima neograničen rok trajanja, tablete se mogu čuvati 10 godina (osim ako proizvođač nije drugačije naveo na pakovanju).
Posebna uputstva
Danas se lijekovi koji sadrže fenolftalein rijetko koriste u medicini. Najčešće se daje prednost drugim modernim, sigurnim laksativima.
Za djecu
Supstanca se propisuje s oprezom. Potrebno je prilagođavanje doze ovisno o dobi i težini djeteta.
Starije osobe
U osobama starost Efekat uzimanja ovog lijeka se javlja u roku od 24-72 sata.
Za mršavljenje
Početkom prošlog stoljeća ova supstanca se koristila za mršavljenje. Sada postoje i drugi lijekovi koji imaju sličan učinak. Mnoge djevojke u potrazi za idealnom figurom zloupotrebljavaju laksative, što ne bi trebalo činiti. Ovo može biti opasno po vaše zdravlje.
Lijekovi koji sadrže (analoge)
ATX kod nivoa 4 odgovara:
Ex Lax, Purgen, Purgofen, Purgil, Phenaloin, Laxatol, Laxoil.
Purgen cijena, gdje kupiti
Cijena laksativa u obliku fenolftaleinskog praha u veleprodaji je oko 1700 rubalja po 1 kg.
Gotovo je nemoguće kupiti proizvod u Moskvi, jer se lijekovi na njegovoj bazi već dugo ne isporučuju u ljekarne.
Cijena fenolftaleina može varirati ovisno o proizvođaču.
