Zamrzavanje rastvora. Rastvori se smrzavaju na nižoj temperaturi od čistog rastvarača.
Rešenja ključaju na više od visoka temperatura kako čisti rastvarač;
Posljedice iz Raoultovog zakona
Idealna su rješenja koja se striktno pridržavaju Raoultovog zakona. Za stvarne otopine neelektrolita, Raoultov zakon se promatra točnije, što je ova otopina razrijeđena. Kako koncentracija otopljene tvari raste, većina rješenja pokazuje odstupanja od Raoultovog zakona.
Relativno smanjenje tlaka zasićene pare rastvarača iznad otopine jednako je molskom udjelu otopljene tvari.
Otopine elektrolita (kiseline, baze, soli) ne poštuju Raoultov zakon. Štaviše, čak iu slučajevima kada su razrijeđeni. O razlozima ove pojave biće reči kasnije.
Iz Raoultovog zakona slijede dvije važne posljedice:
Pogledajmo ih detaljnije.
Vrenje je fizički proces prijelaz tekućine u plinovito stanje ili paru, pri čemu se mjehurići plina formiraju po cijeloj zapremini tečnosti.
Tečnost ključa kada pritisak njene zasićene pare postane jednak spoljašnjem pritisku. Ako se vanjski tlak (na primjer, atmosferski) ne mijenja, a sama tekućina je individualna i kemijski čista tvar, tada ključa u otvorenoj zagrijanoj posudi na konstantnoj temperaturi dok tečna faza potpuno ne nestane.
Dakle, pri atmosferskom pritisku od 101,325 kPa, tačka ključanja prečišćene (destilovane) vode je 100 o C ili 373,16 K.
Ako se neka nehlapljiva tvar otopi u H 2 O, tada će se smanjiti njen tlak zasićene pare. Da bi nastali rastvor proključao, potrebno ga je zagrijati na temperaturu veću od 373,16 K, jer će samo pod takvim uvjetima tlak zasićene pare rastvarača ponovo postati jednak atmosferskom.
Zamrzavanje ili kristalizacija je fizička pojava praćena transformacijom tečnosti u čvrstu materiju. Štaviše, kristalne strukture se formiraju kroz čitav volumen tečnosti.
Proces zamrzavanja počinje kada pritisak zasićene pare iznad tečnosti postane jednak pritisku zasićene pare iznad njenih čvrstih kristala.
Ako vanjski (atmosferski) tlak ostane konstantan, a tekućina ne sadrži strane nečistoće, tada će tokom procesa kristalizacije temperatura ohlađene tekućine ostati konstantna sve dok tečna faza potpuno ne pređe u čvrstu.
Pri atmosferskom pritisku od 101,325 kPa, destilovana voda se smrzava na 0 o C (273,16 K). Pritisak zasićene pare vode iznad leda i tečnosti u ovom slučaju iznosi 613,3 Pa.
Za vodeni rastvor, pritisak zasićene pare rastvarača na 0 o C biće manji od 613,3 Pa, a iznad leda ostaje nepromenjen. Led ubačen u takvu otopinu brzo će se otopiti zbog kondenzacije viška pare iznad njega.
Samo snižavanjem temperature može se ponovo izjednačiti pritisak zasićene pare iznad tečne i čvrste faze i pokrenuti proces kristalizacije.
Eksperimentalno je utvrđeno da je povećanje tačke ključanja (Dt bp) i smanjenje tačke smrzavanja rastvora (Dt sub) u poređenju sa čistim otapalom direktno proporcionalno molalnoj koncentraciji rastvorene supstance. Matematički, ovo se može napisati na sljedeći način:
t kip. rastvor – ne provri. p-telo = Dt bala. = Em
t zamjenik r-tel – t zamjenik rješenje = Dt zamjenik = Km
gdje je m molalna koncentracija otopljene tvari; E i K su, respektivno, ebulioskopske (latinski ebbulio - ispariti) i krioskopske (grčki "krios" - hladno) konstante, čije vrijednosti zavise samo od prirode rastvarača (tabela 7).
Tabela 7. Ebulioskopske E i krioskopske K konstante nekih otapala (deg/mol)
Rice. 7.12. Smanjenje pritiska pare vode iznad rastvora
Pune linije izražavaju granice faznih polja za čistu vodu. Podsjetimo da je linija 1 prikazuje ravnotežu tečnost-para. Nakon dodavanja nehlapljivog rastvora u vodu, pritisak pare iznad rastvora (isprekidana linija 2 ) opada na bilo kojoj temperaturi.
Svaka tečnost će se smrznuti (učvrstiti) kada se pritisak pare iznad nje uporedi sa pritiskom pare iznad čvrste faze (u slučaju vode, iznad leda). Dakle, temperatura smrzavanja otopine T zamjenik bit će niža od temperature smrzavanja T o zamjeniku čisti rastvarač - voda.
F.M. Raul (1883) je eksperimentalno utvrdio da smanjenje temperature smrzavanja (inače - ledena depresija)
DT zamjenik = T o zamjeniku - T zamjenik ,
uzrokovano različitim otopljenim tvarima uzetim u istim molarnim količinama je isto za dati rastvarač. Dakle, za 0,1m vodeni rastvori Za neke tvari primjećuju se sljedeće temperature očvršćavanja:
Supstanca T zamjenik , o C
Vodonik peroksid H 2 O 2 - 0,186
Metil alkohol CH 3 OH - 0,181
Etil alkohol C 2 H 5 OH - 0,183
Saharoza C 12 H 22 O 11 - 0,186
Dekstroza C6H12O6 - 0,188
Pri različitim koncentracijama otopljene tvari DT zamjenik proporcionalno njihovoj molalnoj koncentraciji m :
DT zamjenik = K cr m (7.1)
Faktor proporcionalnosti K cr u jednačini (7.1), tzv krioskopska konstanta, predstavlja molarno smanjenje tačke smrzavanja. Ova vrijednost je numerički jednaka smanjenju točke smrzavanja otopine koja sadrži 1 mol otopljene tvari u 1 kilogramu otapala, pod uvjetom da otopina ima svojstva idealnog. Krioskopska konstanta je karakteristika rastvarača, njena vrijednost ne ovisi o prirodi otopljene tvari.
Molalna koncentracija može se izraziti u smislu mase otopljene tvari ( b) i rastvarač ( A) u gramima (vidi tačku 7.3):
Gdje M - molarna masa rastvorene supstance (g/mol). Zamjenom ovog izraza u jednačinu (7.1) dobijamo
Iz ove jednadžbe proizilazi jedna vrlo važna okolnost, naime: znajući tačan sastav razrijeđene otopine i mjereći temperature smrzavanja čistog otapala i otopine, možete izračunati molarnu masu otopljene tvari:
Jednačina (7.2) je osnova krioskopski(ili kriometrijski)metoda određivanje molarne mase supstanci snižavanjem tačke smrzavanja njihovih rastvora Kriometrijska metoda se široko koristi u laboratorijskoj praksi, uključujući i farmaciju.
Njegov princip je sljedeći. Prvo se mjeri temperatura topljenja (ili smrzavanja) tačnog uzorka A odabrani rastvarač. Zatim se u rastvarač dodaje tačan izvagani dio ispitivane tvari. b i mjeri se tačka topljenja rezultirajuće smjese (ili tačka smrzavanja ako supstanca odabrana kao rastvarač ima nisku tačku topljenja). Težina otopljene tvari mora biti mnogo manja od težine rastvarača da bi otopina bila razrijeđena. Primljena vrijednost DT zamjenik se supstituira u jednačinu (7.2) i uz nju se izračuna molarna masa ispitivane supstance. U najjednostavnijem slučaju, destilovana voda se može koristiti kao otapalo. Međutim, zbog male vrijednosti krioskopske konstante i niske točke smrzavanja, što zahtijeva korištenje kriostata ili posebnih rashladnih smjesa, voda se koristi samo za približnu procjenu molarne mase tvari. U pravilu, posebno kada se proučavaju složene organske tvari velike molarne mase, druge tvari se biraju kao otapala. U ovom slučaju kamfor sa svojom velikom krioskopskom konstantom je od posebnog značaja. Glavni uslov za kriometrijsko određivanje je potpuna rastvorljivost ispitivane supstance u odabranom rastvaraču. Ispod su krioskopske konstante nekih supstanci (pri normalnom atmosferskom pritisku):
Supstanca T pl o C Krioskopska
konstantan K cr
Benzen 5,5 5.12
Sirćetna kiselina 16,8 3,90
Cikloheksan 6,5 20
Kamfor 178,5 39,7
Krioskopska metoda se također koristi za određivanje čistoće tvari. Ovo se zasniva na činjenici da prisustvo čak i male nečistoće smanjuje tačku topljenja uzorka ispitivane supstance. Stoga je u hemiji (kao i u farmaciji) jedan od kriterija čistoće tvari postizanje maksimalne temperature topljenja koja se dalje ne povećava nakon dodatnih operacija prečišćavanja.
Druga važna primjena krioskopskog efekta je priprema rashladnih smjesa. Uz određeni odnos vode (ili snijega) i neke neorganske soli, možete dobiti niske temperature, zadržan dosta dugo. Na primjer, mješavina koja se sastoji od 100 g snijega i 143 g CaCl 2 6H 2 O omogućava vam da dobijete temperaturu od -55 o C.
U područjima s hladnom klimom, tvari protiv smrzavanja kao što su alkohol, glicerin ili etilen glikol se dodaju u vodu koja se koristi u hladnjaku automobila kako bi se spriječilo smrzavanje zimi. Led smrznut na cestama i trotoarima se lako topi kada se posipa kuhinjska sol ili pepela, koji se takođe zasniva na krioskopskom efektu. Samo trebate imati na umu da prekomjerna upotreba soli u ove svrhe može uzrokovati zaslanjivanje obližnjih rezervoara i tla na njihovim obalama i, kao rezultat, narušavanje okoliša.
Zamrzavanje je fazni prijelaz u kojem tečnost prelazi u čvrstu supstancu. Tačka smrzavanja tečnosti je temperatura na kojoj je pritisak zasićene pare iznad tečnosti jednak pritisku zasićene pare iznad kristala čvrste faze koji ispadaju iz nje.
Na ovoj temperaturi i odgovarajućem pritisku zasićene pare, brzina kristalizacije je jednaka brzini topljenja i obje ove faze mogu koegzistirati dugo vremena.
Također M.V. Lomonosov je primijetio da se razrijeđena otopina smrzava na temperaturi nižoj od temperature čistog rastvarača. Dakle, morska voda ne smrzava se na 273 K, već na nešto nižoj temperaturi. Brojni eksperimenti su pokazali da se takva promjena temperature smrzavanja otopine može smatrati općim pravilom.
Procese smrzavanja i ključanja Raoult je detaljno proučavao i predstavio u obliku zakona, koji je kasnije nazvan Raoultovim drugim zakonom.
Razmotrimo najjednostavniji izvod ovog zakona. Na slici 2 prikazan je dijagram koji izražava zavisnost pritiska zasićene pare o temperaturi iznad čistog rastvarača i iznad rastvora.
Kriva 0A je zavisnost pritiska zasićene pare čiste vode o temperaturi.
Kriva BC, DE – zavisnost pritiska zasićene pare vode nad rastvorima sa različitim koncentracijama rastvorene supstance
0D – izražava temperaturnu zavisnost pritiska zasićene pare vode iznad leda.
Sa slike 2 je jasno da je pritisak pare iznad rastvora na 273 K niži nego iznad vode, ali nije jednak pritisku pare iznad leda na istoj temperaturi. Samo na temperaturama ispod 273 K (T'z) tlak pare iznad otopine opada toliko da postaje jednak tlaku pare iznad leda. Ovo odgovara tački B. Pri višim koncentracijama rastvora, krive koje izražavaju zavisnost pritiska vodene pare iznad rastvora o temperaturi nalaze se ispod BC krive, ali paralelne sa njom.
Hajde da se predstavimo sledeća notacija:
R 0 A – pritisak pare iznad čistog rastvarača na 273 K
P A – pritisak pare iznad rastvora na temperaturi smrzavanja T’z
Od pravougaonog trougla Određujemo FOC
Sa slike 2 je jasno da je , gdje je smanjenje temperature smrzavanja otopine.
Zamjenom ovih vrijednosti u gornju jednačinu dobijamo

 (3)
(3)
Od Raoultovog prvog zakona za visoko razrijeđena rješenja imamo
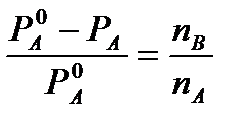
 I
I  (4)
(4)
gdje n A, n B, m A zadržavaju prethodno dodijeljene oznake (vidi gore). Ako M 0 A označava molarnu masu rastvarača, onda

Zamjenom ovog izraza u jednačinu (4) dobijamo

Zatim pomnožite i podijelite desnu stranu ovog izraza sa 1000
 (5)
(5)
Kombinirajmo sve konstantne veličine u jednadžbi (5) u jednu konstantu K (  ), dobijamo sledeći izraz
), dobijamo sledeći izraz
 (6)
(6)
Izraz  predstavlja molalnost rastvora St.
predstavlja molalnost rastvora St.
Zamjenom ovog izraza u jednačinu (6) dobijamo konačnu jednačinu.
 (7)
(7)
Ovo je matematički izraz Raoultovog drugog zakona: smanjenje tačke smrzavanja ili povećanje tačke ključanja rastvora direktno je proporcionalno njegovoj molalnoj koncentraciji.
Koeficijent K u jednačini (7) naziva se krioskopska konstanta, pokazuje molarni pad temperature smrzavanja otopine, je individualne karakteristike rastvarač (K H2O = 1,86º) i ima istu dimenziju kao E (Kº kg mol -1)
Metoda istraživanja zasnovana na mjerenju smanjenja tačke smrzavanja otopina naziva se krioskopska. On, kao i ebulioskopski, omogućava izračunavanje molarne mase otopljene tvari

Slika 3 prikazuje uređaj dizajniran za mjerenje tačke smrzavanja otopina.
 |
OSMOZA I OSMOTSKI PRITISAK.
Veoma važno biološki važno svojstvo rastvora je osmoza.
U prirodi su rastvori često odvojeni od rastvarača membranama koje su propusne samo za čestice rastvarača. U tom slučaju otopljena supstanca ne može difundirati u rastvarač, već će se posmatrati samo prelazak rastvarača u rastvor, tj. rastvarač će se kretati u oba smjera, ali će ipak malo više ući u otopinu nego unutra obrnuti smjer.
Mehanizam osmoze je lako zamisliti na osnovu izotermne destilacije. Neka polupropusna membrana s mikroporama odvoji otapalo i otopinu s koncentracijom C u (slika 4)

U porama ograničenim s jedne strane rastvaračem, a s druge otopinom, dolazi do isparavanja. Zbog povećanja pritiska zasićene pare prema Raoultovom zakonu, pritisak pare iz parne faze se koncentriše na strani rastvarača, prelazeći u rastvor.
Kao rezultat osmoze, volumen otopine se povećava i njegova koncentracija postupno opada; rastvarač koji prodire u rastvor kroz membranu povećava kolonu tečnosti h i samim tim povećava hidrostatički pritisak (vidi sliku 5). Istovremeno će se povećati broj molekula rastvarača koji se kreću kroz membranu u suprotnom smjeru, tj. od rastvora do rastvarača. Postupno će hidrostatički pritisak i razrjeđenje otopine dostići vrijednosti pri kojima će se izjednačiti broj molekula otapala koji se kreću u oba smjera i doći će do osmotske ravnoteže. Višak hidrostatskog tlaka nastao kao rezultat osmoze, mjeren kolonom otopine visine h, na kojoj se uspostavlja osmotska ravnoteža, naziva se osmotski tlak.
![]() pirinač. 5
pirinač. 5
Membrane od kolodijuma, celofana, gvožđe-sinoksid bakra itd. su polupropusne za mnoge rastvore.
ZAKONI OSMOTSKOG PRITISKA.
Proučavanje zakona osmotskog pritiska otkrilo je njihovu potpunu analogiju sa zakonima plina. Za razrijeđene otopine neelektrolita, mogu se formulirati na sljedeći način:
pri konstantnoj temperaturi, osmotski tlak je direktno proporcionalan molarnoj koncentraciji otopljene tvari (analogija s Boyle-Mariotteovim zakonom):

pri konstantnoj molarnoj koncentraciji, osmotski tlak je direktno proporcionalan apsolutnoj temperaturi (analogija s Gay-Lussacovim zakonom):

Iz ova dva zakona proizilazi da pri istim molarnim koncentracijama i temperaturama, otopine različitih neelektrolita stvaraju isti osmotski tlak, tj. ekvimolarne otopine neelektrolita su izotonične (analogija sa Avogadrovim zakonom).
Van't Hoff je predložio jedinstveni zakon za osmotski tlak u otopinama (slično jedinstvenom plinskom zakonu Mendelejev-Claiperon): Osmotski tlak razrijeđenih otopina neelektrolita je direktno proporcionalan molarnoj koncentraciji, koeficijentu proporcionalnosti i apsolutnoj temperaturi:
budući da je c=n/V, gdje je n broj molova neelektrolita, a V volumen otopine, tada  ili
ili ![]()
Razrijeđene otopine neelektrolita.
Koligativna svojstva rješenja
Pritisak zasićene pare
Ravnoteža "pojedinačna tekućina-para" opisana je konstantom ravnoteže
K p =p o nama. par /a ili (1)
Dakle, pošto je aktivnost pojedinačne tečnosti a o x = 1, pritisak zasićene pare je jednak
p o par = K p (2)
i zavisi samo od temperature.
Budući da je aktivnost rastvarača jednaka umnošku a ox njegovog molskog udjela N 1 ili (1 - N 2), gdje je N 2 molarni udio otopljene tvari, konstanta ravnoteže je jednaka:
K p =p 1 o =(p 1 /a o x N 1)=(p 1 /1-N 2) (3)
Odavde dobijamo Raoultov zakon (1886):
p 1 = p 1 o (1-N 2) = p 1 o N 1 (4)
(p 1 o -p 1)/p 1 o)=N 2 (5)
Pritisak zasićene pare rastvora jednak je njegovom pritisku iznad čistog rastvarača pomnoženom sa molskim udelom rastvarača.
Relativno smanjenje pritiska zasićene pare rastvarača u odnosu na čistu otopinu jednako je molskom udjelu otopljene tvari.
Dakle, pritisak pare već zavisi od sadržaja otopljene supstance. Raoultov zakon se može koristiti za određivanje molarne mase otopljene tvari:
Dp/p 1 ° =N 2 =n 2 /n 1 +n 2 ≈m 2 M 1 /m 1 M 2 (6)
Tačka ključanja rastvora
Tečnost ključa kada pritisak zasićene pare postane jednak spoljašnjem pritisku. Pošto je, prema Raoultovom zakonu, pritisak pare iznad rastvora manji od pritiska pare iznad čistog rastvarača, tačka ključanja rastvora je viša od tačke ključanja čistog rastvarača.
Eksperimenti su pokazali da za razrijeđene otopine neelektrolita:
gde je DT povećanje tačke ključanja rastvora u poređenju sa čistim rastvaračem, b je molalitet ([E] = K. Kg/mol) E je ebulioskopska konstanta (od ebbulio (lat.) - ključanje), zavisno samo od toga. o svojstvima rastvarača (njegova temperatura ključanja T o i specifična toplota isparavanja L 1):
E=RT o 2 /1000L 1 (8)
Tačka ključanja čistog rastvarača ima određenu vrijednost pri fiksnom vanjskom pritisku. Tačka ključanja otopine nije konstantna - povećava se kako ključa, jer se zbog isparavanja otapala povećava koncentracija otopine. Istovremeno, pritisak zasićene pare se stalno smanjuje. Stoga se tačkom ključanja otopine smatra temperatura koja odgovara pojavi prvog mjehurića pare u njemu.
Tačka smrzavanja rješenja
Iznad rastvora, pritisak pare rastvarača je niži od pritiska pare iznad čistog rastvarača. Pritisak pare iznad čvrste i tečne faze će takođe biti manji. To se može dogoditi samo na nižoj tački smrzavanja otopine u poređenju sa čistim rastvaračem. Smanjenje tačke smrzavanja rastvora neelektrolita u odnosu na tačku smrzavanja čistog otapala proporcionalno je molalnosti rastvora:
gdje je K krioskopska konstanta (od grčkog "krios" - hladno), ovisno samo o svojstvima rastvarača:
K=RT o 2 /1000L 1, (10)
gdje je T o, L * 1 tačka smrzavanja i specifična toplota fuzije čistog rastvarača.
Pošto koncentracija rastvorene supstance raste sa očvršćavanjem rastvarača, tačka smrzavanja rastvora nije konstantna i opada tokom procesa. Stoga se temperatura formiranja prvog kristala uzima kao temperatura smrzavanja otopine.
U tabeli 2 prikazane su vrijednosti E i K za neka otapala.
Tabela 2.
Kristali rastvarača će biti u ravnoteži sa rastvorom samo kada je pritisak zasićene pare iznad kristala i iznad rastvora isti. Pošto je pritisak pare rastvarača iznad rastvora uvek niži od onog iznad čistog rastvarača, temperatura koja odgovara ovom stanju uvek će biti niža od tačke smrzavanja čistog rastvarača. U ovom slučaju, smanjenje temperature smrzavanja otopine ΔT ne ovisi o prirodi otopljene tvari i određuje se samo omjerom broja čestica otapala i otopljene tvari.
Može se pokazati da je smanjenje temperature smrzavanja otopine ΔT direktno proporcionalno molalnoj koncentraciji otopine:
Raoultov drugi zakon: Povećanje Tboila i smanjenje Tzam otopine proporcionalni su broju čestica otopljene tvari i ne ovise o njenoj prirodi.
Kraj rada -
Ova tema pripada sekciji:
Predavanje br. 5. Fazne ravnoteže. Neelektrolitne otopine
Gasovito stanje supstance karakteriše slaba interakcija između čestica i velike udaljenosti između njih. Zbog toga se gasovi mešaju... Ukupni pritisak gasne mešavine jednak je zbiru parcijalnih pritisaka svih komponenti...
Ako ti treba dodatni materijal na ovu temu, ili niste pronašli ono što ste tražili, preporučujemo da koristite pretragu u našoj bazi radova:
Šta ćemo sa primljenim materijalom:
Ako vam je ovaj materijal bio koristan, možete ga spremiti na svoju stranicu na društvenim mrežama:
| Tweet |
Sve teme u ovoj sekciji:
Predavanje br. 5. Fazne ravnoteže. Neelektrolitne otopine.
Fazne ravnoteže.
U prošlom predavanju smo razmatrali hemijsku ravnotežu, konstantu ravnoteže, njen odnos sa tako dalje. količine i faktori koji utiču na promenu ravnoteže.
Dvokomponentni sistemi.
Rješenje je homogen sistem koji se sastoji od dvije ili više komponenti, čiji se sastav može kontinuirano mijenjati u određenim granicama bez naglih promjena u svojim svojstvima.
Formiranje rastvora je složen fizički i hemijski proces. Proces rastvaranja je uvek praćen povećanjem entropije sistema; Kada se formiraju rješenja, često dolazi do oslobađanja bilo kojeg
Rastvorljivost
Proces rastvaranja povezan je sa difuzijom, odnosno sa spontanom distribucijom čestica jedne supstance između čestica druge. Kada se otopljena tvar doda rastvaraču, proces rastvaranja
Rastvorljivost gasova u tečnostima
Rastvorljivost gasova u tečnostima zavisi od niza faktora: prirode gasa i tečnosti, pritiska, temperature, koncentracije materija rastvorenih u tečnosti (posebno rastvorljivosti gasova).
Neelektrolitne otopine.
Svojstva otopina razmatraju se na primjeru razrijeđenih otopina kod kojih su termički i volumni efekti jednaki 0 (idealna rješenja). U takvim rješenjima čestica se nalazi na velikom
Relativno smanjenje tlaka zasićene pare iznad otopine jednako je molskom udjelu otopljene tvari.
Svaka tečnost počinje da ključa na temperaturi na kojoj pritisak njene zasićene pare dostiže spoljašnji pritisak. T ključanja - T pri kojem je pritisak pare = 101,3 kPa Voda ključa na 100 C,
Osmotski pritisak
Ako su dvije otopine s različitim koncentracijama razdvojene polupropusnom pregradom koja propušta molekule otapala, ali sprječava prolazak čestica otopljene tvari, primijetit ću
